Summary
最適切断温度の媒体(10月)に埋め込まれた未固定凍結組織サンプルは分泌粘液の自然分布とグリコシル化を研究するために使用することができます。このアプローチ組織処理に最小限であり、糖脂質、ムチンおよび糖鎖エピトープの自然なプレゼンテーションが保存されています。組織切片を蛍光や発色検出を用いた免疫組織化学によって分析することができる。
Abstract
ムチンは重量1-3で70%以上の炭水化物を含む複雑かつ高度にグリコシル化され、O-結合型糖タンパク質である。杯細胞と胃粘膜によって生成分泌ムチンは、腸や気道の3,4行は上皮そのマイクロメートル厚の粘液層のための足場を提供する。ムチンに加えて、粘液層は、抗菌ペプチド、サイトカイン、および免疫グロブリン5-9を含む。粘液層は、ホスト自然免疫の重要な部分であり、微生物8,10-12を侵略に対する最初の防衛線を形成している。このように、粘液は、微生物との多数の相互作用に従うものとし、両方の病原体と共生し、分泌ムチンは、これらの相互作用のための重要なインタフェースを形成します。そのような生物学的相互作用の研究は、通常、組織採取と染色のための組織学的方法を含む。組織採取とpreserv用の2つの最も一般的に使用される組織学的方法クリニックで、研究所でationは、次のとおりです。冷凍保護剤メディアに埋め込む続いパラフィン包埋し、組織の凍結が続き、ホルマリン固定。
パラフィン包埋組織サンプルは、明快さと明確に定義された形態を含む組織学的可視化のための最適な性質を持つセクションを生成します。しかし、パラフィン包埋処理中にエピトープの数が変更され、これらのエピトープを勉強するためには、組織切片は、さらに多くのエピトープ検索方法13のいずれかで処理しなければならないとなる。分泌されるムチンと脂質は有機溶剤(キシレンまたはCitrisolv)とのインキュベーションを延長する必要パラフィン包埋クリア化ステップの間に、組織から抽出されます。したがって、このアプローチでは、in vivoでのムチンや粘液の性質や分布に着目した研究のためのサブ最適です。
これとは対照的に、最適切断温度で凍結組織(OCT)は培地埋め込みボイド試料の脱水及び清算、サンプルの水和を維持します。これは、水和した粘液層のより良い保存を可能にし、従って上皮生物学におけるムチンの多数の役割の研究を可能にします。この方法は、組織の最小限の処理を必要とするため、組織は、より自然な状態で保存されています。したがって凍結組織切片は染色前に、追加の処理を必要とせず、容易に免疫組織化学法を用いて解析することができます。
我々は、冷凍結腸サンプルにおけるマイクロメートル厚の分泌粘液層の保全を実証している。同じ組織をパラフィン包埋されている場合、この層を大幅に低減されます。我々はまた、植物レクチンを用いたムチン型糖鎖上に提示されるエピトープの免疫蛍光染色を示す。このアプローチの利点は、それが特別な固定剤の使用を必要とし、すでに研究室に保存されることもあり凍結組織を活用できていないということです。
Protocol
1。 10月の組織埋め込み
- 浅い発泡スチロールの箱に2 - メチルブタンにドライアイスを追加することにより、凍結風呂の準備をする。
- 組織を収穫し、優しく余分な液体を乾燥させるためにティッシュペーパーで湿った。瞬間凍結組織(液体窒素で凍結した組織)を使用している場合は、組織はクライオミクロトーム室に置くことで、-20℃まで昇温することができます。
- ちょうど足りるだけの型の底をカバーするために、ピールウェイ凍結モールドにOCTの少量を追加します。
- 金型内の組織を置き、組織を所望の向きに型の底に休まれていることを確認します。いったん凍結し、組織ブロックは下からまたは側面のいずれかから切片になります。
- 10月で組織をカバーし、凍結浴にモールドを配置。 OCTコンパウンドは、組織のフリーズのように白く点灯します。
- 一度著しい凍結袋の冷凍ブロック、場所オフモールドはがし、凍結した。
- 冷凍ブロックが保つことができる-80°Cでの使用まで。
2。セクショニング組織
- クライオミクロトーム室に置き組織ブロックを、それらが-20℃(約30分)に到達することができます。
- 3から5μm厚のセクションをカットし、セクションの上に、正に帯電したスライドガラスを配置します。組織は、スライドに付着する。
- 空気は30-60分間組織を乾燥させてください。
- スライドは、この段階で使用することも、将来の使用のために-80℃に保つことができる。
3。組織染色
- -80℃で保存したスライド℃:スライドを30分間室温で解凍して空気乾燥することができます。
- 室温で30分間、10%緩衝ホルマリンでスライドを修正しました。
- PBSまたはTBST緩衝液で3回洗浄し、各洗浄用に250mlの緩衝液中でスライドを10回浸す。 PBS緩衝液はアルカリフォスファターゼconjugと発色検出のために、しかし、免疫蛍光染色に使用することができますPBS中のリン酸塩、アルカリホスファターゼ活性を阻害するので、ated抗体は、TBSTで使用する必要があります。
- 組織切片のスライドは現在、染色する準備が整いました。
4。粘液を検出するようなアルシアンブルーと過ヨウ素酸シッフとして組織化学的染色を使用して
- アルシアンブルー染色:
- 水中でスライドをすすぎ、室温で3分間、3%酢酸でインキュベートする。
- 室温で30分間シアンブルーpH2.5の溶液を用いて染色する。
- 10分間流水でスライドを洗浄し、DI水にすすいでください。
- 室温で5分間核ファーストレッドで対比染色する。
- ウォッシュは、DI水で3回スライドします。
- 過ヨウ素酸シッフ染色:
- 水中でスライドをすすぎ、5分間作りたての1パーセント過ヨウ素酸でインキュベートする。
- DI水で3回洗浄し、一度miliQ水に浸す。
- 部屋TEMPERATURで15分間シッフ試薬で染色電子。
- 10分間流水でスライドを洗浄し、DI水にすすいでください。
- 室温で30秒間Surgipathヘマトキシリンで対比染色する。
- ウォッシュは、DI水で3回スライドします。
- インキュベートし、室温でscottの水道水で30秒をスライドします。
- DI水で3回洗浄する。
- 脱水し、100%エタノールで3迅速な変更、及びCitrisolvで3変化、2分毎に続いて95%エタノールで1分間、インキュベートすることにより、スライドをオフにします。室温でのすべて。
- 樹脂培地(Cytoseal 60)とカバースリップ上にスライドをマウントします。
5。組織化学法による糖鎖エピトープを検出するためのレクチンと抗体(表1)を用いて
- レクチンを用いた三糖鎖エピトープの蛍光検出のために、室温で10から30分間PBS中1%BSAを用いてスライドをブロックします。
- ビオチン化レクチンを用いているので、0.1%で15分間インキュベートすることにより内因性ビオチンをブロックするアビジンは、室温で0.01%ビオチンと15分間インキュベートした。
- 各ブロッキング工程の後、PBSでスライドを洗浄します。
- たて1μg/ mlのローダミン共役スクシニル小麦胚芽凝集素(sWGA)、1.3μg/ mlのビオチン化ニワトコレクチン(SNA)および5μgの/ HEPES / NaCl緩衝液(10mMのHEPES、mlではフルオレセイン結合ジャカリンの混合物を調製150mMのNaClのpHは7.5)。
- 平らな面の上または染色ボックス、および層上にレクチン混合物に置きスライド。混合ボリュームが優しく液体にパラフィルムを配置することによって低減させることができ、パラフィルムは、液体を平らにして蒸発を防ぎます。
- 暗所で室温で1時間インキュベートします。
- 洗浄はPBSで3回スライドします。
- 0.7μg/ mlのストレプトアビジン結合CY5(ビオチン-SNAを検出する)、そして暗所で室温で30分間インキュベートを備えたレイヤスライド。
- 洗浄はPBSで3回スライドします。
- 0.1&mで核を対比染色U; g / mlのDAPI。
- VectaMountマウントメディア(または任意の水性媒体)などの水性媒体とカバースリップ上にスライドをマウントします。
6。レクチン染色の特異性の制御
- レクチン染色の特異性は、前染色標的糖鎖エピトープの特定の酵素的切断によって、または小分子との競合によるどちら制御されます。
- ニワトコレクチン(SNA)の結合特異性のために酵素的切断
- 50mMの酢酸ナトリウム、pH 5.5で250 MU / mlにバクターureafaciensシアリダーゼ(AUS)を希釈します。
- 空のチップ箱の底に水を追加し、これはインキュベーション中湿潤チャンバーを形成することになる。
- 場所スライドはカバースリップとスライドとカバーのチップボックス、層150から200μlのAUSの溶液の上部トレイに表向き。気泡の生成を避けること。
- 2.5時間37℃で箱の蓋とインキュベートを閉じます。
- ウォッシュルーム気性でPBSで3回スライドさせるすべて無料のシアル酸を除去するためにature。これらのスライドは、SNA染色に陰性でなければならない。
- ジャカリンとスクシニル小麦胚芽凝集素(sWGA)特異性の競合的阻害剤
- ステップ5.4〜2エッペンドルフバイアルに用意レクチン混合物のアリコートを200μl。
- 他のバイアルに1:10希釈でバイアルとキチン加水分解物(sWGA阻害剤)のいずれかに200mMのメリビオースを(ジャカリン阻害剤)を追加します。
- 阻害剤を含有する混合物でオーバーレイ陰性対照スライドとスライドの残りの部分と同時に、室温で1時間インキュベートする。これらのスライドは、それぞれジャカリンまたはsWGA染色に陰性でなければならない。
7。代表的な結果
凍結保護剤メディアに埋め込まれた凍結組織をパラフィンに包埋した組織サンプル間の比較(10月)はmuciの染色の保全と質の顕著な違いを明らかにしたn個の糖タンパク質。そのようなアルシアンブルーと過ヨウ素酸シッフなど組織化学染料と組織染色では、凍結またはパラフィン包埋サンプル( 図1)から同等の組織切片での非常に異なる結果を生む。それは、パラフィン包埋プロセスはサンプル( 図2)から多くの糖脂質を除去するだけでなく、上皮で分泌されるムチンの分布に影響を与える時に使用される有機溶剤(キシレンまたはCitrisolv)ように見えます。結果として、粘液層は、粘膜細胞に崩壊し、主に杯細胞で発見され表示されます。凍結保護剤メディアの組織のフラッシュ凍結(10月)は、サンプルの水和を維持し、分泌されたムチン層の寸法を維持した。パラフィン包埋プロセスは、同様の方法で他の粘液関連糖鎖や糖脂質に影響を与えた。グリカン分布が見られるエピトープに対して日常的に糖鎖検出のために使用されるレクチン、( 図3)および抗体を用いて調べたムチンや糖脂質( 図6)。レクチン結合が十分に定義されておらず、糖鎖だけでなく、糖鎖構造14,15の空間分布に影響されるので、レクチン染色のための適切な制御を適用することが重要です。酵素的切断と競合阻害:ここでは、試験組織にレクチン染色を制御するための2つの方法を示しています。グリカンエピトープの開裂は、SNAによるシアル酸の結合( 図4)のための制御として例えば細菌シアリダーゼのために、糖鎖の特定の酵素を用いた組織切片を消化することによって行われていた。特定の酵素( 例えばグリコシダーゼ)を研究糖鎖エピトープを除去するために利用できない場合には、レクチン特異性は、そのようなsWGA染色にジャカリン染色またはキチン加水分解のためメリビオース( 図5)のような競争力の阻害剤を添加することにより確認することができる。
我々はルーチンにスナップ凍結組織サンプル、ことここに示さtinelyクリニックで、研究所で得られ、さらに10月に埋め込まれていて、ムチン糖タンパク質およびそれらの上に存在する多くの糖鎖を研究するために使用することができます。
| レクチン/ AB | ソース | 主要な特異性 |
| LFA | Limaxフラバス (イエロースラグ) | 末端シアル酸 |
| MAA * | Maackia amurensis(アムールMaackia) | Galβ1-RのSiaα2-3Galβ1-R / 3-O-硫酸 |
| SNA | ニワトコ (エルダーベリー) | Siaα2-6Gal /Siaα2-6GalNAc |
| WGA | 小麦胚芽 (小麦胚芽) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / SIA |
| sWGA | スクシニル小麦胚芽 (小麦胚芽) | GlcNAcの&Bη; 1-4GlcNAcβ1-4GlcNAc |
| PNA | ラッカセイ (ピーナッツ) | Galβ1-3GalNAc(変更されていないT抗原) |
| ジャカリン | パンノキ属integrifolia(ジャカリン) | Galβ1-3GalNAcは、O-結合型糖鎖に見られる |
| ECA | Erythrinaのcristagalli(コーラルツリー) | Galβ1-4GlcNAc |
| TKH2 | 抗体 | O-結合型グリカン上Siaa2-6GalNAc(STN) |
| CA19-9の | 抗体 | Siaa2-3Galβ1-4(Fuca1-3)GlcNAcを(SLE A) |
| SNH3 | 抗体 | Siaa2-3Galβ1-3(Fuca1-4)GlcNAcを(SLE x)は |
略語:Abを 、抗体、SIA、シアル酸、 ガラクトース 、ガラクトース、GalNAcで 、
表1糖鎖エピトープに対するレクチンや抗体の部分的なリスト。
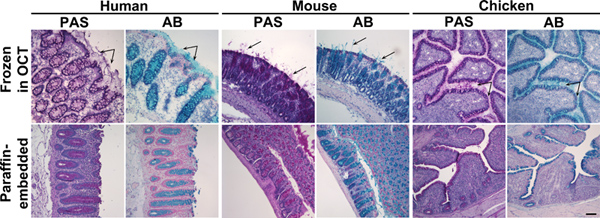
図1。アルシアンブルーと凍結およびパラフィン包埋結腸組織の過ヨウ素酸シッフ染色。ヒト、マウスまたはニワトリ結腸標本は10月中に凍結(上のパネル)またはパラフィン(下のパネル)に埋め込 まれた組織切片を過ヨウ素酸シッフ(PAS)で染色したアルシアンブルー(AB)または。これらの試薬は、それぞれ、ピンクやブルーの粘液を染色。上部パネル:凍結した組織では、杯細胞におけるムチンに加えて、分泌される粘液はまた気力だったible(矢印)。下部パネル:パラフィン包埋された組織では、粘液染色は杯細胞に限られていた。核はSurgipath(PAS)またはMayerの(AB)のヘマトキシリンで対比染色した。スケールバーは100μmを示す。 拡大図を表示するには、ここをクリックしてください 。

図2。ムチンの実質的な損失でCitrisolvインキュベーション結果。冷凍鶏肉回腸標本の連続切片を10%に固定した緩衝ホルマリンと水和保っ(左パネル)、70%、90%、20分間、100%エタノールで順次インキュベーションによるエタノールで脱水各(中央パネル)、またはエタノールで脱水し、1時間(右パネル)のCitrisolvでクリア。脱水されたサンプルは、ヘマトキシリンおよびエオシン(H&E)またはアルシアンブルー染色前にPBSに戻って再水和した。エタノールの脱水とCitrisolvクリア改善組織MORphology( 例えば 、一番上の行に、真ん中と右の画像対左の画像)。エタノールの脱水はアルシアンブルー染色(中段、左と真ん中の画像を比較してください)に有意な影響を及ぼさなかった。これとは対照的に、Citrisolvのインキュベーションはアルシアンブルー染色を減少させ、パラフィン包埋組織( 図1)に見られるものと類似していたパターンで杯細胞(中段、右の画像)に閉じ込められた。これらのデータは、パラフィン包埋された試料中の粘液顆粒の強い染色がクリアステップ中に縮小し、杯細胞の粘液の凝縮によるものであることを示唆している。凍結10月埋組織における粘液の暗く密度の低い染色は、組織内の粘液のより自然な分布を反映している。箱入りの領域の高倍率は、矢印が付いています。スケールバーは50μm(上段と中段の行)と10μm(下段)を示している。

図3。の結合凍結及びパラフィン包埋組織上のグリカンエピトープにレクチン。鶏小腸(回腸)の標本は10月(上部パネル)で凍結またはジャカリン(青)、sWGA(緑)およびSNAでプローブした(下のパネル)、パラフィンに包埋(赤)。箱入りの領域の高倍率は、矢印が付いています。凍結した組織では、O-結合型糖鎖に結合ジャカリンはルーメン(ジャカリン、上部パネル、矢印)に杯細胞からにじみ出ているように見えた構造を明らかにした。これとは対照的に、パラフィン包埋組織への結合ジャカリンは杯細胞(ジャカリン、下部パネル、矢印)および絨毛刷子縁(左下の画像、矢印)に限定されていた。 β1 - 4GlcNAcのsWGA染色部分的に凍結した組織(上部パネル、矢印)の両方でジャカリンレクチンの結合と共局在し、パラフィン包埋組織(下のパネル、矢印)インチこれとは対照的に、α2-6結合シアル酸への結合のSNAレクチン(SNA、矢じり)細胞内で、ジャカリン(色と共局在していません画像、矢印、点線の矢印が付いた青色のジャカリンが付いている赤のSNA)。スケールバーは100μm(左画像)と20μm(拡大箱入りの領域)を示しています。

図4。 SNAによるシアル酸染色のための酵素的切断を制御します。鶏小腸標本は37℃で250 MU /ミリリットルバクターureafaciensシアリダーゼ(AUS)または2.5時間の50 mM酢酸ナトリウム、pH 5.5緩衝液を用いて培養したAUSの治療は、シアル酸にSNA結合特異性を確認し、ビオチン化SNAで染色廃止。スケールバーは100μmを示す。

図5。ジャカリンとsWGA持つグリカン染色のための競合阻害コントロール。鶏小腸(回腸)の標本は特定のLECの存在下でジャカリンとsWGA混合物と共にインキュベートしたスズ阻害剤:メリビオース(中央列)、キチン加水分解物(右列)または阻害剤を含まない(およびD)。上部パネル:(左)阻害せずジャカリン染色。 (中央)ジャカリン染色はメリビオースによって阻害された。 (右)キチン加水分解物はジャカリン染色を阻害しなかった。下部パネル:(左)阻害せずに染色sWGA。 (中央)メリビオースはsWGA染色を阻害しなかった。 (右)sWGA染色はキチン加水分解物によって阻害された。この阻害は、組織とレクチンの特異的な相互作用を確認します。染色阻害のアスタリスクマーク画像。スケールバーは100μmを示す。

図6。分泌型ムチン、脂質や凍結ヒト大腸癌組織における糖鎖エピトープの検出。絨毛癌と粘液癌から大腸がん生検は、液体窒素で瞬間凍結したと10月中に包埋した。組織切片を1時間インキュベートしたガングリオシド(大腸癌マーカーCA19-9)、およびシアリルTnで見つかった糖鎖エピトープ - - との30分間のインキュベーションに続いてムチンに豊富な糖鎖エピトープ(TKH2抗体で検出)、分泌ムチンMUC5AC、シアリルルイスAに対する抗体を用いたビオチン化ロバ抗マウスIgG二次抗体、ペルオキシダーゼ·アビジン結合物と30分間のインキュベーション。追加の組織をペルオキシダーゼ·アビジン結合物と30分間のインキュベーションに続いて、ビオチン化レクチンSNAおよびsWGAで1時間インキュベートした。ペルオキシダーゼ染色は、AECのキットを用いて開発されました。ブラックスケールバーは200μmを示す。
Discussion
凍結組織の粘液とグリカンエピトープの保全は、パラフィン包埋した組織のものよりも優れている。我々は、分泌された粘液層の保全( 図1および図3)、パラフィン包埋された組織と比較して凍結した組織内の3糖鎖構造( 図3)の分布を示した。そのようなカルノア液(60%エタノール、30%クロロホルム、10%酢酸)17などの特殊な固定剤は、組織サンプル中の粘液層の最適な保全のために開発されている。理想的には、この溶液は粘液研究のために専用されており、粘液層16から17の滑らかな外観を維持することが示された組織サンプルを収集するために使用されるべきである。 10月中に埋め込まれた未定着凍結サンプルの粘液層が表示され、ゴツゴツしたいくつかの地域で組織から切り離すかもしれませんが、全体的な層の厚さはカルノア液およびembeddで固定した組織で観察されたものと一致しているパラフィン16から17のed。 16 -例えば、凍結ヒト結腸組織切片における粘液層がCarnoy's固定ヒト結腸サンプル55.4±2.5μmである(204.8μmの範囲7.7)のために報告された範囲内にある〜100μm程度( 図1)です。
それは、何十年も前から知られており、その結果生体試料18〜30%収縮し、組織13からキシレンなどの有機溶剤、Citrisolvとある程度クロロホルム抽出脂質、糖脂質とは、タンパク質がその中のエタノール脱水の結果。固定(10%緩衝ホルマリン)、脱水(増加エタノール濃度)、およびクリア(Citrisolvまたはキシレン):パラフィン包埋組織のための処理は、次の手順が含まれます。未固定凍結組織切片の上にこれらの手順を模倣することによって、我々はCitrisolvが(Figurパラフィン包埋組織のものに類似している組織形態が生じる凍結組織切片からの粘 液を抽出することを実証e 2と、右パネル)。これとは対照的に、粘液層( 図2、左と中央パネル)ホルマリンまたはエタノールとのインキュベーションによって変化しなかった。 Citrisolv /キシレンで長時間のインキュベーション、粘液層の崩壊の結果を必要とする標準的なパラフィン包埋手順のクリアステップ、このことが示唆している。ホルマリン固定は粘液層にダメージを与えないとホルマリンで固定した凍結組織切片を、容易にグリカン、糖脂質およびタンパク質( 図2、図3及び図6)に対するレクチンや抗体で染色することができます。これらの効果は、膜結合タンパク質および組織病理学の研究のために無視できるかもしれないが、彼らはそのような分泌粘液層のような高度に水和した構造のために荒廃しています。しかしムチンの組織学的研究はまだ粘液層の保全が次善であるパラフィン包埋サンプルを主に行っています。そのような自体の正確なIDとして粘液層組成の深さの分析でcretedまたは膜結合MUC糖タンパク質の組み合わせは、特異的抗体とタンパク質バックボーンの同定のための質量分析を必要とします。粘液層の保全は、このような研究のための初期の要件ですが。
多くの研究室では、さまざまなプロジェクトのために、過去に収集した10月中に凍結組織サンプルを持って、これらの組織は、容易にムチン、糖脂質および粘液の保全のために独自に設計された特殊な固定液中に組織を収集する必要性を排除する糖鎖分布を調べるために使用することができます。凍結した組織では、最小限の処理を受けるため、自然の中で水和している糖鎖の天然分布は、保持されます。これは、微生物 - 宿主相互作用の分野では特に重要である。これらの "障壁"分子飾る分泌ムチンと多くのグリカン構造の自然主義的な分布と個体数の知識は、宿主の防御、微生物の搾取とpathogenesを理解する上で鍵となるだろうです。
Disclosures
特別な利害関係は宣言されません。
Acknowledgments
著者らは、撮影時の彼の助けニコールM.ネメト(ジョージア大学)と鶏の組織を収穫で彼らの助けのためのジャンヌ·M·フェア(LANL)と、スティーブンA.スプリンガーに感謝したいと思います。この研究ではすべての鳥の世話は、ロスアラモス国立セキュリティ、LLCは、ロスアラモスのオペレータの機関動物実験委員会によって承認された実験動物とすべてのプロトコルの人道的使用のための健康のガイドラインの国立研究所を満たしていた米国エネルギー省との契約番号DE-AC52-06NA25396下の国立研究所。本研究ではマウスのケアはUCSDの動物承認されたプロトコルに準拠しています。ヒトの組織は、UCSDの承認されたIRBのプロトコルの一部として得られた。この作品は、神経疾患や脳卒中の国立研究所(ニューロ顕微鏡共用施設、UCサンディエゴ)からカリフォルニアラボ料大統領プログラム(PG)の大学とグラントNS047101から助成118645によってサポートされていました。
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



