Summary
Muestras de tejido congeladas no fijadas embebidas en un medio de temperatura óptima de corte (OCT) se puede utilizar para estudiar la distribución natural y glicosilación de moco secretado. En este enfoque de procesado de tejido es mínima y la presentación natural de glicolípidos, mucinas y glycan epítopos-se conserva. Las secciones de tejido pueden ser analizadas por inmunohistoquímica usando detección de fluorescencia o cromogénico.
Abstract
Las mucinas son complejos y fuertemente glicosilada unidos a O glicoproteínas, que contienen más de 70% en peso de carbohidratos 1-3. Mucinas secretadas, producida por las células caliciformes y la mucosa gástrica, el andamio para proporcionar una capa de moco micrómetros de espesor que recubre el epitelio del intestino y el tracto respiratorio 3,4. Además de las mucinas, las capas de moco también contienen péptidos antimicrobianos, citoquinas, y las inmunoglobulinas 5-9. La capa de moco es una parte importante de la inmunidad innata del huésped, y constituye la primera línea de defensa contra los microorganismos invasores 8,10-12. Como tal, el moco está sujeta a numerosas interacciones con microbios, ambos patógenos y simbiontes, y mucinas secretadas forman una interfaz importante para estas interacciones. El estudio de tales interacciones biológicas generalmente implica métodos histológicos para la recogida de tejido y la tinción. Los dos métodos más comúnmente utilizados para la recogida de tejidos histológicos y preserción en la clínica y en los laboratorios de investigación son: la fijación en formol seguido por inclusión en parafina, y la congelación de tejidos, seguido de la incorporación en la crio-protectores de los medios de comunicación.
Embebidos en parafina las muestras de tejido producir secciones con cualidades óptimas para la visualización histológica que incluyen la claridad y la morfología bien definida. Sin embargo, durante el proceso de inclusión en parafina de un número de epítopos se altera y con el fin de estudiar estos epítopos, las secciones de tejido tiene que ser procesado con uno de los muchos métodos de recuperación del epítopo 13. Mucinas secretadas y los lípidos se extraen del tejido durante la etapa de compensación de inclusión en parafina, que requiere prolongar la incubación con solventes orgánicos (xileno o Citrisolv). Por lo tanto, este enfoque es sub-óptimo para estudios centrados en la naturaleza y distribución de las mucinas y moco in vivo.
Por el contrario, los tejidos de congelación en la temperatura óptima de corte (OCT) un medio de inclusiónanula la deshidratación y la limpieza de la muestra, y mantiene la hidratación de la muestra. Esto permite una mejor conservación de la capa de moco hidratado, y por lo tanto permite el estudio de las numerosas funciones de las mucinas en la biología epitelial. Como este método requiere un procesamiento mínimo del tejido, el tejido se conserva en un estado más natural. Por lo tanto congelados secciones tejidos no requieren ningún procesamiento adicional antes de la tinción y pueden ser fácilmente analizados usando métodos de inmunohistoquímica.
Se demuestra la conservación de los micrómetros de espesor capa de mucus secretado en muestras de colon congelados. Esta capa se reduce drásticamente cuando los mismos tejidos se incrustan en parafina. También se demuestra la tinción de inmunofluorescencia de epítopes de glicano presentados en mucinas utilizando lectinas de plantas. La ventaja de este enfoque es que no requiere el uso de fijadores especiales y permite la utilización de tejidos congelados que pueden estar ya conservados en el laboratorio.
Protocol
1. Tissue Embedding en octubre
- Prepare un baño de congelación mediante la adición de hielo seco para 2-metil butano en una caja de espuma de poliestireno superficial.
- Se recoge el tejido, y suavemente húmedo en un pañuelo de papel para secar el exceso de líquido. Si se utiliza snap-congelado tejido (tejido que se congeló en nitrógeno líquido), permitir que el tejido se caliente a -20 ° C colocándolo en una cámara de crio-micrótomo.
- Añadir una pequeña cantidad de octubre al molde Peel-A-Way congelación, lo suficiente para cubrir el fondo del molde.
- Coloque el tejido en el molde, asegúrese de que el tejido se apoya sobre el fondo del molde en la orientación deseada. Una vez congelado, el bloque de tejido se seccionaron ya sea desde el fondo o desde los lados.
- Cubrir el tejido con octubre, y colocar el molde en el baño de congelación. El compuesto octubre se volverá blanco como el tejido se congela.
- Una vez congelado, pelar el molde del bloque congelado y colocar en una bolsa de congelación marcada.
- Los bloques congelados se pueden mantenera -80 º C hasta su uso.
2. Tejido Seccionamiento
- Coloque bloques de tejido en la cámara criogénica micrótomo, y les permiten llegar a -20 º C (unos 30 minutos).
- Cortar una sección gruesa 3-5 micras, y colocar un portaobjetos de vidrio cargado positivamente en la parte superior de la sección. El tejido se adhiere a la diapositiva.
- Seque al aire los tejidos durante 30-60 min.
- Los portaobjetos se pueden utilizar en esta etapa, o pueden ser mantenidas a -80 ° C para su uso futuro.
3. La tinción de tejidos
- Las diapositivas que fueron almacenadas a -80 ° C: deje que los portaobjetos para descongelar y secar al aire a temperatura ambiente durante 30 min.
- Fijar los portas con 10% formalina tamponada durante 30 min a temperatura ambiente.
- Se lava tres veces en PBS o tampón TBST, para cada lavado Sumergir los portaobjetos 10 veces en tampón de 250 ml. Tampón PBS se puede utilizar para la tinción de inmunofluorescencia, sin embargo, para la detección cromogénica con fosfatasa alcalina-ConjugATED anticuerpo, TBST debe ser usado ya que el fosfato en PBS inhibe la actividad de la fosfatasa alcalina.
- Muestras de tejido se desliza ahora está listo para ser teñido.
4. Utilizando tinciones histoquímicas como Alcian Blue y ácido periódico de Schiff para detectar moco
- Alcian Blue mancha:
- Enjuagar los portaobjetos en agua, se incuba en 3% de ácido acético durante 3 min a temperatura ambiente.
- Tiñen con Azul Alcian pH 2,5 solución durante 30 min a temperatura ambiente.
- Lavar los portaobjetos en agua corriente del grifo durante 10 minutos, enjuague con agua DI.
- Contrateñir en Fast Red nuclear durante 5 min a temperatura ambiente.
- Lavado de los portaobjetos tres veces en agua DI.
- Ácido periódico de Schiff mancha:
- Enjuagar los portaobjetos en agua, incubar en recién preparada 1% de ácido periódico durante 5 min.
- Lavar tres veces en agua DI, sumergir una vez en agua miliQ.
- Teñir con reactivo de Schiff durante 15 min a temperatur ambientee.
- Lavar los portaobjetos en agua corriente del grifo durante 10 minutos, enjuague con agua DI.
- Contrateñir en Surgipath hematoxilina durante 30 segundos a temperatura ambiente.
- Lavado de los portaobjetos tres veces en agua DI.
- Incubar los portaobjetos 30 segundos en agua del grifo de Scott a temperatura ambiente.
- Lavar tres veces en agua DI.
- Deshidratar y aclarar portaobjetos mediante la incubación de 1 min en 95% de etanol, seguido de tres cambios rápidos en 100% de etanol, y tres cambios en Citrisolv, 2 min cada una. Todos a temperatura ambiente.
- Montar las diapositivas en cubreobjetos con medio resinoso (Cytoseal 60).
5. Uso de lectinas y anticuerpos (Tabla 1) para detectar epítopes de glicano por métodos histoquímicos
- Para la detección de fluorescencia de tres epítopes de glicano utilizando lectinas, bloquear los portaobjetos con 1% de BSA en PBS durante 10-30 minutos a temperatura ambiente.
- Desde una lectina biotinilada se utiliza, bloquear la biotina endógena por incubación de 15 min con 0,1%Avidina, seguido por 15 min de incubación con 0,01% de biotina a temperatura ambiente.
- Lavar los portaobjetos en PBS después de cada etapa de bloqueo.
- Recién preparar una mezcla de 1 g / ml de rodamina conjugada con aglutinina de germen de trigo succinilada (sWGA), 1,3 mg / ml biotinilado aglutinina de Sambucus nigra (SNA) y 5 mg / ml de fluoresceína conjugado jacalin en HEPES / NaCl (10 mM HEPES, 150 mM NaCl pH 7,5).
- Colocar los portaobjetos en una superficie plana o en una caja de tinción, y la capa de la mezcla de lectina en la parte superior. El volumen de la mezcla se puede reducir colocando suavemente Parafilm sobre el líquido, el parafilm aplana el líquido y evita la evaporación.
- Incubar 1 hora a temperatura ambiente en la oscuridad.
- Lavado de los portaobjetos tres veces con PBS.
- Diapositivas capa con 0,7 ug / ml de estreptavidina conjugada con Cy5 (para detectar la biotina-SNA), y se incuba durante 30 min a temperatura ambiente en la oscuridad.
- Lavado de los portaobjetos tres veces con PBS.
- Contrateñir núcleos con 0,1 & mu, g / ml DAPI.
- Montar diapositivas en cubreobjetos con medio acuoso tal como VectaMount medios de montaje (o cualquier medio acuoso).
6. El control de la especificidad de tinción de lectina
- Especificidad tinción de lectina se controla por escisión enzimática específica de diana glicano epítopo antes de la tinción o por competencia con las moléculas pequeñas.
- La escisión enzimática de Sambucus nigra aglutinina (SNA) especificidad de unión
- Diluir Arthrobacter ureafaciens sialidasa (AUS) a 250 mU / ml en 50 mM de acetato de sodio pH 5,5.
- Añadir agua a la parte inferior de un vacío punta de la caja, esta formará una cámara húmeda durante la incubación.
- Colocar los portaobjetos boca arriba en la bandeja superior de la punta de la caja, la capa de 150-200 l solución AUS en la diapositiva y cubrir con un cubreobjetos. Evitar la formación de burbujas de aire.
- Cerrar la tapa de la caja y se incuba a 37 ° C durante 2,5 hr.
- Lavado de los portaobjetos tres veces en PBS a temple habitacióntura para eliminar todos los ácidos siálicos libres. Estas diapositivas deben ser negativos para la tinción de SNA.
- Los inhibidores competitivos de jacalin y germen de trigo crioaglutininas succinilada especificidad (sWGA)
- Alícuota de 200 l de la mezcla preparada en la etapa lectina de 5,4 a dos viales Eppendorf.
- Añadir 200 mM Melibiosa (inhibidor jacalin) a uno de los viales y quitina-hidrolizado a una dilución 1:10 (sWGA inhibidor) al otro vial.
- Superposición de portaobjetos de control negativas con los inhibidores de las mezclas que contienen y se incuba 1 hora a temperatura ambiente al mismo tiempo que el resto de las diapositivas. Estas diapositivas deben ser negativos para jacalin o manchas sWGA, respectivamente.
7. Los resultados representativos
Una comparación entre las muestras de tejido embebidas en parafina de los tejidos congelados incrustados en crio-protectores de los medios de comunicación (OCT) reveló diferencia sorprendente en la conservación y la calidad de la tinción para mucin glicoproteínas. Tinción de tejidos con tintes histoquímicos, tales como Azul de Alcian y ácido periódico de Schiff, producen resultados muy diferentes en secciones de tejidos embebidos comparables de muestras congeladas o de parafina (Figura 1). Parece que el disolvente orgánico (xileno o Citrisolv) que se utiliza durante el proceso de incrustación de parafina afecta a la distribución de las mucinas secretadas en epitelios, así como la eliminación de la mayor parte de los glicolípidos de las muestras (Figura 2). Como resultado, la capa de moco aparecerá plegada en las células de la mucosa y se encuentra principalmente en las células caliciformes. Congelación de los tejidos en flash crio-protectores de los medios de comunicación (OCT) mantuvo la hidratación de la muestra y conserva las dimensiones mucinas secretadas capa. El proceso de inclusión en parafina afectados otros asociados moco-glicanos y glicolípidos de una manera similar. Glycan distribución se examinó utilizando lectinas, que se utilizan habitualmente para la detección de glicano (Figura 3) y anticuerpos contra epítopos que se encuentran enmucinas y glicolípidos (Figura 6). Debido a lectina de unión no está bien definida y es afectada por la distribución espacial de los glicanos, así como la estructura de glicano 14,15, es importante aplicar los controles apropiados para la tinción de lectina. Aquí se muestran dos métodos para el control de la tinción de lectina en los tejidos ensayados: La escisión enzimática y la inhibición competitiva. La escisión de los epítopes de glicano se realizó mediante la digestión de la sección de tejido con glicanos específicos de enzimas, por ejemplo sialidasa bacteriana como control para la unión de ácido siálico por SNA (Figura 4). En los casos en que la enzima específica (por ejemplo glicosidasa) no está disponible para retirar el epítopo glicano estudiado, especificidad lectina puede ser confirmado mediante la adición de un inhibidor competitivo como Melibiosa para la tinción jacalin o hidrolizado de quitina-para la tinción sWGA (Figura 5).
Estamos aquí demostrar que se congelaron las muestras de tejido, que son routinely obtenida en la clínica y en los laboratorios de investigación, puede integrarse también en octubre y se utilizan para estudiar las glicoproteínas mucina y los glicanos presentes muchos de ellos.
| Lectina / Ab | Fuente | Mayor especificidad |
| LFA | Limax flavus (babosa amarilla) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfato en Galβ1-R |
| SNA | Sambucus nigra (saúco) | Siaα2-6Gal / Siaα2-6GalNAc |
| Ventajas de Windows Original | Triticum vulgaris (germen de trigo) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Triticum vulgaris succinilados (germen de trigo) | GlcNAc & beta, 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (maní) | Galβ1-3GalNAc (sin modificar el antígeno T) |
| Jacalin | Artocarpus integrifolia (jacalin) | Galβ1-3GalNAc encontrado en O-glicanos ligados |
| ECA | Erythrina crista (árbol de Coral) | Galβ1-4GlcNAc |
| TKH2 | Anticuerpo | Siaa2-6GalNAc (STN) a O-glicanos ligados |
| CA19-9 | Anticuerpo | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Anticuerpo | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (LES x) |
Abreviaturas: Ab, anticuerpos; Sia, ácido siálico; Gal, galactosa; GalNAc,
Tabla 1. Una lista parcial de las lectinas y anticuerpos para epítopes de glicano.
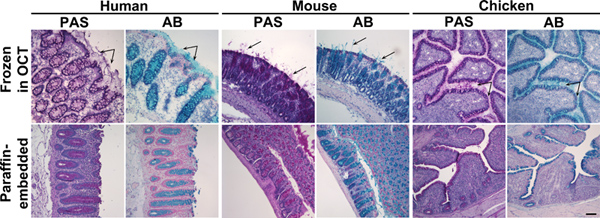
Figura 1. Alcian Blue y tinción ácido periódico de Schiff de tejidos de colon congeladas y en parafina. Las secciones de tejido de humano, de ratón o de pollo especímenes de colon congeladas en OCT (panel superior) o embebidos en parafina (panel inferior) se tiñeron con ácido peryódico de Schiff (PAS) o Alcian Blue (AB). Estos reactivos mancha de moco de color rosa o azul, respectivamente. Panel superior: En tejidos congelados, además de mucinas en las células caliciformes, moco secretado era también visible (flechas). Panel inferior: En tejidos incluidos en parafina, la tinción de moco se limitaba a las células caliciformes. Los núcleos se contratiñeron con Surgipath (PAS) o de hematoxilina de Mayer (AB). La barra de escala indica 100 micras. Haga clic aquí para ampliar la cifra .

Figura 2. Resultados Citrisolv de incubación en una pérdida sustancial de las mucinas. Las secciones seriadas de las muestras congeladas de pollo íleon fueron fijadas en 10% formalina tamponada y se mantiene hidratada (panel izquierdo), se deshidrataron en etanol mediante incubación secuencial en 70%, 90% y 100% de etanol durante 20 min cada (panel central), o se deshidrataron en etanol y se aclaró con Citrisolv durante 1 h (panel derecho). Muestras deshidratadas se rehidrataron volver a PBS antes de hematoxilina y eosina (H & E) tinción con azul Alcian o. Etanol deshidratación y Citrisolv compensación mejorada tejido morfología (fila por ejemplo, superior, medio e imágenes derecha versus imagen de la izquierda). Deshidratación de etanol no tuvo ningún efecto significativo sobre la tinción con azul Alcian (fila del medio, comparar imágenes izquierda y centro). En contraste, la incubación Citrisolv tinción con Azul de Alcian reducido y confinado a las células caliciformes (fila del medio, imagen derecha) en un patrón que es similar a la observada en tejidos incluidos en parafina (Figura 1). Estos datos implican que la fuerte tinción de los gránulos de moco en las muestras incluidas en parafina se debe a la contracción y condensación de moco en las células caliciformes durante la etapa de compensación. La tinción más débil y menos densa de moco en octubre congeladas de tejidos embebidos refleja una distribución más natural de mucus en el tejido. Mayores aumentos de las zonas en caja están marcados con flechas. Las barras de escala indican 50 micras (filas superior y central) y 10 micras (fila inferior).

Figura 3. La unión delectinas a epítopes de glicano sobre tejidos congelados y embebidos en parafina. Pollo intestino delgado (íleon) Las muestras congeladas en OCT (paneles superiores) o embebidos en parafina (paneles inferiores) se probaron con jacalin (azul), sWGA (verde) y SNA (rojo ). Mayores aumentos de las zonas en caja están marcados con flechas. En los tejidos congelados de unión a O-glicanos ligados jacalin reveló estructuras que parecían ser la exudación de células caliciformes en el lumen (jacalina, panel superior, flechas). En contraste, la unión a tejidos incluidos en parafina jacalin se limitaba a las células caliciformes (jacalina, panel inferior, flechas) y al borde en cepillo vellosidades (imagen inferior izquierda, flecha). tinción sWGA de β1-4GlcNAc parcialmente co-localizada con la unión de la lectina jacalin en ambos tejidos congelados (panel superior, flechas), y en tejidos incluidos en parafina (panel inferior, flechas). En contraste, la lectina SNA unión a α2-6 ácidos siálicos unidos es intracelular (SNA, puntas de flecha), y no co-localizar con jacalin (colorimagen, la SNA en rojo marcado con una flecha, jacalin en azul marcada con la flecha de puntos). Las barras de escala indican 100 micras (imagen izquierda) y 20 m (magnificadas áreas enmarcadas).

Figura 4. La escisión enzimática de control para la tinción de ácido siálico con SNA. Especímenes de pollo intestino delgado se incubaron con 250 mU / ml Arthrobacter ureafaciens sialidasa (AUS) o con 50 mM de acetato de sodio pH 5,5 tampón durante 2,5 horas a 37 ° C. AUS tratamiento elimina la tinción con biotina SNA, lo que confirma la especificidad de unión a ácidos SNA siálico. La barra de escala indica 100 micras.

Figura 5. Control de inhibición competitiva para la tinción de glicano con jacalin y sWGA. Pollo intestino delgado (íleon) muestras fueron incubadas con una mezcla jacalin y sWGA en presencia de LEC específicainhibidores de estaño: melibiosa (columna central), quitina-hidrolizado (columna derecha) o sin inhibidor (A y D). Panel superior: (izquierda) tinción jacalin sin inhibidores. (Centro) jacalin tinción fue inhibida por Melibiosa. (Derecha), hidrolizado de quitina no inhibió la tinción jacalin. Panel inferior: (izquierda) tinción sWGA sin inhibidor. (Centro) Melibiosa no inhibió la tinción sWGA. (Derecha) tinción sWGA fue inhibida por quitina-hidrolizado. Esto confirma la inhibición de la interacción específica de lectinas con los tejidos. Los asteriscos marca de imagen de la inhibición de la tinción. La barra de escala indica 100 micras.

Figura 6. La detección de las mucinas secretoras, glicolípidos y epítopes de glicano en congelados tejidos humanos con cáncer colorrectal. Biopsias de cáncer colorrectal carcinoma de las vellosidades y carcinoma mucoso se snap-congelado en nitrógeno líquido y se embebieron en octubre Las secciones de tejido se incubaron durante 1 hcon anticuerpos contra la mucina secretada MUC5AC, sialil Lewis a - glicano epítopo encontrado en gangliósidos (cáncer colorrectal marcador CA 19-9), y sialil-Tn - abundante epítopo de glicanos de las mucinas (detectada con TKH2 anticuerpo), seguido de 30 minutos de incubación con burro biotinilado anti-ratón IgG anticuerpo secundario, y 30 min de incubación con estreptavidina conjugada con peroxidasa. Otros tejidos se incubaron durante 1 h con el biotinilado SNA lectinas y sWGA, seguido de 30 minutos de incubación con estreptavidina conjugada con peroxidasa. Tinción de peroxidasa fue desarrollado utilizando AEC kit. Barra de escala indica Negro 200 micras.
Discussion
La preservación de epítopos de moco y glicano en tejidos congelados es superior a la de los tejidos que se incluyeron en parafina. Hemos demostrado la preservación de la capa de mucosidad secretada (Figuras 1 y 3) y la distribución de las tres estructuras de glicanos (Figura 3) en tejidos congelados en comparación con tejidos incluidos en parafina. Fijadores especializados tales como una solución de Carnoy (60% de etanol, 30% de cloroformo, 10% de ácido acético) 17 se han desarrollado para la conservación óptima de la capa de moco en las muestras de tejido. De manera óptima, esta solución debería ser utilizado para recoger muestras de tejido que están dedicados para los estudios de moco y se muestra para conservar el aspecto liso de la capa de moco 16-17. La capa de moco en las muestras congeladas no fijadas incrustado en octubre aparece rugoso y en algunas zonas puede desprenderse del tejido, sin embargo, el espesor de la capa es en general de acuerdo con la observada en los tejidos que se fijaron con solución de Carnoy y embedded en parafina 16-17. Por ejemplo, la capa de moco congelado en la sección de tejido humano de colon es de ~ 100 m (Figura 1), que se encuentra dentro del rango reportado para Carnoy's fijo muestra colon humano 55,4 ± 2,5 micras (rango de 7,7 a 204,8 m) 16.
Se ha sabido desde hace décadas que los resultados de deshidratación de etanol en ~ 30% la contracción de las muestras biológicas 18, y que los disolventes orgánicos tales como xileno, Citrisolv y lípidos extracto de cloroformo, glucolípidos y, en cierta medida, las proteínas de los tejidos 13. Procesamiento de tejidos para la inclusión en parafina incluye las siguientes etapas: fijación (10% formalina tamponada), deshidratación (aumento de la concentración de etanol) y de compensación (Citrisolv o xileno). Al imitar estos pasos no fijadas sobre secciones de tejido congeladas, hemos demostrado que Citrisolv extrae la mucosidad de las secciones de tejido congeladas resultantes en la morfología del tejido que es similar a la de los tejidos incluidos en parafina (Figure 2, panel derecho). En contraste, la capa de mucus no se alteró por la incubación con formalina o etanol (Figura 2, izquierda y paneles centrales). Esto sugiere que la etapa de compensación de procedimiento estándar de inclusión en parafina, que requiere una incubación prolongada en Citrisolv / xileno, da como resultado el colapso de la capa de moco. La fijación con formalina no daña la capa de moco y secciones de tejidos congelados que fueron fijadas con formalina fácilmente se puede teñir con lectinas y anticuerpos contra glicanos, glicolípidos y proteínas (Figuras 2, 3 y 6). Estos efectos pueden ser insignificantes para el estudio de las proteínas unidas a la membrana y el tejido patología, pero tienen efectos devastadores para las estructuras altamente hidratadas tales como la capa de moco secretado. Sin embargo los estudios histológicos de las mucinas están siendo llevados a cabo con muestras embebidas en parafina, en el que la preservación capa de moco es subóptima. En el análisis en profundidad de la capa de moco composición tal como la identidad exacta de sí mismocreted o unido a la membrana de glicoproteína MUC requieren combinaciones de anticuerpos específicos y espectrometría de masas para la identificación de las cadenas principales de proteínas. La preservación de la capa de moco es más que el primer requisito para dichos estudios.
Muchos laboratorios han muestras de tejidos congelados en OCT que fueron recogidos en el pasado para diferentes proyectos, estos tejidos pueden usarse fácilmente para estudiar las mucinas, glicolípidos y de distribución de glicano que elimina la necesidad de recoger los tejidos en fijadores especiales que están diseñados exclusivamente para la preservación moco. Los tejidos congelados someterse a un procesamiento mínimo y por lo tanto la distribución natural de los glicanos, que son hidratados en la naturaleza, se conserva. Esto es especialmente importante en el campo de las interacciones huésped microbiano. El conocimiento de la distribución y abundancia de naturalista mucinas secretadas y las estructuras de glicanos muchas decorar estas moléculas "barrera" será clave en la comprensión de defensa del huésped, la explotación microbiana y patógenoses.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Los autores desean agradecer a Nicole M. Nemeth (Universidad de Georgia) y Jeanne M. Fair (LANL) por su ayuda en la recolección de tejidos de pollo, y Steven A. Springer por su ayuda durante el rodaje. El cuidado de las aves en este estudio fue de acuerdo con los Institutos Nacionales de Salud directrices para el uso humano de los animales de laboratorio y todos los protocolos fueron aprobados por el Cuidado de Animales institucional y el Comité de Uso de Los Alamos National Security, LLC, operador de Los Alamos Laboratorio Nacional bajo el Contrato No. DE-AC52-06NA25396 con el Departamento de Energía de EE.UU.. El cuidado de los ratones en este estudio está en conformidad con UCSD protocolo animal aprobado. Los tejidos humanos se obtuvieron como parte del protocolo de UCSD IRB aprobado. Este trabajo fue apoyado por la beca 118645 de la Universidad de California Cuota del Programa Laboratorio Presidente (PG) y NS047101 subvención del Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (Fondo para Microscopía Neurociencia compartido, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



