Summary
Bevegelig frosne vevsprøver innebygd i Optimal Cutting Temperatur medium (OCT) kan brukes til å studere naturlig fordeling og glykosylering av utskilt slim. I denne tilnærmingen vev behandlingen er minimal og den naturlige presentasjon av glykolipider mucins og glycan-epitoper er bevart. Vevsdelene kan analyseres ved immunhistokjemi med fluorescens eller kromogen deteksjon.
Abstract
Mucins er komplekse og tungt glykosylert O-koblede glykoproteiner, som inneholder mer enn 70% karbohydrat etter vekt 1-3. Utskilt mucins, produsert av goblet celler og mage mucosa, gi stillas for en mikrometer tykt slim lag som linjer epitel i tarmen og luftveier 3,4. I tillegg til mucins, slim lag også inneholde antimikrobielle peptider, cytokiner, og immunglobuliner 5-9. Slim laget er en viktig del av verten medfødte immunitet, og danner den første linjen i forsvaret mot invaderende mikroorganismer 8,10-12. Som sådan, er slimet gjenstand for en rekke interaksjoner med mikrober, både patogener og symbionter, og skilles mucins danner et viktig grensesnitt for disse sammenhengene. Studiet av slike biologiske interaksjoner innebærer vanligvis histologiske metoder for vev innsamling og farging. De to mest brukte histologiske metoder for vev innsamling og Preservasjon i klinikken og i forskningslaboratorier er: formalin fiksering etterfulgt av parafin embedding, og vev fryser, etterfulgt av å sette inn i Cryo-protectant medier.
Parafin-innebygde vevsprøver produsere deler med optimale kvaliteter for histologisk visualisering inkludert klarhet og veldefinert morfologi. Men under parafin innebygging prosessen en rekke epitoper blir endret og for å studere disse epitoper, vevssnitt må viderebehandles med en av mange epitop uttaksmetodene 13. Utskilte mucins og lipider er hentet fra vevet under parafin-embedding clearing steg, som krever forlenge inkubasjon med organiske løsemidler (xylen eller Citrisolv). Derfor denne tilnærmingen er sub-optimal for studier med fokus på natur og distribusjon av mucins og slim in vivo.
I kontrast, frysing vev i Optimal Cutting Temperatur (OCT) innebygging medium enhulrom dehydrering og clearing av prøven, og opprettholder prøven hydrering. Dette gir bedre bevaring av hydratisert slimlaget, og dermed tillater studiet av de tallrike roller mucins i epithelial biologi. Som denne metoden krever minimal behandling av vev, er vevet bevart i en mer naturlig tilstand. Derfor frosset vev seksjoner ikke krever noen ytterligere behandling før farging og kan lett analyseres ved hjelp av immunhistokjemi metoder.
Vi viser bevaring av mikrometer tykt utskilt slimlaget i frosne kolon prøver. Dette laget er drastisk redusert når de samme vev er innebygd i parafin. Vi viser også immunfluorescens farging av sukkerkjedene epitoper presentert på mucins bruker anlegget lektiner. Fordelen med denne tilnærmingen er at den ikke krever bruk av spesielle fiksativer og tillater utnytte frosne vev som kan allerede bli bevart i laboratoriet.
Protocol
1. Tissue Embedding i OCT
- Forbered et iskaldt bad ved å legge tørris til 2-metyl butan i et grunt Styrofoam boks.
- Høste vevet, og forsiktig fuktig på en vev papir for å tørke overflødig væske. Hvis du bruker snap-frosne vev (vev som var frosset i flytende nitrogen), la vevet å varme opp til -20 ° C ved å plassere den i en Cryo-mikrotom kammer.
- Tilsett en liten mengde oktober til Peel-A-Way fryseform, akkurat nok til å dekke bunnen av formen.
- Plasser vevet i støpeformen, husk vevet hvilte på bunnen av formen med ønsket orientering. Når frosset vil vevsblokk være seksjonert enten fra bunnen eller fra sidene.
- Dekk vev med OCT, og plasser formen i iskaldt bad. OCT forbindelsen blir hvit som vevet fryser.
- Når frosset, skrelle mold av den frosne blokk og plasser i en markert frysing bag.
- De frosne blokker kan holdesved -80 ° C inntil bruk.
2. Tissue Seksjonering
- Sted vevsblokker i Cryo-mikrotom kammer, og tillate dem å nå -20 ° C (ca 30 min).
- Skjær en 3-5 mikrometer tykk delen, og plasser en positivt ladet glass lysbilde på toppen av seksjonen. Vevet vil følge lysbildet.
- Lufttørke vev for 30-60 min.
- Lysbildene kan brukes på dette stadiet, eller de kan holdes ved -80 ° C for fremtidig bruk.
3. Tissue Farging
- Lysbilder som ble lagret ved -80 ° C: tillat lysbildene å tine og lufttørke ved romtemperatur i 30 min.
- Fest objektglassene med 10% bufret formalin i 30 min ved romtemperatur.
- Vask tre ganger i PBS eller TBST buffer, for hver vask dyppe lysbildene 10 ganger i 250 ml buffer. PBS buffer kan benyttes for immunfluorescens farging, men for kromogent deteksjon med alkalisk fosfatase-conjugrerte antistoff bør TBST brukes siden fosfatet i PBS hemmer Alkalisk fosfatase aktivitet.
- Vevsdelene lysbilder er nå klar til å bli farget.
4. Bruke histochemical Flekker som Alcian Blue og Perjodsyre Schiff å oppdage Slim
- Alcian Blå flekk:
- Skyll lysbildene i vann, inkuberes i 3% eddiksyre i 3 min ved romtemperatur.
- Flekken med Alcian blå pH 2,5 løsning i 30 minutter ved romtemperatur.
- Vask lysbildene i rennende springvann i 10 minutter, skyll i DI vann.
- Counterstain i Nuclear Fast Red i 5 min ved romtemperatur.
- Wash glir tre ganger i DI vann.
- Periodisk Acid Schiff flekk:
- Skyll lysbildene i vann, inkuberes i nylagde 1% Perjodsyre i 5 min.
- Vask tre ganger i DI vann, dypp en gang i miliQ vann.
- Stain med Schiff reagens i 15 min ved romtemperature.
- Vask lysbildene i rennende springvann i 10 minutter, skyll i DI vann.
- Counterstain i Surgipath Hematoxylin i 30 sek ved romtemperatur.
- Wash glir tre ganger i DI vann.
- Inkuber lysbilder 30 sek i Scotts springvann ved romtemperatur.
- Vask tre ganger i DI vann.
- Dehydrere og fjerner lysbilder ved inkubering 1 min i 95% etanol, etterfulgt av tre raske endringer i 100% etanol, og tre endringer i Citrisolv, 2 min hver. Alt ved romtemperatur.
- Montere lysbilder på dekkglass med resinous medium (Cytoseal 60).
5. Bruke Lektiner og antistoffer (Tabell 1) for å oppdage glycan epitoper av histochemical Metoder
- For fluorescens deteksjon av tre sukkerkjedene epitoper hjelp lektiner, blokkere lysbildene med 1% BSA i PBS i 10-30 min ved romtemperatur.
- Siden en biotinylert lektin brukes, blokkere endogen biotin ved inkubering 15 minutter med 0,1%Avidin, etterfulgt av 15 min inkubering med 0,01% biotin ved romtemperatur.
- Vask lysbildene i PBS etter hvert blokkering trinn.
- Tilbereder en blanding av 1 ug / ml Rhodamine-konjugert succinylated hvetespirer agglutinin (sWGA), 1,3 ug / ml biotinylert Sambucus nigra agglutinin (SNA) og 5 ug / ml Fluorescein-konjugert Jacalin i HEPES / NaCl buffer (10 mM HEPES, 150 mM NaCl pH 7,5).
- Place lysbilder på en flat overflate eller i en farging boksen og lag den lectin blandingen på toppen. Blandingen volum kan reduseres ved forsiktig å plassere Parafilm på væske, flater Parafilm væsken og hindrer fordampning.
- Inkuber 1 time ved romtemperatur i mørket.
- Wash glir tre ganger med PBS.
- Layer lysbilder med 0,7 ug / ml streptavidin-konjugert Cy5 (for å påvise det biotinylerte-SNA) og inkuber i 30 minutter ved romtemperatur i mørke.
- Wash glir tre ganger med PBS.
- Counterstain atomkjerner med 0,1 & mu g / ml DAPI.
- Montere lysbilder på dekkglass med vandig medium som VectaMount montering media (eller noen vandige media).
6. Kontrollerende for lektin Staining Spesifisitet
- Lektin farging spesifisitet styres enten ved spesifikk enzymatisk spalting av målet glycan epitop før farging eller av konkurranse med små molekyler.
- Enzymatisk spalting for Svarthyll agglutinin (SNA) binding spesifisitet
- Fortynne Arthrobacter ureafaciens sialidase (AUS) til 250 mU / ml i 50 mM natriumacetat pH 5,5.
- Tilsett vann til bunnen av en tom tip-boks, vil dette danne en fuktig kammer under inkubering.
- Sted lysbilder med billedsiden opp på den øverste skuffen i tip-boksen, lag 150-200 ul AUS løsning på lysbildet og dekk med et dekkglass. Unngå luftboble formasjon.
- Lukke boksen lokket og inkuber ved 37 ° C i 2,5 timer.
- Vask glir tre ganger i PBS ved romtemperaturenperatur å fjerne alle gratis Sialic syrer. Disse lysbildene skal være negativt for SNA farging.
- Konkurransedyktige hemmere for Jacalin og succinylated hvetekim agglutinin (sWGA) spesifisitet
- Aliquot 200 pl av den lectin blandingen fremstilt i trinn 5.4 til to Eppendorf hetteglass.
- Legg 200 mM Melibiose (Jacalin inhibitor) til en av ampullene og Chitin-hydrolysat på 1:10 fortynning (sWGA inhibitor) til den andre beholderen.
- Overleggsplan negative kontrollprøver lysbilder med hemmere-inneholdende blanding og inkuber 1 time ved romtemperatur samtidig som resten av lysbildene. Disse lysbildene skal være negativt for Jacalin eller sWGA farging, henholdsvis.
7. Representant Resultater
En sammenligning mellom vevsprøver innebygd i parafin til frosne vev innebygd i Cryo-protectant medier (OCT) avslørte påfallende forskjell i bevaring og kvalitet for farging for Mucin glykoproteiner. Tissue farging med histokjemiske fargestoffer, som Alcian Blue og Perjodsyre Schiff, produserer svært ulike resultater i sammenlignbare vevsdelene fra frosne eller parafin innebygde prøver (Figur 1). Det ser ut til at det organiske løsningsmiddel (xylen eller Citrisolv) som brukes under parafin embedding prosessen påvirker fordelingen av utskilte mucins på epitel samt å fjerne mye av glykolipider fra prøvene (figur 2). Som følge av dette synes slimlaget kollapset på slimhinnen celler og er for det meste finnes i begeret celler. Flash frysing av vev i Cryo-protectant media (OCT) opprettholdt prøve fuktighet og bevart det utskilte mucins laget dimensjoner. Parafinen embedding prosessen påvirket andre slim-tilknyttede glykaner og glykolipider på en lignende måte. Glycan distribusjon ble undersøkt ved hjelp av lektiner, som rutinemessig benyttes for glykan deteksjon (figur 3) og antistoffer mot epitoper funnet påmucins og glykolipider (figur 6). Fordi lektin binding ikke er godt definert og er påvirket av den romlige fordelingen av glykaner samt glykan struktur 14,15, er det viktig å anvende egnede reguleringsmetoder for lektin farging. Her viser vi to metoder for å kontrollere lektin flekker på de testede vev: enzymatisk spalting og kompetitiv hemming. Spalting av ved sukkerkjedene epitoper ble gjort ved å fordøye vevsdeler med glycan-spesifikke enzymer, for eksempel bakteriell sialidase som kontroll for Sialic syrebindende etter SNA (figur 4). I tilfeller hvor spesifikt enzym (f.eks glycosidase) ikke er tilgjengelig for å fjerne sukkerdelen epitop studert kan lektin spesifisitet bekreftes ved tilsetning av en kompetitiv hemmer eksempel Melibiose for Jacalin flekker eller chitin-hydrolysat for sWGA farging (figur 5).
Vi viser her at snap-frosne vevsprøver, som er rutinertinely oppnådd i klinikken og i forskningslaboratorier, kan videre innebygd i OCT og brukes til å studere mucin glykoproteiner og de mange glykaner stede på dem.
| Lektin / Ab | Kilde | Major spesifisitet |
| LFA | Limax flavus (Yellow slug) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfat på Galβ1-R |
| SNA | Svarthyll (hyllebær) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (Hvetespirer) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Succinylated Triticum vulgaris (Hvetespirer) | GlcNAc & beta; 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (Peanut) | Galβ1-3GalNAc (umodifisert T-antigen) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1-3GalNAc funnet på O-linked glykaner |
| ECA | Erythrina cristagalli (Coral tree) | Galβ1-4GlcNAc |
| TKH2 | Antistoff | Siaa2-6GalNAc (STN) på O-linked glykaner |
| CA19-9 | Antistoff | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Antistoff | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLE x) |
Forkortelser: Ab, antistoff, Sia, Sialic syre; Gal, Galaktose; GalNAc,
Tabell 1. En delvis liste over lektiner og antistoffer for sukkerkjedene epitoper.
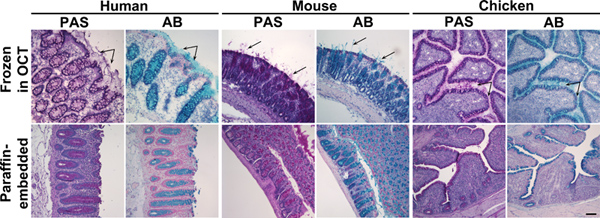
Figur 1. Alcian Blå og Perjodsyre Schiff farging av frosne og parafin-embedded kolon vev. Tissue deler av mennesker, mus eller kylling kolon prøver frosset i OCT (øvre panel) eller innebygd i parafin (nedre panel) ble farget med Perjodsyre Schiff (PAS) eller Alcian Blue (AB). Disse reagensene stain slim rosa eller blå, henholdsvis. Øvre panel: I frosset vev, i tillegg til mucins i begeret celler, ble utskilt slim også visvertible (piler). Nedre panel: I parafin-embedded vev, ble slim farging begrenset til goblet celler. Atomkjerner ble kontrafarget med Surgipath (PAS) eller Mayer (AB) Hematoxylin. Målestokk viser 100 mikrometer. Klikk her for å se større figur .

Figur 2. Citrisolv inkubering resulterer i vesentlig tap av mucins. Seriesnitt av frossen kylling ileum prøver ble fiksert i 10% buffret formalin og holdt hydratiserte (venstre panel), dehydrert i etanol ved sekvensiell inkubasjon i 70%, 90% og 100% etanol i 20 min hver (midtre panelet), eller dehydrert i etanol og klarert med Citrisolv for 1 hr (høyre panel). Tørkede prøver ble rehydratisert tilbake til PBS før Hematoxylin og Eosin (H & E) eller Alcian blå farging. Etanol dehydrering og Citrisolv clearing forbedret vev morphology (f.eks øverste raden, midten og til høyre mot venstre bilde). Etanol dehydrering hadde ingen signifikant effekt på Alcian Blå flekker (midterste raden, sammenligne venstre og midtre bilder). I kontrast, redusert Citrisolv inkubering Alcian blå flekker og begrenset det til goblet celler (midterste raden, rett bilde) i et mønster som var lik den som ble sett i parafin-embedded vev (figur 1). Disse dataene viser at den sterke farging av slim granulater i parafin-embedded prøver er pga krymping og kondens av slim i goblet celler under clearing trinn. Den svakere og mindre tett farging av slim i frosne oktober-embedded vev reflekterer en mer naturlig fordeling av slim i vevet. Høyere forstørrelse av eske områder er merket med piler. Scale Linjene indikerer 50 mikrometer (øvre og midtre rader) og 10 mikrometer (nederste rad).

Figur 3. Binding avlektiner til sukkerkjedene epitoper på frosne og parafin-embedded vev. Chicken tynntarmen (ileum) prøver frosset i OCT (øvre paneler) eller innebygd i parafin (nedre paneler) ble analysert med Jacalin (blå), sWGA (grønn) og SNA (rød ). Høyere forstørrelse av eske områder er merket med piler. I frosne vev Jacalin binding til O-linked glykaner avdekket strukturer som syntes å være oser fra goblet celler inn i lumen (Jacalin, øvre panel, piler). I kontrast, ble Jacalin binding til parafin-embedded vev begrenset til begeret celler (Jacalin, nedre panel, piler) og til villi børstesømmen (nederst til venstre bilde, pil). sWGA farging av β1-4GlcNAc delvis samlokalisert med bindingen av Jacalin lektin både frosne vev (øvre panel, piler), og i parafin-embedded vev (nedre panel, piler). I kontrast er SNA lektin binding til α2-6 knyttet Sialic syrer intracellulær (SNA, pilspisser), og ikke co-lokalisere med Jacalin (fargebilde, SNA i rødt merket med pilspiss, Jacalin i blått merket med stiplet pil). Skala linjer indikerer 100 mikrometer (venstre bilde) og 20 mikrometer (forstørret eske områder).

Figur 4. Enzymatisk spalting kontroll for Sialic acid farging med SNA. Chicken tynntarm prøver ble inkubert med 250 mU / ml Arthrobacter ureafaciens sialidase (AUS) eller med 50 mM natriumacetat pH 5,5 buffer i 2,5 timer ved 37 ° C. AUS behandling opphever flekker med biotinylert SNA, bekrefter SNA bindende spesifisitet til Sialic syrer. Målestokk indikerer 100 um.

Figur 5. Konkurrerende inhibering kontroll for glykan farging med Jacalin og sWGA. Chicken tynntarmen (ileum) prøver ble inkubert med et Jacalin og sWGA blandingen i nærvær av spesifikke lectin hemmere: Melibiose (midterste kolonne), Chitin-hydrolysatet (høyre kolonne) eller uten inhibitor (A og D). Øvre panel: (venstre) Jacalin farging uten hemmere. (I midten) Jacalin farging ble hemmet av Melibiose. (Høyre) Chitin-hydrolysat ikke hemme Jacalin farging. Nedre panel: (venstre) sWGA farging uten inhibitor. (I midten) Melibiose ikke hemme sWGA farging. (Høyre) sWGA farging ble hemmet av Chitin-hydrolysat. Denne hemming bekrefter spesifikk interaksjon av lektiner med vevene. Asterisker mark bilde av flekker hemming. Målestokk indikerer 100 um.

Figur 6. Påvisning av sekretoriske mucins, glycolipids og sukkerkjedene epitoper i frosne menneskelige kolorektal kreft vev. Kolorektal kreft biopsier fra villous karsinom og slimete karsinom var snap-frosset i flytende nitrogen og innebygd i oktober Vevssnitt ble inkubert i 1 timemed antistoffer mot det utskilte mucin MUC5AC, sialyl Lewis a - glykan epitop finnes på gangliosider (tykktarmskreft markør CA 19-9), og sialyl-Tn - rikelig glykan epitop på mucins (påvist med TKH2 antistoff), etterfulgt av 30 min inkubering med biotinylert esel anti-mus IgG sekundært antistoff, og 30 min inkubasjon med peroksidase-konjugert streptavidin. Ytterligere vev ble inkubert i 1 time med det biotinylerte lektiner SNA og sWGA, etterfulgt av 30 min inkubering med peroksidase-konjugert streptavidin. Peroksidase farging ble utviklet ved hjelp AEC kit. Svart skala indikerer 200 mikrometer.
Discussion
Bevaring av slim og glycan epitoper i frosne vev er bedre enn av vev som ble bygd i parafin. Vi demonstrerte bevaring av utskilt slimlaget (figur 1 og 3) og fordeling av tre glykaner strukturer (figur 3) i frosne vev sammenlignet med parafin-embedded vev. Spesialiserte fiksativer som Carnoy løsning (60% etanol, 30% kloroform, 10% eddiksyre) 17 har blitt utviklet for optimal bevaring av slimlaget i vevsprøver. Optimalt bør denne løsningen brukes til å samle vevsprøver som er dedikert for slim studier og ble vist for å bevare den glatte utseende slimlaget 16-17. Slim lag i Bevegelig frosne prøver innebygd i OCT vises robust og i noen områder kan løsne fra vevet, men den samlede tykkelsen er i overensstemmelse med det som er observert i vev som ble løst med Carnoy løsning og embedded i parafin 16-17. For eksempel, er slimlaget i fryst menneskets tykktarm vevsdeler ~ 100 mikrometer (Figur 1), som er innenfor området rapportert for Carnoy's-fixed menneskets tykktarm prøven 55,4 ± 2,5 um (område 7,7 til 204,8 uM) 16.
Det har vært kjent i flere tiår at etanol dehydrering resulterer i ~ 30% krymping av biologiske prøver 18, og at organiske løsemidler som xylen, Citrisolv og Kloroformekstraktet lipider, glykolipider og til en viss grad, proteiner fra vevene 13. Tissue behandling for parafin innebygging omfatter følgende trinn: fiksering (10% bufret formalin), dehydrering (økende etanolkonsentrasjon) og avregning (Citrisolv eller xylen). Ved å etterligne disse trinnene på Bevegelige helligdager frosne vevsdelene, viste vi at Citrisolv trekker slim fra frosne vevsdelene resulterer i vev morfologi som er lik som parafin-embedded vev (Figur2 e, høyre panel). I kontrast, ble slimlaget ikke endres ved inkubasjon med formalin eller etanol (figur 2, venstre og midtfelter). Dette tyder på at clearing trinn av standard parafin embedding prosedyre, som krever forlenget inkubasjon i Citrisolv / xylen, resulterer i kollaps av slimlaget. Formalin fiksering ikke skader slimlaget og frosne vev seksjoner som ble løst med formalin kan lett farges med lektiner og antistoff mot glykaner, glykolipider og proteiner (figurene 2, 3 og 6). Disse effektene kan være ubetydelig for studiet av membran-bundet protein og vev patologi, men de er ødeleggende for svært hydrerte strukturer som det utskilte slimlaget. Men histologiske undersøkelser av mucins er fortsatt utført det meste med parafin-embedded prøver, der slimlaget bevaring er suboptimal. Dybdeanalyser av slimlaget sammensetning slik som den nøyaktige identiteten SEcreted eller membran bundet MUC glykoprotein kombinasjoner krever spesifikke antistoffer og massespektrometri for identifikasjon av protein backbones. Bevaring av slimlaget er men første forutsetning for slike studier.
Mange laboratorier har vevsprøver frosset i OCT som ble samlet inn i fortiden for ulike prosjekter, kan disse vev kan lett brukes til å studere mucins, glycolipids og glycan distribusjon eliminerer behovet for å samle vev i spesielle fiksativ som er designet unikt for slim bevaring. Frosset vev gjennomgår minimal prosessering og derfor naturlig fordeling av glykaner, som er hydratisert i naturen, er bevart. Dette er spesielt viktig i riket av mikrobiell-vert interaksjoner. Kunnskap om naturalistisk distribusjon og overflod av utskilt mucins og de mange sukkerkjedene strukturer dekorere disse "barriere" molekyler vil være sentralt i forståelsen vert forsvar, mikrobiell utnyttelse og pathogeneser.
Disclosures
Ingen interessekonflikter erklært.
Acknowledgments
Forfatterne ønsker å takke Nicole M. Nemeth (University of Georgia) og Jeanne M. Fair (LANL) for deres hjelp i høstingen kylling vev, og Steven A. Springer for hans hjelp under filmingen. Omsorgen for alle fuglene i denne studien var i samsvar med National Institutes of Health retningslinjer for human bruk av forsøksdyr og alle protokoller ble godkjent av Institutional Animal Care og bruk komiteer ved Los Alamos National Security, LLC, operatør av Los Alamos National Laboratory under kontrakt No DE-AC52-06NA25396 med det amerikanske Department of Energy. Omsorgen for mus i denne studien er i samsvar med UCSD dyr godkjent protokoll. Humant vev ble oppnådd som en del av UCSD godkjent IRB protokollen. Dette arbeidet ble støttet av stipend 118645 fra University of California Lab Fee President Program (PG) og stipend NS047101 fra National Institute of nevrologiske lidelser og hjerneslag (Neuroscience Mikroskopi Felles Facility, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



