Summary
Não fixadas amostras de tecidos congelados embebidos em meio óptimo de temperatura de corte (OCT) podem ser usados para estudar a distribuição natural e glicosilação de muco secretado. Neste processamento de tecidos abordagem é mínima e a apresentação natural de glicolípidos, mucinas e glicano-epítopos é preservada. As secções de tecido podem ser analisados por imuno-histoquímica utilizando detecção por fluorescência ou cromogénico.
Abstract
As mucinas são complexos e altamente glicosilada O-linked glicoproteínas, que contêm mais do que 70% em peso de hidratos de carbono 1-3. Mucinas segregadas, produzido pelas células caliciformes e a mucosa gástrica, o andaime para fornecer uma camada de muco micrômetros de espessura, que reveste o epitélio do intestino e do trato respiratório 3,4. Além de mucinas, as camadas de muco também contêm péptidos antimicrobianos, citoquinas, e as imunoglobulinas 5-9. A camada de muco é uma parte importante da imunidade do hospedeiro inato, e forma a primeira linha de defesa contra a invasão de microorganismos 8,10-12. Como tal, o muco é objecto de numerosas interacções com micróbios, ambos os patógenos e simbiontes, e mucinas segregadas constituem uma interface importante para estas interacções. O estudo de tais interacções biológicas normalmente envolve métodos histológicos para a recolha de tecidos e de coloração. Os dois mais utilizados métodos histológicos para a recolha de tecidos e preservandoção na clínica e em laboratórios de pesquisa são: a fixação de formalina seguido de parafina e congelamento de tecido, seguido de incorporação em crio-protetores mídia.
Amostras de tecido emblocado em parafina produzir seções com qualidades ideais para a visualização histológica incluindo clareza e bem definida morfologia. No entanto, durante o processo de incorporação de um número de parafina de epitopos se alterou e, a fim de estudar estes epítopos, as secções de tecido têm de ser posteriormente tratados com um dos métodos de recuperação de epítopo de muitas 13. Mucinas segregadas e lípidos são extraídos do tecido durante o passo de compensação inclusão em parafina, a qual requer prolongar a incubação com solventes orgânicos (ou xileno Citrisolv). Portanto, esta abordagem é sub-ótima para estudos sobre a natureza e distribuição de mucinas e muco in vivo.
Em contraste, os tecidos de congelamento na temperatura de corte ótima (outubro) a incorporação de um meiovazios desidratação e limpeza da amostra, e mantém a hidratação da amostra. Isto permite uma melhor conservação da camada de muco hidratada e, assim, permite o estudo das várias funções de mucinas em biologia epitelial. Como este método requer um tratamento mínimo do tecido, o tecido é conservado num estado mais natural. Secções congeladas de tecidos, por conseguinte, não necessitam de qualquer tratamento adicional antes da coloração e pode ser facilmente analisada através de métodos imuno-histoquímicos.
Nós demonstramos a preservação de micrômetros de espessura da camada de muco secretado em amostras de cólon congelados. Esta camada é drasticamente reduzida quando os mesmos tecidos são embebidas em parafina. Também demonstramos coloração por imunofluorescência de epítopos de glicano apresentados em mucinas utilizando lectinas vegetais. A vantagem desta abordagem é a de que ele não requer o uso de fixadores especiais e permite a utilização de tecidos congelados que já podem ser conservadas no laboratório.
Protocol
1. A incorporação de tecidos em outubro
- Preparar um banho de congelação de gelo seco através da adição de 2-metil-butano em uma caixa de Styrofoam raso.
- Colheita do tecido, e gentilmente húmido sobre um papel de tecido para secar o excesso de líquido. Se usar snap-congelado tecido (tecido que foi congelado em azoto líquido), permitem que o tecido se aquecer para -20 ° C, colocando-o em uma câmara de crio-micrótomo.
- Adicionar uma pequena quantidade de OCT para o molde Peel-A-Way congelação, apenas o suficiente para cobrir a parte inferior do molde.
- Colocar o tecido no molde, certifique-se de que o tecido é repousou no fundo do molde na orientação desejada. Uma vez congelado, o bloco de tecido vão ser seccionadas a partir do fundo ou pelos lados.
- Cobrir o tecido com OCT, e colocar o molde no banho de congelação. O composto outubro ficará branco como o tecido se congela.
- Uma vez congelado, descascar o molde fora do bloco congelado e coloque em um saco marcado congelamento.
- Os blocos congelados podem ser mantidosà temperatura de -80 ° C até à sua utilização.
2. Tecido Seccionamento
- Coloque os blocos de tecido na câmara de crio-micrótomo, e lhes permitem chegar a -20 ° C (cerca de 30 min).
- Cortar uma secção de 3-5 mm de espessura, e colocar uma lâmina de vidro de carga positiva na parte superior da secção. O tecido irá aderir à lâmina.
- Secar os tecidos durante 30-60 min.
- As lâminas podem ser usados nesta fase, ou eles podem ser mantidos à temperatura de -80 ° C para uso futuro.
3. Coloracao de tecidos
- As lâminas que foram armazenadas a -80 ° C: permitir que as lâminas para descongelar e secar ao ar à temperatura ambiente durante 30 min.
- Fixar as lâminas com 10% de formalina tamponada durante 30 minutos à temperatura ambiente.
- Lavar três vezes em PBS ou tampão TBST, para cada lavagem mergulhar as lâminas 10 vezes em 250 ml de tampão. Tampão PBS pode ser utilizado para a coloração de imunofluorescência, no entanto, para a detecção cromogénica com Fosfatase Alcalina Conjug-ated anticorpo, TBST deve ser usado uma vez que o fosfato de PBS inibe a actividade da fosfatase alcalina.
- Lâminas de cortes histológicos agora está pronto para ser manchada.
4. Usando manchas histoquímicos como Alcian Blue e Ácido Periódico de Schiff para detectar Muco
- Alcian Blue mancha:
- Enxaguar as lâminas em água, incubar em 3% de ácido acético durante 3 minutos à temperatura ambiente.
- Cora com Alcian Blue solução de pH 2,5 durante 30 minutos à temperatura ambiente.
- Lavar as lâminas em água corrente da torneira durante 10 minutos, enxaguar em água desionizada.
- Contracoloração em vermelho rápido nuclear durante 5 min à temperatura ambiente.
- Lavar as lâminas três vezes em água desionizada.
- Ácido Periódico de Schiff mancha:
- Enxaguar as lâminas em água, preparado de fresco incubar em 1% de ácido periódico para 5 min.
- Lavar três vezes em água desionizada, uma vez que mergulha na água MiliQ.
- Mancha com o reagente de Schiff durante 15 min a temperatur quartoe.
- Lavar as lâminas em água corrente da torneira durante 10 minutos, enxaguar em água desionizada.
- Contracoloração em Surgipath hematoxilina durante 30 segundos à temperatura ambiente.
- Lavar as lâminas três vezes em água desionizada.
- Incubar as lâminas 30 seg em água de Scott torneira à temperatura ambiente.
- Lavar três vezes em água desionizada.
- Desidratar e limpar as lâminas através da incubação de 1 min em etanol a 95%, seguida por três mudanças rápidas em etanol a 100%, e três mudanças de Citrisolv, 2 min cada. Todos à temperatura ambiente.
- Monte slides em lamínulas com meio resinosos (Cytoseal 60).
5. Utilizando lectinas e anticorpos (Tabela 1) para detectar epítopos de glicano por métodos histoquímicos
- Para a detecção de fluorescência de três epítopos de glicano utilizando lectinas, bloquear as lâminas com BSA a 1% em PBS durante 10-30 min à temperatura ambiente.
- Uma vez que uma lectina biotinilada é usado, bloquear biotina endógena por incubação de 15 min com 0,1%Avidina, seguido de 15 min de incubação com biotina 0,01% à temperatura ambiente.
- Lavar as lâminas em PBS após cada passo de bloqueio.
- Recém preparar uma mistura de 1 ug / ml de rodamina conjugada com aglutinina de gérmen de trigo succinilada (sWGA), 1,3 ug / ml de biotina Sambucus nigra aglutinina (SNA) e 5 ug / ml de fluoresceína jacalina-conjugado em HEPES / NaCl tampão (HEPES 10 mM, 150 mM NaCl pH 7,5).
- Colocar as lâminas em uma superfície plana ou numa caixa de coloração, e a camada de mistura de lectina no topo. O volume de mistura pode ser reduzido pela colocação de parafilme suavemente sobre o líquido, o parafilme achata o líquido e evitar a evaporação.
- Incubar 1 hora à temperatura ambiente no escuro.
- Lavar as lâminas três vezes com PBS.
- Lâminas de camada com 0,7 ug / ml de estreptavidina conjugada com CY5 (para detectar a biotina-SNA), e incubar durante 30 min à temperatura ambiente no escuro.
- Lavar as lâminas três vezes com PBS.
- Contracoloração núcleos com 0,1 m &u, g / ml de DAPI.
- Montar as lâminas em lamelas com meio aquoso tal como VectaMount meios de fixação (ou qualquer meio aquoso).
6. Controlando a Especificidade de coloração Lectina
- Especificidade coloração lectina é controlado ou por clivagem enzimática específica do epítopo alvo glicano antes da coloração ou por competição com moléculas pequenas.
- Clivagem enzimática para Sambucus nigra aglutinina (SNA) especificidade de ligação
- Diluir Arthrobacter ureafaciens sialidase (AUS) a 250 mU / ml em 50 mM de acetato de sódio pH 5,5.
- Adicionar água para o fundo de uma caixa vazia ponta-, isso irá formar uma câmara húmida durante a incubação.
- Colocar as lâminas voltadas para cima na bandeja superior do, camada de ponta-caixa 150-200 solução AUS ul no slide e cobrir com uma lamela. Evitar a formação de bolhas de ar.
- Fechar a tampa da caixa e incubar a 37 ° C durante 2,5 horas.
- Lavar as lâminas três vezes em PBS a têmpera quartotura para remover todos os ácidos siálicos livres. Esses slides deve ser negativo para a coloração SNA.
- Os inibidores competitivos para jacalina e succinilado aglutinina do germe de trigo especificidade (sWGA)
- Alíquota de 200 ul da mistura preparada no passo lectina 5,4 a dois frascos de Eppendorf.
- Adicionar 200 mM Melibiose (inibidor jacalina) a um dos frascos e quitina-hidrolisado a uma diluição de 1:10 (sWGA inibidor) para a outra cuvete.
- Sobreposição negativos lâminas de controlo com o que contém os inibidores da mistura e incubar 1 hora à temperatura ambiente, ao mesmo tempo que o resto dos slides. Esses slides deve ser negativo para jacalina ou coloração sWGA, respectivamente.
7. Resultados representativos
Uma comparação entre amostras de tecido embebidos em parafina para tecidos congelados embutidos em crio-protetores mídia (outubro) revelou diferença marcante na preservação e qualidade de coloração para Muciglicoproteínas n. Coloração histoquímica de tecidos com corantes, tais como Alcian Blue e ácido periódico de Schiff, produzir resultados muito diferentes em secções de tecido congeladas ou comparáveis de amostras parafinizadas (Figura 1). Afigura-se que o solvente orgânico (ou xileno Citrisolv) que é utilizado durante o processo de inclusão em parafina afecta a distribuição de mucinas segregadas em epitélios bem como a remoção tanto dos glicolípidos a partir das amostras (Figura 2). Como resultado, a camada de muco aparece recolhido nas células da mucosa e é encontrada principalmente nas células caliciformes. Flash congelamento de tecidos em crio-protetores de mídia (outubro) manteve a hidratação da amostra e preservadas as dimensões da camada de mucinas secretadas. O processo de inclusão em parafina afectados outros muco-glicanos e glicolípidos associados de uma maneira similar. Distribuição glicano foi examinada utilizando lectinas, que são rotineiramente usadas para detecção de glicano (Figura 3) e os anticorpos contra epítopos encontradosmucinas e glicolípidos (Figura 6). Porque a ligação da lectina não é bem definido e é afectada pela distribuição espacial dos glicanos, assim como a estrutura de glicano 14,15, é importante aplicar os controlos apropriados para a coloração com lectina. Aqui demonstramos dois métodos para controlar manchas de lectina sobre os tecidos testados: de clivagem enzimática e de inibição competitiva. A clivagem dos epítopos de glicano foi feito através da digestão da secção de tecido com glicano específicos de enzimas, por exemplo sialidase bacteriana como controlo para a ligação de ácido siálico por SNA (Figura 4). Nos casos em que a enzima específica (por exemplo glicosidases) não estão disponíveis para a remoção do epítopo glicano estudada, a especificidade da lectina pode ser confirmada pela adição de um inibidor competitivo, tais como Melibiose jacalina para coloração ou quitina-hidrolisado para coloração sWGA (Figura 5).
Nós demonstramos aqui que as amostras de tecido snap-congelados, que são routinely obtido na clínica e em laboratórios de investigação, pode ainda ser incorporado em OCT e utilizado para estudar moléculas de mucina e os glicanos muitos presentes neles.
| Lectina / Ab | Fonte | Maior especificidade |
| LFA | Limax flavus (lesma Amarelo) | Terminal Sia |
| * MAA | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfato em Galp1-R |
| SNA | Sambucus nigra (sabugueiro) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (germe de trigo) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Triticum vulgaris succinilado (germe de trigo) | GlcNAc & beta; 4GlcNAcβ1 1-4GlcNAc- |
| ANP | Arachis hypogaea (amendoim) | Galp1-3GalNAc (não modificada do antigénio T) |
| Jacalina | Artocarpus integrifolia (jacalina) | Galp1-3GalNAc encontrado em O-linked glycans |
| ECA | Erythrina cristagalli (árvore Coral) | Galp1-4GlcNAc |
| TKH2 | Anticorpo | Siaa2-6GalNAc (STN), em O-glicanos ligados |
| CA19-9 | Anticorpo | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (LES a) |
| SNH3 | Anticorpo | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (sLex) |
Abreviaturas: Ab, anticorpos; Sia, ácido siálico; Gal, Galactose; GalNAc,
Tabela 1. Uma lista parcial de lectinas e anticorpos para epítopos de glicano.
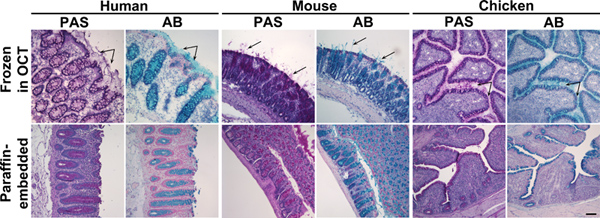
Figura 1. E coloração com Alcian Blue Periodic Acid Schiff de tecidos do cólon e congelados embebidos em parafina. Secções de tecido de rato, humano ou amostras de cólon frango congelados em OCT (painel superior) ou embebidos em parafina (painel inferior) foram corados com ácido periódico de Schiff (PAS) ou Alcian Blue (AB). Estes reagentes mancha muco rosa ou azul, respectivamente. Painel superior: Em tecidos congelados, para além de mucinas das células caliciformes, muco secretado foi também visvel (setas). Painel inferior: Na-tecidos embebidos em parafina, coloração com muco estava confinada a células caliciformes. Os núcleos foram contrastadas com Surgipath (PAS) ou (AB) de hematoxilina de Mayer. Barra de escala indica 100 mm. Clique aqui para ver maior figura .

Figura 2. Resultados de incubação Citrisolv em perda substancial de mucinas. Secções seriadas de amostras de íleo de galinha congeladas foram fixados em formalina tamponada a 10% e mantidos hidratados (painel esquerdo), desidratados em etanol, por incubação sequencial de 70%, 90% e etanol a 100% durante 20 min cada (painel do meio), ou desidratados em etanol e aclarado com Citrisolv durante 1 hora (painel da direita). Amostras desidratadas foram reidratados volta à PBS antes de Hematoxilina e Eosina (H & E) ou coloração Alcian Blue. Desidratação de etanol e Citrisolv compensação melhor tecido morphology (linha, por exemplo, alto, médio e imagens direita versus imagem à esquerda). Desidratação de etanol não teve efeito significativo na coloração Alcian Blue (linha do meio, comparar as imagens esquerda e do meio). Em contraste, a incubação Citrisolv reduzida coloração azul Alcian e confinada a células caliciformes (linha do meio, a imagem da direita) num padrão que é semelhante à observada em tecidos embebidos em parafina (Figura 1). Estes dados implicam que a forte coloração de grânulos de muco em parafinizado é devido ao encolhimento e de condensação de muco nas células caliciformes durante a etapa de limpeza. A coloração mais fraca e menos denso do muco em congelados OCT-tecidos embebidos reflecte uma distribuição mais natural de muco no tecido. Ampliações de áreas dentro de caixas são marcadas com setas. Barras de escala indicam 50 fim (linhas superior e do meio) e 10 uM (linha inferior).

Figura 3. A ligação delectinas para epitopos glicano em tecidos congelados e parafina. Frango intestino delgado (íleo) espécimes congelados em outubro (painéis superiores) ou em parafina (painéis inferiores) foram sondados com jacalina (azul), sWGA (verde) e SNA (vermelho ). Ampliações de áreas dentro de caixas são marcadas com setas. Em tecidos congelados jacalina ligação para O-glicanos ligados revelaram estruturas que parecem ser exsudação a partir de células caliciformes no lúmen (jacalina, painel superior, as flechas). Em contraste, a ligação jacalina para tecidos embebidos em parafina foi confinada às células caliciformes (jacalina, painel inferior, setas) e para a borda em escova das vilosidades (imagem inferior esquerda, seta). sWGA coloração de β1-4GlcNAc parcialmente co-localizada com a ligação da lectina jacalina em ambos os tecidos congelados (painel superior, setas), e em tecidos embebidos em parafina (painel inferior, setas). Em contraste, a lectina de ligação a SNA α2-6 ácidos siálicos ligados é intracelular (SNA, pontas de seta), e não se co-localizar com jacalina (corimagem, o SNA em vermelho marcado com seta, jacalina em azul marcado com a seta pontilhada). Barras de escala indicam 100 mm (imagens à esquerda) e 20 um (áreas ampliadas em caixa).

Figura 4. A clivagem enzimática de controlo para a coloração de ácido siálico com SNA. Espécimes galinha intestino delgado foram incubadas com 250 mU / ml Arthrobacter ureafaciens sialidase (AUS) ou com 50 mM de tampão de acetato de sódio a pH 5,5 durante 2,5 horas a 37 ° C. AUS tratamento elimina a coloração com biotinilado SNA, confirmando SNA especificidade de ligação a resíduos de ácido siálico. Barra de escala indica 100 mm.

Figura 5. Controle de inibição competitiva para a coloração de glicano com jacalina e sWGA. Galinha do intestino delgado (íleo) amostras foram incubadas com uma mistura jacalina sWGA e na presença de lec específicoinibidores de estanho: melibiose (coluna do meio), quitina-hidrolisado (coluna da direita) e sem inibidor (A e D). Painel superior: (esquerda) jacalina coloração sem inibidores. (Centro) coloração jacalina foi inibida por Melibiose. (Direita) Quitina-hidrolisado não inibiu coloração jacalina. Painel inferior: (esquerda) sWGA coloração sem inibidor. (Centro) Melibiose não inibiu a coloração sWGA. (Direita) coloração sWGA foi inibida por quitina-hidrolisado. Isto confirma a inibição da interacção específica de lectinas com os tecidos. Asteriscos imagem marca de inibição de coloração. Barra de escala indica 100 mm.

Figura 6. Detecção de mucinas secretoras, glicolipídios e epítopos glicano em tecidos humanos congelados câncer colorretal. Biópsias de câncer colorretal de carcinoma de vilosidades e carcinoma muco foram snap-congelado em nitrogênio líquido e incorporado em outubro As secções de tecido foram incubadas durante 1 hcom anticorpos contra a mucina segregada MUC5AC, sialil Lewis a - glicano epítopo encontrado em gangliósidos (cancro colorectal marcador CA 19-9) e sialil-Tn - epitopo glicano abundante em mucinas (detectado com anticorpo TKH2), seguido por 30 min de incubação com biotinilado de burro anti-rato IgG de anticorpo secundário, e 30 minutos de incubação com peroxidase conjugada com estreptavidina. Outros tecidos foram incubados durante 1 hora com o biotinilado lectinas SNA e sWGA, seguido por 30 minutos de incubação com peroxidase conjugada com estreptavidina. A coloração da peroxidase foi desenvolvida utilizando AEC kit. Barra de escala preta indica 200 m.
Discussion
Preservação de muco e glicano epítopos em tecidos congelados é superior à dos tecidos que foram embebidos em parafina. Nós demonstramos a preservação da camada de muco secretado (Figuras 1 e 3) e a distribuição de três estruturas de glicanos (Figura 3), em comparação com tecidos congelados embebidos em parafina tecidos. Fixadores especializados, tais como solução de Carnoy (etanol a 60%, clorofórmio a 30%, 10% de ácido acético) 17 ter sido desenvolvido para a conservação óptima da camada de muco em amostras de tecido. Em condições óptimas, esta solução deve ser utilizado para recolher amostras de tecido que são dedicados para estudos de muco e foi mostrado para preservar a aparência lisa da camada de muco 16-17. A camada de muco em amostras congeladas não fixadas incorporado em OCT parece resistente e em algumas áreas pode separar a partir do tecido, no entanto, a espessura de camada total está de acordo com o observado em tecidos que foram fixados com solução de Carnoy e embedded em parafina 16-17. Por exemplo, a camada de muco na secção de tecido do cólon humano congelado é de ~ 100 mm (Figura 1), que está dentro do intervalo descrito para Carnoy's fixo amostra de cólon humano de 55,4 ± 2,5 um (intervalo 7,7-204,8 mm) 16.
Tem sido conhecido durante décadas, que resulta em desidratação de etanol ~ o encolhimento de 30% das amostras biológicas 18, e que os solventes orgânicos tais como xileno e lípidos Citrisolv extracto de clorofórmio, glicolípidos e, em certa medida, das proteínas a partir dos 13 tecidos. Processamento de tecidos para inclusão em parafina inclui as seguintes etapas: fixação (10% de formalina tamponada), desidratação (aumentando a concentração de etanol), e de compensação (Citrisolv ou xileno). Imitando estes passos não fixadas em secções de tecido congeladas, foi demonstrado que Citrisolv extrai muco a partir de secções de tecido congeladas, resultando em morfologia de tecido que é semelhante ao de tecidos embebidos em parafina (Figure 2, painel da direita). Em contraste, a camada de muco não foi alterada pela incubação com formalina ou etanol (Figura 2, para a esquerda e painéis centrais). Isto sugere que a etapa de limpeza de um procedimento padrão inclusão em parafina, o qual requer a incubação prolongada em Citrisolv / xileno, resulta no colapso da camada de muco. Fixação em formalina não danifica a camada de muco e secções congeladas de tecidos que foram fixadas com formalina pode ser facilmente manchado com lectinas e anticorpos contra glicanos, glicolípidos e proteínas (Figuras 2, 3 e 6). Estes efeitos podem ser insignificante para o estudo de proteínas ligadas à membrana e os tecidos patologia, mas eles são devastadoras para as estruturas altamente hidratados, tais como a camada de muco secretado. No entanto estudos histológicos de mucinas são ainda realizados principalmente com amostras embebidas em parafina, nas quais a camada de muco preservação é de qualidade inferior. Em análises aprofundadas de composição do muco camada como a identidade precisa de sicreted ou ligados membrana glicoproteína MUC combinações exigem anticorpos específicos e de espectrometria de massa para a identificação dos esqueletos proteicos. Preservação da camada de muco é, mas a exigência inicial para esses estudos.
Muitos laboratórios têm amostras de tecidos congelados em OCT que foram recolhidos no passado por diferentes projectos, estes tecidos podem ser prontamente usados para estudar as mucinas, glicolípidos e distribuição de glicano eliminando a necessidade de recolha de tecidos em fixadores especiais que são concebidos exclusivamente para a preservação de muco. Tecidos congelados objecto de processamento mínimo e, por conseguinte, a distribuição natural de glicanos, que são hidratados na natureza, é preservado. Isto é especialmente importante no reino do microbiana acolhimento interações. Conhecimento da distribuição e abundância naturalista de mucinas secretadas e as estruturas glicano muitos decorar esses "barreira" moléculas será a chave para a compreensão de defesa do hospedeiro, a exploração microbiana e patógenosé.
Disclosures
Não há conflitos de interesse declarados.
Acknowledgments
Os autores gostariam de agradecer a Nicole M. Nemeth (University of Georgia) e Jeanne M. Feira (LANL) por sua ajuda na colheita de tecidos de galinha, e Steven A. Springer por sua ajuda durante as filmagens. O cuidado de todas as aves em estudo estava em conformidade com as diretrizes do Instituto Nacional de Saúde para o uso humano dos animais de laboratório e todos os protocolos foram aprovados pelo Animal Care Institucional e Comissões de Uso do Los Alamos National Security, LLC, operadora do Los Alamos Laboratório Nacional sob Contrato n º DE-AC52-06NA25396 com o Departamento de Energia dos EUA. O cuidado de camundongos deste estudo está em conformidade com UCSD protocolo animal aprovado. Tecidos humanos foram obtidos como parte da UCSD protocolo IRB aprovado. Este trabalho foi financiado por bolsa 118645 da Universidade da Califórnia Lab Programa Taxa Presidente (PG) e NS047101 concessão do Instituto Nacional de Distúrbios Neurológicos e Derrame (Mecanismo de Microscopia Neuroscience compartilhada, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



