Summary
本文中描述了一种机器人的方法,在使用大分子X-射线晶体结构的测定中使用的脂质中间相为高通量膜蛋白结晶。 3个机器人能处理粘性和粘蛋白载货中间相积分的方法进行了介绍。
Abstract
膜蛋白的结构与功能的研究极大地受益于高分辨率的3-D结构的类型通过大分子的X射线晶体(MX)。 MX的一个重要成分,是理想的衍射高质量晶体的稳定供应。内的内消旋或脂质立方相(LCP)的膜蛋白结晶的方法是可用于膜蛋白结晶的几种方法之一。它使得使用的共连续的中间相,在晶体生长。作为一种方法,它有一些引人注目的成功后期,已经引起了人们的关注与兴趣使用它的许多研究小组现在。相关的挑战的方法之一是,主机中间相是非常粘稠,粘,让人联想起了厚厚的牙膏。因此,在一个可重复的方式小批量结晶井手动分配需要技巧,耐心和稳健的手。一种协议,用于做举ST开发的膜结构与功能的生物(MS&FB)1〜3 组 。朱庇特视频文章描述的方法是1,4。
本手册的方法建立中尺度试验具有明显的优势与特色的应用程序,,如水晶优化和衍生。但它确实患有低通量的方法。在这里,我们展示了机器人表演观结晶试验的协议。一个机器人提供的优势,速度,准确性,精密化,小型化,能够长时间连续工作下可被视为恶劣条件下,如在黑暗中,在还原气氛中或高或低的温度下。 一个机器人观 ,正确使用时,可以大大提高生产力促进结晶,这是一个缓慢的步骤中的膜蛋白的结构和功能研究整体结构确定管道。
在这个视频文章中,我们演示了如何使用三种市售的机器人,可以免除的粘性和粘性的中间相不可或缺的观 crystallogenesis,。第一个机器人开发在MS&FB 5,6组。另外两个最近成为这里包括的完整性。
在本文中涉及的协议的概述示于图1,所有的操作均在室温(〜20℃)的环境条件下进行。
Protocol
1。准备的结晶板
设置机器人做结晶试验开始与制备的基板的玻璃夹心结晶板( 图2),在参考文献2中详细描述。底板必须首先被硅烷化双棍的多孔隔板,创建的井,必须施加到板。根据材料逐项列出需要的材料和用品。
- 将板在纸巾上,适用几滴硅烷化溶液,均匀的板面用薄纸分发。
- 板浸在烧杯中的水,去除多余的硅烷化解决方案。
- 板的烧杯,将其放置在干燥的纸巾,硅烷化的一面,而其暴露的表面干燥用纸巾轻轻擦拭。
- 剥离保护盖的穿孔,双棍间隔和应用的隔离物,粘性侧下降,干燥,硅烷化的玻璃板表面。成为确保间隔件的底板上正确的位置,与上部左手角落和两个相邻的两边的间隔件和板,重合。
- 使用的辊或BRAYER平坦的间隔件的底板上,以建立它们之间的紧密密封。
预组装板市售(HR3-151,汉普顿研究MD11-55-100;,分子尺寸和LCP96T-UVP70U Swissci)。出于成本的原因,我们更愿意把我们自己的组装板后,上述协议。
(2) 在细观机器人1
观机器人被证明在这个视频文章中的第一个,是一个目前正在使用的MS&FB组( 图3)。细节的机器人,可根据材料和参考第5。的材料和成套设备NT需要使用的机器人是根据材料逐项建立的结晶试验。
- 将机器人的甲板上的第1节中制备与间隔件的底板。它有自己的平台,标志着底板对齐的目的,具有良好的位置。板应标记,以资识别。
- 固定96孔沉淀剂的块在其自己的平台的甲板上的机器人旁边的结晶板。
- 小心打开块脱落的塑料密封帽。
- 打开加湿器和指示在甲板上的机器人的底板和跨潮湿的空气流的。已被证明的加湿以减少沉淀剂溶液的蒸发,并增强跨越的结晶板5的重现性。它可以被打开之前设置预加湿的区域环境相对湿度低时,或以其他方式,就在中间相开始分配。
- 初始化机器人按照制造商的说明。仪器的具体说明不会在任何细节,因为确切的程序会随时间而改变。从本质上讲,期间发生初始化的是,在机器人上的分装臂的中间相,在三个正交方向X,Y和Z设置有基准位置
- 将蛋白质的载货中间相微量注射器,点胶针,手臂的机器人( 图3)。如何准备的中间相,以及如何将其加载到注射器中的全部细节已在参考文献3,7-10。
- 从隔板上的结晶底板拆下上部的保护盖,和在平板上的孔对齐,基准点上的底板平台。注意,对于该视频的目的,保护盖留在原地,以帮助在查看器的取向步骤期间。
- 对齐分配希瑞恩的针尖e的底部以及在左手角落的结晶板(孔A1)的最上面。这是通过眼调节的高度或Z-坐标的分装臂一边看如何接近的针尖来的阱的底部。可以判断的平台上,而有一点点调节分配的手臂的高度,从一侧向另一侧移动板的尖端刚刚接触到井底。
- 输入到计算机中的分装臂的前端接触的板的Z-坐标。配药被编程,以在从该基准的Z位置对应的基板的表面的80微米与针尖。
- 由眼睛的针尖在中心孔A1的位置。储存在控制计算机的参考X,Y坐标的分配臂尖为中心。此坐标被用来定义盘上剩余的井的中心。
- 镨输入法使用适当的命令机器人计算机上,以确保新鲜的中间相填充的注射器的分配针和第一和随后的井接收其全部的中间相。挤压中间相的针尖,用纸巾擦去。
- 启动运行机器人(X-AP)计划发起了一轮的沉淀分配的机器人臂的提示进行清洗,并准备吸解决方案的沉淀块的冲洗步骤。
- 激活分配函数在机器人上设置在运动顺序装载与载货蛋白的中间相(通常是50 nl)的第一,八口井的列,在一个时间,然后通过沉淀剂溶液(通常为800 nl)的水井。加载列之间,中间相送出臂返回到停车位置的针头末端被放置在一个湿的海绵干燥,以防止中间相的尖端处。配药中间相和沉淀剂的方法,重复横跨板11次,直到板填充。与中间相和沉淀剂的装载的96孔板中以5分钟来完成。
- 只要填充板和机器人手臂已经回到公园的位置,取出盘子从甲板上的机器人,并把它放在一个平坦的固体表面。
- 随即,密封板的盖玻璃,以及组合物的随时间的变化最小化。重要的是要确保完全覆盖所有96个孔,该玻璃盖对准方形与底板和盖玻璃,没有延伸超出底板的足迹。甲的辊或BRAYER用于建立紧密和均匀的密封件之间的盖玻璃和隔板。
- 检查板,可以肯定的,因为它应该去设置。什么人找的是一个“炸蛋上的泛在每口井的外观。炒鸡蛋的蛋黄相对应的中间相。白色的蛋是沉淀的解决方案和平底锅的边缘的周长是结晶良好。在理想的情况下,三是同心的。
- 板放置在用于晶体生长的温度 - 控制的存储区域。
- 如果没有更多的板块设置,删除的沉淀块从甲板的机器人,封紧袋口,并把它放回存储。
- 包含中间相从分配的机器人手臂上取下注射器,拆除,部分,包括针头和套圈,仔细洗,甲醇和干,准备以备下次使用。
3。 在细观机器人2中。蚊子LCP
蚊子LCP的机器人( 图4)采用类似的中间相分配器机器人1所使用的。相反的机器人,它通过分发沉淀的一次性吸头。使用编程软件来设置仪器工作与特定的的结晶板和precipit蚂蚁块,在一个指定的序列,以及免除用户定义的卷的中间相和沉淀剂。这样的细节由生产商所提供的,并在这里将不进行描述。
- 准备一个Hamilton注射器,完全用针和充满蛋白质载货中间相,如上述那样根据机器人1和JOVE文章1712 1。
- 夹紧位置上的分装臂的机器人的注射器。
- 使用安装在甲板激光传感器建立分配注射器的针上的X和Y坐标。这是一个重要的步骤,以确保准确地被分配的中间相上的板在各孔的中心。
- 随着触摸控制面板上的一个按钮,总理的注射器的针排出中间相。取出挤压的中间相从针尖与组织中准备用于使用机器人井加载。
- 前放置在甲板上的机器人的湿润的结晶板连接平台,用几滴的水,以帮助保持板在毛细作用的表面。
- 从间隔的玻璃底板上取下保护盖,并将其放置在其平台上牢固,确保良好的附着力。在平台上使用的三个基准点对准3角井,从而确保适当的定位孔的上盘相对于分送针尖。该仪器现在命令输入分配周期。
- 第二个吸步骤中间相被分配到一个小玻璃盘前加载井用新鲜的中间相周期的开始。的机器人第一中间相负载时的盘上的8孔一列垂直的,然后使用一次性吸头的顶部分配沉淀剂溶液的中间相丸剂。沿板的长度,重复该过程11次,直到所有的井填充。整个过程大约需要5分钟才能完成。
- 清除从机器人平台填充板和密封用的盖玻璃,如上所述,根据机器人1。
- 板放置,适当标记的,在晶体生长的温度控制环境。
4。 在细观机器人3。狮鹫LCP
狮鹫LCP的机器人( 图5)采用上面所描述的机器人1和2类似的中间相分配系统。什么区别于其他两个是同时,所有96个沉淀的解决方案中分配。
- 准备载货的蛋白质-中间相,将其加载到分注注射器中,如上所述,根据机器人1和2,并在JOVE文章1712 1。
- 夹紧位置上的分装臂的机器人的注射器。
- 沉淀剂溶液块和结晶板放置在甲板上的机器人。
- 装入96尖HEAD与沉淀的解决方案。用户定义的延迟时间,以方便吸粘性沉淀。
- 命令仪器进入点胶周期。周期开始时,中间相顺序被分配到一个过程,需要大约1分钟完成的96口井在。然后,该96尖头一次分配所有96沉淀剂的解决方案的顶部的中间相在结晶井的丸药。整个板块在加载过程结束后2分钟。
- 从机器人平台卸下填充板和密封用的盖玻璃,如上所述,根据机器人1。
- 板放置,适当标记的,在晶体生长的温度控制环境。
5。代表性的成果
此视频文章的目的是演示如何设置自动结晶实验,带有粘性的,膜蛋白载货的中间相的玻璃sandwic小时96孔结晶板。强调的是自动化,通过使用专门的机器人,需要最少的人工干预。可重复性和精确性,大量的中间相和沉淀分配,而在井的位置,当机器人。这些都是重要的从点有效的筛选条件,支持crystallogenesis视图。他们也分析管道中的下一步骤是评估经常做的晶体生长与成像设备的关键。下降或静脉推注的位置是关键的成像过程,,不规则放置不当的丸井通常需要用户干预以纠正,并需要一定的时间。的正确和不正确的加载板的实施例用于说明的目的, 如图6中所示。
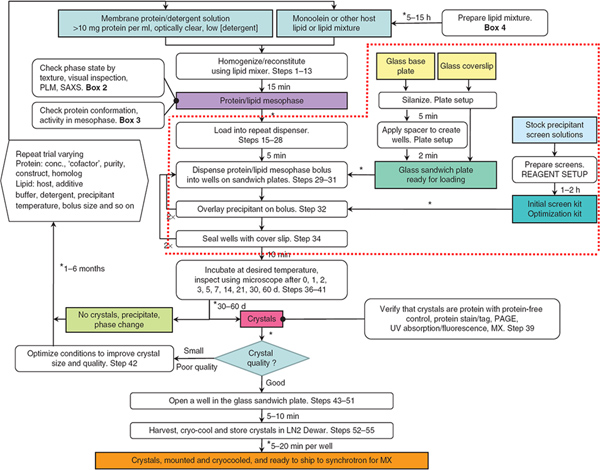
图1的流程图总结了在生产,收获和低温冷观种植的膜蛋白晶体所涉及的步骤。红色虚线包围的步骤是此朱庇特的文章关注的焦点。机器人用,步骤29-32,免除中间相和沉淀的解决方案。从参考文献3。 点击此处查看大图 。

图2,一种完全加载并密封的96孔玻璃夹心结晶板。在各孔中含有50 NL立方相和1μl的沉淀剂溶液。为了清楚起见,立方相已与苏丹红染色和沉淀剂溶液包括亚甲基蓝。从参考文献5。
_upload/4000/4000fig3.jpg“ALT =”图3“/>
图3: 在,细观机器人(机器人)。该机器人有两个武器。臂1分注蛋白质充满油脂的中间相。臂分配沉淀的解决方案。在填充过程中,在96孔板中保持固定在甲板上的机器人本身是固定的位置。两只手臂移动,提供中间相和沉淀的解决方案。从参考文献3。

图4。蚊子:LCP机器人(机器人2)。在机器人1,蚊子的LCP的甲板,赖以坐的96孔板中和沉淀剂溶液块相比,在填充过程中水平移动。

图5。:狮鹫,LCP机器人(机器人3)。在一个成立,脂质立方相分配器转移到96孔板中,以提供蛋白质的载货的中间相。甲板上,然后翻译水平的沉淀剂溶液尖头定位下盘。同时配发了96沉淀的解决方案。的图片来自制造商( http://www.artrobbins.com/ )和标记。

图6。完全装载和密封的96孔玻璃夹层板(A)和井正常(B)和不正确(C,D)使用在,细观机器人(机器人)的填充。板在条形码标签上A用于跟踪板在板孵化器/成像设备。面板的BD中,沉淀剂溶液和中间相的标记P和M分别。在锅上的预期的'炒鸡蛋以及在B的外观是一个适当的加载和密封良好的特征。在C中,沉淀剂,已被分配入井不当在偏离中心的位置,并在与隔离物接触来。在C语言中,它会显得过于中间相的体积比它应该是。 D.对于规模与沉淀剂溶液的不完全加载的一个例子中所示,所有的孔的直径为6毫米。
Discussion
在这个视频文章中,我们已经演示了如何使用机器人自动设置在观结晶试验在96孔玻璃夹层板使用蛋白质充满油脂的中间相。在这项工作中所用的机器人专门设计的,包括一个正排量玻璃注射器的粘性和粘性的中间相的纳升体积的准确和可重复的交付,作为最初描述7。
机器人的准确度和精确度是很重要的功能。然而,这些特征的程度和规律,机器人的性能进行评估和校准。不用说, 机器人的性能应该被评估,而单 独的板正在设立 。这是不恰当的假设,机器人将完美,离开了机器人在无人值守的情况下运行。周到和细心的经营者应在POS银行足球比赛要注意通过声音或东西时不正常工作,并立即纠正的外观。此外, 应该仔细检查每块板,经眼的均匀性以及内容尽快的密封板和在它之前放好结晶试验 。这应该只需要几秒钟来执行,并且可以做到,而下盘被加载。注意到,例如,特定井未正确填写可能突出一定的沉淀剂的分配尖端发生故障的事实。应交付的中间相被看作是不规则的,相关的故障项目,必须立即予以纠正。通过在组注意到这些问题,并作出相应的调整,将节省时间和材料,包括宝贵的脂质和膜蛋白。如果成像器是用来跟踪晶体生长,准确度和精确度也可以被监测,在成像过程中。例如,系统的问题,跌落或丸剂位置的成像表明,什么是不正确和,纠正行动上游某处的协议是必要的。
的利益,可靠的性能,因此机器人必须在定期校准和需要。校准应包括交付以及丸和沉淀放置在井的沉淀和中间相的音量。很明显,只要有可能,应校准使用卷和材料,类似那些在此期间所覆盖的质量控制工作进行的试验中,将用于完成。
同样重要的校准也是如此有库存的机器人零部件及用品供应充足。灾难和意外故障,堵塞和崩溃也时有发生。在这样的情况下,具有提供一个替换沉淀剂交付小费,例如,可能意味着一个极有价值的膜蛋白质制剂,因为它应该使用不被浪费。
的机器人的一些优点包括这样的事实,它将工作基本上连续的,它并没有患有或“抱怨”疲劳。机器人也可以用作不被视为人类友好的条件下,如在黑暗中,在控制的照明和环境条件,并且在极端的温度。在这篇文章中表现出的机器人〜20℃的环境条件下使用但是,也有蛋白质和项目,需要非环境温度,控制光11,12和氧化性或还原性环境13。所有这些都可以被照顾,相对容易,使用时的结晶机器人。
在早期的朱庇特视频文章中,我们演示了如何结晶实验的中尺度方法手动设置1。最小量的中间相可省去用手可靠有限公司by的视力,稳定霸道的人设立的试验。根据我们的经验,大量的中间相低至100 NL很容易处理。我们知道,一个实验室中手动分配的默认音量大约是40 NL。然而,相当小的体积可以使用机器人。另外,我们已经表明,机器人14可省去中间相体积低至550皮升。从这项工作进一步小型化的机器人,很明显,是可能的,如果实施的话,会导致宝贵的膜蛋白需要进行结晶试验的数量大量减少。
在这段视频中的文章,三种市售机器人被用来证明使用脂质介孔高通量膜蛋白结晶。其中第一个被开发的MS&FB集团根据我们的经验,设立审判手动,如在朱庇特1712 1。这是仪器MENT我们有最熟悉和当前文章的大部分被用于其使用。另外两个机器人示范MS&FB的时候写的文章,在这里的利益,完整性和相关的画面。所有这三个机器人使用非常相同的中间相分配系统,其中的本质特征是一种容积式玻璃注射器5,7。它们的不同之最显著方面的沉淀交付。机器人1和2可以同时免除沉淀剂为8个孔,在一个时间的结晶板的一个单列。相比之下,机器人分配沉淀所有96个解决方案,在一个单一的行动。机器人2是唯一的工具,用一次性沉淀分配技巧。有其优点和缺点,不同的乐器依赖于特定的应用相关,这些都不会在这里详细阐述。我只想说,所有这三个工作,并产生了晶体的我mbrane蛋白在中观法。
生物大分子晶体结构测定的整个过程的下一个步骤是收割和低温冷晶体板设立此视频文章中所描述的记录和处理X射线衍射。这些主题均包含在单独的朱庇特的这一系列文章中1,15。
Disclosures
没有利益冲突的声明。
Acknowledgments
有很多谁促成了这一工作,大部分是从膜的结构和功能的生物集团,无论是过去和现在的成员。我们致以热烈的感谢和赞赏。这项工作是支持的,部分资金从科学基金会爱尔兰(07/IN.1/B1836人),美国国立卫生研究院(GM75915,P50GM073210的和U54GM094599),FP7 COST行动CM0902。
Materials
| Name | Company | Catalog Number | Comments |
| Brayer (roller) | Fisher Scientific | 50820937 | Tool |
| Gas-tight syringes | Hamilton | 81030 | Tool |
| Glass coverslips | Marienfeld | 01029990911 | Disposable |
| Glass plates | Marienfeld | 1527127092 | Disposable |
| Gryphon LCP Robot | Art Robbins | NA | Tool |
| In meso robot | Anachem/Gilson | NA | Tool |
| Lab notebook | Various | NA | Tool |
| Mosquito LCP Robot | TTP Labtech | NA | Tool |
| Perforated double-stick spacer tape | Saunders Corporation (hole-punched) | customized | Disposable |
| Precipitant solutions | Various | Various | Reagent |
| Purified water | Millipore | NA | Reagent |
| Rain-X | Shell Car Care | 80199200 | Reagent |
| Syringe tips | Hamilton | 7770-020 (gauge 22) | Tool |
| Tissues | Various | Various | Disposable |
| Water bottle | various | NA | Reagent |
References
- Caffrey, M., Porter, C. Crystallizing membrane proteins for structure determination using lipidic mesophases. J. Vis. Exp. (45), e1712 (2010).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Crystallogr. 36, 1372-1377 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. (49), e2501 (2011).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D Bio.l Crystallogr. 60, 1795-1807 (2004).
- Peddi, A. High-throughput automated system for crystallizing membrane proteins in lipidic mesophases. IEEE Trans. Autom. Sci. Eng. 4, 129-140 (2007).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Caffrey, M. Crystallizing membrane proteins for structure-function studies using lipidic mesophases. Biochem. Soc. Trans. 39, 725-732 (2011).
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M. Membrane protein crystallization. J. Struct. Biol. 142, 108-132 (2003).
- Gushchin, I., Reshetnyak, A., Borshchevskiy, V., Ishchenko, A., Round, E., Grudinin, S., Engelhard, M., Buldt, G., Gordeliy, V. Active State of Sensory Rhodopsin II: Structural Determinants for Signal Transfer and Proton Pumping. J. Mol. Biol. 412, 591-600 (2011).
- Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N. Three-dimensional structure of cyanobacterial photosystem I at 2.5 angstrom resolution. Nature. 411, 909-917 (2001).
- Grawert, T., Span, I., Eisenreich, W., Rohdich, F., Eppinger, J., Bacher, A., Groll, M. Probing the reaction mechanism of IspH protein by x-ray structure analysis. Proc. Natl. Acad. Sci. USA. 107, 1077-1081 (2010).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Crystallogr. 39, 604-606 (2006).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and cryo-cooling crystals of membrane proteins grown in lipidic mesophases for structure determination by macromolecular crystallography. J. Vis. Exp. (67), e4001 (2012).



