Summary
Häri beskrivs en robot strategi för hög genomströmning kristallisation av membranproteiner i lipida mesofaser för användning i strukturbestämning med makromolekylär röntgenkristallografi. Tre robotar som klarar den viskösa och klibbiga protein-lastad mesofas integrerad metoden införs.
Abstract
Struktur-funktion studier av membranproteiner stor nytta av att ha tillgängliga högupplösta 3-D strukturer av den typ som tillhandahålls genom makromolekylär röntgenkristallografi (MX). En väsentlig ingrediens i MX är en stadig tillförsel av helst diffraktion kvalitet kristaller. Den i meso-eller lipidisk kubisk fas (LCP) metod för att kristallisera membranproteiner är en av flera metoder som finns tillgängliga för kristallisering membranproteiner. Den använder sig av en bikontinuerlig mesofas att växa kristaller. Som metod, har det haft några spektakulära framgångar sent och har rönt stor uppmärksamhet med många forskargrupper nu intresserade av att använda den. En av utmaningarna i samband med metoden är att webbhotell mesofasen är extremt trögflytande och klibbig, påminner om en tjock tandkräm. Således dispensering det manuellt på ett reproducerbart sätt i små volymer till kristallisation brunnar kräver skicklighet, tålamod och en stadig hand. Ett protokoll för att göra just som utvecklades i membranet Structural & Funktionell biologi (MS & FB) Grupp 1-3. Jove video artiklar som beskriver metoden är tillgängliga 1,4.
Den manuella metoden för att ställa upp i meso studier har klara fördelar med specialitet applikationer, såsom kristall optimering och derivatisering. Det lider emellertid från att vara en låg genomströmning metod. Här visar vi ett protokoll för att utföra i meso kristallisering prövningar robot. En robot erbjuder fördelarna med snabbhet, exakthet, precision, miniatyrisering och att kunna arbeta kontinuerligt under längre perioder under vilka kan betraktas som fientliga förhållanden såsom i mörkret, i en reducerande atmosfär eller vid låga eller höga temperaturer. En i meso robot, när de används på rätt sätt, kan avsevärt förbättra produktiviteten hos membranprotein struktur och funktion forskning genom att underlätta kristallisering som är en av de långsamma stegen iövergripande strukturen bestämning rörledning.
I den här videon artikeln visar vi att använda tre kommersiellt tillgängliga robotar som kan undvara det viskösa och klibbiga mesofas integrerad i meso crystallogenesis. Den första roboten utvecklades i MS & FB Grupp 5,6. De andra två har nyligen blivit tillgängliga och ingår här är komplett.
En översikt av protokoll behandlas i denna artikel visas i fig 1. Alla manipulationer utfördes vid rumstemperatur (~ 20 ° C) under omgivningsbetingelser.
Protocol
1. Förbereda Kristallisation Plate
Ställa in att göra en kristallisering rättegång robot börjar med beredningen av bottenplatta av glas sandwich kristallisering plattan (figur 2), beskrivs i detalj i referens 2. Bas-plattan måste först silaniseras och den perforerade dubbla stick distans som skapar brunnarna, ska tillämpas på plattan. De material och förnödenheter som behövs för detta är specificerade i material.
- Placera plattan på en pappershandduk, tillämpa några droppar silanisering lösning och fördela den jämnt över plattans yta med en pappersnäsduk.
- Avlägsna överskott silanisering lösning genom nedsänkning av plattan i en bägare med vatten.
- Ta plattan ur bägaren, placera den på en torr pappershandduk, silaniserad uppåt och torka sin exponerade ytan genom att torka lätt med en pappershandduk.
- Dra av skyddskåpan på den perforerade, dubbel-stick distansoch tillämpa distansorganet, klibbiga sidan nedåt, till den torra, silanerad yta av glasplattan. Kontrollera att distansorganet är rätt placerad på bottenplattan, med den övre vänstra hörnet och de två intilliggande sidor av distansorganet och plattan, sammanfallande.
- Använd en rulle eller Brayer att platta ut distansorganet på bas-plattan och för att skapa en tät tätning mellan dem.
Förmonterade plattor är kommersiellt tillgängliga (HR3-151, Hampton Forskning, MD11-55-100, molekylära dimensioner, och LCP96T-UVP70U, Swissci). Av kostnadsskäl föredrar vi att montera våra egna tallrikar efter protokollet ovan.
2. I Meso Robot 1
Den första i meso robot påvisas i denna video artikeln är en för närvarande används i MS & FB Group (Figur 3). Fullständig information om roboten finns under Material och i Reference avsnitt 5. De material och equipment som krävs för att skapa en kristallisering studie med roboten är specificerade i material.
- Placera basplattan med distans framställts i avsnitt 1 på däck av roboten. Den har sin egen plattform märkt med väl positioner för syfte basplatta inriktning. Plattan bör märkas för identifiering.
- Säkra 96-brunnars fällningsmedel blocket i sin egen plattform på däck av roboten bredvid kristallisering plattan.
- Öppna blocket försiktigt genom att dra bort plasten tätningslocket.
- Slå på luftfuktare och rikta strömmen av fuktig luft över och över bottenplatta på däck av roboten. Fuktaren har visats reducera förångning av utfällningsmedlet lösningen och förbättra reproducerbarheten över kristallisa plattan 5. Det kan slås på innan installation att i förväg fukta området när omgivningens relativa fuktigheten är låg, eller på annat sätt, strax före utlämning av mesofasen påbörjas.
- Initiera roboten enligt tillverkarens instruktioner. Instrument specifika instruktioner kommer inte att beskrivas här i detalj eftersom exakta rutiner kommer att förändras över tiden. Huvudsak, vad som händer under initiering är att mesofasen utmatning armen på roboten är försedd med referenspositioner i tre ortogonala riktningar X, Y och Z.
- Fäst protein lastat mesofas i en Hamilton-spruta, komplett med doseringsnålen, till Arm 1 av roboten (figur 3). Fullständig information om hur du förbereder mesofasen och hur du lägger det i sprutan har beskrivits i Referenser 3,7-10.
- Ta bort den övre skyddshöljet från distans på kristallisering basplatta och rikta brunnarna på plattan med referenserna på basplattan plattform. Observera för att denna video har skyddshöljet kvar på plats för att hjälpa Viewer under inriktningen steg.
- Rikta nålen spets dosering Syringe med botten av den översta väl i det vänstra hörnet av kristallisationen plattan (brunn A1). Detta görs genom ögat justera höjden eller Z-koordinat utmatning armen medan tittar på hur nära nålspetsen kommer till botten av brunnen. Att spetsen är bara vidrör botten av brunnen kan bedömas genom att flytta plattan från sida till sida på plattformen samtidigt aldrig så lite justering av höjden på dosering armen.
- Träda in i datorn Z-koordinaten för utmatning armen där spetsen kommer i kontakt med plattan. Dispensering är programmerad att ske med nålspetsen 80 mikrometer från denna referens Z-läge som motsvarar ytan på bas-plattan.
- Position genom öga nålspetsen i mitten av Well A1. Butik i styrdatorn referensen X, Y-koordinat för utmatning armen där spetsen är centrerad. Denna koordinat används för att definiera centrum av de återstående brunnarna på plattan.
- PrIME sprutan med lämpligt kommando på roboten datorn för att säkerställa att färskt mesofasen fyller doseringsnålen och att de första och efterföljande brunnar får sitt fulla sortiment av mesofas. Torka av extruderad mesofas på nålspetsen med en vävnad.
- Starta Kör Robot (X-AP) för att initiera en runda spola steg där de utfällande utlämning tips om Arm 2 av roboten tvättas och är beredda att suga lösningar från fällningsmedel blocket.
- Aktivera dosera funktion på roboten att sätta i gång den sekventiella laddningen av brunnar med protein-lastad mesofas (vanligtvis 50 ni) först, en kolonn av åtta brunnar vid en tidpunkt, följt av fällningsmedel lösningar (vanligtvis 800 nl). Mellan lastning kolumner, fuktade mesofas dispensering armen återgår till parkeringsläge, där änden av nålen är placerad i en svamp för att förhindra att mesofasen på spetsen torkar ut. Processen för dosering mesofas och utfällningsmedlet upprepas11 gånger över plattan tills plattan är fylld. Lastningen av en 96-brunnars platta med mesofas och utfällningsmedlet tar 5 minuter att slutföra.
- Så snart plattan är fylld och robotarmarna har återvänt till sina park positioner, ta bort plattan från däcket av roboten och placera den på en plan fast yta.
- Omedelbart täta plattan med en lock-glas för att minimera tidsberoende förändringar i väl komposition. Det är viktigt att säkerställa att alla 96 brunnar täcks in fullständigt, att locket glas är inriktad fyrkant med bas-plattan och att ingen av locket glas sträcker sig utanför fotavtrycket för bas-plattan. En rulle eller Brayer används för att skapa en tät och enhetlig tätning mellan locket glas och distansorganet.
- Inspektera plattan att vara säker på uppsättningen gick som den skulle. Vad man letar efter är en "stekt ägg på en pan" utseende i varje brunn. Äggulan av stekt ägg motsvarar mesofasen. Den vita av ägget är fällningsmedel Solutipå och kanten av pannan är omkretsen av kristallisationen väl. Idealt är tre är koncentriska.
- Placera plattan i en temperaturreglerad lagringsutrymme för kristalltillväxt.
- Om inga fler plattor ska sättas upp, ta bort fällningsmedel blocket från däcket av roboten, stänger till ordentligt och sätta tillbaka in i lager.
- Ta sprutan innehåller mesofasen från tubens armen av roboten, demontera den och tvätta dess delar, inklusive doseringsnålen och hylsa, försiktigt med metanol och torka i förberedelse för nästa användning.
3. I Meso Robot 2. Mygga LCP
Mosquito LCP roboten (figur 4) innefattar en liknande mesofas dispenser som används av roboten 1. I motsats till Robot 1, doserar det fällningsmedel genom engångsspetsar. Programmeringsverktyg används för att ställa in instrumentet för att arbeta med särskilda kristallisations plattor och NEDERBÖRDant block, och att avstå användardefinierade volymer mesofas och fällningsmedel i en specificerad sekvens. Sådana detaljer ges av tillverkaren och kommer inte att beskrivas här.
- Förbered en Hamilton-spruta, komplett med nål och fylld med protein-lastat mesofas, såsom beskrivits ovan under Robot 1 och i JUPITER artikel 1712 1.
- Spänn sprutan i läge på utmatning armen av roboten.
- Använd bänk monterad lasersensor att fastställa X-och Y-koordinaterna för nålen på dosering sprutan. Detta är ett viktigt steg för att säkerställa att den mesofasen utmatas korrekt vid centrum av varje brunn på plattan.
- Med en enkel knapptryckning på kontrollpanelen, prime sprutan för att driva mesofas från nålen. Ta extruderad mesofas från nålspetsen med en vävnad som förberedelse för att använda roboten för att ladda brunnar.
- Innan du placerar kristallisation plattan på däck av roboten fuktigsv ytan av plattformen med några droppar vatten för att hjälpa till att hålla plattan på plats genom kapillaritet.
- Ta bort skyddet från distans på glaset basplatta och placera den på sin plattform ordentligt för att säkerställa god vidhäftning. Använd de tre referenserna på plattformen att anpassa 3 hörn brunnarna därigenom säkerställer korrekt positionering av brunnarna på plattan med avseende på utmatning nålspetsen. Instrumentet är nu beordras att ange en utmatningscykel.
- Cykeln börjar med en andra primer steg där mesofas fördelas på en liten glasskiva omedelbart innan vi går vidare för att ladda brunnar med färsk mesofas. Roboten 1. Laster med mesofas en vertikal kolumn av 8 brunnar på plattan och sedan använder engångsspetsar att avstå fällningsmedel lösning ovanpå mesofas bolus. Processen upprepas 11 gånger längs längden av plattan tills alla brunnar är fyllda. Hela processen tar ca 5 min att slutföra.
- Ta bortden fyllda plattan från plattformen av roboten och försegla den med ett lock-glas såsom beskrivits ovan under Robot 1.
- Placera plattan, korrekt märkta, i en temperaturstyrd miljö för kristalltillväxt.
4. I Meso robot 3. Gryphon LCP
Gryphon LCP roboten (figur 5) innefattar en liknande mesofas dispenseringssystem som beskrivits ovan för Robotar 1 och 2. Vad skiljer den från de andra två är att alla 96 fällningsmedel lösningar doseras samtidigt.
- Förbered protein-lastad mesofas och ladda den i dosering sprutan, som beskrivs ovan, under Robotar 1 och 2, och i JUPITER artikel 1712 1.
- Spänn sprutan i läge på utmatning armen av roboten.
- Placera fällningsmedel lösningen blocket och kristallisering platta på däck av roboten.
- Ladda 96-tip head med fällningsmedel lösningar. Ett användardefinierat fördröjningstiden är anordnad för att underlätta suga viskösa fällningsmedel.
- Kommando instrumentet för att ange en utmatningscykel. Cykeln börjar med mesofasen dispenseras sekventiellt in de 96 brunnarna i en process som tar ungefär 1 minut att fullborda. Den 96-tip huvud doserar sedan alla 96 fällningsmedel lösningar samtidigt på toppen av mesofas bolus i kristallisation brunnarna. Hela plattan lastningen är klar i 2 minuter.
- Avlägsna den fyllda plattan från plattformen av roboten och försegla den med ett lock-glas såsom beskrivits ovan under Robot 1.
- Placera plattan, korrekt märkta, i en temperaturstyrd miljö för kristalltillväxt.
5. Representativa resultat
Syftet med denna video artikeln är att visa hur man ställer in automatiskt kristallisation försök med en trögflytande, membranprotein-lastat mesofas i glas sandwich 96-brunnars kristallisation plattor. Tyngdpunkten ligger på automatisering genom användning av specialiserade robotar som kräver minimal manuell hantering. Reproducerbarhet och precision när det gäller volymer mesofas och dispenseras fällningsmedel och placeringen av både inom väl, förväntas när en robot används. Dessa är viktiga ur synvinkel av effektiv screening av förhållanden som stödjer crystallogenesis. De är också kritisk för nästa steg i analysen rörledning som är att utvärdera kristalltillväxt ofta gjort med bildbehandlingsutrustning. Släpp eller bolus plats är nyckeln till avbildningsprocessen, och oregelbundna och felaktig placering av bolus i brunnen kräver vanligtvis användaren att korrigera för och tar tid. För illustrationsändamål, är exempel på korrekt och felaktigt laddade plattor visas i Figur 6.
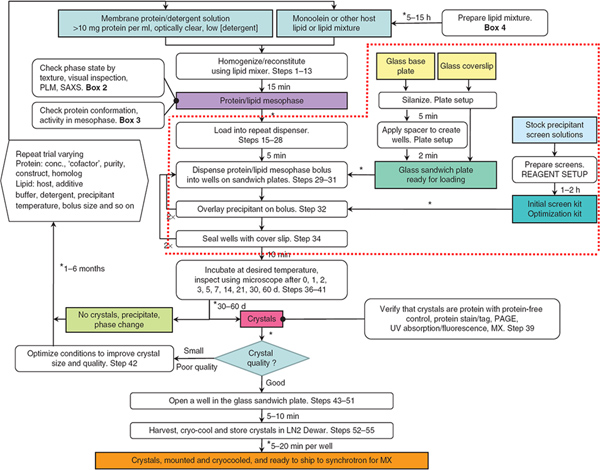
Figur 1. Flödesdiagrammet sammanfattar de olika stegen i produktionen, skörd och kryo-kylning av i meso-odlade kristaller membranprotein. Steg omgivna av den streckade röda linjen står i fokus för denna JUPITER artikel. Robotar användes för att fördela mesofas och fällningsmedel lösningar i steg 29-32. Från ref 3. Klicka här för att se större bild .

Figur 2. En fullastad och förseglade 96-håls glas smörgås kristallisering plattan. Varje brunn innehåller 50 nl kubisk fas och 1 pl fällningsmedel lösning. För tydlighetens skull har den kubiska fasen har färgas med Sudan Red och utfällningsmedlet lösningen innefattar metylenblått. Från referens 5.
_upload/4000/4000fig3.jpg "alt =" Bild 3 "/>
Figur 3. In meso roboten (Robot 1). Roboten har två armar. Arm 1 matar ut protein-lastad lipidisk mesofas. Arm 2 doserar fällningsmedel lösningar. Under fyllning, förblir 96-brunnars platta fixerad i läge på däcket av roboten som själv är stationär. De två armarna rör sig för att leverera mesofas och fällningsmedel lösningar. Från Referens 3.

Figur 4. Mosquito LCP robot (robot 2). I motsats till Robot 1, däck Mosquito LCP, på vilken sitter en 96-brunnsplatta och utfällningsmedlet lösningen blocket, rör sig horisontellt under påfyllningen.

Figur 5. Gryphon LCP robot (robot 3). Under eninrätta, flyttar lipidiska kubiska fasen dispenser för att leverera protein-lastad mesofas på 96-brunnars platta. Däcket översätter sedan horisontellt för att placera plåten under fällningsmedel lösning spets huvud. Samtliga 96 fällningsmedel lösningar dispenseras samtidigt. Bild kommer från tillverkaren ( http://www.artrobbins.com/ ) och märkt.

Figur 6. En fullastad och förseglad 96-brunnars glas sandwichskivor (A) och brunnarna ordentligt (B) och felaktigt (C, D) fylldes med i meso roboten (robot 1). Streckkodsetiketten på plattan i A används för att spåra plattan i plattan inkubatorn / avbildningsanordning. I paneler BD fällningsmedel lösning och mesofas är märkta P och M respektive. Den förväntade "stekt ägg på en pan-utseende av brunnen i B är karakteristisk för en korrekt laddad och förseglas väl. I C, har fällningsmedel avgivits i brunnen felaktigt i ett excentriskt läge och har kommit i kontakt med distansorganet. I C verkar det också att volymen av mesofasen är mindre än den borde vara. Ett exempel på ofullständig belastning med fällningsmedel lösning visas i D. skala, är diametern av alla brunnar 6 mm.
Discussion
I denna video artikeln har vi visat hur man använder en robot för att automatiskt ställa in i meso kristallisation försök i 96-brunnar glas sandwich med en protein-lastad lipidisk mesofas. De robotar som används i detta arbete var speciellt utformade för att inkludera en positiv förskjutning spruta glas för noggrann och reproducerbar leverans av metod i nanoliter volymer av den viskösa och klibbiga mesofas, såsom ursprungligen beskrivits 7.
Noggrannhet och precision är viktiga inslag i en robot. Men dessa egenskaper är bara så bra som den grad till och korrekthet som robot prestanda utvärderas och kalibrering utförs. Det säger sig självt att prestandan av roboten bör utvärderas medan enskilda plattor håller på att upprättas. Det är inte lämpligt att anta att roboten fungerar felfritt och lämna roboten att köra utan uppsikt. Den uppmärksamma och observant aktör bör vara i en position att notera med ett ljud eller ett utseende när något inte fungerar och att rätta till det genast. Dessutom bör varje platta noggrant inspekteras med ögat för enhetliga och innehåll, så snart som plattan förseglas och innan den ställs undan för kristallisation försök. Detta bör endast kräver några sekunder att utföra och kan göras medan nästa platta laddas. Märker, till exempel, kan det vissa brunnar inte korrekt ifyllda belysa det faktum att en viss fällningsmedel tubens spets fungerar inte. Skulle leverans av mesofas ses vara oregelbunden, skulle den relevanta felaktiga posten måste korrigeras omedelbart. Genom att notera dessa frågor och göra de relevanta justeringarna under uppsättningen kommer att spara tid och material, inklusive värdefull lipid och membranprotein. Om en kameran används för att spåra kristalltillväxt, kan noggrannhet och precision även övervakas under avbildning. Till exempel systematiska problem med droppe eller bolusläge vid imager visar att något inte står rätt och att korrigerande åtgärder någonstans uppströms i protokollet behövs.
I syfte att tillförlitlig prestanda därför roboten måste kalibreras på ett regelbundet schema och behov. Kalibreringar bör omfatta volymen av fällningsmedel och mesofas levereras liksom bolus och fällningsmedel placering i brunnen. Självklart bör i möjligaste mån kalibrering göras med hjälp av volymer och material som liknar dem som kommer att användas i försök utförda i den period som den kvalitetskontrollen.
Lika viktigt som kalibrering så också är med i lager ett tillräckligt utbud av robotdelar och tillbehör. Katastrofala och oväntade fel, blockeringar och krascher kan och göra uppstå. I ett sådant fall, med tillgång till en ersättare fällningsmedel leverans spets, till exempel, kan innebära att en extremt värdefull membranprotein preparat används som det ska ochinte slösas bort.
Några av fördelarna med en robot innefattar det faktum att det kommer att fungera väsentligen kontinuerligt och att det inte lider av eller "klagar över" trötthet. En robot kan också användas under förhållanden som inte anses människa-vänlig, som i mörkret under kontrollerade belysning och miljöförhållanden, och vid extrema temperaturer. Robotarna visade i denna artikel har alla används under omgivningsförhållanden vid ~ 20 ° C. Men det är proteiner och projekt som kräver icke-omgivningstemperaturer, kontrollerad ljus 11,12 och en oxiderande eller en reducerande miljö 13. Alla dessa kan tillgodoses, med relativ lätthet, då en kristallisering robot används.
I en tidigare JUPITER video artikel vi visade hur kristallisation försök från i meso metoden sätts upp manuellt 1. Den minsta mängd mesofas som kan dispenseras tillförlitligt hand är begränsad by synskärpa och stadig hänthet den person inrätta försöken. Enligt vår erfarenhet är volymer mesofas så låga som 100 nl lätt att hantera. Vi känner en labbet där standardvolymen doseras manuellt är ca 40 nl. Men betydligt mindre volymer är möjliga med hjälp av en robot. Separat, har vi visat att mesofas volymer så låga som 550 pikoliter kan dispenseras robot 14. Från det arbetet stod det klart att ytterligare miniatyrisering av roboten är möjligt som, om de genomförs, skulle leda till en stor minskning av mängden värdefulla membranprotein som behövs för att genomföra en kristallisation rättegång.
I den här videon artikeln har tre kommersiellt tillgängliga robotar som används för att påvisa hög kapacitet kristallisering membranprotein med lipida mesofaser. Den första av dessa har utvecklats i MS & FB-gruppen baserat på vår erfarenhet inrättande försök manuellt, vilket beskrivs i JUPITER 1712 1. Detta är instrumentetsning har vi mest kännedom och huvuddelen av den aktuella artikeln ägnas åt dess användning. De andra två robotar var på demonstrationen i MS & FB-gruppen vid tidpunkten för artikeln skrevs och relevant film ingår här med tanke på fullständighet. Alla tre robotar använder mycket samma mesofasen dosering system, huvudsakligen kännetecknas av en positiv förskjutning glasspruta 5,7. De skiljer sig mest markant när det gäller fällningsmedel leverans. Robotar 1 och 2 kan fördela fällningsmedel samtidigt i 8 brunnar, en enda kolumn på en kristallisering platta i taget. Däremot avstår Robot 3 alla 96 fällningsmedel lösningar i en enda åtgärd. Robot 2 är det enda instrumentet med engångs utfällande utlämning tips. Det finns för-och nackdelar som är förknippade med de olika instrumenten som är beroende på den speciella tillämpningen, dessa kommer inte att utarbetas på här. Det räcker med att säga att alla tre arbete och har producerat kristaller av migmbrane proteiner från i meso metoden.
Nästa steg i den övergripande processen strukturbestämning genom makromolekylär kristallografi är att skörda och kryo-cool kristaller från plattor som inrättats enligt denna video artikeln och registreras och behandlas röntgendiffraktion från dem. Dessa ämnen behandlas i separata Jove artiklar i denna serie 1,15.
Disclosures
Inga intressekonflikter deklareras.
Acknowledgments
Det finns många som har bidragit till detta arbete och de flesta är från membranet strukturell och funktionell biologi Group både tidigare och nuvarande medlemmar. Till alla vi varmt tack och uppskattning. Detta arbete stöddes delvis av anslag från vetenskapsrådet Irland (07/IN.1/B1836), National Institutes of Health (GM75915, P50GM073210 och U54GM094599) och FP7 COST Action CM0902.
Materials
| Name | Company | Catalog Number | Comments |
| Brayer (roller) | Fisher Scientific | 50820937 | Tool |
| Gas-tight syringes | Hamilton | 81030 | Tool |
| Glass coverslips | Marienfeld | 01029990911 | Disposable |
| Glass plates | Marienfeld | 1527127092 | Disposable |
| Gryphon LCP Robot | Art Robbins | NA | Tool |
| In meso robot | Anachem/Gilson | NA | Tool |
| Lab notebook | Various | NA | Tool |
| Mosquito LCP Robot | TTP Labtech | NA | Tool |
| Perforated double-stick spacer tape | Saunders Corporation (hole-punched) | customized | Disposable |
| Precipitant solutions | Various | Various | Reagent |
| Purified water | Millipore | NA | Reagent |
| Rain-X | Shell Car Care | 80199200 | Reagent |
| Syringe tips | Hamilton | 7770-020 (gauge 22) | Tool |
| Tissues | Various | Various | Disposable |
| Water bottle | various | NA | Reagent |
References
- Caffrey, M., Porter, C. Crystallizing membrane proteins for structure determination using lipidic mesophases. J. Vis. Exp. (45), e1712 (2010).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Crystallogr. 36, 1372-1377 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. (49), e2501 (2011).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D Bio.l Crystallogr. 60, 1795-1807 (2004).
- Peddi, A. High-throughput automated system for crystallizing membrane proteins in lipidic mesophases. IEEE Trans. Autom. Sci. Eng. 4, 129-140 (2007).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Caffrey, M. Crystallizing membrane proteins for structure-function studies using lipidic mesophases. Biochem. Soc. Trans. 39, 725-732 (2011).
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M. Membrane protein crystallization. J. Struct. Biol. 142, 108-132 (2003).
- Gushchin, I., Reshetnyak, A., Borshchevskiy, V., Ishchenko, A., Round, E., Grudinin, S., Engelhard, M., Buldt, G., Gordeliy, V. Active State of Sensory Rhodopsin II: Structural Determinants for Signal Transfer and Proton Pumping. J. Mol. Biol. 412, 591-600 (2011).
- Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N. Three-dimensional structure of cyanobacterial photosystem I at 2.5 angstrom resolution. Nature. 411, 909-917 (2001).
- Grawert, T., Span, I., Eisenreich, W., Rohdich, F., Eppinger, J., Bacher, A., Groll, M. Probing the reaction mechanism of IspH protein by x-ray structure analysis. Proc. Natl. Acad. Sci. USA. 107, 1077-1081 (2010).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Crystallogr. 39, 604-606 (2006).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and cryo-cooling crystals of membrane proteins grown in lipidic mesophases for structure determination by macromolecular crystallography. J. Vis. Exp. (67), e4001 (2012).



