Summary
Ici est décrit une approche robotique à haut débit cristallisation des protéines membranaires dans des mésophases lipidiques pour une utilisation dans la détermination de la structure macromoléculaire à l'aide cristallographie aux rayons X. Trois robots capables de gérer la protéine visqueuse et collante chargé de mésophase partie intégrante de la méthode sont présentés.
Abstract
Études structure-fonction des protéines membranaires ayant grandement bénéficier de disponibles en haute résolution des structures 3-D du type prévu par macromoléculaire cristallographie aux rayons X (MX). Une composante essentielle de MX est un approvisionnement régulier de l'idéal de diffraction des cristaux de qualité. Le méso ou lipidique dans la phase cubique (LCP) Méthode de cristallisation de protéines membranaires est l'une des nombreuses méthodes disponibles pour la cristallisation des protéines membranaires. Il fait usage d'une mésophase bicontinue dans laquelle faire croître des cristaux. En tant que méthode, il a eu quelques succès spectaculaires de la fin et a attiré beaucoup d'attention aux nombreux groupes de recherche s'intéressent maintenant à l'utiliser. L'un des défis associés à la méthode, c'est que la mésophase hébergement est extrêmement visqueuse et collante, qui rappelle un dentifrice d'épaisseur. Ainsi, le distribuer manuellement de façon reproductible dans de petits volumes dans des puits de cristallisation exige des compétences, de la patience et une main ferme. Un protocole pour faire juer qui a été développé dans la membrane structurale et fonctionnelle Biologie (MS & FB) 1-3. Articles Jove vidéo décrivant la méthode sont disponibles 1,4.
L'approche manuelle pour la mise en place de méso essais a des avantages distincts avec des applications spécialisées, telles que l'optimisation de cristal et dérivatisation. Il ne souffrent cependant d'être une méthode à faible débit. Ici, nous démontrons un protocole pour effectuer des essais de cristallisation méso robotique. Un robot offre les avantages de la rapidité, l'exactitude, la précision, la miniaturisation et être capable de travailler en continu pendant des périodes prolongées dans ce qui pourrait être considéré comme des conditions hostiles, comme dans l'obscurité, dans une atmosphère réductrice ou à des températures basses ou élevées. Un de méso robot, lorsqu'il est utilisé correctement, peut grandement améliorer la productivité de structure des protéines membranaires et de recherche sur la fonction, en facilitant la cristallisation qui est l'une des étapes lentes dul'ensemble du pipeline détermination de la structure.
Dans cet article, vidéo, nous démontrons l'utilisation de trois robots disponibles dans le commerce qui peuvent dispenser la mésophase visqueuse et collante partie intégrante de cristallogenèse méso. Le premier robot a été développé dans le MS & FB Group 5,6. Les deux autres sont récemment devenus disponibles et sont incluses ici par souci d'exhaustivité.
Un aperçu du protocole abordés dans cet article sont présentés dans la figure 1. Toutes les manipulations ont été effectuées à température ambiante (~ 20 ° C) dans des conditions ambiantes.
Protocol
1. Préparation de la plaque de cristallisation
Mise en place de faire un essai de cristallisation robot commence par la préparation de la plaque de base de la plaque de cristallisation du verre sandwich (figure 2), décrit en détail dans la référence 2. La plaque de base doit d'abord être traité au silane et le bâton perforé double entretoise qui crée les puits, il faut appliquer à la plaque. Les matériaux et les fournitures nécessaires à cet effet sont détaillés sous la rubrique Matériel.
- Placez la plaque sur une serviette en papier, appliquer quelques gouttes de solution de silanisation et répartissez sur toute la surface de la plaque avec un mouchoir en papier.
- Retirer l'excès de solution de silanisation par immersion de la plaque dans un récipient rempli d'eau.
- Prenez la plaque de la bécher, placez-le sur une serviette en papier, côté silanisé en place, et sécher la surface exposée en frottant légèrement avec une serviette en papier.
- Retirez le couvercle de protection sur la perforation, double-bâton entretoiseet appliquer l'entretoise, côté adhésif vers le bas, à la surface sèche et silanisée de la plaque de verre. Assurez-vous que l'entretoise est positionné correctement sur la plaque de base, avec le coin supérieur gauche et les deux côtés adjacents de l'entretoise et la plaque, en même temps.
- Utiliser un rouleau ou rouleau-tampon pour aplatir l'entretoise sur la plaque de base et à créer un joint étanche entre eux.
Plaques préfabriquées sont disponibles dans le commerce (HR3-151, Hampton Research; MD11-55-100, dimensions moléculaires et LCP96T-UVP70U, Swissci). Pour des raisons de coût, on préfère monter nos propres plaques suivant le protocole ci-dessus.
2. En Méso Robot 1
Le premier robot à méso être démontré dans cet article la vidéo est celle actuellement en usage dans les États membres et FB Group (figure 3). Tous les détails du robot peut être trouvé sous Matériaux et dans l'article 5 de référence. Les matériaux et equipment nécessaire de mettre en place un essai de cristallisation en utilisant le robot sont détaillés sous la rubrique Matériel.
- Placer la plaque de base avec espacement préparés dans la section 1 sur le pont du robot. Il a sa propre plate-forme marquée avec des positions et à des fins de plaque de base d'alignement. La plaque doit être étiqueté aux fins d'identification.
- Fixer le bloc 96-précipitant ainsi dans sa propre plate-forme sur la plate-forme du robot à côté de la plaque de cristallisation.
- Ouvrez le bloc soigneusement en enlevant le bouchon d'étanchéité en plastique.
- Activer l'humidificateur et diriger le courant d'air humide et de l'autre côté sur la plaque de base sur le pont du robot. L'humidificateur a été montré pour réduire l'évaporation de la solution de précipitant et d'améliorer la reproductibilité de l'autre côté de la plaque 5 cristallisation. Il peut être mis en marche avant de mettre en place une pré-humidifier la zone où l'humidité relative ambiante est faible, ou non, juste avant la distribution de mésophase commence.
- Initialiser le robot en suivant les instructions du fabricant. Instructions spécifiques de l'instrument ne sera pas décrit ici en détail parce que les procédures exactes va changer au fil du temps. Pour l'essentiel, ce qui se produit pendant l'initialisation est que la distribution de mésophase bras du robot est muni d'positions de référence dans trois directions orthogonales X, Y et Z.
- Fixez la mésophase protéines chargées dans une seringue Hamilton, avec distribution d'aiguilles, à Bras 1 du robot (figure 3). Tous les détails de la façon de préparer la mésophase et comment le charger dans la seringue ont été décrits dans les références 3,7-10.
- Retirez le couvercle de protection supérieure de l'entretoise sur la cristallisation plaque de base et alignez les puits de la plaque avec des repères sur la plate-forme de base de la plaque. Remarque, dans le but de cette vidéo, le couvercle de protection a été laissé en place pour aider à la visionneuse lors de l'étape d'alignement.
- Alignez la pointe de l'aiguille de la distribution syringe avec le fond de la couche supérieure et dans le coin gauche de la plaque de cristallisation (puits A1). Ceci est réalisé en ajustant la hauteur des yeux ou de coordonnée Z du bras de distribution tout en regardant la proximité de la pointe de l'aiguille vient au fond du puits. Que la pointe est juste de toucher le fond du puits peut être jugée en déplaçant la plaque de gauche à droite sur la plate-forme tandis que très légèrement le réglage en hauteur du bras de distribution.
- Entrer dans l'ordinateur la coordonnée Z du bras de distribution lorsque les contacts d'extrémité de la plaque. Distribution est programmé pour avoir lieu avec la pointe de l'aiguille 80 micromètres à partir de cette référence Z-position qui correspond à la surface de la plaque de base.
- Position à l'œil nu la pointe de l'aiguille au centre du puits A1. A conserver dans l'ordinateur de contrôle de la référence X, coordonnée Y du bras de distribution lorsque la pointe est centrée. Cette coordonnée est utilisée pour définir le centre des puits restants sur la plaque.
- Prime la seringue en utilisant la commande appropriée sur l'ordinateur du robot afin de s'assurer que mésophase frais remplit l'aiguille de distribution et que les premiers puits et ensuite recevoir leur gamme complète de mésophase. Essuyez mésophase extrudé sur la pointe de l'aiguille avec un mouchoir.
- Démarrez le Robot Run (X-AP) programme d'initier un cycle de rinçage étapes où les conseils précipitants de distribution sur le bras 2 du robot sont lavés et sont prêts à aspirer des solutions à partir du bloc de précipitation.
- Activer l'. Dispenser fonction sur le robot pour mettre en mouvement le chargement séquentiel de puits avec des protéines chargé de mésophase (habituellement 50 nl) d'abord, une colonne de huit puits à la fois, suivie par des solutions précipitants (généralement 800 Nl) Entre les colonnes de chargement, les rendements mésophase bras distributeur à une position de stationnement où l'extrémité de l'aiguille est placée dans une éponge humide pour éviter la mésophase à la pointe de sécher. Le processus de distribution mésophase et précipitant est répété11 fois à travers la plaque jusqu'à ce que la plaque est remplie. Le chargement d'une plaque de 96 puits avec mésophase et précipitant prend 5 minutes à remplir.
- Dès que la plaque est remplie et les bras du robot sont retournés à leurs postes parc, retirez la plaque sur le pont du robot et placez-le sur une surface plane et solide.
- Immédiatement, sceller la plaque avec un couvercle en verre pour minimiser le temps dépendant de changements dans la composition bien. Il est important de veiller à ce que tous les puits 96 sont entièrement recouverts, que le couvre-objet est aligné avec le carré de plaque de base et que aucun des couvre-objet s'étend au-delà de l'empreinte de la plaque de base. Un galet ou rouleau-tampon est utilisé pour créer un joint étanche et un uniforme entre la lamelle et la pièce d'écartement.
- Inspecter la plaque pour s'assurer que la mise en place est allé comme il se doit. Ce que l'on cherche est un "oeuf sur le plat sur une plaque 'apparition dans chaque puits. Le jaune de l'oeuf sur le plat correspond à la mésophase. Le blanc de l'œuf est le précipitant solutiet sur le bord de la cuve est le périmètre de la cristallisation bien. Idéalement, les trois sont concentriques.
- Placer la plaque dans une zone de stockage à température contrôlée pour la croissance cristalline.
- Si aucun des plaques plus doivent être mis en place, retirez le bloc précipitant à partir du pont du robot, fermez-le complètement et de le remettre dans le stockage.
- Retirez la seringue contenant la mésophase du bras de distribution du robot, la démonter et laver ses parties, y compris l'aiguille de distribution et la virole, soigneusement avec du méthanol et sec en préparation pour la prochaine utilisation.
3. En Méso Robot 2. Mosquito LCP
Le Mosquito LCP robot (figure 4) comprend un distributeur de mésophase similaire à celle utilisée par Robot 1. Contrairement à Robot 1, il distribue précipitant par l'intermédiaire d'embouts jetables. Logiciel de programmation est utilisé pour configurer l'instrument pour travailler avec des plaques de cristallisation particuliers et precipitblocs de fourmis, et pour distribuer des volumes définis par l'utilisateur de mésophase et de précipitation dans un ordre spécifié. Ces détails sont fournis par le fabricant et ne seront pas décrits ici.
- Préparer une seringue de Hamilton, avec son aiguille et rempli de protéines chargé de mésophase, comme décrit ci-dessus sous robot 1 et à l'article JoVE 1712 1.
- Serrer la seringue en position sur le bras de distribution du robot.
- Utilisez la plate-forme montée capteur laser pour établir les coordonnées X et Y de l'aiguille sur la seringue de distribution. Il s'agit d'une étape importante nécessaire pour s'assurer que la mésophase est distribué avec précision au centre de chaque puits de la plaque.
- Avec le toucher d'un bouton sur le panneau de commande, purger la seringue pour expulser mésophase de l'aiguille. Retirer mésophase extrudé à partir de la pointe de l'aiguille avec un mouchoir en vue de l'utilisation du robot pour charger puits.
- Avant de placer la plaque de cristallisation sur le pont de l'humidité de roboten la surface de la plate-forme avec quelques gouttes d'eau pour aider à maintenir la plaque en place par capillarité.
- Retirez le couvercle de protection de l'entretoise sur la plaque de base en verre et le placer sur sa plate-forme fermement pour assurer une bonne adhérence. Utiliser les trois repères sur la plate-forme pour aligner les 3 puits d'angle, assurant ainsi un positionnement correct des puits de la plaque par rapport à la pointe de l'aiguille de distribution. L'instrument est alors commandé pour entrer dans un cycle de distribution.
- Le cycle commence par une étape d'amorçage seconde où mésophase est distribué sur une petite plaque de verre juste avant de passer à charger puits avec mésophase frais. Les charges mésophase premier robot avec une colonne verticale de 8 puits sur la plaque, puis utilise les embouts jetables pour dispenser solution de précipitant au-dessus du bol mésophase. Le processus est répété 11 fois sur la longueur de la plaque jusqu'à ce que tous les puits sont remplis. L'ensemble du processus prend environ 5 minutes à compléter.
- Enleverla plaque remplie de la plate-forme du robot et de le sceller avec un couvercle en verre comme décrit ci-dessus en vertu de robot 1.
- Placer la plaque, bien marquée, dans un environnement à température contrôlée pour la croissance cristalline.
4. En Méso Robot 3. Gryphon LCP
Le Gryphon LCP robot (figure 5) comprend un système de distribution mésophase similaire à celle décrite ci-dessus pour Robot 1 et 2. Ce qui la distingue des deux autres, c'est que les 96 solutions précipitants sont distribués simultanément.
- Préparer la mésophase protéines charge et chargez-le dans la seringue de distribution, tel que décrit ci-dessus, sous Robots 1 et 2, et à l'article JoVE 1712 1.
- Serrer la seringue en position sur le bras de distribution du robot.
- Placer le bloc de solution de précipitant et de la plaque de cristallisation sur le pont du robot.
- Chargez le hea 96-pointed avec des solutions de précipitation. Défini par l'utilisateur le temps de retard est prévu pour faciliter l'aspiration précipitants visqueux.
- Commander l'appareil pour saisir un cycle de distribution. Le cycle commence avec la mésophase être distribuée de manière séquentielle dans les 96 puits dans un processus qui prend environ 1 minute pour terminer. La tête 96-pointe distribue ensuite tous les 96 solutions précipitant à la fois au-dessus des bolus de mésophase dans les puits de cristallisation. Le processus plaque entière chargement est terminé en 2 min.
- Retirer la plaque remplie à partir de la plate-forme du robot et de le sceller avec un couvercle en verre, comme décrit ci-dessus sous 1 Robot.
- Placer la plaque, bien marquée, dans un environnement à température contrôlée pour la croissance cristalline.
5. Les résultats représentatifs
Le but de cet article vidéo est de montrer comment mettre en place des essais de cristallisation automatiquement avec un liquide visqueux, protéine membranaire chargé de mésophase en verre Sandwicplaques de cristallisation h à 96 puits. L'accent est mis sur l'automatisation grâce à l'utilisation de robots spécialisés qui nécessitent un minimum d'intervention manuelle. Reproductibilité et la précision, en termes de volumes de mésophase et précipitant distribuée et la mise en place de l'intérieur du puits, on s'attend quand un robot est utilisé. Elles sont importantes du point de vue d'un dépistage efficace des conditions qui favorisent la cristallogenèse. Ils sont également essentiels pour la prochaine étape dans le pipeline d'analyse qui consiste à évaluer la croissance des cristaux se fait souvent avec l'équipement d'imagerie. Lieu de dépose ou de bolus est essentielle pour le processus d'imagerie, et le placement irrégulier et incorrect de bolus dans le puits nécessite habituellement intervention de l'utilisateur pour corriger et prend du temps. A titre d'illustration, des exemples de plaques correctement et incorrectement chargées sont présentés dans la figure 6.
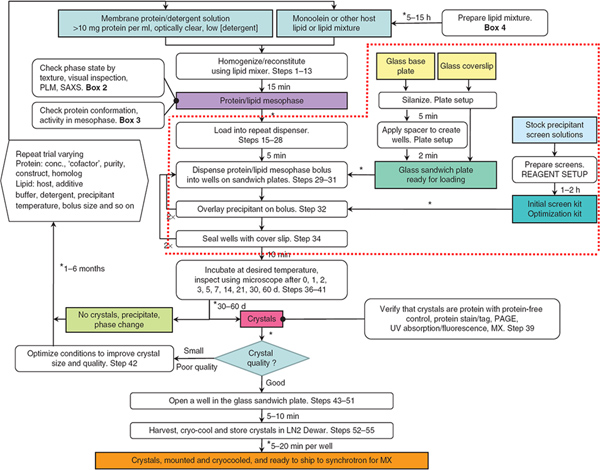
Figure 1. L'organigramme résume les étapes de la production, de récolte et de cryo-refroidissement à méso-cultivés cristaux de protéines membranaires. Étapes, entourée par la ligne pointillée rouge font l'objet de cet article JoVE. Les robots ont été utilisés pour distribuer des solutions mésophase et précipitant dans les étapes 29-32. De la référence 3. Cliquez ici pour agrandir la figure .

Figure 2. A pleine charge et scellé plaque de 96 puits de cristallisation du verre sandwich. Chaque puits contient 50 nl phase cubique et 1 ul de solution de précipitation. Pour plus de clarté, la phase cubique a été coloré avec le rouge Soudan et la solution de précipitant comprend le bleu de méthylène. De la référence 5.
_upload/4000/4000fig3.jpg "alt =" Figure 3 "/>
Figure 3. Dans méso robot (Robot 1). Le robot a deux bras. Bras 1 dispense le mésophase protéines chargé lipidique. Bras 2 distribue des solutions précipitants. Pendant le remplissage, la plaque 96-puits reste fixe en position sur la plate-forme du robot lui-même qui est à l'arrêt. Les deux bras se déplacent pour offrir des solutions mésophase et de précipitation. De la référence 3.

Figure 4. Le Mosquito LCP robot (Robot 2). Contrairement à Robot 1, le pont de la LCP Mosquito, sur laquelle asseoir la plaque de 96 puits et le bloc de solution de précipitant, se déplace horizontalement pendant le remplissage.

Figure 5. Le Gryphon LCP robot (Robot 3). Au cours d'unemis en place, le distributeur phase lipidique cubique se déplace pour fournir des protéines chargé de mésophase sur la plaque de 96 puits. La plate-forme se traduit ensuite horizontalement afin de positionner la plaque sous la tête de pointe solution de précipitant. Les 96 solutions précipitants sont distribués simultanément. Image provenant du fabricant ( http://www.artrobbins.com/ ) et étiquetés.

Figure 6. A pleine charge et scellé de 96 puits en plaque sandwich verre (A) et les puits correctement (B) et mal (C, D) rempli en utilisant le méso en robot (Robot 1). L'étiquette code à barres sur la plaque A est utilisé pour suivre la plaque de la plaque incubateur / appareil d'imagerie. Dans les panneaux de BD, la solution de précipitant et de mésophase sont marquées P et M, respectivement. La attendu 'oeuf sur le plat sur une plaque'aspect du puits en B est caractéristique d'un correctement chargé et scellé bien. En C, la précipitation a été distribuée dans le puits de façon irrégulière en une position excentrée et est entré en contact avec l'entretoise. En C, il semblerait aussi que le volume de mésophase est inférieure à ce qu'elle devrait être. Un exemple de chargement incomplet avec une solution de précipitant est représenté sur la D. Pour l'échelle, le diamètre de tous les puits est de 6 mm.
Discussion
Dans cet article, nous avons montré la vidéo comment utiliser un robot pour configurer automatiquement dans des essais de cristallisation méso dans des plaques 96 puits en sandwich verre à l'aide d'une mésophase protéines chargé lipidique. Les robots utilisés dans ce travail ont été spécialement conçus pour inclure une seringue volumétrique en verre pour une distribution précise et reproductible de volumes nanolitre de la mésophase visqueuse et collante, comme décrit à l'origine 7.
Exactitude et précision sont des caractéristiques importantes d'un robot. Toutefois, ces caractéristiques sont seulement aussi bon que le degré et la régularité performances du robot qui est évalué et l'étalonnage est effectué. Il va sans dire que les performances du robot doivent être évalués tandis que les plaques individuelles sont mises en place. Il n'est pas approprié de supposer que le robot fonctionne parfaitement et de laisser le robot pour fonctionner sans surveillance. L'opérateur attentif et observateur doit être en position de noter par un bruit ou une apparence quand quelque chose ne fonctionne pas correctement et de le corriger immédiatement. En outre, chaque plaque doit être soigneusement contrôlé par l'oeil de l'uniformité de contenu et dès que la plaque et avant d'être mis de côté pour des essais de cristallisation. Ce ne devrait nécessiter que quelques secondes à réaliser et peut se faire alors que la plaque suivante est en cours de chargement. Remarquant, par exemple, que les puits particuliers ne sont pas correctement rempli peut mettre en évidence le fait qu'une certaine précipitation embout de distribution ne fonctionne pas correctement. Si la livraison de mésophase être considérée comme irrégulière, l'élément pertinent défectueux devra être corrigée immédiatement. En notant ces questions et de faire les ajustements nécessaires au cours de mise en place permettra d'économiser du temps et de matériaux, y compris les lipides et les protéines de membrane précieuse. Si un imageur est utilisé pour suivre la croissance des cristaux, l'exactitude et la précision peut également être surveillée pendant l'imagerie. Par exemple, les problèmes systématiques avec chute rapide ou en boluslieu par l'imageur indiquer que quelque chose ne va pas et que des mesures correctives quelque part en amont dans le protocole est nécessaire.
Dans un souci de performances fiables signifie que le robot doit être étalonné sur une base régulière et selon les besoins. Étalonnages devraient inclure volume de précipitation et de mésophase livrés ainsi que le placement de bolus et précipitant dans le puits. Évidemment, là où l'étalonnage doit être fait en utilisant des volumes et des matériaux semblables à celles qui seront utilisées dans les essais effectués pendant la période couverte par l'exercice de contrôle de la qualité.
Aussi important que l'étalonnage est donc trop d'avoir en stock un nombre suffisant de pièces de robots et de fournitures. Échecs catastrophiques et inattendue, les blocages et plantages peuvent et se produisent. Dans un tel cas, disposant d'une pointe de livraison de remplacement précipitant, par exemple, peut vouloir dire qu'une préparation de membrane extrêmement précieuse protéine est utilisée comme il se doit etn'est pas gaspillé.
Parmi les avantages d'un robot, notamment le fait qu'il fonctionne essentiellement de manière continue et qu'il ne souffre pas d'ou 'se plaignent de la «fatigue. Un robot peut également être utilisé dans des conditions qui ne sont pas considérés humain-amical, comme dans l'obscurité, sous un éclairage contrôlé et les conditions environnementales et à des températures extrêmes. Les robots présentés dans cet article ont tous été utilisés dans des conditions ambiantes à ~ 20 ° C. Cependant, il ya des protéines et des projets qui nécessitent températures non ambiantes, de la lumière contrôlée et un oxydant 11,12 ou à un environnement réduisant 13. Tous ces éléments peuvent être pris en compte, avec une relative facilité, quand un robot de cristallisation est utilisé.
Dans un article antérieur vidéo JoVE nous a montré comment des essais de cristallisation par la méthode de méso sont mis en place manuellement 1. Le volume minimum de mésophase qui peut être distribuée de manière fiable à la main est limitée by l'acuité visuelle et constante impartialité de la personne mise en place des essais. D'après notre expérience, les volumes de mésophase aussi faibles que 100 nl sont faciles à manipuler. Nous connaissons un laboratoire où le volume par défaut délivrée manuellement est d'environ 40 nl. Cependant, les volumes considérablement plus petites sont possibles en utilisant un robot. Par ailleurs, nous avons montré que les volumes de mésophase aussi faibles que 550 picolitres peut être distribuée de manière robotisée 14. A partir de ce travail, il était clair que la miniaturisation est possible par un robot qui, si elles étaient appliquées, conduiraient à une réduction importante de la quantité de protéine membranaire précieux nécessaire de procéder à un essai de cristallisation.
Dans cet article, vidéo, trois robots disponibles dans le commerce ont été utilisés pour démontrer à haut débit cristallisation des protéines de membrane en utilisant mésophases lipidiques. Le premier d'entre eux a été élaboré par le Groupe MS & FB basée sur notre expérience mise en place d'essais manuellement, comme décrit dans JoVE 1712 1. C'est l'instrumentment nous avons le plus familiarité et la majeure partie de l'actuel article est consacré à son utilisation. Les deux autres robots étaient en démonstration dans le groupe MS & FB au moment où l'article a été écrit et les images pertinentes sont incluses ici dans l'intérêt de l'exhaustivité. Les trois robots utilisent beaucoup la mésophase même système de distribution, la caractéristique essentielle est une seringue volumétrique en verre 5,7. Ils diffèrent plus significativement en ce qui concerne la prestation de précipitation. Robots 1 et 2 peut se passer précipitant simultanément dans 8 puits, une colonne unique, sur une plaque de cristallisation à la fois. En revanche, Robot 3 dispense les 96 solutions précipitant en une seule action. Robot 2 est le seul instrument à usage unique précipitants seringue. Il ya des avantages et des inconvénients associés aux différents instruments qui dépendent de l'application particulière; ils ne seront pas élaborés ici. Qu'il suffise de dire que tous les travaux de trois et ont produit des cristaux de moimbrane protéines par la méthode de méso.
Les prochaines étapes dans le processus global de détermination de la structure par cristallographie macromoléculaire sont à la récolte et à la cryo-cool cristaux à partir de plaques mises en place comme décrit dans cet article la vidéo et d'enregistrer et de processus de diffraction des rayons X d'eux. Ces sujets sont traités dans les différents articles de cette série Jove 1,15.
Disclosures
Aucun conflit d'intérêt déclaré.
Acknowledgments
Nombreux sont ceux qui ont contribué à ce travail et la plupart sont de la membrane structurale et fonctionnelle groupe de biologie, les deux membres passés et présents. Pour tout ce que nous adressons nos plus vifs remerciements et son appréciation. Ce travail a été financé en partie par des subventions de la Science Foundation Ireland (07/IN.1/B1836), le National Institutes of Health (GM75915, P50GM073210 et U54GM094599), et le 7e PC CM0902 Action COST.
Materials
| Name | Company | Catalog Number | Comments |
| Brayer (roller) | Fisher Scientific | 50820937 | Tool |
| Gas-tight syringes | Hamilton | 81030 | Tool |
| Glass coverslips | Marienfeld | 01029990911 | Disposable |
| Glass plates | Marienfeld | 1527127092 | Disposable |
| Gryphon LCP Robot | Art Robbins | NA | Tool |
| In meso robot | Anachem/Gilson | NA | Tool |
| Lab notebook | Various | NA | Tool |
| Mosquito LCP Robot | TTP Labtech | NA | Tool |
| Perforated double-stick spacer tape | Saunders Corporation (hole-punched) | customized | Disposable |
| Precipitant solutions | Various | Various | Reagent |
| Purified water | Millipore | NA | Reagent |
| Rain-X | Shell Car Care | 80199200 | Reagent |
| Syringe tips | Hamilton | 7770-020 (gauge 22) | Tool |
| Tissues | Various | Various | Disposable |
| Water bottle | various | NA | Reagent |
References
- Caffrey, M., Porter, C. Crystallizing membrane proteins for structure determination using lipidic mesophases. J. Vis. Exp. (45), e1712 (2010).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Crystallogr. 36, 1372-1377 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. (49), e2501 (2011).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D Bio.l Crystallogr. 60, 1795-1807 (2004).
- Peddi, A. High-throughput automated system for crystallizing membrane proteins in lipidic mesophases. IEEE Trans. Autom. Sci. Eng. 4, 129-140 (2007).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Caffrey, M. Crystallizing membrane proteins for structure-function studies using lipidic mesophases. Biochem. Soc. Trans. 39, 725-732 (2011).
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M. Membrane protein crystallization. J. Struct. Biol. 142, 108-132 (2003).
- Gushchin, I., Reshetnyak, A., Borshchevskiy, V., Ishchenko, A., Round, E., Grudinin, S., Engelhard, M., Buldt, G., Gordeliy, V. Active State of Sensory Rhodopsin II: Structural Determinants for Signal Transfer and Proton Pumping. J. Mol. Biol. 412, 591-600 (2011).
- Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N. Three-dimensional structure of cyanobacterial photosystem I at 2.5 angstrom resolution. Nature. 411, 909-917 (2001).
- Grawert, T., Span, I., Eisenreich, W., Rohdich, F., Eppinger, J., Bacher, A., Groll, M. Probing the reaction mechanism of IspH protein by x-ray structure analysis. Proc. Natl. Acad. Sci. USA. 107, 1077-1081 (2010).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Crystallogr. 39, 604-606 (2006).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and cryo-cooling crystals of membrane proteins grown in lipidic mesophases for structure determination by macromolecular crystallography. J. Vis. Exp. (67), e4001 (2012).



