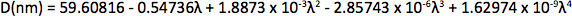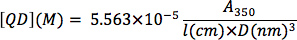Summary
We beschrijven de bereiding van colloïdale quantum dots met minimale hydrodynamische grootte voor single-molecule fluorescentie beeldvorming. Vergeleken met conventionele quantum dots, deze nanodeeltjes zijn vergelijkbaar in grootte met globulaire eiwitten en zijn geoptimaliseerd voor single-molecule helderheid, stabiliteit tegen afbraak en resistentie tegen specifieke binding aan eiwitten en cellen.
Abstract
Single-molecule beeldvorming is een belangrijk instrument voor het begrijpen van de mechanismen van biomoleculaire functie en voor het visualiseren van de ruimtelijke en temporele heterogeniteit van moleculaire gedrag dat cellulaire biologie 1 tot 4 ten grondslag liggen. Om een afzonderlijk beeld molecuul van belang, is het meestal geconjugeerd aan een fluorescerend label (kleurstof, eiwit, kraal, of quantum dot) en waargenomen met epifluorescentie of totale interne reflectiefluorescentie (TIRF) microscopie. Terwijl kleurstoffen en fluorescerende eiwitten zijn de steunpilaar van de fluorescentie beeldvorming voor tientallen jaren, hun fluorescentie is niet stabiel onder hoge foton flux die nodig zijn om individuele moleculen te observeren, waardoor slechts een paar seconden van observatie voordat volledig verlies van signaal. Latex kralen en kleurstof gemerkte korrels een verbeterde signaal stabiliteit, maar ten koste van grotere hydrodynamische grootte drastisch, wat nadelig kan veranderen de verspreiding en het gedrag van de moleculen onder studie.
ntent "> Quantum dots (QD's) bieden een evenwicht tussen deze twee problematische regimes. Deze nanodeeltjes zijn samengesteld uit halfgeleidende materialen en kunnen worden gemanipuleerd met een hydrodynamisch compacte afmetingen met een uitzonderlijke weerstand tegen fotodegradatie 5. Aldus in de afgelopen jaren QDs zijn geweest bij zodat op lange termijn observatie van complexe macromoleculaire gedrag op de single molecule-niveau. Maar deze deeltjes hebben nog steeds is gebleken dat een verminderde diffusie vertonen in drukke moleculaire omgevingen, zoals de mobiele cytoplasma en de neuronale synaptische spleet, waar hun maten zijn nog steeds te groot 4,6 , 7.Onlangs hebben wij de engineering van de kernen en oppervlaktecoatings van QDs voor minimale hydrodynamische grootte, terwijl de afweging van offsets aan colloïdale stabiliteit, fotostabiliteit, helderheid en niet-specifieke binding dat het nut van compacte QDs hebben gehinderd in het verleden 8,9. Het doel van dit artikel is aan te tonende synthese, modificatie en karakterisering van deze geoptimaliseerde nanokristallen, bestaande uit een gelegeerd Hg x Cd 1-x Se kern bekleed met een isolerende Cd y Zn 1-y S shell, verder bekleed met een multidentaat ligand polymeer gemodificeerd met korte polyethyleenglycol ( PEG) ketens (figuur 1). Vergeleken met conventionele CdSe nanokristallen, Hg x Cd 1-x Se legeringen bieden meer kwantumopbrengsten van fluorescentie, fluorescentie bij rode en nabij-infrarode golflengten verbeterde signaal-ruisverhouding in cellen en excitatie bij niet-cytotoxische zichtbare golflengten. Multidentaat polymeer coatings binden aan het oppervlak nanokristallen in een gesloten vlakke conformatie om hydrodynamische grootte minimaliseren en PEG neutraliseert de oppervlaktelading om niet-specifieke binding minimaliseren cellen en biomoleculen. Het eindresultaat is een helder fluorescerende nanokristallen met emissie tussen 550 tot 800 nm en een totale hydrodynamische afmeting in de buurt 12 nm. Dit is in de same groottebereik zoveel oplosbare globulaire eiwitten in cellen en aanzienlijk kleiner dan conventionele PEGylated QDs (25-35 nm).
Protocol
De volgende synthese procedures omvatten standaard luchtvrije technieken en het gebruik van een vacuüm / inert gas spruitstuk gedetailleerde methodologie kan worden gevonden in referenties 10 en 11. MSDS voor alle potentieel toxische en ontvlambare stoffen moet worden geraadpleegd voor gebruik en alle brandbare en / of lucht-labiele verbindingen dienen te worden in hoeveelheden verdeeld in septum afgesloten flacons in een zuurkast of een handschoen zak.
1. Synthese van Mercurius cadmiumselenide (Hg x Cd 1-x Se) Quantum Dot Cores
- Bereid een 0,4 M oplossing van selenium in trioctylphosphine (TOP). Voeg selenium (0,316 g, 4 mmol) in een 50 ml 3-halskolf, dan evacueren en vullen met argon via een Schlenk-lijn. Onder lucht-vrije omstandigheden (droge stikstof of argon atmosfeer), 10 ml TOP en verhit tot 100 ° C onder roeren gedurende 1 uur tot een heldere, kleurloze oplossing opleveren. Koel de oplossing tot kamertemperatuur en zet het flesje.
- Aan een 250 ml 3-hals kolf, voeg cadmiumoxide (CdO 0,0770 g, 0,6 mmol), tetradecylphosphonic acid (TDPA, 0,3674 g, 1,32 mmol) en octadeceen (ODE, 27,6 ml) en de oplossing evacueren met een Schlenk-lijn onder roeren. Verhoog de temperatuur tot 100 ° C en evacueren nog 15 min met een laag kookpunt onzuiverheden te verwijderen.
- Onder argon of stikstofgas, verwarm het mengsel tot 300 ° C gedurende 1 uur volledig oplossen van de CdO. De oplossing verandert van een roodachtige kleur helder en kleurloos. Koel de oplossing tot kamertemperatuur.
- Voeg hexadecylamine (HDA, 7,0 g) aan de oplossing cadmium, warmte tot 70 ° C en evacueren. Zodra een constante druk is bereikt, de temperatuur stijgen tot 100-110 ° C en reflux de oplossing gedurende 30 minuten. Schakel de Schlenk-lijn klep inert gas en direct plaats de thermokoppel in de oplossing.
- Onder lucht-vrije omstandigheden, voeg difenylfosfine (DPP, 100 pl) aan de oplossing en verhogen de temperatuur tot 310 ° C. Verwijder 7,5 ml van de 0,4 M TOP-Se-oplossing(3 mmol selenium) in een wegwerpbare plastic spuit bevestigd aan een 16 gauge naald.
- Zodra de temperatuur evenwicht bereikt bij 310 ° C, zet de temperatuurregelaar op 0 ° C en snel direct te injecteren de TOP-Se oplossing in het cadmium oplossing. De oplossing zal veranderen van kleurloos tot geel-oranje en de temperatuur zal snel dalen en nemen weer toe tot ~ 280 ° C. Na 1 min reactie Verwijder de kolf uit de verwarmingsmantel en snel koelen met een luchtstroom totdat de temperatuur minder dan 200 ° C.
- Wanneer de temperatuur ~ 40 ° C bereikt, verdunnen met 30 ml hexaan, de meeste van de resterende cadmium voorloper zal vestigen van de oplossing. Verwijder het precipitaat door centrifugeren (5.000 xg, 10 min).
- In zes 50 ml polypropyleen conische centrifugebuis Verdun 12 ml van het ruwe nanokristallen oplossing met 40 ml aceton, centrifuge (5.000 g gedurende 10 min) en decanteer zorgvuldig en verwijder het supernatant.
- Los het nanocrystal pellets in hexaan (25 ml totaal volume). Extract deze oplossing 3 keer met een gelijk volume methanol, behouden de bovenste fase. Voor de derde extractie, kan de hoeveelheid methanol worden aangepast aan ~ 15 ml van een geconcentreerde oplossing van hexaan pure CdSe QDs verkrijgen op ongeveer 200 uM. De typische opbrengst van deze reactie is 3 pmol CdSe nanokristallen met een diameter van 2,3 nm (50-60% reactieopbrengst).
- Bepaal de nanokristallen diameter en concentratie door het meten van de UV-Vis-absorptiespectrum en de raadpleging van de grootte-fitting grafiek van Mulvaney en collega's 12 en het uitsterven correlaties van Bawendi en collega's 13. Zie bijlage voor meer informatie.
- Mercury kationenuitwisseling: de nanokristallen kunnen gedeeltelijk worden uitgewisseld met kwik tot rood-verschuiving van de absorptie en fluorescentie-emissie. Meng de volgende om in een 20 ml glazen flesje met roerstaaf (deze reactie kan worden geschaald naar keuze): 3 ml hexaan, 2 ml chloroform, 1 ml 200 pM CdSe QD oplossing (200 nmol), 15 pl oleylamine (OLA) en 500 ul van een 0,1 M oplossing van Hg (OT) 2 in chloroform. Kwik octanethioate (HgOT 2) kunnen worden bereid door kwik acetaat en octanethiol in methanol (zie appendix). De kationenuitwisselingsreactie verloopt, kan de mate van roodverschuiving worden bewaakt met UV-Vis absorptiespectrofotometrie. Nadat de gewenste absorptieband is bereikt, meet de absorptie van de nanokristallen oplossing bij 350 nm en het nieuwe extinctiecoëfficiënt, aannemende dat de concentratie nanokristallen niet veranderd (30,7 uM in dit voorbeeld). Quench de reactie door het verwijderen van de niet-gereageerde kwik: voeg 5 ml decaan, 10 ml hexaan en 7 ml methanol en pak de oplossing, het bijhouden van de bovenste fase die de nanokristallen. Extraheer tweemaal met hexaan en methanol, en het volume van methanol zodat de bovenste fase ~ 7 ml. Als de fasen te scheiden traag, kan de oplossing gecentrifugeerd (5000 xg,10 min). Voeg 100 ul TOP, 100 pl OLA, en 100 pl oliezuur de nanokristallen gevolgd door 40 ml aceton precipitatie te induceren. Verzamel de nanokristallen via centrifugeren en verspreiden in 3 ml hexaan. Centrifugeer opnieuw om onoplosbare componenten te verwijderen en opnieuw bepalen nanokristallen concentratie met de nieuwe extinctiecoëfficiënt bij 350 nm. Laat de oplossing nanokristallen leeftijd ten minste 24 uur bij kamertemperatuur alvorens de volgende stap.
2. De groei van Cadmium Zink Sulfide (Cd y Zn 1-y S) Shell
- Bereid 0,1 M shell voorloper oplossingen in 50 ml 3-hals kolven. Cadmium precursor: cadmiumacetaat hydraat (230,5 mg, 1 mmol) en 10 ml oleylamine (OLA). Zinc precursor: zinkacetaat (183,5 mg, 1 mmol) en 10 ml OLA. Zwavel precursor: zwavel (32,1 mg, 1 mmol) en 10 ml ODE. Onder vacuüm, verwarmen elke oplossing tot reflux gedurende 1 uur tot heldere oplossingen opleveren, en dan opladen met argon. De oplossing van zwavel kanworden afgekoeld tot kamertemperatuur, maar de cadmium en zink precursors worden gehandhaafd op ongeveer 50 ° C. Berekeningen van shell voorloper hoeveelheden zijn te vinden in referentie 14.
- In een 3-halskolf: Hg x Cd 1-x Se QDs (120 nmol, 2,3 nm diameter), ODE (2 ml) en trioctylphosphine oxide (TOPO, 250 mg). Evacueer uit het hexaan bij kamertemperatuur met behulp van de Schlenk-lijn. Verhoog de temperatuur tot 100 ° C en reflux gedurende 15 minuten. Verander de Schlenk lijn klep argon of stikstofgas en plaats het thermokoppel in de nanokristallen oplossing.
- Verhoog de temperatuur tot 120 ° C, voeg 0,5 monolagen van zwavel precursor oplossing (140 ul) en laat de reactie doorgaan gedurende 15 minuten. Kleine porties (<50 ul) kunnen worden verwijderd met een glazen spuit om de voortgang van de reactie via fluorescentie en / of UV-Vis spectrofotometrie controleren. Verhoog de temperatuur tot 140 ° C, voeg 0,5 monolagen van cadmium voorloperoplossing (140 pl) en laat de reactie doorgaan gedurende 15 minuten. Voeg 500 pl watervrije OLA aan de reactieoplossing.
- Bij 160 ° C voeg 0,5 monolagen zwavel precursor oplossing (220 pl) gevolgd door een gelijke hoeveelheid zink precursor oplossing bij 170 ° C met 15 min tussen elke toevoeging. Vervolgens bij 180 ° C voeg 0,25 monolagen zwavel precursor oplossing (150 pl) en zink precursor oplossing 15 min intervallen.
- Koel de oplossing tot kamertemperatuur en opnieuw berekent een nieuwe extinctiecoëfficiënt voor deze deeltjes met een UV-Vis spectrum, ervan uitgaande dat het aantal nanokristallen niet veranderd (120 nmol in 3,8 ml reactieoplossing). Bewaar de reactieoplossing als een ruw mengsel in een vriezer, de nanokristallen worden ontdooid en gezuiverd als nodig met dezelfde methode beschreven in paragraaf 1.8 en 1.9.
- De nanokristallen kan worden gekarakteriseerd met behulp van elektronenmicroscopie, UV-Vis absorptie spectroscopie en fluorescentiespectroscopie. Kwantumopbrengst kangeheel berekend met een integrerende bol of relatief ten opzichte van een bekende standaard met de referentiemethoden 15.
3. Phase Transfer
- Voeg gezuiverd kern / schil Hg x Cd 1-x Se / Cd y Zn 1-y S QDs (5 ml, 20 uM) in een 50 ml 3-halskolf en verwijderen hexaan onder hoog vacuüm om een droge film werd verkregen. De kolf met argon, voeg watervrije pyridine (3 ml) aan de nanodeeltjes film en verhit slurry tot 80 ° C. In de loop van 1-2 uur de nanodeeltjes zal volledig oplossen.
- Voeg 1-thioglycerol (1 ml) aan de oplossing en geroerd bij 80 ° C gedurende 2 uur. Afkoelen van de oplossing tot kamertemperatuur en voeg triethylamine (0,5 ml) aan thioglycerol deprotoneren. Roer gedurende 30 minuten. De oplossing kan troebel worden na toevoeging van triethylamine vanwege de slechte oplosbaarheid van polaire nanokristallen in dit oplosmiddelmengsel.
- Breng de QD oplossing in een 50 ml conische centrifugebuis containing een mengsel van 20 ml hexaan en 20 ml aceton en meng goed. Isoleer het neergeslagen nanokristallen via centrifugatie (5.000 xg, 10 min), en was het pellet met aceton.
- Los het pellet QD in DMSO (5 ml) met bad sonicatie en centrifuge (7000 xg, 10 min) om mogelijke aggregaten te verwijderen. Bepaal de nanodeeltjes concentratie van een UV-Vis-absorptiespectrum. Deze oplossing zuivere QDs moet binnen 3 uur, het oppervlak thiolen langzaam kan oxideren onder omgevingsomstandigheden in lucht.
- Verdun de QD die 10 micrometer of minder met DMSO en overbrengen naar een 50 ml kolf. Bereid een 5 mg / ml oplossing van gethioleerd polyacrylzuur (synthese beschreven in Appendix) in DMSO. Voeg de polymeeroplossing (0,15 mg polymeer per nmol QDs) druppelsgewijs aan de oplossing onder roeren QD en ontgas de oplossing bij kamertemperatuur gedurende 5 minuten.
- Spoel de QD / polymeeroplossing met argon en verhit tot 80 ° C gedurende 90 minuten. Afkoelen van de oplossing tot kamertemperatuur eend druppelsgewijs een gelijk volume van 50 mM natriumboraat, pH 8. Roer gedurende 10 minuten.
- Zuiver het QDs via dialyse (20 kDa cutoff) in 50 mM natriumboraat, pH 8, en dan concentreren de deeltjes met een centrifugaal filter (10 kDa cutoff). Het gehalte van een UV-Vis-absorptiespectrum.
4. PEG Coating
- In een 4 ml glazen flesje met roerstaaf, 1 nmol QDs in boraatbuffer mengen met een 40.000 x molaire overmaat van 750 Da monoamino-polyethyleenglycol (30 mg, 40 umol). Indien een specifieke chemische functionaliteit wordt toegevoegd aan de nanokristallen (bijvoorbeeld hydrazide of maleïmide) kan worden geïntroduceerd door vervanging van een deel van de amino-PEG met een heterobifunctionele amino-PEG (30% molfractie werkt meestal goed). Verdun de nanokristallen oplossing 1 uM met boraatbuffer. Deze reactie kan worden geschaald naar wens.
- Bereid een verse oplossing van DMTMM (20 mg, 72 umol) in DMSO (144 ul). Deze oplossing kan in het kort worden verwarmd under een stroom van warm tapwater of ondergedompeld in een badsonicator volledig oplossen van de DMTMM. Voeg snel een 25.000 x molaire overmaat van deze 0,5 M DMTMM oplossing (50 pl) van de QD oplossing en geroerd bij kamertemperatuur gedurende 30 minuten.
- Herhaal stap 4.2 vier keer aan de nanokristallen oppervlak verzadigen met PEG. Voeg tenslotte 200 pi 1 M Tris buffer om de reactie te blussen en zuiveren nanokristallen met dialyse, centrifugale filters of ultracentrifugatie.
- De nanokristallen worden geanalyseerd monodispersiteit, hydrodynamische grootte, oppervlaktelading en met vloeistofchromatografie, agarose gel elektroforese en fluorescentie microscopie. Hydrodynamische grootte en grootteverdeling gebruik van een geautomatiseerd systeem vloeistofchromatografie (GE AKTAprime Plus) bepalen met een Superose 6 kolom, een stroomsnelheid van 0,5 ml / min met PBS buffer eluens en absorptie detectie bij 260 of 280 nm. Vergelijk nanodeeltjes elutietijden met die van molecuulgewichtstandaarden. Voor agarose gel electrophoweerstand Bereid een 0,5% agarosegel in 50 mM natriumboraatbuffer (pH 8,5) of 50 mM natriumfosfaat buffer (pH 7,4), 1 uM monsters te mengen met 10% glycerol en belasting in putten, en lopen bij 100 V gedurende 30 min . Afbeelding van de nanokristallen in de gel met behulp van een UV-hand-wand of UV-transilluminator en voor fluorescentie excitatie. Het afbeelden van de nanokristallen op single molecule niveau met fluorescentiemicroscopie de deeltjes tot 0,2 nM verdund in 10 mM fosfaatbuffer, 2,5 ul druppel van de oplossing op een dekglaasje bedekt en voorzichtig een tweede dekglaasje bovenop de vloeistof te verspreiden kraal een film tussen de dekglaasjes. Beeld aan het oppervlak gebonden deeltjes met een hoge numerieke apertuur doel (bij voorkeur ten minste 1,40) hetzij in epifluorescentie of TIRF mode met excitatie golflengte van 400-580 nm en een elektronen vermenigvuldigende CCD camera. Exacte imaging parameters zullen variëren tussen microscopie setup.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Figuur 2 geeft representatieve absorptie en fluorescentie spectra voor CdSe nanokristallen, Hg x Cd 1-x Se nanokristallen na kationuitwisseling, en Hg x Cd 1-x Se / Cd y Zn 1-y S nanokristallen na shell groei. De kern CdSe nanokristallen hebben een quantum opbrengst van fluorescentie bij 15% (inclusief lange-golflengte diep-trap emissie), maar dit rendement daalt tot minder dan 1% na kwik uitwisseling, waarschijnlijk te wijten aan de drager vallen geïntroduceerd door bovengrondse atoom verstoring 9 rekening te brengen. Echter, de groei van een dunne schil van Cd y Zn 1-y S verhoogt deze efficiëntie tot meer dan 70%, wat grotendeels wordt gehandhaafd na overdracht aan het water (50% is normaal). Daarentegen CdSe / Cd y Zn 1-y S nanokristallen zonder kwik opname verliest een aanzienlijke fractie van de kwantumopbrengst in water tenzij een dikke schil wordt gekweekt. Aldus door het opnemen kwik in de kern nanocrystal, de geringe omvang van de nanokristallen kan worden gehandhaafd (zie TEM in figuur 3) zonder in te boeten helderheid. Het is belangrijk op te merken dat kappen met Cd y Zn 1-y S de spectra verschuift naar het rode door lekkage van de elektronische ladingsdragers in het omhulselmateriaal, deze verschuiving is ongeveer 20-30 nm voor CdSe geleiders 16 en neemt toe met toenemende kwikgehalte in de kern (tot 100 nm).
Het gebruik van een 2-staps faseovergangs water is essentieel voor het verkrijgen van een homogene populatie van nanokristallen die geen verdere grootte sorteren clusters en aggregaten te verwijderen. In de eerste stap worden de nanokristallen naar DMSO met 1-thioglycerol, die oleylamine verplaatst op het oppervlak van de nanokristallen. Thioglycerol wordt dan vervangen door een lineaire multidentaat polymeer, wat resulteert in zeer stabiele deeltjes met een minimale verhoging van hydrodynamische grootte gevolg van de organische coating (<4 nm BIJDRAGEop de hydrodynamische diameter). De grootte-uitsluiting chromatogram in figuur 4a blijkt dat de grootte vergelijkbaar is met die van conalbumine (75 kDa) en na modificatie met 750 Da amino-PEG, de maat is verhoogd tot slechts 12 nm, vergelijkbaar met die van een IgG-antilichaam . PEG modificatie neutraliseert de oppervlaktelading, zoals bevestigd in de agarose gel elektroforese experiment weergegeven in figuur 4b. We routinematig gebruik size-exclusion chromatografie en gelelektroforese voor snelle typering van grootte, grootteverdeling en oppervlaktelading. Dynamische lichtverstrooiing en zeta potentiometrie kunnen ook worden gebruikt, maar de verstrooiing dwarsdoorsnede van deze ultrakleine deeltjes zeer klein, en we hebben gevonden als gevolg van commerciële instrumenten niet reproduceerbaar zijn. Figuur 5a toont een microfoto van epifluorescentie deze nanokristallen afgezet op een glas dekglaasje en opgewonden met 545 nm zichtbaar licht. Deze nanokristallen worden gemakkelijk o. BServed de individuele molecuul met 30 frames per seconde met een elektronen vermenigvuldigende CCD camera Figuur 5b toont dat het aantal fluorescerende deeltjes waargenomen in elk frame varieert in de tijd met permanente excitatie, dit komt door een combinatie van knipperen en fotodegradatie . Knipperend domineert voor de eerste ~ 7 minuten voor oxidatieve afbraak langzaam duidelijk wordt.

Figuur 1. Schematische weergave van de nanodeeltjes synthese procedure. (A) Cadmium en selenium voorlopers reageren op CdSe nanokristallen, die worden behandeld met kwik octanethiolate, het induceren van een gedeeltelijke Cd → Hg kationenuitwisseling aan Hg x Cd 1-x Se ternaire legering nanokristallen opbrengst te genereren. Een schaal van Cd y Zn 1-y S wordt vervolgens gekweekt op de kern met cadmiumacetaat, zinkacetaat en zwavel. (B) Als synthesized, worden deze nanokristallen bekleed met niet-polaire organische liganden (oleylamine). Deze deeltjes in waterige buffers oplosbaar zijn de liganden vervangen door een multidentaat ligand polymeer, dat covalent is gekoppeld met amino-PEG.

Figuur 2. Optische eigenschappen van Hg x Cd 1-x Se / Cd y Zn 1-y S nanokristallen. (A) Opname (zwart) en fluorescentie spectra (rood) van CdSe nanokristallen kernen, Hg x Cd 1-x Se kernen na kationuitwisseling, en Hg x Cd 1-x Se / Cd y Zn 1-y S nanokristallen na shell groei . Spectra worden gecompenseerd voor de duidelijkheid (b) Fluorescentie spectra van Hg x Cd 1-x Se / Cd y Zn 1-y S met verschillende relatieve hoeveelheden kwik oprichting. De blauwe spectrum toont kernen met nul kwikgehalte (x = 0, CdSe).

Figuur 3. Transmissie electronen microscoop (a) en deeltjesgrootteverdeling (b) van Hg x Cd 1-x Se / Cd y Zn 1-y S nanokristallen, die een gemiddelde diameter ± standaardafwijking van 3,2 ± 0,6 nm.

Figuur 4. Hydrodynamische karakterisering van Hg x Cd 1-x Se / Cd y Zn 1-y S QDs in waterige oplossing. (A) Grootte-uitsluiting chromatogram van nanokristallen bekleed in een multidentaat ligand voor polymeer (rood) en na (blauw) conjugatie aan amino-PEG. Molecuulgewicht eiwitstandaarden zijn boven plaatsen. (B) Agarose gel elektroforese experiment van de QDs in natriumboraatbuffer (pH ~ 8,5) voor (links) En na (rechts) conjugatie aan amino-PEG. Het is goed gemarkeerd met een pijl en elektrode polariteiten worden aangegeven aan de rechterkant, waaruit blijkt dat voor conjugatie van de nanokristallen migreren als anionische deeltjes en de gepegyleerde nanokristallen zijn elektrostatisch neutraal.

Figuur 5. Hg x Cd 1-x Se / Cd y Zn 1-y S QDs geadsorbeerd op een dekglaasje bedekt in fosfaatbuffer, afgebeeld met epifluorescentiemicroscopie. (A) QD beeld verkregen op 33 frames per seconde. Beeld is 15 urn x 15 urn. (B) Aantal TL QDs per gezichtsveld bij continu verlichting gedurende 20 minuten met kwik booglamp met 545 nm (30 nm banddoorlaat) excitatiefilter en een 625 nm (20 nm banddoorlaat) emissie filter en 100x 1,4 NA doelstelling. Metingen van 3 gezichtsveld werden gemiddeld over 20 min op 12.5 frames per seconde.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vergeleken met conventionele CdSe quantum dots, kan ternaire legering Hg x Cd 1-x Se nanokristallen worden afgestemd in grootte en fluorescentie golflengte onafhankelijk van elkaar. De grootte wordt eerst geselecteerd tijdens de synthese van CdSe nanokristallen kernen en de fluorescentie golflengte wordt gekozen in een secundaire kwik kationuitwisselingsstap, die niet wezenlijk veranderen de nanokristallen maat 9. Het is belangrijk om de gezuiverde Hg x Cd 1-x Se nanokristallen bij kamertemperatuur incuberen gedurende ten minste 24 uur voor capping. Dit kan een aantal zwak geadsorbeerd kwik kationen te diffunderen in de nanokristallen rooster. Zonder dat dit proces plaatsvindt, een tweede fluorescentie band in het nabije infrarood vaak door homogene nucleatie van HgS nanokristallen van gedissocieerde kwikionen waargenomen.
In het voorbeeld van dit werk hebben we CdSe kernen bereid met een maat buurt 2,3 nm, die kan wordenafgestemd fluorescentie tussen 550-800 nm na aftopping door het veranderen van de hoeveelheid kwik opgenomen in de kern rooster. Met een 2,5 monolaag shell, de uiteindelijke diameter van deze QDs was in de buurt 3,2 nm, die in wezen is de kleinste maat nanodeeltje dat we kunnen die zowel voldoende fotostabiel en voldoende licht voor te bereiden op single-molecule imaging (extinctiecoëfficiënt in de buurt 350.000 M -1 cm -1 op 400 nm en kwantumopbrengst bijna 50% in water). Deze nanokristallen zijn aanzienlijk helderder en meer fotostabiel dan eerder beschreven nanokristallen met een vergelijkbare omvang die uitzenden over deze spectrale bereik (bijv. CdTe, InAs, InP). Net als de meeste fluoroforen, de fluorescentie van deze deeltjes op de single molecule niveau is onderbroken (knipperend) 5,6.
Voor sommige toepassingen kan het gunstig zijn iets groter nanokristallen gebruiken. Door het gebruik van een grotere CdSe nanokristallen kern, de fluorescentie bandwidth is smaller na kwik kation-uitwisseling. Typische fluorescentie piekbreedtes voor Hg x Cd 1-x Se nanokristallen met emissie in de 600 tot 650 nm venster zijn 50 tot 70 nm voor 2,3 nm kernen en 40-50 nm voor 3,2 nm kernen. Daardoor kunnen grotere nanokristallen een grotere capaciteit voor spectrale multiplexing. Bovendien zal het verhogen van de grootte ook de absorptie doorsnede van de nanokristallen. De dikte van de CdS interim buitenlaag zal ook de helderheid en verder de fluorescentie stabiliteit verlengen tijdens excitatie. De CdSe kern formaat kan eenvoudig worden verhoogd door uitbreiding van de duur van de CdSe kern synthese, en het toezicht op de effectieve grootte door middel van UV-Vis absorptie spectrofotometrie.
We hebben gevonden dat waterige QDs gecoat met carbonzuren zijn gevoelig voor niet-specifieke adsorptie aan cellen en eiwitten en dat neutralisatie van hun sterke negatieve lading in fysiologische buffers critical voor het minimaliseren van niet-specifieke interacties 17. In de voorbeelden hebben we kortketenige PEG de oppervlaktelading neutraliseren en stabiliteit in water te handhaven. PEG kan worden ingebracht in het polymeerskelet noch voor bevestiging aan het QDs of na coating. Beide procedures leiden bijna neutrale deeltjes, maar die eerst bekleed met de carboxyl-polymeer aanzienlijk kleiner, waarschijnlijk door een betere multidentate interactie met het oppervlak. Voor complete neutralisatie met PEG oppervlak hebben wij gevonden dat herhaalde toevoeging van carbonzuur activeringsmiddelen is noodzakelijk vanwege de korte halfwaardetijd van de reactieve species. We gebruiken DMTMM in plaats van vaker carbodiimide reagentia (bijvoorbeeld EDC) vanwege de verbeterde stabiliteit van DMTMM in opslag en door verbeterde reactie-efficiëntie in water 18.
Ten slotte is het belangrijk op te merken dat de quantum dots en vele andere soorten van nanokristallen bevattencytotoxische elementen 5. Cadmium en kwik-ionen kan invloed hebben op de normale processen van levende cellen en organismen en kankerverwekkend kunnen zijn 19-21. Echter de cytotoxiciteit van conventionele CdSe / ZnS nanokristallen is uitgebreid bestudeerd en is gemeld dat robuust gecoat nanokristallen met stabiele organische liganden geen openlijk cytotoxische responsen op te wekken in vergelijking met hun bestanddelen, omdat hun toxische elementen doeltreffend afgezonderd van oxidatiemiddelen 5. Bovendien, voor single-molecule imaging toepassingen toxische effecten onwaarschijnlijk vanwege de extreem kleine concentraties gebruikt voor beeldvorming (typisch 1 nM of minder) die ordes van grootte kleiner dan het begin van detecteerbare toxische effecten (50-100 nM). De meeste single-molecule experimenten uitvoering QDs tot dusver gebruikte commercieel verkrijgbare CdSe / ZnS nanokristallen, die aanzienlijk groter zijn dan die hierin beschreven. Door het minimaliseren van de nanocrystal grootte, het aantal oppervlakte-atomen per deeltje en het totale aantal toxische atomen per deeltje aanzienlijk verminderd, waardoor de totale potentiële toxicologische effecten. De opname van kwik in de nanokristallen verder zal verminderen toxiciteit potentieel als tweewaardig kwik is bekend dat minder toxisch dan tweewaardige cadmium in vele celtypen 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Geen belangenconflicten verklaard.
Acknowledgments
De auteurs willen graag Dr Hong Yi danken aan de Emory University Geïntegreerde Microscopy Core voor elektronenmicroscopie beeldvorming. Dit werk werd gesponsord door NIH subsidie (PN2EY018244, R01 CA108468, U54CA119338, en 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).