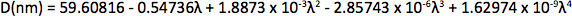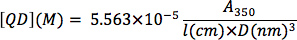Summary
Nous décrivons la préparation de points quantiques colloïdaux dont la taille hydrodynamique réduit au minimum pour l'imagerie de fluorescence de molécules uniques. Par rapport aux points quantiques, ces nanoparticules ont une taille similaire à des protéines globulaires et sont optimisés pour une seule molécule de la luminosité, de la stabilité contre la photodégradation et la résistance à la liaison non spécifique des protéines et des cellules.
Abstract
Une seule molécule d'imagerie est un outil important pour la compréhension des mécanismes de la fonction biomoléculaire et pour visualiser l'hétérogénéité spatiale et temporelle des comportements moléculaires qui sous-tendent la biologie cellulaire 1-4. À l'image d'une molécule individuelle d'intérêt, il est généralement conjugué à un marqueur fluorescent (colorant, de protéines, de perles, ou points quantiques) et observé avec épifluorescence ou fluorescence à réflexion interne totale (TIRF) microscopie. Alors que les colorants et les protéines fluorescentes ont été le pilier de l'imagerie de fluorescence pendant des décennies, leur fluorescence est instable sous haute flux de photons nécessaires pour observer les molécules individuelles, ce qui donne seulement quelques secondes d'observation avant la perte totale du signal. Des billes de latex et de perles colorant étiquetés assurer la stabilité du signal amélioré, mais au détriment de la taille hydrodynamique considérablement plus grande, ce qui peut altérer la diffusion délétère et le comportement de la molécule étudiée.
ntent "> Les quantum dots (QDs) offrent un équilibre entre ces deux régimes problématiques. Ces nanoparticules sont constituées de matériaux semi-conducteurs et peut être conçu avec une taille hydrodynamique compact avec une résistance exceptionnelle à la photodégradation 5. Ainsi, ces dernières années QDs ont joué un rôle en permettant aux observation à long terme du comportement complexe macromoléculaire sur le niveau de la molécule unique. Cependant, ces particules ont encore été trouvé exposer diffusion avec facultés affaiblies en environnements encombrés moléculaires tels que le cytoplasme cellulaire et synaptique neuronale de la fente, où leurs tailles sont encore trop grandes 4,6 , 7.Récemment, nous avons conçu les cœurs et les revêtements de boîtes quantiques de taille hydrodynamique réduite au minimum, tout en tenant compte des décalages à la stabilité colloïdale, photostabilité, la luminosité et la liaison non spécifiques qui ont entravé l'utilité des boîtes quantiques compacts dans le passé 8,9. Le but de cet article est de démontrerla synthèse, la modification et la caractérisation de ces nanocristaux optimisées, composée d'un alliage Cd Hg 1-x Se x noyau revêtu d'un isolant Zn Cd Y 1-Y S coquille, en outre revêtu avec un ligand polydenté polymère modifié par du polyéthylèneglycol court ( PEG) (figure 1). Par rapport aux nanocristaux de CdSe conventionnels, Hg x Cd 1-x Se alliages offrent de meilleures rendements quantiques de fluorescence, fluorescence à des longueurs d'onde rouge et proche infrarouge pour améliorer signal-sur-bruit dans les cellules, et d'excitation à la non-cytotoxiques longueurs d'onde visibles. Multidentés revêtements polymères se lier à la surface du nanocristal dans une conformation fermée et plane pour réduire au minimum la taille hydrodynamique, et PEG neutralise la charge de surface pour minimiser liaison non spécifique aux cellules et de biomolécules. Le résultat final est un nanocristal fluorescent vives avec des émissions entre 550-800 nm et une taille hydrodynamique totale près de 12 nm. C'est dans le sgamme de taille ame autant de protéines globulaires solubles dans les cellules, et sensiblement plus petits que les points quantiques conventionnels PEGylées (25-35 nm).
Protocol
Les procédés de synthèse suivantes impliquent l'air standard sans techniques et l'utilisation d'un aspirateur / collecteur de gaz inerte; méthodologie détaillée peut être trouvée dans les références 10 et 11. FDS pour toutes les substances potentiellement toxiques et inflammables doit être consulté avant toute utilisation et les composés inflammables et / ou de l'air labile doit être répartie dans des flacons scellés septum dans une boîte à gants ou un sac à gants.
1. Synthèse de séléniure de cadmium mercure (Hg x Cd 1-x Se) Quantum Dot Cores
- Préparer une solution 0,4 M de sélénium dans trioctylphosphine (TOP). Ajouter le sélénium (0,316 g, 4 mmol) à un 50 ml à 3 cols, puis évacuer et remplir avec de l'argon à l'aide d'une ligne de Schlenk. Sous air sans conditions (azote sec ou d'argon), ajouter 10 ml TOP et de la chaleur à 100 ° C sous agitation pendant 1 heure pour obtenir une solution limpide et incolore. Refroidir la solution à température ambiante et mis de côté dans le ballon.
- Pour un 250 ml à 3 cols, ajouter de l'oxyde de cadmium (CdO 0,0770 g, 0,6 mmol), d'acide tetradecylphosphonic (TDPA, 0,3674 g, 1,32 mmol), et l'octadécène (ODE, 27,6 ml), et évacuer la solution en utilisant une ligne de Schlenk tout en remuant. Augmenter la température à 100 ° C et pour évacuer encore 15 min pour éliminer les impuretés à bas point d'ébullition.
- Sous atmosphère d'argon ou d'azote gazeux, on chauffe le mélange à 300 ° C pendant 1 heure pour dissoudre complètement l'oxyde de cadmium. La solution passera d'une couleur rougeâtre limpide et incolore. Refroidir la solution à température ambiante.
- Ajouter hexadécylamine (HDA, 7,0 g) à la solution de cadmium, de la chaleur à 70 ° C, et l'évacuation. Une fois qu'une pression constante est atteinte, augmenter la température à 100-110 ° C et le reflux de la solution pendant 30 min. Changer la valve de ligne de Schlenk de gaz inerte et insérer le thermocouple directement dans la solution.
- Sous des conditions exemptes d'air, ajouter diphénylphosphine (DPP, 100 ul) à la solution et à augmenter la température à 310 ° C. Retirer 7,5 ml de 0,4 M TOP-Se solution(Mmol sélénium 3) dans une seringue jetable en plastique fixée à une aiguille de calibre 16.
- Une fois que la température s'équilibre à 310 ° C, régler le régulateur de température à 0 ° C et rapidement injecter la solution TOP-Se directement dans la solution de cadmium. La solution passe de l'incolore au jaune-orange et la température va rapidement baisser et augmenter de nouveau à ~ 280 ° C Après 1 min de réaction, enlever le ballon de la chemise de chauffage et refroidir rapidement avec un courant d'air jusqu'à ce que la température est inférieure à 200 ° C.
- Lorsque la température atteint 40 ° C, diluer avec 30 ml d'hexane, la plupart du précurseur de cadmium restant s'installer hors de la solution. Retirer ce précipité par centrifugation (5000 xg, 10 min).
- Dans chacun des six tube de 50 ml en polypropylène à centrifuger conique, diluer 12 ml de la solution brute nanocristal avec 40 ml d'acétone, centrifugeuse (5000 xg pendant 10 min), et soigneusement décanter et éliminer le surnageant.
- Dissoudre le nanocrpellets ystal dans l'hexane (25 ml volume total). Extrait cette solution 3 fois avec un volume égal de methanol, tout en conservant la phase supérieure. Pour la troisième extraction, le volume de méthanol peut être ajusté à ~ 15 ml pour obtenir une solution d'hexane concentré de points quantiques de CdSe purs à environ 200 uM. Le rendement de cette réaction typique est de 3 mol nanocristaux de CdSe d'un diamètre de 2,3 nm (50-60% rendement de la réaction).
- Déterminer le diamètre nanocristal et de la concentration en mesurant le spectre d'absorption UV-Vis et consulter le tableau des tailles d'ajustement de Mulvaney et ses collègues 12 et les corrélations d'extinction des Bawendi et ses collègues 13. Voir l'annexe pour plus de détails.
- D'échange de cations mercure: les nanocristaux peuvent être partiellement échangée avec du mercure pour décalage vers le rouge l'absorption et l'émission de fluorescence. Mélanger les éléments suivants ensemble dans l'ordre dans un flacon en verre de 20 ml avec un barreau d'agitation (cette réaction peut être mise à l'échelle au choix): 3 ml d'hexane, 2 ml de chloroforme, 1 Cd ml uM 200Se QD solution (200 nmol), 15 ul oléylamine (LLO), et 500 ul d'une solution 0,1 M de Hg (OT) 2 dans du chloroforme. Mercure octanethioate (HgOT 2) peut être préparé en faisant réagir l'acétate de mercure et octanethiol dans le méthanol (voir annexe). Au fur et à la réaction d'échange de cations, dans la mesure du décalage vers le rouge peut être surveillée par spectrophotométrie d'absorption UV-Vis. Après la bande d'absorption souhaitée est atteinte, mesurer l'absorption de la solution de nanocristaux à 350 nm et de déterminer le coefficient d'extinction nouveau, en supposant que la concentration n'a pas changé nanocristal (30,7 uM dans cet exemple). Stopper la réaction en enlevant le mercure n'a pas réagi: ajouter 5 ml décane, 10 ml d'hexane, et 7 ml de méthanol et d'extraire la solution, en gardant la phase supérieure contenant des nanocristaux. Extraire deux fois plus à l'hexane et le méthanol, et réglez le volume de méthanol afin que la phase supérieure est d'environ 7 ml. Si les phases sont lents à se séparer, la solution peut être centrifugé (5000 xg,10 min). Ajouter 100 ul TOP, 100 LLO ul et 100 ul d'acide oléique aux nanocristaux suivis par 40 ml d'acétone pour induire la précipitation. Recueillir les nanocristaux par centrifugation et disperser dans 3 ml d'hexane. Centrifuger de nouveau pour éliminer les composants insolubles et déterminer la concentration nanocristal nouveau, en utilisant le coefficient d'extinction nouveau à 350 nm. Laisser la solution nanocristal à vieillir pendant au moins 24 heures à température ambiante avant de procéder à l'étape suivante.
2. Croissance de Sulfure de zinc cadmium (Cd y Zn 1-y S) Shell
- Préparer solutions à 0,1 M précurseurs shell dans 50 ml 3 flacons à col. Cadmium précurseur: l'hydrate d'acétate de cadmium (230,5 mg, 1 mmol) et 10 ml d'oléylamine (LLO). Précurseur de zinc: l'acétate de zinc (183,5 mg, 1 mmol) et 10 ml LLO. Précurseur de soufre: soufre (32,1 mg, 1 mmol) et 10 ml ODE. Sous vide, chauffer chaque solution au reflux pendant 1 heure pour obtenir des solutions claires, puis rechargez avec de l'argon. La solution de soufre peutrefroidir à la température ambiante, mais des précurseurs de cadmium et de zinc sont maintenues à environ 50 ° C. Le calcul des quantités de précurseurs shell ne peut être trouvée dans la référence 14.
- Ajouter à un ballon à 3 cols: Hg x Cd 1-x Se QDs (120 nmol, 2,3 nm de diamètre), ODE (2 ml), et l'oxyde de trioctylphosphine (TOPO, 250 mg). Évacuer hors de l'hexane à température ambiante en utilisant la ligne de Schlenk. Augmenter la température à 100 ° C et le reflux pendant 15 min. Changer la vanne en ligne de Schlenk de l'argon ou de l'azote gazeux et insérer le thermocouple dans la solution de nanocristaux.
- Augmenter la température à 120 ° C, ajouter 0,5 monocouches de solution de précurseur de soufre (140 pi), et laisser la réaction se poursuivre pendant 15 min. Petites fractions (<50 pi) peut être enlevé en utilisant une seringue en verre pour surveiller la progression de la réaction en utilisant la fluorescence et / ou spectrophotométrie d'absorption UV-Vis. Augmenter la température à 140 ° C, ajouter 0,5 monocouches de solution de précurseur de cadmium (140 pi), et laisser la réaction se poursuivre pendant 15 min. Ajouter 500 ul de la LLO anhydre à la solution réactionnelle.
- À 160 ° C ajouter 0,5 monocouches de solution de précurseur de soufre (220 pi), suivi par une quantité égale de solution de précurseur de zinc à 170 ° C et à 15 minutes entre chaque addition. Puis à 180 ° C ajouter 0,25 monocouches de solution de précurseur de soufre (150 ul) et de la solution de précurseur de zinc dans des intervalles de 15 min.
- Refroidir la solution à température ambiante et à nouveau calculer un nouveau coefficient d'extinction pour ces particules en utilisant un spectre UV-Vis, en supposant que le nombre de nanocristaux n'a pas changé (120 nmol dans 3,8 ml solution de réaction). Stocker la solution de réaction comme un mélange brut dans un congélateur, les nanocristaux peuvent être décongelés et purifié si nécessaire en utilisant la même méthode décrite dans les sections 1.8 et 1.9.
- Les nanocristaux peuvent être caractérisées par microscopie électronique, spectroscopie d'absorption UV-Vis, et la spectroscopie de fluorescence. Rendement quantique peut êtrecalculée en utilisant absolument une sphère d'intégration ou relativement en comparaison à une norme connue en utilisant les méthodes de référence 15.
3. Transfert de phase
- Ajouter purifiée noyau / enveloppe Hg x Cd 1-x Se / Zn Cd y 1-y S QD (5 ml, 20 uM) à une de 50 ml à 3 cols et enlever l'hexane sous vide poussé pour obtenir un film sec. Remplir la fiole avec de l'argon, ajouter de la pyridine anhydre (3 ml) pour le film de nanoparticules et de la chaleur de la suspension à 80 ° C. Au cours de 1-2 heures les nanoparticules se dissoudre complètement.
- Ajouter 1-thioglycérol (1 ml) à la solution et agiter à 80 ° C pendant 2 heures. Puis refroidir la solution à température ambiante et ajouter la triéthylamine (0,5 ml) à déprotoner le thioglycérol. Agiter pendant 30 min. La solution peut devenir trouble après l'addition de triéthylamine en raison de la faible solubilité des nanocristaux polaires dans ce mélange de solvants.
- Transférer la solution dans un QD centrifugation de 50 ml cont tube coniqueAining un mélange de 20 ml d'hexane et 20 ml d'acétone, et bien mélanger. Isoler les nanocristaux précipitées par centrifugation (5000 xg, 10 min), et laver le culot avec de l'acétone.
- Dissoudre le culot QD dans le DMSO (5 ml) avec sonication en bain, puis centrifuger (7000 xg, 10 min) pour éliminer les agrégats possibles. Déterminer la concentration de nanoparticules à partir d'un spectre d'absorption UV-Vis. Cette solution de BQs purs doivent être utilisés à moins de 3 h, comme les thiols de surface peuvent s'oxyder lentement dans des conditions ambiantes dans l'air.
- Diluer la solution QD à 10 uM ou moins avec du DMSO et transférer dans un flacon de 50 ml. Préparer un 5 mg / ml, solution d'acide polyacrylique thiolé (synthèse décrite en annexe) dans le DMSO. Ajouter la solution de polymère (0,15 mg de polymère par nmol QDs) goutte à goutte à la solution une fois par jour, tout en agitant et dégazer la solution à la température ambiante pendant 5 min.
- Purger la solution QD / polymère avec de l'argon et de la chaleur à 80 ° C pendant 90 min. Puis refroidir la solution à température ambiante uned goutte à goutte ajouter un volume égal de 50 mM borate de sodium, pH 8. Agiter pendant 10 min.
- Purifier les boîtes quantiques par dialyse (20 kDa de coupure) dans 50 mM borate de sodium, pH 8, puis concentrer les particules à l'aide d'un filtre centrifuge (10 kDa de coupure). Déterminer la concentration d'un spectre d'absorption UV-Vis.
4. Revêtement PEG
- Dans un flacon en verre de 4 ml avec un barreau d'agitation, mélanger 1 nmol QDs dans un tampon de borate avec un excès molaire de 40.000 x 750 Da monoamino-polyéthylène glycol (30 mg, 40 pmol). Si une fonctionnalité chimique spécifique doit être ajouté à des nanocristaux (par exemple hydrazide ou maléimide), il peut être introduit par substitution, une fraction de l'amino-PEG avec un hétéro-amino-PEG (30% molaire fonctionne généralement bien). Diluer la solution de nanocristaux à 1 uM avec un tampon de borate. Cette réaction peut être mis à l'échelle comme vous le souhaitez.
- Préparer une solution fraîche de DMTMM (20 mg, 72 pmol) dans du DMSO (144 pi). Cette solution peut être chauffée brièvement uous un flux de chaleur eau du robinet ou immergé dans un bain sonique pour dissoudre complètement la DMTMM. Ajouter rapidement un excès molaire x 25.000 de cette solution 0,5 M DMTMM (50 pi) à la solution une fois par jour et agiter à température ambiante pendant 30 min.
- Répétez l'étape 4.2 de plus de quatre fois pour saturer la surface du nanocristal avec du PEG. Enfin, ajouter 200 ul de tampon Tris 1 M pour arrêter la réaction et de purifier les nanocristaux utilisant la dialyse, filtres centrifuges, ou ultracentrifugation.
- Les nanocristaux peuvent être analysés pour monodispersité, taille hydrodynamique, et la charge de surface par chromatographie en phase liquide, électrophorèse sur gel, et la microscopie à fluorescence. Pour déterminer la taille hydrodynamique et la distribution de taille en utilisant un système de chromatographie liquide automatisé (GE AKTAprime Plus), utiliser une colonne de Superose 6, avec un débit de 0,5 ml / min avec un tampon PBS éluant, et la détection de l'absorption à 260 ou 280 nm. Comparer les temps d'élution des nanoparticules avec ceux des standards de poids moléculaire. Pour électrophorèse sur gel d'agaroserésistance, préparer un gel d'agarose à 0,5% dans 50 mM de tampon borate de sodium (pH 8,5) ou 50 mM de tampon phosphate de sodium (pH 7,4), mélanger des échantillons de 1 pM avec 10% de glycérol et de charge dans des puits, et fonctionner à 100 V pendant 30 min . L'image des nanocristaux dans le gel à l'aide d'une baguette à la main UV ou transilluminateur UV et l'excitation de fluorescence. À l'image des nanocristaux à l'échelle de la molécule unique par microscopie à fluorescence, diluer les particules à 0,2 nm dans un tampon phosphate 10 mM, déposez 2,5 ul de la solution sur une lamelle de verre, et très délicatement une lamelle de seconde sur le dessus de la perle liquide à s'étaler un film entre les lamelles. L'image de la surface assortis de particules en utilisant un objectif à grande ouverture numérique (idéalement au moins 1,40) en mode épifluorescence ou la FRBR avec une excitation à des longueurs d'onde entre 400-580 nm et d'une caméra CCD multiplicateur d'électrons. Paramètres d'imagerie exactes varieront entre l'installation de microscopie.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La figure 2 illustre l'absorption et des spectres de fluorescence représentant des nanocristaux de CdSe, Hg x Cd 1-x Se nanocristaux après échange cationique, Hg et Cd x 1-x Se / Zn Cd y 1-y nanocristaux S après croissance de la coquille. Les nanocristaux de CdSe de base ont un rendement quantique de fluorescence près de 15% (y compris les grandes longueurs d'onde profonde piège d'émission) mais cette efficacité tombe à moins de 1% après mercure échange, probablement en raison de facturer pièges à porteurs de perturbations introduites par atome de surface 9. Toutefois, la croissance d'une fine enveloppe de Cd y Zn 1-y S augmente cette efficacité à plus de 70%, ce qui est largement maintenu après le transfert de l'eau (50% est typique). En revanche, les nanocristaux de CdSe / Cd y Zn 1-y S sans incorporation mercure perdre une fraction importante de leur rendement quantique dans l'eau à moins d'une coque épaisse est cultivé. Ainsi, en incorporant le mercure dans le coeur nanocrystal, la petite taille du nanocristal peut être maintenue (voir TEM dans la figure 3) sans pour autant sacrifier la luminosité. Il est important de noter que le plafonnement de Cd y Zn 1-y S décale le spectre vers le rouge en raison de la fuite des porteurs de charges électroniques dans le matériau de la coque, ce changement est d'environ 20-30 nm pour CdSe noyaux 16, et augmente avec augmentant la teneur en mercure dans le noyau (jusqu'à 100 nm).
L'utilisation d'un transfert de phase 2-étape de l'eau est critique pour l'obtention d'une population homogène de nanocristaux qui ne nécessitent pas de taille de plus de tri pour éliminer les amas et les agrégats. Dans la première étape, les nanocristaux sont transférés à l'aide du DMSO 1-thioglycérol, l'oléylamine, qui déplace sur la surface du nanocristal. Thioglycérol est alors remplacé par un polymère linéaire multidenté, conduisant à des particules très stables avec une augmentation minime de la taille hydrodynamique résultant du revêtement organique (<4 nm contributisur le diamètre hydrodynamique). Le chromatogramme d'exclusion de taille représentée sur la figure 4a confirme que la taille est comparable à celle de la conalbumine (75 kDa), et après la modification avec 750 Da amino-PEG, la taille est augmentée à seulement 12 nm, semblable à celle d'un anticorps IgG . PEG modification neutralise la charge de surface, comme le confirme l'expérience électrophorèse sur gel d'agarose représenté sur la figure 4b. Nous utilisons régulièrement chromatographie d'exclusion stérique et électrophorèse sur gel pour la caractérisation rapide de la taille, distribution de la taille et de charge de surface. Diffusion de la lumière dynamique et potentiométrie zêta peut également être utilisé, mais la section efficace de diffusion de ces particules ultrapetites est très petit, et nous avons constaté que les résultats des instruments commerciaux ne sont pas reproductibles. Figure 5a montre une micrographie épifluorescence de ces nanocristaux déposés sur un lamelle de verre et excité à 545 nm de la lumière visible. Ces nanocristaux sont facilement o. Figure 5b bserved au niveau d'une seule molécule à 30 images par seconde avec une caméra CCD multiplicateur d'électrons montre que le nombre de particules fluorescentes observées dans chaque trame fluctue dans le temps avec une excitation continue, ce qui est dû à une combinaison de clignoter et la photodégradation . Domine clignotant pour la première fois ~ 7 min avant la photodégradation par oxydation devient peu à peu évident.

Représentation schématique la figure 1. De la procédure de synthèse de nanoparticules. (A) les précurseurs de cadmium et de sélénium réagissent pour générer nanocristaux de CdSe, qui sont traitées par le mercure octanethiolate, induisant partielle Cd → d'échange de cations Hg pour donner x Hg 1-x Cd nanocristaux Se alliage ternaire. Une coque de Cd y Zn 1-y S est ensuite poussé sur le noyau en utilisant l'acétate de cadmium, l'acétate de zinc et du soufre. (B) Comme synthesized, ces nanocristaux sont revêtues ligands organiques non polaires (oléylamine). Pour solubiliser ces particules dans des tampons aqueux, les ligands sont remplacés par un ligand polydenté polymère, qui est couplé de manière covalente à amino-PEG.

Figure 2. Propriétés optiques des Hg x Cd 1-x Se / Zn Cd y nanocristaux 1-y S. (A) Absorption (noir) et spectres de fluorescence (rouge) de CdSe nanocristal carottes, Hg x Cd 1-x Se noyaux après échange de cations, et Hg x Cd 1-x Se / Zn Cd y 1-y nanocristaux S après croissance de la coquille . Spectres sont décalés pour plus de clarté (b) Spectres de fluorescence de Hg x Cd 1-x Se / Cd y Zn 1-y S avec différentes quantités relatives de mercure incorporation. Le spectre bleu représente noyaux avec zéro teneur en mercure (x = 0, CdSe).

La figure 3. Microscopie électronique à transmission (a) et de la distribution granulométrique (b) de Hg 1-x Cd x Se / Cd y Zn 1-y S nanocristaux, montrant un diamètre moyen ± écart-type de 3,2 ± 0,6 nm.

La figure 4. Caractérisation hydrodynamique de Hg x Cd 1-x Se / Cd y Zn 1-y S QDs en solution aqueuse. (A) chromatogramme d'exclusion de taille des nanocristaux enrobés dans un polymère ligand polydenté avant (rouge) et après (bleu) pour la conjugaison amino-PEG. Moléculaires étalons protéiques de poids sont indiqués au-dessus des parcelles. (B) l'électrophorèse sur gel d'agarose expérience des points quantiques dans un tampon de borate de sodium (pH ~ 8,5) avant (gauche) Et après (à droite) la conjugaison d'amino-PEG. Le puits est marqué d'une flèche et polarités des électrodes sont indiquées sur la droite, avant de montrer que la conjugaison des nanocristaux migrent sous forme de particules anioniques et les nanocristaux PEGylées sont électrostatiquement neutre.

Figure 5. Hg x Cd 1-x Se / Cd y Zn 1-y QDs S adsorbés sur une lamelle de verre dans un tampon phosphate, imagés par microscopie à épifluorescence. (A) image QD obtenu à 33 images par seconde. Image 15 um x 15 um. (B) Nombre de points quantiques fluorescentes par champ de vision lors de l'illumination continue pendant 20 min avec une lampe à vapeur de mercure à 545 nm (30 nm de bande passante) filtre d'excitation et 625 nm un passe-bande (20 nm) d'émission de filtre et 100x 1.4 Objectif NA. Mesures à partir de 3 champs de vue ont été en moyenne de plus de 20 min à 12,5 images par seconde.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Par rapport aux points quantiques de CdSe, alliage ternaire Hg x Cd 1-x Se nanocristaux peuvent être réglés en taille et en longueur d'onde de fluorescence de manière indépendante. La taille est d'abord sélectionné lors de la synthèse de nanocristaux de CdSe noyaux, et la longueur d'onde de fluorescence est choisi dans une étape d'échange de cations mercure secondaire, qui ne modifie pas sensiblement la taille des nanocristaux 9. Il est important de laisser le mercure purifié x Cd 1-x nanocristaux Se incuber à température ambiante pendant au moins 24 heures avant bouchage. Ce qui permet une partie des cations mercure faiblement adsorbés à diffuser dans le réseau nanocristal. Sans laisser ce processus se produise, une deuxième bande de fluorescence dans le proche infrarouge est souvent observé en raison de la nucléation homogène des nanocristaux de ions de mercure HgS dissociées.
Dans l'exemple montré dans ce travail, nous avons préparé des noyaux de CdSe avec une taille de près de 2,3 nm, ce qui peut êtrel'écoute de la fluorescence entre 550-800 nm après coiffage en modifiant la quantité de mercure incorporé dans le réseau de base. Avec une coque 2,5 monocouche, le diamètre final de ces BQs était proche de 3,2 nm, ce qui est essentiellement la nanoparticule plus petite taille que l'on peut préparer à la fois suffisamment photostables et suffisamment lumineux pour l'imagerie de molécules uniques (coefficient d'extinction près de 350.000 M -1 cm -1 à 400 nm et le rendement quantique proche de 50% dans l'eau). Ces nanocristaux sont sensiblement plus lumineux et plus photostables que décrites précédemment nanocristaux de tailles comparables qui émettent plus de cette gamme spectrale (par exemple le CdTe, InAs, InP). Comme la plupart des fluorophores, de la fluorescence à partir de ces particules à l'échelle de la molécule unique est intermittente (clignotement) 5,6.
Pour certaines applications, il peut être avantageux d'utiliser des nanocristaux un peu plus grandes. En utilisant un plus grand noyau de nanocristal de CdSe, la fluorescence bandwidth est plus étroite après l'échange cation de mercure. Largeur des pics typiques de fluorescence pour Hg Cd x nanocristaux Se 1-x avec d'émission dans la fenêtre de 600-650 nm sont 50-70 nm de 2,3 nm et noyaux 40-50 nm de 3,2 nm noyaux. De ce fait, les grandes nanocristaux permettra une plus grande capacité de multiplexage spectral. En outre, l'augmentation de la taille va aussi augmenter la section efficace d'absorption des nanocristaux. L'augmentation de l'épaisseur de la couche de CdS coquille intérimaire permettra également d'augmenter la luminosité et prolonger encore la stabilité lors de l'excitation de fluorescence. La taille du noyau CdSe peut être augmentée simplement en prolongeant la durée de la synthèse de base de CdSe, et le suivi de la taille effective par spectrophotométrie d'absorption UV-Vis.
Nous avons trouvé que les points quantiques enrobés aqueux avec des acides carboxyliques sont sujettes à une adsorption non spécifique aux cellules et de protéines, et que la neutralisation de leur charge négative forte dans des tampons physiologiques est critical pour minimiser les interactions non spécifiques 17. Dans les exemples ici, on utilise du PEG à courte chaîne pour neutraliser la charge de surface et de maintenir la stabilité dans l'eau. PEG peut être introduit dans le squelette du polymère, soit avant la fixation des boîtes quantiques ou après le revêtement. Les deux procédures se traduisent par des particules pratiquement neutre, mais ceux revêtus avec le premier polymère carboxyle sont sensiblement plus petites, probablement en raison de l'interaction multidenté améliorée avec la surface. Pour la neutralisation de surface avec PEG, nous avons trouvé que l'addition répétée d'acides carboxyliques agents d'activation est nécessaire en raison de la courte demi-vie des espèces réactives. Nous utilisons DMTMM à la place de plus réactifs carbodiimide communs (EDC) en raison de l'amélioration de la stabilité de DMTMM en stockage et en raison de l'amélioration de l'efficacité de réaction dans de l'eau 18.
Enfin, il est important de noter que les points quantiques et de nombreux autres types de nanocristaux contiennentéléments cytotoxiques 5. Ions cadmium et le mercure peut affecter les processus normaux de cellules vivantes et des organismes et peut-être cancérogène 19-21. Toutefois, la cytotoxicité de CdSe classique / nanocristaux ZnS a été largement étudiée et il a été rapporté que des nanocristaux enrobés robuste avec des ligands organiques stables ne sont pas susciter des réactions ouvertement cytotoxiques par rapport à leurs éléments constitutifs, simplement parce que leurs éléments toxiques sont séquestrés efficacement l'écart des agents oxydants 5. De plus, pour les applications d'imagerie à molécule unique, les effets toxiques est peu probable en raison des concentrations extrêmement faibles utilisés pour l'imagerie (typiquement de 1 nM ou moins) qui sont des ordres de grandeur plus faible que le début de la détectables effets toxiques (50-100 nM). La plupart des expériences de mise en œuvre d'une seule molécule QDs à ce jour ont utilisé CdSe disponible dans le commerce / nanocristaux ZnS, qui sont sensiblement plus importantes que celles décrites aux présentes. En minimisant le nanocrystal taille, le nombre total des atomes de la surface des particules et par le nombre total d'atomes toxiques par des particules sont sensiblement réduites, ce qui réduit le potentiel total de l'impact toxicologique. L'incorporation de mercure dans le nanocristal est prévu afin de réduire davantage le potentiel de toxicité, le mercure divalent est connu pour être moins toxique que le cadmium divalent dans de nombreux types cellulaires 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Aucun conflit d'intérêt déclaré.
Acknowledgments
Les auteurs tiennent à remercier le Dr Hong Yi à la base Emory University microscopie intégrée pour l'imagerie par microscopie électronique. Ce travail a été financé par des subventions du NIH (PN2EY018244, R01 CA108468, U54CA119338 et 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).