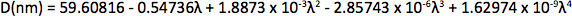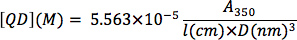Summary
我々は、単一分子蛍光イメージングのための最小限に流体力学的サイズを有するコロイド量子ドットの調製を記載している。従来の量子ドットに比べ、これらのナノ粒子はサイズが球状タンパク質と類似しており、単一分子の明るさ、光分解に対する安定性、タンパク質や細胞への非特異的な結合への抵抗のために最適化されています。
Abstract
1分子イメージングは、生体分子機能のメカニズムを理解するための細胞生物学1-4根底にある分子の挙動の空間的および時間的異質性を可視化するための重要なツールです。画像興味のある個々の分子には、それは一般的に蛍光タグ(染料、タンパク質、ビーズ、または量子ドット)にコンジュゲートと落射蛍光または全内部反射蛍光(TIRF)顕微鏡で観察しています。色素や蛍光タンパク質は何十年も蛍光イメージングの主力となっているが、それらの蛍光は、信号が完全に失われる前に、観測の数秒しかもたらして、個々の分子を観察するために必要な高い光子フラックス下では不安定である。ラテックスビーズと色素標識ビーズが改善された信号安定性を提供しますが、有害な研究対象の分子の拡散挙動を変更することができます大幅に大きい流体力学的サイズを犠牲にして。
ntent "は>量子ドット(QD)は、これら二つの問題が政権の間のバランスを提供します。これらのナノ粒子は半導体材料で構成され、光分解5〜並外れた耐性を有する流体力学的にコンパクトなサイズで設計することができるため、近年、量子ドットは有効に尽力されました単一分子レベルでの複雑な高分子の挙動の長期観測。しかし、これらの粒子はまだそのような彼らのサイズがまだ大きすぎる4,6細胞質および神経シナプス間隙などの混雑した環境での分子拡散障害を示すことが見出された、7。コロイド安定性、光安、明るさ、過去8,9にコンパクトQDの効用を妨げてきた非特異的結合に対するオフセットバランスを取りながら、最近我々は、コアおよび流体力学的サイズを最小化するための量子ドットの表面コーティングを設計した。この記事の目的は、実証することである絶縁カドミウム亜鉛Y 1-Y Sシェル、短いポリエチレングリコールで修飾された多座配位高分子でさらに被覆(でコーティングされた合金化水銀X CD 1-X SEのコアで構成され、これらの最適化されたナノ結晶の合成、修正、および特性PEG)鎖( 図1)。従来のCdSeナノ結晶と比較して、水銀X CD 1-X SE合金は強化された細胞内の信号対雑音、非細胞毒性可視波長での励起のために赤と近赤外波長の蛍光、蛍光の大きい量子収率を提供します。多座ポリマーコーティングは、流体力学的サイズを最小にするために閉鎖とフラットなコンフォメーションでナノ結晶表面に結合し、PEGは細胞や生体分子に非特異的な結合を最小限に抑えるために表面電荷を中和する。最終的な結果は、550から800 nmおよび12 nm付近合計流体力学的サイズとの間の発光と明るい蛍光ナノ結晶である。これは、sにありますAMEサイズの細胞には多くの水溶性球状タンパク質などの範囲、および従来のPEG化された量子ドット(25-35 nm)に比べてかなり小さい。
Protocol
以下の合成手順は、標準的な空気のない技術や真空/不活性ガスマニホールドの使用を含む、詳細な方法論は、10と11の参考文献に記載されています。すべての潜在的に有毒で引火性の物質のMSDSは、使用する前に相談する必要があり、すべての可燃性および/または空気に不安定な化合物は、グローブボックスやグローブバッグ内セプタム密封バイアルに分注しなければならない。
1。水銀カドミウムセレン化水銀(Hg X CD 1-X SE)量子ドットのコアの合成
- トリオクチルホスフィン(TOP)にセレンの0.4M溶液を調製します。 50ミリリットルの3つ口フラスコにセレン(0.316グラム、4ミリモル)を加え、その後、避難及びアルゴンシュレンラインを使用して記入してください。空気のない状態(乾燥窒素またはアルゴン雰囲気)、10mlのTOPを追加して、100℃に加熱下で、無色透明の溶液を得た1時間攪拌した。室温への解決策を冷却し、脇フラスコを設定します。
- 250mlの3つ口フラスコに、酸化カドミウムを追加(CdOの0.0770グラム、0.6ミリモル)、テトラデシルホスホン酸(TDPA、0.3674グラム、1.32 mmol)、およびオクタデセン(ODE、27.6ミリリットル)、攪拌しながらシュレンクラインを使用してソリューションを避難させる。 100℃まで温度を高め、低沸点不純物を除去するために、さらに15分間避難してください。
- アルゴンまたは窒素ガス下で、完全にCDOを溶解させるために1時間300℃に混合物を加熱する。解決策は、無色透明に赤みを帯びた色に変わります。室温への解決策を冷やす。
- 、カドミウム溶液にヘキサを(HDA、7.0グラム)を加え70℃に加熱して、避難してください。一定の圧力が達成されれば、100から110℃、30分間加熱還流液に温度を上昇させる。不活性ガスにシュレンラインバルブを切り替えて、ソリューションに直接熱電対を挿入します。
- 空気を含まない条件下で、溶液中にジフェニルを(DPP、100μl)を追加し、310℃まで温度を上げる0.4MのTOP-Seの溶液を7.5ミリリットルを削除(3ミリモルセレン)16ゲージの針に取り付けられた使い捨てプラスチックシリンジインチ
- 温度は310℃で平衡化したら、0に温度調節器をセット℃、迅速カドミウム溶液に直接TOP-Seの溶液を注入する。溶液は黄色〜オレンジ色に無色から変更され、温度はすぐにドロップすると、〜280℃に再び増加します温度が200℃未満になるまで反応の1分後、加熱マントルからフラスコを取り外し、空気の流れを迅速クール
- 温度が約40に達したとき℃、30ミリリットルをヘキサンで希釈し、残りのカドミウム前駆体のほとんどは、溶液から沈殿する。遠心分離(5,000×g、10分間)することにより、この沈殿物を除去。
- 6 50mlポリプロピレンコニカル遠心チューブの各々において、40mlのアセトン、遠心(10分間5000×g)であり、慎重にデカントで原油ナノ結晶溶液12mlを希釈し、上清を捨てる。
- nanocrを溶かすヘキサン中ystalペレット(25ミリリットル全容積)。上相を保持し、メタノールの等量でこのソリューションを3回抽出する。 3回目の抽出については、メタノールの体積は約200μMで純粋CdSe量子ドットの濃ヘキサン溶液を得るために〜15mlに調整することができる。この反応の典型的な収率は2.3ナノメートル(50〜60%の反応収率)の直径を有するCdSeナノ結晶の3モルである。
- UV-Vis吸収スペクトルを測定し、マルヴェイニーや同僚12のサイズにフィットするチャートとBawendiや同僚13の絶滅の相関関係を調べることによってナノ結晶径と濃度を決定する。詳細については、付録Aを参照してください。
- マーキュリーの陽イオン交換:ナノ結晶が部分的に吸収し、蛍光発光を赤にシフトする水銀と交換することができる。 3ミリリットルヘキサン、2 mlのクロロホルム、1ミリリットル200μMのCD:撹拌棒を備えた20 mlのガラスバイアル(この反応は、必要に応じてスケーリングされる)順序で一緒に次のように混ぜるSE QD溶液(200 nmol)を、15μlのオレイルアミン(OLA)、クロロホルム中のHg(OT)2の0.1M溶液500μl。マーキュリーoctanethioate(HgOT 2)(付録参照)をメタノールに酢酸水銀とオクタンチオールを反応させることにより調製することができる。陽イオン交換反応が進行するにつれて、赤方偏移の程度は、紫外可視吸光光度法で監視することができる。所望の吸収バンドが達成された後、350 nmのナノ結晶溶液の吸収を測定し、ナノ結晶の濃度は(この例では30.7μM)で変更されていないことを前提として、新たな吸光係数を決定する。未反応の水銀を除去することにより、反応をクエンチ:5ミリリットルデカン、10mlのヘキサン、7 mlのメタノールを追加して、ナノ結晶を含む上相を維持し、解決策を抽出します。ヘキサンとメタノールでさらに2回抽出し、上相が約7ミリリットルになるようにメタノールの音量を調整します。相が分離することが遅い場合は、溶液(5000×gで遠心分離し、することができる10分)。沈殿を誘導するために40mlのアセトンに続いてナノ結晶に100μlのTOP、OLAを100μl、100μlのオレイン酸を追加します。遠心分離によりナノ結晶を収集し、3 mlのヘキサン中に分散。不溶成分を除去し、350 nmでの新しい吸光係数を用いて、再びナノ結晶の濃度を決定するために、再び遠心分離します。次のステップに進む前に、室温で少なくとも24時間エージングするナノ結晶溶液を許可します。
2。カドミウム硫化亜鉛の成長(CD YのZn 1-Y S)シェル
- 50ミリリットルの3つ口フラスコに0.1 M殻前駆体溶液を準備します。カドミウム前駆体:酢酸カドミウム水和物(230.5 mg、1 mmol)を、10mlのオレイルアミン(OLA)。亜鉛前駆体:酢酸亜鉛(183.5 mg、1 mmol)をおよびOLA 10ミリリットル。硫黄前駆:硫黄(32.1 mg、1 mmol)を10ミリリットルとODE。真空下で、明確な解決策を得るために1時間還流し、それぞれの溶液を加熱した後、アルゴンで充電してください。硫黄溶液月室温に冷却することが、カドミウムおよび亜鉛前駆体は、約50℃に維持されているシェル前駆体の量の計算は、基準14に記載されています。
- 水銀X CD 1-X SE量子ドット(120ナノモル、2.3 nmの直径)は、ODE(2 ml)に溶解し、トリオクチルホスフィンオキシド(TOPO、250mg)を3口フラスコに入れる。シュレンク·ラインを使用して室温でヘキサンをオフに避難してください。 100℃、15分間還流する温度を上げます。アルゴンや窒素ガスにシュレンラインバルブを変更して、ナノ結晶溶液の熱電対を挿入します。
- 120に温度を上げ℃、硫黄前駆体溶液の0.5単層(140μl)を追加し、反応は15分間続行できるようになります。小アリコート(<50μl)を蛍光および/またはUV-Vis吸収分光光度計を用いて反応の進行状況を監視するために、ガラスシリンジを用いて除去することができる。 140に温度を上げ℃、カドミウム前駆体溶液の0.5単層を追加します(140μL)を加え、反応を15分間進行させる。反応液に500μlの無水OLAを追加します。
- 160℃の各添加の間、15分で170℃の亜鉛前駆体溶液の等量続い硫黄前駆体溶液の0.5単層(220μl)を°Cを追加。その後、180°Cの硫黄前駆体溶液(150μL)および15分インターバルで亜鉛前駆体溶液の0.25単層を追加します。
- 室温への解決策を冷却して再ナノ結晶の数は(3.8 ml反応液中の120 nmol)が変更されなかったと仮定し、UV-Visスペクトルを使用して、これらの粒子のための新たな吸光係数を計算します。冷凍庫で粗混合物として反応液を保管してください。セクション1.8と1.9で説明したのと同じ方法を使用して、必要に応じてナノ結晶が融解し、精製することができる。
- ナノ結晶は、電子顕微鏡、UV-Vis吸収分光、蛍光分光法を用いて特徴付けることができる。量子収率はかもしれないリファレンス15のメソッドを使用して、既知の標準と比較して絶対的に積分球を用いて、または比較的計算。
3。相間移動
- 50ミリリットルの3つ口フラスコに、コア/シェル水銀X CD 1-X SE / CD YのZn 1-Y S量子ドット(5ミリリットル、20μM)を追加し、精製したドライフィルムを得るために、高真空下でヘキサンを除去する。 ℃のスラリーを80ナノ粒子膜と熱に無水ピリジン(3ミリリットル)を追加し、アルゴンでフラスコを埋める1〜2時間のコースでナノ粒子が完全に溶解します。
- 液に1 - チオグリセロール(1ミリリットル)を加え、80℃で攪拌℃で2時間インキュベートする。その後、室温まで冷却し、解決策をチオグリセロールを脱プロトン化し、トリエチルアミン(0.5 ml)を加える。 30分間かき混ぜる。解決策は、この混合溶媒中の極性ナノ結晶の溶解性が悪いが原因でトリエチルアミンを添加した後に曇ることがあります。
- 50mlコニカル遠心管の続きにQDのソリューションを転送20mlのヘキサンと20 mlのアセトンの混合物をaining、よく混ぜる。遠心分離(5,000×g、10分間)を介してナノ結晶沈殿を分離して、アセトンでペレットを洗浄。
- 浴超音波処理とDMSO中QDペレットを(5ml)に溶解した後、可能な凝集物を除去するために遠心分離(7,000×g、10分間)。 UV-Vis吸収スペクトルから、ナノ粒子の濃度を測定します。表面チオールがゆっくりと空気中の周囲条件下で酸化させることができるように純粋な量子ドットのこのソリューションは、3時間以内に使用してください。
- DMSOで10μm以下にQDの溶液を希釈し、50 mlのフラスコに移す。 DMSO中のチオールポリアクリル酸(付録に記載されている合成)の5 mg / mlの溶液を調製します。 5分間室温で溶液を攪拌して脱気しながらQD溶液に滴下してポリマー溶液(nmolの量子ドットあたり0.15ミリグラムポリマー)を追加します。
- アルゴン80〜熱°Cで90分間持つQD /ポリマー溶液をパージします。その後、室温まで冷却ソリューションをdは滴下50mMホウ酸ナトリウム、pH8の等量のを追加します。 10分間かき混ぜる。
- 50mMホウ酸ナトリウム、pH8中透析(20kDaのカットオフ)を介して量子ドットを浄化した後、遠心フィルター(10kDaのカットオフ)を使用して粒子を濃縮。 UV-Vis吸収スペクトルから濃度を決定する。
4。 PEGのコーティング
- 攪拌棒を備えた4 mlのガラスバイアル中で、750ダモノアミノ - ポリエチレングリコール(30 mgを、40マイクロモル)の40,000 Xモル過剰のホウ酸緩衝液中の1 nmolの量子ドットを混在させる。特定の化学物質の機能がナノ結晶( 例えばヒドラジドまたはマレイミド)に追加する場合には、これはヘテロ二アミノ-PEGとアミノ-PEG(30%のモル分率は、典型的にはうまく機能)の一部を置き換えることにより導入することができる。ホウ酸緩衝液と1μMのナノ結晶溶液を希釈します。必要に応じて、この反応は、スケーリングすることができる。
- DMSO中DMTMMた(20mg、72マイクロモル)(144μl)を新鮮な溶液を調製します。このソリューションは簡単に加熱することができるU暖かい水道水の流れをNDERまたは完全DMTMMを溶解させるために風呂に沈めソニケーター。迅速QDソリューションにこの0.5MのDMTMMソリューションの25000 Xモル過剰(50μl)を加え、30分間室温でかき混ぜる。
- PEGを用いてナノ結晶表面を飽和させるために4.2 4回以上繰り返します。最後に、反応をクエンチし、200μlの1Mトリス緩衝液を追加して、透析、遠心フィルタ、または遠心分離を使用してナノ結晶を精製する。
- ナノ結晶は、単分散、流体力学的サイズ、液体クロマトグラフィー、アガロースゲル電気泳動、蛍光顕微鏡を用いて表面電荷のために分析することができる。自動液体クロマトグラフィーシステム(GE AKTAprime Plus)を使用して流体力学的サイズとサイズ分布を決定するには、260または280 nmでスーパーロース6カラム、PBS緩衝液で0.5 ml / minの流速、および吸収検出を使用しています。分子量標準のものとナノ粒子の溶出時間を比較します。アガロースゲルelectropho用抵抗は、50mMホウ酸ナトリウム緩衝液(pH8.5)または50mMリン酸ナトリウム緩衝液(pH7.4)、0.5%アガロースゲルを準備し、ウェルに10%グリセロールおよび負荷で1μMの試料を混合し、30分間、100Vで実行。紫外線ハンドワンドまたはUVトランスイルミネーターを用いたゲルと蛍光励起用のイメージナノ結晶を。蛍光顕微鏡を用いた単一分子レベルで画像ナノ結晶に、カバーガラス上に溶液2.5μlをドロップし、10mMリン酸緩衝液で0.2 nMの粒子を希釈し、慎重に広めるために液体ビーズの上に別カバースリップを置くカバーガラスの間にフィルム。画像400から580 nmおよび電子増倍CCDカメラの間の波長での励起による落射蛍光または全反射モードのいずれかで高開口数対物(理想的には少なくとも1.40)を用いて、表面に結合した粒子を。正確な撮像パラメータは、顕微鏡のセットアップの間で異なります。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
図2は、CdSeナノ結晶、陽イオン交換後の水銀X CD 1-X SEナノ結晶、およびHg X CD 1-X SE / CD Y Znの殻の成長後の1-Y Sナノ結晶の代表的な吸収および蛍光スペクトルを示す。コアのCdSeナノ結晶は15%近くに蛍光の量子収率を持っている(長波長ディープトラップの排出を含む)が、この効率は、表面原子の中断9を通じて導入されたキャリアのトラップを充電によって生じる可能性が高い、水銀交換後は1%未満に低下します。しかしカドミウムYのZn 1-yを Sの薄いシェルの成長は、主に水(50%が典型的である)への移転後 も維持される70%以上にこの効率を向上させます。厚い殻が栽培されていない限り、それとは対照的に、水銀の取り込みなしのCdSe / CD YのZn 1-Y Sナノ結晶は、水にそれらの量子収率のかなりの部分を失う。従ってコアnanocrystaに水銀を組み込むことにより、リットル、ナノ結晶のサイズが小さいことは、明るさを犠牲にすることなく( 図3のTEMを参照)を維持することができる。このシフトは、CdSeコア16の20から30 nm付近であり、増加すると、それはCD Y Znの1-yを Sでキャッピングするシェル材料への電子の電荷キャリアの漏れに起因する赤にスペクトルをシフトすることに注意することが重要である(最大100 nm)をコアに水銀含有量を増加させる。
水への2ステップの相間移動の使用は、クラスタおよび凝集物を除去し、さらに選別サイズを必要としないナノ結晶の均質な集団を得るために重要です。最初のステップでは、ナノ結晶は、ナノ結晶の表面にオレイルアミンを変位1 - チオグリセロールを使用して、DMSOに転送されます。グリセロールは、その後有機被膜(<4 nmのcontributi起因する流体力学的サイズで最小限の増加に伴って非常に安定した粒子で、その結果、線形座ポリマーに置き換えられます流体力学的直径にしてください)。 図4aに示すように、サイズ排除クロマトグラムは、サイズがコンアルブミン(75 kDa)のものと同様であることを確認し、750ダアミノ-PEGで修飾した後、サイズは、わずか12 nmのIgG抗体の場合と同様に増加さ。 図4bに示すように、アガロースゲル電気泳動の実験で確認されたようにPEG修飾は、表面電荷を中和する。我々は日常的に迅速なサイズのキャラクタリゼーション、サイズ分布、及び表面電荷のためにサイズ排除クロマトグラフィー、ゲル電気泳動を使用しています。動的光散乱およびゼータ電位差を使用することもできますが、これらの超粒子の散乱断面積が非常に小さく、私たちは、商業金融商品からの結果が再現できないことを発見した。 図5aは、これらのナノ結晶の落射蛍光顕微鏡写真の上に堆積を示していガラスカバースリップと545 nmの可視光で励起される。これらのナノ結晶は容易にOであり、電子増倍CCDカメラで毎秒30フレームの単一分子レベルでbserved 図5bは、各フレームで観察蛍光粒子の数は連続的な励起と時間の経過とともに変動することを示しています。これが点滅し、光分解の組み合わせによるものである。酸化的光分解がゆっくりと明らかになる前に点滅を第一〜7分間支配する。

図1:ナノ粒子合成法の概略図。 (a)は、カドミウム及びセレンの前駆体は、Hg X CD 1-X SEの三元合金のナノ結晶を得るために部分的なCD→Hgの陽イオン交換を誘発し、水銀octanethiolateで治療されるCdSeナノ結晶を生成するために反応する。カドミウムのZn 1-yのyの Sのシェルは、その後、酢酸カドミウム、酢酸亜鉛、硫黄を使用して、コア上に成長させる。 (b)のようにsynthesized、これらのナノ結晶は、非極性有機配位子(オレイルアミン)でコーティングされています。水性緩衝液中で、これらの粒子を可溶化するために、配位子が共有結合アミノ-PEGに結合された多座配位高分子に置き換えられます。

図2 1-X SEのHg X CD / CDのZn 1-yをY Sナノ結晶の光学的性質。 ()吸収(黒)とCdSeナノ結晶コア、HgのX CD 1-X SEの陽イオン交換後のコアとシェルの成長後のHg X CD 1-X SE / CD YのZn 1-Y Sナノ結晶の蛍光スペクトル(赤) 。スペクトルは、水銀の取り込みの異なる相対量で明確にするために水銀X CD 1-X SE / CDのZn 1-yのyの Sの(b)の蛍光スペクトルをオフセットしている。青色スペクトルはゼロ水銀含有量(X = 0は、CdSe)とコアを描いている。

図3透過型電子顕微鏡写真(a)と(b)1-X SEのHg X CD / CD Y Znの1-Y Sナノ結晶の粒径分布は、平均直径±3.2の標準偏差が±0.6 nmを示す。

図4水溶液中のHg X CD 1-X SE / CDのZn 1-yをY S QDの流体力学的特性評価。 (a)の前に、多座配位高分子で被覆されたナノ結晶のサイズ排除クロマトグラフ(赤)と後(青)アミノ-PEGへの結合。分子量のタンパク質標準は、プロット上に示されている。前にホウ酸ナトリウム緩衝液中の量子ドットの(b)は、アガロースゲル電気泳動実験(pH約8.5)(左アミノ-PEG)と後(右)の共役。よく、アニオン性粒子およびPEG化ナノ結晶は、静電的に中立であるように抱合前にナノ結晶が移行することを示す、矢印及び電極極性右側に表示されていますが付いています。

図5のHg X CD 1-X SE / CD YのZn 1-yの落射蛍光顕微鏡で画像化リン酸緩衝液中でカバーガラスに吸着Sの量子ドット。 (a)は、量子ドットの画像は毎秒33フレームで得られた。画像は、15μm×15μmである。 545ナノメートル(30nmのバンドパス)励起フィルターと625ナノメートル(20nmのバンドパス)発光フィルターと100xの1.4 NA対物と水銀アークランプで20分間の連続点灯時の視野あたりの蛍光量子ドットの(b)の数。ビューの3つのフィールドからの測定値は、毎秒12.5コマで20分かけて平均した。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
従来のCdSe量子ドットに比べて、三元合金のHg X CD 1-X SEナノ結晶は、独立して大きさと蛍光波長に同調させることができる。サイズは、第1 CdSeナノ結晶コアの合成時に選択され、蛍光波長は、実質的にナノサイズ9を変えない二水銀カチオン交換工程で選択されます。精製された水銀X CD 1-X Seのナノ結晶がキャッピング前に、少なくとも24時間室温でインキュベートすることができますすることが重要です。これが弱く吸着水銀陽イオンの一部が結晶格子中に拡散することができます。このプロセスが発生させることなく、近赤外における第2の蛍光バンドがしばしば解離水銀イオンからHGSナノ結晶の均一核生成に起因して観測されています。
この仕事に示す例では、なることができる、2.3 nm付近サイズでCdSeのコアを用意コア格子に組み込ま水銀の量を変えることにより、キャッピング後に550から800 nmの間の蛍光にチューニング。 2.5単層シェルでは、これらの量子ドットの最終的な直径は、本質的に我々は単一分子イメージングのために十分に光安定と十分な明るさでもあり、その準備をすることができる最小サイズのナノ粒子(350,000付近で吸光係数M -1 cmでいる、3.2 nmの近くにあった水中の50%近くに400nmと量子収率で-1)。これらのナノ結晶は、このスペクトルの範囲( 例えば CdTeのは、InAs、InP系)の上に放出し匹敵するサイズで前述したナノ結晶よりも実質的に明るく、より光です。ほとんどの蛍光団と同様に、単一分子レベルでのこれらの粒子からの蛍光が(点滅)5,6断続的に発生します。
一部のアプリケーションでは、それがやや大きいナノ結晶を使用することが有益かもしれません。大きいCdSeナノ結晶コア、蛍光bandwiを使用することによりDTHは水銀陽イオン交換後の狭くなっている。 600から650 nmのウィンドウの放出を伴う水銀X CD 1-X SEナノ結晶の典型的な蛍光ピーク幅は2.3 nmのコアの50から70 nmと3.2 nmのコア40〜50 nmである。これにより、大規模なナノ結晶がスペクトル多重化のための大容量を可能にします。また、サイズを大きくすると、同様にナノ結晶の吸収断面積を増加させます。 CdSのシェル中間層の厚さを増加させると、明るさを向上させ、さらに励起時に蛍光安定性を延長します。 CdSeコアのサイズは、CdSeコア合成の期間を延長し、紫外可視吸光光度法による効果的なサイズを監視することによって、単純に増加させることができる。
我々は、カルボン酸で被覆された水性量子ドットは細胞やタンパク質の非特異的吸着しやすく、生理的緩衝液中の彼らの強い負電荷の中和がCRであることを発見した非特異的な相互作用を最小限にするための17 itical。ここに示した例では、表面電荷を中和し、水の安定を維持するために短鎖PEGを使用しました。 PEGは、量子ドットへの取付けの前または後のいずれかにコーティングポリマー骨格に導入することができる。手順はほぼ中性の粒子になりますが、カルボキシルポリマーとのそれらの最初のコーティングされた表面との両方が改善された多座相互作用などが原因で、実質的に小さい。 PEGを用いた完全な表面を中和するため、我々はカルボン酸活性化剤の添加が原因で繰り返し反応種の半減期が短いために必要であることを見出した。我々は、理由の改良されたストレージ内DMTMMの安定性と水18で改善された反応効率のためのより一般的なカルボジイミド試薬の場所( 例えば 、EDC)でDMTMM使用。
最後に、量子ドットやナノ結晶の他の多くの種類が含まれていることに注意することが重要です細胞毒性要素5。カドミウム、水銀イオンは生体細胞と生物の通常のプロセスに影響を与えることができ、19から21発癌性があるかもしれません。しかし、従来のCdSe / ZnSのナノ結晶の細胞毒性は広く研究されており、それが彼らの毒性元素を効率的に酸化剤から離して隔離されているという理由だけで、安定した有機配位子を持つ強壮コーティングされたナノ結晶は、その構成要素に比べてあからさまに細胞傷害性応答を誘発しないことが報告されている5。また、1分子イメージングアプリケーション用に、毒性影響がありそうもない、検出可能な毒性作用(50-100 nM)の発症よりも数桁アールイメージング(典型的には1 nm以下)に使用される非常に低濃度に起因しています。日付に量子ドットを実装した単一分子のほとんどの実験は、本明細書に記載のものよりはるかに大きい市販のCdSe / ZnSのナノ結晶を、利用してきました。 nを最小化することにより、anocrystalサイズ、粒子あたりの表面原子の総数及び粒子あたり有毒原子の総数は、実質的にそれによって毒性影響の合計可能性を低減、削減されます。ナノ結晶中への水銀の取り込みは、二価水銀は多くの細胞型19から21の二価カドミウムよりも毒性が低いことが知られているように、毒性の可能性をさらに低減することが期待されています。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
特別な利害関係は宣言されません。
Acknowledgments
著者らは、電子顕微鏡イメージングのためのエモリー大学の統合顕微鏡コアで博士香港李に感謝したいと思います。この作品は、NIHの助成金(PN2EY018244、R01 CA108468、U54CA119338、そして1K99CA154006-01)が主催した。
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).