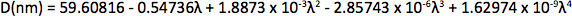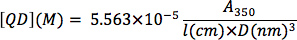Summary
Vi beskriver fremstillingen av kolloidale kvanteprikker med minimert hydrodynamisk størrelse for single-molekyl fluorescens imaging. Sammenlignet med konvensjonelle kvanteprikker, disse nanopartiklene er omtrent samme størrelse som globular proteiner og er optimalisert for single-molekyl lysstyrke, stabilitet mot fotonedbrytning, og motstand mot uspesifikke binding til proteiner og celler.
Abstract
Enkelt-molekyl imaging er et viktig verktøy for å forstå mekanismene for biomolekylære funksjon og for å visualisere romlige og tidsmessige heterogenitet av molekylære atferd som ligger til grunn cellebiologi 1-4. Å image en enkelt molekyl av interesse, er det vanligvis konjugert til en fluoriserende tag (fargestoff, protein, perle, eller quantum prikk) og observert med epifluorescence eller total intern refleksjon fluorescens (TIRF) mikroskopi. Mens fargestoffer og fluorescerende proteiner har vært bærebjelken i fluorescens bildebehandling i flere tiår, er deres fluorescens ustabil under høye foton flukser er nødvendige for å observere individuelle molekyler, gir bare noen få sekunder av observasjon før fullstendig tap av signal. Lateksperler og dye-merkede perler gir forbedret signal stabilitet, men på bekostning av drastisk større hydrodynamisk størrelse, som kan skadelig endre diffusjon og oppførselen til molekylet under studien.
ntent "> Quantum prikker (QDs) tilbyr en balanse mellom disse to problematiske regimer. Disse nanopartikler består av halvledermaterialer, og kan være konstruert med en hydrodynamisk kompakt størrelse med eksepsjonell motstand mot fotonedbrytning 5. Dermed siste årene QDs har vært medvirkende i slik langsiktig observasjon av komplekse macromolecular oppførsel på ett molekyl-nivå. Men disse partiklene har likevel blitt funnet å utvise nedsatt diffusjon i overfylte molekylære miljøer som mobilnettet cytoplasma og nevrale synaptiske spalten, der deres størrelser er fortsatt for stor 4,6 , 7.Nylig har vi utviklet kjernene og overflatebelegg av QDs for minimal hydrodynamisk størrelse, mens balansere forskyvninger til kolloidal stabilitet, fotostabilitet, lysstyrke og uspesifikke binding som har hindret nytten av kompakte QDs i det siste 8,9. Målet med denne artikkelen er å visesyntesen, modifikasjon og karakterisering av disse optimaliserte nanokrystaller, sammensatt av et legert Hg x CD 1-x Se kjerne belagt med et isolerende Cd y Zn 1-y S skall, videre belagt med en polymer multidentate ligand modifisert med korte polyetylenglykol ( PEG) kjeder (figur 1). Sammenlignet med konvensjonelle CdSe nanokrystaller, Hg x CD 1-x Sé legeringer tilby større quantum utbytter av fluorescens, fluorescens på rødt og nær-infrarøde bølgelengder for forbedret signal-til-støy i celler, og eksitasjon på ikke-cytotoksiske synlige bølgelengder. Multidentate polymer belegg binder seg til nanocrystal overflaten i en lukket og flat konformasjon å minimere hydrodynamisk størrelse, og PEG nøytraliserer overflateladning for å minimere ikke-spesifikke binding til celler og biomolekyler. Sluttresultatet er en lyst fluorescerende nanocrystal med utslipp mellom 550-800 nm og en total hydrodynamisk størrelse nær 12 nm. Dette er i same størrelsesområdet så mange løselig globular proteiner i celler, og betydelig mindre enn konvensjonelle pegylert QDs (25-35 nm).
Protocol
Følgende syntese prosedyrer involverer standard luft-frie teknikker og bruk av et vakuum / inert gass manifold; detaljerte metoder kan finnes i referanser 10 og 11.. HMS for alle potensielt giftige og brannfarlige stoffer bør konsulteres før bruk og all brannfarlige og / eller air-labile forbindelser skal alikvoteres inn septum-forseglede ampuller i en hanskerommet eller hanske bag.
1. Syntese av Mercury kadmium selen (Hg x Cd 1-x Se) Quantum Dot kjerner
- Forbered en 0,4 M løsning av selen i trioctylphosphine (TOP). Legg selen (0,316 g, 4 mmol) i en 50 ml 3-halset kolbe, og deretter evakuere og fylle med argon ved hjelp av en Schlenk-linjen. Under luft-frie betingelser (tørr nitrogen eller argonatmosfære), tilsettes 10 ml TOP og varme til 100 ° C under omrøring i 1 time og ga en klar, fargeløs oppløsning. Avkjøl løsningen til romtemperatur og satt kolben til side.
- Til en 250 ml 3-halset kolbe, tilsett kadmium oksid (CdO 0,0770 g, 0,6 mmol), tetradecylphosphonic syre (TDPA, 0,3674 g, 1,32 mmol) og oktadecen (ODE, 27,6 ml) og evakuere løsningen ved hjelp av en Schlenk linje under omrøring. Øke temperaturen til 100 ° C og evakueres til et ytterligere 15 minutter for å fjerne lav kokepunkt urenheter.
- Under argon eller nitrogengass, oppvarme blandingen til 300 ° C i 1 time til fullt oppløse CdO. Løsningen vil endre seg fra en rødlig farge til klar og fargeløs. Avkjøl løsningen til romtemperatur.
- Legg hexadecylamine (HDA, 7,0 g) til kadmium løsning, varme til 70 ° C, og evakuere. Når en konstant trykk er oppnådd, øker temperaturen til 100 til 110 ° C og tilbakeløp løsningen i 30 minutter. Slå Schlenk linje ventil til inertgass og sette termoelementet direkte inn i løsningen.
- Under luft-frie forhold, legge diphenylphosphine (DPP, 100 ul) til oppløsningen og øke temperaturen til 310 ° C. Fjern 7,5 ml av 0,4 M TOP-Se løsning(3 mmol selen) i en engangs plastsprøyte festet til en 16 gauge nål.
- Når temperaturen equilibrates ved 310 ° C, satt temperaturregulatoren til 0 ° C og raskt injiser TOP-Se løsningen direkte inn i kadmium løsning. Løsningen vil endre seg fra fargeløs til gul-oransje og temperaturen vil raskt falle og øke igjen til ~ 280 ° C. Etter 1 min av reaksjon, fjern kolben fra varmekappe og raskt avkjøle med en strøm av luft til temperaturen er mindre enn 200 ° C.
- Når temperaturen når ~ 40 ° C, fortynnes med 30 ml heksan, og mesteparten av den gjenværende kadmium forløperen vil avgjøre ut av oppløsningen. Fjern dette bunnfallet ved sentrifugering (5000 xg, 10 min).
- I hver av seks 50 ml polypropylen konisk sentrifugerør, fortynne 12 ml av det rå nanocrystal løsningen med 40 ml aceton, sentrifuge (5000 x g i 10 min), og nøye dekanter og kast supernatanten.
- Oppløse nanocrystal pellets i heksan (25 ml totalt volum). Pakk denne løsningen 3 ganger med et likt volum metanol, beholder den øverste fase. For tredje ekstraksjon, kan volumet av metanol justeres til ~ 15 ml for å oppnå en konsentrert heksanoppløsning av rene CdSe QDs på omtrent 200 pM. Typisk utbytte av denne reaksjonen er 3 mikromol av CdSe nanokrystaller med en diameter på 2,3 nm (50-60% reaksjon utbytte).
- Bestem nanocrystal diameter og konsentrasjon ved å måle UV-Vis absorpsjon spekteret og rådgivning størrelsen montering diagram av Mulvaney og medarbeidere 12 og utryddelse korrelasjoner av Bawendi og kolleger 13. Se vedlegg for detaljer.
- Mercury kationebytter: nanokrystaller kan være delvis byttet ut med kvikksølv til rød-shift absorpsjon og fluorescensemisjonen. Bland følgende sammen for i et 20 ml hetteglass med stirbar (denne reaksjonen kan bli skalert som ønsket): 3 ml heksan, 2 ml kloroform, 1 ml 200 pM CdSE QD løsning (200 nmol), 15 pl oleylamine (OLA), og 500 pl av en 0,1 M løsning av Hg (OT) 2 i kloroform. Kvikksølv octanethioate (HgOT 2) kan fremstilles ved omsetning av kvikksølv-acetat og octanethiol i metanol (se vedlegg). Som kationbytte reaksjonen forløper, kan omfanget av røde skift overvåkes med UV-Vis absorpsjon spektrofotometri. Etter at den ønskede absorpsjonsbåndet er oppnådd, måle absorpsjonen av nanocrystal løsningen ved 350 nm og bestemme nye ekstinksjonskoeffisient, forutsatt at nanocrystal konsentrasjonen ikke har forandret seg (30,7 uM i dette eksemplet). Stans reaksjonen ved å fjerne uomsatt kvikksølv: tilsett 5 ml dekan, 10 ml heksan, og 7 ml metanol, og trekke ut oppløsningen, holder den øverste fase inneholdende nanokrystaller. Ekstraher to ganger mer med heksan og metanol, og justere volumet av metanol slik at toppen fasen er ~ 7 ml. Hvis fasene er trege å skille, kan løsningen bli sentrifugert (5000 xg,10 min). Tilsett 100 pl TOP, 100 ul OLA, og 100 pl oljesyre til nanokrystaller etterfulgt av 40 ml aceton for å indusere utfelling. Samle nanokrystaller via sentrifugering og spre i 3 ml heksan. Sentrifuger igjen for å fjerne uoppløselige komponenter og bestemme nanocrystal konsentrasjonen på nytt, med det nye ekstinksjonskoeffisient ved 350 nm. La nanocrystal løsning til alder i minst 24 timer i romtemperatur før du går videre til neste trinn.
2. Vekst av kadmium Zinc Sulfid (Cd y Zn 1-y S) Shell
- Forbered 0,1 M skall forløper løsninger i 50 ml 3-necked flasker. Kadmium forløper: kadmium acetate hydrat (230,5 mg, 1 mmol) og 10 ml oleylamine (OLA). Sink forløper: sinkacetat (183,5 mg, 1 mmol) og 10 ml OLA. Svovel forløper: svovel (32,1 mg, 1 mmol) og 10 ml ODE. Under vakuum, varme hver løsning til tilbakeløp i 1 time for å gi klare oppløsninger, og deretter lade med argon. Den svovel løsning kanbli avkjølt til romtemperatur, men kadmium og sink forløpere blir opprettholdt på ca 50 ° C. Beregninger av skall forløper mengder kan bli funnet i referanse 14.
- Legg til en 3-halset kolbe: Hg x CD 1-x Se QDs (120 nmol, 2,3 nm diameter), ODE (2 ml), og trioctylphosphine oksyd (TOPO, 250 mg). Evakuere utenfor heksan ved romtemperatur ved hjelp av Schlenk-linjen. Øke temperaturen til 100 ° C og tilbakeløp i 15 minutter. Endre Schlenk linje ventil til argon eller nitrogengass, og sett termoelement i nanocrystal løsningen.
- Øke temperaturen til 120 ° C, tilsett 0,5 monolag av svovel forløper løsning (140 ul), og la reaksjonen fortsette i 15 min. Små alikvoter (<50 ul) kan fjernes ved hjelp av en glassprøyte å overvåke utviklingen av reaksjonen ved hjelp av fluorescens-og / eller UV-Vis absorpsjon spektrofotometri. Øke temperaturen til 140 ° C, tilsett 0,5 monolag av kadmium forløper løsning (140 ul), og la reaksjonen fortsette i 15 min. Legg 500 pl vannfritt OLA til reaksjonsløsningen.
- Ved 160 ° C tilsett 0,5 monolag av svovel forløper løsning (220 pl) etterfulgt av en lik mengde av sink forløper løsning ved 170 ° C med 15 min mellom hver tilsetning. Deretter ved 180 ° C tilsett 0,25 monolag av svovel forløper løsning (150 ul) og sink-forløper løsning i 15 min intervaller.
- Avkjøl løsningen til romtemperatur og igjen beregne en ny ekstinksjonskoeffisient for disse partiklene ved hjelp av en UV-Vis spekteret, forutsatt at antall nanokrystaller ikke endret (120 nmol i 3,8 ml reaksjonsløsning). Oppbevar reaksjonsoppløsningen som en råblanding i en fryser; nanokrystaller kan tines og renses etter behov ved hjelp av den samme metoden som er beskrevet i avsnittene 1.8 og 1.9.
- Nanokrystaller kan karakteriseres ved hjelp av elektronmikroskopi, UV-Vis absorpsjonsspektroskopi, og fluorescens spektroskopi. Kvanteutbytte kan væreberegnet absolutt ved hjelp av en integrert sfære eller relativt i forhold til en kjent standard ved hjelp av metodene av referanse 15.
3. Fase Transfer
- Legg renset kjerne / skall Hg x CD 1-x Se / Cd y Zn 1-y S QDs (5 ml, 20 pM) til en 50 ml 3-halset kolbe og fjern heksan under et høyt vakuum for å gi en tørr film. Fyll kolben med argon, tilsett vannfri pyridin (3 ml) til nanopartikkel film og varme oppslemmingen til 80 ° C. I løpet av 1-2 timer nanopartikler vil fullt oppløses.
- Tilsett 1-tioglyserol (1 ml) til løsningen og omrør ved 80 ° C i 2 timer. Deretter avkjøle løsningen til romtemperatur og tilsett trietylamin (0,5 ml) for å deprotonate tioglyserol. Omrør i 30 min. Løsningen kan bli uklar etter tilsetningen av trietylamin skyldes dårlig oppløselighet av polare nanokrystaller i denne oppløsningsmiddelblanding.
- Overfør QD løsningen i et 50 ml konisk sentrifugerør fortsaining en blanding av 20 ml heksan og 20 ml aceton, og bland godt. Isoler de utfelte nanokrystaller via sentrifugering (5000 xg, 10 min), og vaske pelleten med aceton.
- Oppløs QD pelleten i DMSO (5 ml) med badekar sonikering, og deretter sentrifuge (7000 xg, 10 min) for å fjerne mulige aggregater. Bestem nanopartikkel konsentrasjonen fra en UV-Vis absorpsjonsspektrum. Denne løsningen av rene QDs bør brukes innen 3 hr, som overflaten tioler kan sakte oksidere under omgivelsesbetingelser i luft.
- Fortynn QD løsningen til 10 uM eller mindre med DMSO og overføre til en 50 ml kolbe. Forberede en 5 mg / ml oppløsning av thiolated polyakrylsyre (syntese beskrevet i tillegg) i DMSO. Legg polymeroppløsningen (0,15 mg polymer pr nmol QDs) dråpevis til QD løsning under omrøring og Degas løsningen ved romtemperatur i 5 min.
- Purge QD / polymerløsning med argon og oppvarm til 80 ° C i 90 min. Deretter avkjøle løsningen til romtemperatur end dråpevis tilsett samme volum av 50 mM natriumborat, pH 8. Omrør i 10 min.
- Rense QDs via dialyse (20 kDa cutoff) i 50 mM natriumborat, pH 8, og deretter konsentrere partiklene ved hjelp av en sentrifugal filter (10 kDa cutoff). Bestemme konsentrasjonen fra en UV-Vis absorpsjonsspektrum.
4. PEG Coating
- I et 4 ml hetteglass med stirbar, bland 1 nmol QDs i boratbuffer med en 40.000 x molart overskudd av 750 Da monoamino-polyetylenglykol (30 mg, 40 pmol). Hvis en spesifikk kjemisk funksjonalitet som skal legges til de nanokrystaller (f.eks hydrazid eller maleimid), kan det bli innført ved å erstatte en del av den amino-PEG med en heterobifunksjonelle amino-PEG (30% molfraksjon typisk fungerer bra). Fortynne nanocrystal løsning til en mikroM med boratbuffer. Denne reaksjonen kan bli skalert som ønsket.
- Forbered en frisk oppløsning av DMTMM (20 mg, 72 pmol) i DMSO (144 ul). Denne løsningen kan bli kort oppvarmet under en strøm av varmt, rennende vann eller under vann i et badekar sonikator å fullt oppløse DMTMM. Raskt legge en 25.000 x molart overskudd av dette 0,5 M DMTMM løsning (50 ul) til QD løsningen og omrør ved romtemperatur i 30 min.
- Gjenta trinn 4,2 fire ganger for å mette nanocrystal overflaten med PEG. Endelig tilsettes 200 pl 1 M Tris-buffer for å stanse reaksjonen og rense nanokrystaller hjelp dialyse, sentrifugale filtre eller ultrasentrifugering.
- Nanokrystaller kan bli analysert for monodispersity, hydrodynamisk størrelse og overflateladning hjelp væskekromatografi, agarosegelelektroforese og fluorescensmikroskopi. Å bestemme hydrodynamisk størrelse og størrelsesfordeling ved hjelp av en automatisert væskekromatografi system (GE ÄKTAprime plus), bruker en Superose 6 kolonne, en strømningshastighet på 0,5 ml / min med PBS buffer elueringsmiddel, og absorpsjon påvisning ved 260 eller 280 nm. Sammenlign nanopartikkel elueringsmiddel ganger med de av molekylvektstandarder. For agarosegel electrophoresis, forberede en 0,5% agarosegel i 50 mM natriumborat-buffer (pH 8,5) eller 50 mM natriumfosfat-buffer (pH 7,4), bland 1 uM prøver med 10% glyserol og last i brønner, og kjøre på 100 V i 30 min . Bilde nanokrystaller i gel ved hjelp av en UV hånd wand eller UV-transilluminator og fluorescenseksitasjon. Skal avbilde nanokrystaller på enkelt molekyl nivå med fluorescens mikroskopi, fortynne partiklene til 0,2 nM i 10 mM fosfatbuffer, slipp 2,5 pl av løsningen på et dekkglass, og nøye plassere en andre dekkglass på toppen av den flytende limstrengen å spre en film mellom dekkglass. Image overflaten-bundne partikler ved hjelp av en høy numerisk apertur objektiv (ideelt minst 1,40) i enten epifluorescence eller TIRF modus med eksitasjon ved bølgelengder mellom 400-580 nm og en elektrondonor-multiplisere CCD kamera. Eksakt bildebehandling parametere vil variere mellom mikroskopi oppsett.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Figur 2 viser representative absorpsjon og fluorescensspektra for CdSe nanokrystaller, Hg x CD 1-x SE nanokrystaller etter kationebytter, og Hg x Cd 1-x Se / Cd y Zn 1-y S nanokrystaller etter skall vekst. Kjernen CdSe nanokrystaller har en kvanteutbytte av fluorescens nær 15% (inkludert lang bølgelengde dype felle utslipp), men denne effektiviteten synker til mindre enn 1% etter kvikksølv utveksling, sannsynligvis på grunn av ladningsbærere feller introdusert gjennom overflaten atom avbrudd 9. Men veksten av et tynt skall av Cd y Zn 1-y S øker denne effektiviteten til mer enn 70%, noe som i stor grad er opprettholdt etter overføring til vann (50% er typisk). I kontrast, CdSe / Cd y Zn 1-y S nanokrystaller uten kvikksølv inkorporering miste en betydelig del av sin kvanteutbytte i vann med mindre en tykk skallet er vokst. Således ved å innlemme kvikksølv inn i kjernen nanocrystal, den lille størrelsen av nanocrystal kan opprettholdes (se TEM i Figur 3) uten å ofre lysstyrke. Det er viktig å merke seg at tildekking med Cd y Zn 1-y S skifter spektrene til den røde grunn av lekkasje av de elektroniske ladningsbærere inn i skallet materiale, dette skiftet er rundt 20-30 nm for CdSe kjerner 16, og øker med økende kvikksølvinnhold i kjernen (opptil 100 nm).
Bruk av en 2-trinns faseoverførings til vann er kritisk for å oppnå en homogen populasjon av nanokrystaller som ikke krever ytterligere størrelser sortering for å fjerne klynger og aggregater. I det første trinnet, blir de overført til nanokrystaller DMSO anvendt 1-tioglyserol som forskyver oleylamine på overflaten av nanocrystal. Tioglyserol blir da erstattet med en lineær multidentate polymer, noe som resulterer i meget stabile partikler med en minimal økning i hydrodynamisk størrelse som følge av organisk belegg (<4 nm bidrag tilpå til hydrodynamiske diameter). Størrelsen-exclusion kromatogrammet vist i figur 4a bekrefter at størrelsen er lik som conalbumin (75 kDa), og etter modifisering med 750 Da amino-PEG, er størrelsen økt til bare 12 nm, lik som en IgG antistoff . PEG modifikasjon nøytraliserer overflateladning, som bekreftet i agarosegelelektroforese eksperiment avbildet i figur 4b. Vi rutinemessig bruker størrelse-exclusion kromatografi og gel elektroforese for rask karakterisering av størrelse, størrelsesfordeling, og overflate kostnader. Dynamisk lysspredning og Zeta potensiometri kan også brukes, men spredningstverrsnitt-delen av disse ultrasmall partikler er svært liten, og vi har funnet at resultater fra kommersielle instrumenter er ikke reproduserbar. Figur 5a viser en epifluorescence mikrografi av disse nanokrystaller avsettes på en dekkglass og spent med 545 nm synlig lys. Disse nanokrystaller er lett o. bserved på enkelt-molekyl nivå ved 30 bilder per sekund med et elektron-multiplisere CCD kamera Figur 5b viser at antallet fluorescerende partikler observert i hver ramme svinger over tid med kontinuerlig eksitasjon, og dette er på grunn av en kombinasjon av blinkende og fotonedbrytning . Blinker dominerer for første ~ 7 min før oksidativt fotonedbrytning sakte blir tydelig.

Figur 1. Skjematisk fremstilling av nanopartikler syntese prosedyren. (A) kadmium og selen forløpere reagerer å generere CdSe nanokrystaller, som er behandlet med kvikksølv octanethiolate, indusere delvis Cd → Hg kationebytter hvorved Hg x CD 1-x Sé ternære legering nanokrystaller. Et skall av Cd y Zn 1-y S blir deretter dyrket på kjernen ved hjelp av kadmium-acetat, sink-acetat, og svovel. (B) Som synthesized blir disse nanokrystaller belagt med upolare organiske ligander (oleylamine). Å oppløse disse partiklene i vandige buffere, er ligander erstattet med en multidentate polymer ligand, som er kovalent bundet til amino-PEG.

Figur 2. Optiske egenskaper Hg x Cd 1-x Se / Cd y Zn 1-y S nanokrystaller. (A) Absorption (svart) og fluorescensspektra (rød) av CdSe nanocrystal kjerner, Hg x Cd 1-x SE kjerner etter kationebytter, og Hg x Cd 1-x Se / Cd y Zn 1-y S nanokrystaller etter skall vekst . Spektrene er forskjøvet for klarhet (b) fluorescensspektra av Hg x Cd 1-x Se / Cd y Zn 1-y S med ulike relative mengder kvikksølv innlemmelse. Den blå spekteret viser kjerner med null kvikksølv (x = 0, CdSe).

Figur 3. Transmisjonselektronmikroskop mikrografi (a) og partikkelstørrelsesfordeling (b) av Hg x CD 1-x Se / Cd y Zn 1-y S nanokrystaller, viser en gjennomsnittlig diameter ± standardavvik på 3,2 ± 0,6 nm.

Figur 4. Hydrodynamisk karakterisering av Hg x CD 1-x Se / Cd y Zn 1-y S QDs i vannoppløsning. (A) gelfiltrerings kromatogram av nanokrystaller belagt i en multidentate polymer ligand før (rød) og etter (blå) konjugering til amino-PEG. Molekylvekt protein standarder er angitt ovenfor tomter. (B) agarosegelelektroforese eksperiment av QDs i natrium boratbuffer (pH ~ 8,5) før (venstre) Og etter (høyre) konjugering til amino-PEG. Brønnen er merket med en pil og elektrode polariteter er angitt til høyre, som viser at før konjugering nanokrystaller migrere anioniske partikler og pegylert nanokrystaller er elektrostatisk nøytral.

Figur 5. Hg x Cd 1-x Se / Cd y Zn 1-y S QDs adsorberes på et dekkglass i fosfatbuffer, avbildes med epifluorescence mikroskopi. (A) QD bildet innhentet ved 33 bilder per sekund. Bildet er 15 mikrometer x 15 mikrometer. (B) Antall fluorescerende QDs per synsfelt under kontinuerlig belysning i 20 min med kvikksølv arc lampe med 545 nm (30 nm Båndpassdesign) eksitasjon filter og en 625 nm (20 nm Båndpassdesign) utslipp filter og 100x 1,4 NA mål. Målinger fra tre synsfelt ble midlet over 20 minutter ved 12,5 bilder per sekund.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Sammenlignet med konvensjonelle CdSe kvanteprikker, kan trefoldig legering Hg x CD 1-x SE nanokrystaller være innstilt på størrelse og fluorescens bølgelengde uavhengig. Størrelsen er første valgt under syntesen av CdSe nanocrystal kjerner, og fluorescensen bølgelengden er valgt på en sekundær kvikksølv kationebytter steg, som ikke i vesentlig grad endre nanocrystal størrelse 9. Det er viktig å tillate det rensede Hg x CD 1-x Sé nanokrystaller inkubere ved romtemperatur i minst 24 timer før capping. Dette tillater noen av de svakt adsorberte kvikksølv kationer å diffundere inn i nanocrystal gitteret. Uten at denne prosessen skal skje, en andre fluorescens band i nær-infrarødt er ofte observert på grunn av homogen nukleasjon av Hgs nanokrystaller fra dissosiert kvikksølv ioner.
I eksemplet i dette arbeidet, utarbeidet vi CdSe kjerner med en størrelse nær 2,3 nm, noe som kan væreinnstilt i fluorescens mellom 550-800 nm etter tildekking ved å endre mengden av kvikksølv innlemmet i kjernen gitteret. Med en 2,5 monolayer shell, var det siste diameter av disse QDs nær 3,2 nm, som er egentlig den minste størrelsen nanopartikkel som vi kan forberede som er både tilstrekkelig photostable og tilstrekkelig lys for single-molekyl imaging (ekstinksjonskoeffisient nær 350 000 M -1 cm -1 ved 400 nm og kvanteutbytte nær 50% i vann). Disse nanokrystaller er vesentlig lysere og mer photostable enn tidligere beskrevet nanokrystaller med sammenlignbare størrelser som avgir over denne spektralområdet (f.eks CdTe, INAS, INP). Som de fleste fluoroforer er fluorescensen fra disse partiklene på ett molekyl nivå intermitterende (blinkende) 5,6.
For noen programmer, kan det være fordelaktig å bruke noe større nanokrystaller. Ved å bruke en større CdSe nanocrystal kjerne, fluorescens bandwiDTH er smalere etter kvikksølv kationebytter. Typiske fluorescens peak bredder for Hg x CD 1-x SE nanokrystaller med utslipp i 600-650 nm vinduet er 50-70 nm for 2,3 nm kjerner og 40-50 nm for 3,2 nm kjerner. Dermed større nanokrystaller aktivere en større kapasitet for spektral multipleksing. I tillegg vil øke størrelsen likeledes øke absorpsjonen tverrsnitt av nanokrystaller. Øke tykkelsen av CdS interim skallet laget vil også øke lysstyrken, og videre forlenge fluorescens stabilitet under eksitasjon. Den CdSe kjerne størrelse kan økes ganske enkelt ved å forlenge varigheten av den CdSe kjernen syntese, og overvåke den effektive størrelse gjennom UV-Vis absorpsjon spektrofotometri.
Vi har funnet at vandige QDs belagt med karboksylsyrer er tilbøyelige til ikke-spesifikk adsorpsjon til celler og proteiner, og at nøytralisering av deres sterke negativ ladning i fysiologiske buffere er critical for å minimere uspesifikke interaksjoner 17. I eksemplene her vi brukt kortkjedet PEG å nøytralisere overflateladning og opprettholde stabiliteten i vann. PEG kan bli innført i polymerskjelettet enten før fastgjøring til QDs eller etter belegging. Begge prosedyrene resulterer i nesten nøytrale partikler, men de første belagt med den carboxyl-polymer er vesentlig mindre, sannsynligvis på grunn av forbedret multidentate interaksjon med overflaten. For komplett overflate nøytralisering med PEG, har vi funnet at gjentatt tilsetning av karboksylsyre aktiverende agenter er nødvendig på grunn av den korte halveringstiden av de reaktive arter. Vi bruker DMTMM i stedet for mer vanlige karbodiimid reagenser (f.eks EDC) på grunn av den forbedrede stabilitet av DMTMM i lagring og på grunn av økt reaksjonseffektivitet i vann 18.
Til slutt er det viktig å merke seg at kvanteprikker og mange andre typer nanokrystaller inneholdercytotoksiske elementer 5. Kadmium og kvikksølv ioner kan påvirke vanlige prosesser av levende celler og organismer, og kan være kreftfremkallende 19-21. Men cytotoksisitet av konvensjonelle CdSe / ZNS nanokrystaller har vært mye studert, og det har blitt rapportert at robustly belagt nanokrystaller med stabile organiske ligander ikke framprovosere åpenlyst cytotoksiske svar i forhold til sine bestanddeler, rett og slett fordi deres giftige elementer er effektivt sequestered borte fra oksidasjonsmidler 5. Videre, for enkelt-molekyl bildebehandlingsprogrammer, toksiske virkninger er usannsynlig på grunn av de ekstremt små konsentrasjoner som brukes for avbildning (vanligvis 1 nm eller mindre) som er størrelsesordener mindre enn utbruddet av påvisbare toksiske effekter (50-100 nM). De fleste av de single-molekylet eksperimenter implementere QDs hittil har utnyttet kommersielt tilgjengelig CdSe / ZNS nanokrystaller, som er vesentlig større enn de som er beskrevet her. Ved å minimere nanocrystal størrelse, blir det totale antall av overflate atomer per partikkel og det totale antall av giftige atomer per partikkel er vesentlig redusert, og dermed redusere den totale potensial for toksikologisk innvirkning. Inkorporering av kvikksølv inn i nanocrystal forventes å ytterligere redusere toksisiteten potensial, som toverdig kvikksølv er kjent for å være mindre toksiske enn toverdig kadmium i mange celletyper 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen interessekonflikter erklært.
Acknowledgments
Forfatterne ønsker å takke dr. Hong Yi ved Emory University Integrert Mikroskopi Kjerne for elektronmikroskopi imaging. Dette arbeidet ble sponset av NIH tilskudd (PN2EY018244, R01 CA108468, U54CA119338, og 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).