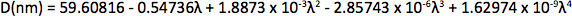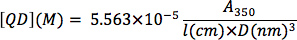Summary
Descreve-se a preparação de pontos quânticos coloidais com minimizada tamanho hidrodinâmico para uma única molécula de imagens de fluorescência. Em comparação com os pontos convencionais quântica, estas nanopartículas são semelhantes em tamanho às proteínas globulares e são optimizadas para uma única molécula de brilho, estabilidade contra a fotodegradação, e resistência a ligação não específica a proteínas e células.
Abstract
Única molécula-imagem é uma ferramenta importante para a compreensão dos mecanismos da função biomolecular e para visualizar a heterogeneidade espacial e temporal de comportamentos moleculares subjacentes à biologia celular 1-4. A imagem de uma molécula individual de interesse, é tipicamente conjugado com um marcador fluorescente (corante, proteína, grânulo, ou quantum dot) e observadas com epifluorescência ou por reflexão total interna microscopia de fluorescência (TIRF). Embora os corantes fluorescentes e de proteínas têm sido o esteio de imagens de fluorescência ao longo de décadas, a fluorescência é instável sob elevados fluxos de fótons necessárias para observar as moléculas individuais, obtendo-se apenas de alguns segundos de observação antes de completa perda de sinal. Esferas de látex e os grânulos de corantes marcados proporcionar estabilidade melhorada do sinal, mas à custa de maior tamanho hidrodinâmico drasticamente, o que pode alterar prejudicialmente a difusão e o comportamento da molécula em estudo.
ntent "pontos quânticos (QDs>) oferecem um equilíbrio entre estes dois regimes problemáticos. Estas nanopartículas são compostos de materiais semicondutores e podem ser projetados com um tamanho compacto hidrodinamicamente com excepcional resistência à fotodegradação 5. Assim, nos últimos anos QDs têm sido fundamentais na viabilização observação a longo prazo do comportamento complexo macromolecular no nível única molécula. No entanto, estas partículas têm sido ainda encontrados para exibir difusão prejudicada em ambientes aglomerados moleculares, tais como o citoplasma celular e a fenda sináptica neuronal, onde os tamanhos são ainda demasiado grande de 4,6 , 7.Recentemente, temos os núcleos de engenharia e revestimentos de superfície de QDs para minimizar tamanho hidrodinâmico, enquanto equilibra as compensações para a estabilidade coloidal, fotoestabilidade, brilho e ligação inespecíficos que têm dificultado a utilidade de QDs compactos no 8,9 passado. O objetivo deste artigo é demonstrara síntese, modificação e caracterização destes nanocristais optimizado, composto por uma liga Hg x 1-x Cd núcleo Se revestidas com um isolante y Zn Cd 1-y shell S, ainda revestidos com um ligante de polímero multidentado modificada com polietilenoglicol curto ( cadeias PEG) (Figura 1). Comparado com nanocristais CdSe convencionais, Hg x CD ligas 1-X SE oferecer maiores rendimentos quânticos de fluorescência, com comprimentos de onda de vermelho e de infravermelho próximo para reforço de sinal-para-ruído de células, de excitação e de não citotóxicas comprimentos de onda visíveis. Os revestimentos de polímero multidentados se ligar à superfície de nanocristais de uma conformação fechada e plana para minimizar o tamanho hidrodinâmico, e PEG neutraliza a carga de superfície para minimizar a ligação não específica de células e biomoléculas. O resultado final é um nanocristais brilhantemente fluorescentes com emissão entre 550-800 nm e um tamanho hidrodinâmico quase total 12 nm. Isto é, no same gama de dimensões, como muitas proteínas globulares solúveis em células, e substancialmente mais pequenas do que as convencionais QDs peguilado (25-35 nm).
Protocol
Os procedimentos de síntese a seguir envolvem padrões de ar livres de técnicas e a utilização de um colector de vácuo / gás inerte; metodologia detalhada pode ser encontrada nas referências 10 e 11. MSDS para todas as substâncias potencialmente tóxicas e inflamáveis deve ser consultado antes do uso e compostos de todos inflamáveis e / ou ar-lábil deve ser aliquotado em septo fechados frascos em uma caixa de luva ou saco de luvas.
1. Síntese de Mercúrio seleneto de cádmio (Cd Hg x 1-X SE) Quantum Núcleos Dot
- Prepare uma solução 0,4 M de selênio em trioctylphosphine (TOP). Adicionar selénio (0,316 g, 4 mmol) a um balão de 50 ml de 3 tubuladuras, em seguida evacuar e encher-se com árgon utilizando uma linha Schlenk. Sob condições isentas de ar (azoto anidro ou atmosfera de árgon), adicionam-se 10 ml TOP e aquecer a 100 ° C com agitação durante 1 h para dar uma solução límpida e incolor. Arrefece-se a solução à temperatura ambiente e ajustar o balão de lado.
- Para um balão de 250 ml com 3 tubuladuras, adicionar óxido de cádmio (CdO 0,0770 g, 0,6 mmol), ácido tetradecylphosphonic (TDPA, 0,3674 g, 1,32 mmol), e octadeceno (ODE, 27,6 ml), e evacuar a solução utilizando uma linha de Schlenk, sob agitação. Aumentar a temperatura para 100 ° C e de evacuar para mais 15 min para remover as impurezas de baixo ponto de ebulição.
- Sob atmosfera de árgon ou de azoto, aquece-se a mistura a 300 ° C durante 1 hora para dissolver completamente o CdO. A solução irá mudar de uma cor avermelhada para transparente e incolor. Arrefecer a solução à temperatura ambiente.
- Adicionar hexadecilamina (HDA, 7,0 g) à solução de cádmio, de calor a 70 ° C, e de evacuar. Uma vez que a pressão constante é atingido, aumentar a temperatura até 100-110 ° C e refluxo da solução durante 30 min. Alternar a válvula da linha de Schlenk de gás inerte e inserir o termopar directamente na solução.
- Sob condições isentas de ar, adicionam difenilfosfina (DPP, 100 ul) à solução e aumentar a temperatura para 310 ° C. Remover 7,5 ml de 0,4 M de solução de TOP-Se(3 selénio mmol) de uma seringa descartável de plástico ligada a uma agulha de calibre 16.
- Uma vez que a temperatura se equilibra a 310 ° C, ajustar o controlador de temperatura de 0 ° C e rapidamente injectar a solução TOP-Se directamente na solução de cádmio. A solução passa de incolor a amarelo-laranja e a temperatura irá cair rapidamente e aumentar de novo até ~ 280 ° C. Após 1 min de reacção, retirar o balão da manta de aquecimento e esfriar rapidamente com um fluxo de ar até que a temperatura seja inferior a 200 ° C.
- Quando a temperatura atinge 40 ° C, dilui-se com 30 ml de hexano, sendo a maioria do restante precursor cádmio vai resolver para fora da solução. Remover este precipitado por centrifugação (5000 xg, 10 min).
- Em cada um dos seis tubos de polipropileno de 50 ml de centrífuga cónico, diluir 12 ml da solução de nanocristais bruto com 40 ml de acetona, de centrifugação (5000 xg durante 10 min), e decantar cuidadosamente o sobrenadante e descartar.
- Dissolve-se o nanocrpelotas ystal em hexano (25 ml volume total). Extrair esta solução três vezes com um volume igual de metanol, mantendo a fase superior. Para a terceira extracção, o volume de metanol pode ser ajustado para ~ 15 ml para se obter uma solução concentrada de hexano QDs CdSe puros em cerca de 200 uM. O rendimento típico da reacção é de 3 mol de nanocristais CdSe com um diâmetro de 2,3 nm (50-60% de rendimento da reacção).
- Determine o diâmetro nanocristais e concentração através da medição do espectro de absorção de UV-Vis e consulta a carta do tamanho-instalação do Mulvaney e colegas de trabalho de 12 e as correlações de extinção Bawendi e colegas de trabalho 13. Veja o Apêndice para mais detalhes.
- Mercury de permuta catiónica: os nanocristais pode ser parcialmente permutado com mercúrio para vermelho-deslocar a absorção e emissão de fluorescência. Misture a seguir, em conjunto, a fim de um frasco de vidro de 20 ml com barra de agitação (esta reacção pode ser dimensionada como desejado): 3 ml de hexano, 2 ml de clorofórmio, 1 mL de Cd ^ M 200Se solução QD (200 nmol), 15 ul de oleilamina (OLA), e 500 ul de uma solução 0,1 M de Hg (OT) 2 em clorofórmio. Mercury octanethioate (HgOT 2) podem ser preparados por reacção de acetato de mercúrio e octanethiol em metanol (ver apêndice). À medida que os catiões reacção prossegue de câmbio, o grau de deslocamento vermelho pode ser monitorizada com UV-Vis espectrofotometria de absorção. Depois a banda de absorção desejada tenha sido atingida, medir a absorção da solução de nanocristais em 350 nm e determinar o coeficiente de extinção novo, partindo do princípio de que a concentração dos nanocristais não foi alterada (30,7 uM neste exemplo). Extingue-se a reacção pela remoção do mercúrio que não reagiu: adicionam-se 5 ml de decano, 10 ml de hexano e 7 ml de metanol e extrai-se a solução, mantendo-se a fase superior que contém os nanocristais. Extrair duas vezes com hexano e metanol, e ajustar o volume de metanol de modo a que a fase superior é de aproximadamente 7 ml. Se as fases são lentos a separar-se, a solução pode ser centrifugada (5000 xg,10 min). Adicionar 100 ul TOP, 100 OLA ul e 100 ul de ácido oleico para os nanocristais seguidos por 40 ml de acetona para induzir a precipitação. Colete os nanocristais através de centrifugação e dispersar em 3 ml de hexano. Centrifugar novamente para remover os componentes insolúveis, e determinar a concentração de nanocristais de novo, utilizando o coeficiente de extinção a 350 nm novo. Permitir que a solução de nanocristais de idade, pelo menos, 24 horas a temperatura ambiente, antes de prosseguir para o passo seguinte.
2. Crescimento de sulfeto de zinco Cádmio (Cd y Zn 1-y S) Shell
- Preparar soluções 0,1 M de precursores de casca, em 50 ml de 3 tubuladuras erlenmeyer. Cádmio precursor: hidrato de acetato de cádmio (230,5 mg, 1 mmol) e 10 ml de oleilamina (OLA). Precursor de zinco: acetato de zinco (183,5 mg, 1 mmol) e 10 ml OLA. Precursor de enxofre: enxofre (32,1 mg, 1 mmol) e 10 ml ODE. Sob vácuo, aquecer cada solução a refluxo durante 1 hora para se obter soluções límpidas, e, em seguida, carregar-se com árgon. A solução de enxofre podeser arrefecida até à temperatura ambiente, mas os precursores de cádmio e de zinco são mantidos a aproximadamente 50 ° C. Os cálculos das quantidades de precursor de casca podem ser encontrados na referência 14.
- Adicionar a um frasco de 3 tubuladuras de: Cd Hg x 1-x Se QDs (120 nmol, 2,3 mm de diâmetro), ODE (2 ml), e óxido de trioctylphosphine (TOPO, 250 mg). Evacuar fora do hexano, à temperatura ambiente utilizando a linha de Schlenk. Aumentar a temperatura para 100 ° C e refluxo, durante 15 min. Alterar a válvula da linha de Schlenk de árgon ou de azoto gasoso e inserir o termopar na solução de nanocristais.
- Aumentar a temperatura para 120 ° C, adicionar 0,5 monocamadas de solução precursora de enxofre (140 ul), e permitir que a reacção prosseguir durante 15 min. Alíquotas pequenas (<50 ul) podem ser removidos utilizando uma seringa de vidro para monitorar o progresso da reacção utilizando fluorescência e / ou UV-Vis espectrofotometria de absorção. Aumentar a temperatura para 140 ° C, adicionar 0,5 monocamadas de solução precursora de cádmio (140 ul), e permitir que a reacção prosseguir durante 15 min. Adicionar 500 ul de OLA anidro à solução de reacção.
- A 160 ° C adicionar 0,5 monocamadas de solução precursora de enxofre (220 uL) seguido por uma quantidade igual de solução de precursor de zinco a 170 ° C com 15 minutos entre cada adição. Em seguida, a 180 ° C adicionar 0,25 monocamadas de solução precursora de enxofre (150 ul) e uma solução de precursor de zinco em intervalos de 15 min.
- Arrefece-se a solução à temperatura ambiente e novamente calcular um coeficiente de extinção de novo para essas partículas, utilizando um espectro de UV-Vis, assumindo que o número de nanocristais não mudou (120 nmol em 3,8 ml solução de reacção). Armazene a solução de reacção como uma mistura em bruto num congelador; os nanocristais podem ser descongeladas e purificados conforme necessário, utilizando o mesmo método descrito nas secções 1.8 e 1.9.
- Os nanocristais podem ser caracterizados utilizando microscopia electrónica, espectroscopia UV-Vis, absorção e espectroscopia de fluorescência. Rendimento quântico pode sercalculado absolutamente usando uma esfera de integração ou relativamente, em comparação com um padrão conhecido, utilizando os métodos de referência 15.
3. Transferência de Fase
- Adicionar purificado núcleo / invólucro Hg x Cd 1-x Se / y Zn Cd 1-y S QDs (5 ml, 20 mM) a 50 ml de 3 tubuladuras e remover o hexano sob vácuo forte para se obter uma película seca. Encher o balão com árgon, adicionar piridina anidra (3 ml) à película de nanopartículas e aquecer a suspensão a 80 ° C. Ao longo de 1-2 h as nanopartículas irá dissolver completamente.
- Adicionar 1-tioglicerol (1 ml) à solução e agita-se a 80 ° C durante 2 horas. Em seguida, arrefecer a solução até à temperatura ambiente e adicionou-se trietilamina (0,5 ml) para desprotonar tioglicerol. Agita-se durante 30 min. A solução pode tornar-se turva após a adição de trietilamina, devido à fraca solubilidade de nanocristais polares desta mistura de solventes.
- Transferir a solução para um QD 50 ml cont tubo de centrífuga cónicoaining uma mistura de 20 ml de hexano e 20 ml de acetona, e misturar bem. Isolar os nanocristais precipitados através de centrifugação (5000 xg, 10 min), e lavar o sedimento com acetona.
- Dissolve-se o pellet QD em DMSO (5 ml) com ultra-sons de banho, e em seguida de centrifugação (7000 xg, 10 min) para remover agregados possíveis. Determinar a concentração das nanopartículas de um espectro de absorção no UV-Vis. Esta solução de QDs puros deve ser utilizada no prazo de 3 horas, como os tióis de superfície pode oxidar lentamente em condições ambientes, ao ar.
- Dilui-se a solução QD para 10 uM ou menos com DMSO e transferir para um balão graduado de 50 ml. Prepara-se uma solução de 5 mg / ml de ácido poliacrílico tiolada (síntese descrita no Apêndice) em DMSO. Adicionar a solução de polímero (0,15 mg de polímero por nmol QDs) gota a gota à solução com agitação QD e desgaseificar a solução à temperatura ambiente durante 5 min.
- Purgar a solução QD / polímero com árgon e de calor a 80 ° C durante 90 min. Em seguida, arrefecer a solução até à temperatura ambiente de umd gota a gota adicionar um volume igual de borato de sódio 50 mM, pH 8. Agita-se durante 10 min.
- Purificar os QDs através de diálise (20 kDa de corte), em borato de sódio 50 mM, pH 8, e, em seguida, concentrar as partículas utilizando um filtro de centrífuga (10 de corte kDa). Determinar a concentração de um espectro de absorção no UV-Vis.
4. PEG Revestimento
- Num frasco de vidro de 4 ml com barra de agitação, uma mistura QDs nmol em tampão de borato com um excesso molar de 40.000 x 750 Da monoamino-polietileno-glicol (30 mg, 40 umol). Se uma funcionalidade química específica, deve ser adicionado aos nanocristais (por exemplo, hidrazida ou maleimida), pode ser introduzido através da substituição de uma fracção do amino-PEG com um amino-PEG heterobifuncional (30% fracção molar normalmente funciona bem). Dilui-se a solução de nanocristais de 1 uM com tampão de borato. Esta reacção pode ser dimensionada como desejado.
- Prepara-se uma solução fresca de DMTMM (20 mg, 72 umol) em DMSO (144 ul). Esta solução pode ser aquecida brevemente under um fluxo de água da torneira quente ou submerso num banho de ultra-sons para dissolver completamente o DMTMM. Rapidamente adicionar um excesso de 25.000 x molar desta solução 0,5 M DMTMM (50 ul) à solução QD e agitar à temperatura ambiente durante 30 min.
- Repetir o passo 4,2 mais quatro vezes para saturar a superfície de nanocristais com PEG. Finalmente, adiciona-se 200 ul de tampão Tris 1 M para parar a reacção e purificar os nanocristais utilizando diálise, filtros centrífugos, ou ultracentrifugação.
- Os nanocristais podem ser analisadas para monodispersity, tamanho hidrodinâmico, e carga de superfície utilizando a cromatografia líquida, electroforese em gel de agarose, e microscopia de fluorescência. Para determinar o tamanho e distribuição de tamanho hidrodinâmico utilizando um sistema de cromatografia líquido automatizado (GE AKTAprime Plus), utilizar uma coluna de Superose 6, uma taxa de fluxo de 0,5 ml / min com PBS eluente tampão, e detecção de absorção a 260 ou 280 nm. Comparar os tempos de eluição de nanopartículas com os de padrões de peso molecular. Por eletroforese em gel de agaroseresistência, preparar um gel de agarose a 0,5% em 50 mM de tampão de borato de sódio (pH 8,5) ou 50 mM de tampão de fosfato de sódio (pH 7,4), misturar amostras de 1 uM, com 10% de glicerol e de carga em poços, e rodar a 100 V durante 30 min . Imagem os nanocristais no gel usando uma varinha de mão UV ou luz UV e para a excitação de fluorescência. Para os nanocristais imagem ao nível única molécula utilizando a microscopia de fluorescência, diluir as partículas para 0,2 nM em tampão fosfato 10 mM, 2,5 ul de soltar a solução sobre uma lamela de vidro e coloque cuidadosamente uma segunda lamela por cima do cordão de líquido para espalhar uma película entre as lamelas. Imagem da superfície ligados partículas usando um objetivo alta abertura numérica (o ideal é pelo menos 1,40) em modo de epifluorescência ou TIRF com excitação em comprimentos de onda entre 400-580 nm e um elétron-multiplicação da câmera CCD. Parâmetros de imagem exactas variarão entre a configuração de microscopia.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A Figura 2 representa a absorção representante e espectros de fluorescência de nanocristais de CdSe, x Hg Cd nanocristais 1-X SE depois de troca de cátions e Hg x CD 1-X SE / Cd y Zn 1-y S nanocristais após crescimento shell. Os nanocristais CdSe núcleo ter um rendimento quântico de fluorescência perto de 15% (incluindo o comprimento de onda de emissão de armadilha de profundidade), mas este rendimento cai para menos de 1% depois da troca mercúrio, provavelmente devido a carregar armadilhas transportadora introduzidas através da ruptura da superfície átomo 9. No entanto, o crescimento de uma fina camada de Zn Cd y y 1-S aumenta essa eficiência superior a 70%, o que é em grande parte mantida após a transferência de água (50% é comum). Em contraste, nanocristais de CdSe / Cd y Zn 1-y S sem incorporação de mercúrio perder uma fração substancial de seu rendimento quântico na água, a menos que uma casca grossa é cultivado. Assim, por incorporação de mercúrio no núcleo nanocrystal, o pequeno tamanho dos nanocristais pode ser mantida (ver TEM na Figura 3), sem sacrificar o brilho. É importante notar que o capeamento com Zn Cd y 1-S y desloca a espectros para o vermelho, devido à fuga dos portadores de carga electrónica no material do invólucro, o deslocamento é de cerca de 20-30 nm para CdSe núcleos 16, e aumenta com a o aumento do conteúdo de mercúrio no núcleo (até 100 nm).
A utilização de uma transferência de fase 2 passo-a água é crítica para a obtenção de uma população homogénea de nanocristais que não necessitam mais de tamanho de triagem para remover aglomerados e agregados. No primeiro passo, os nanocristais são transferidos para DMSO utilizando 1-tioglicerol, o qual desloca oleilamina na superfície dos nanocristais. Tioglicerol é, então, substituído com um polímero linear multidentado, resultando em partículas altamente estáveis com um aumento mínimo no tamanho hidrodinâmico resultante do revestimento orgânico (<4 nm contributiem que o diâmetro hidrodinâmico). O cromatograma de exclusão de tamanho representado na Figura 4a confirma que o tamanho é semelhante ao de conalbumina (75 kDa) e, após a modificação com 750 Da amino-PEG, o tamanho é aumentado até 12 nm, semelhante ao de um anticorpo IgG . PEG modificação neutraliza a carga de superfície, tal como confirmado no experimento de eletroforese em gel de agarose mostrado na Figura 4b. Rotineiramente utilizar cromatografia de exclusão de tamanho e de electroforese em gel para caracterização rápida de dimensão, distribuição de tamanho e a carga superficial. Dispersão de luz dinâmica e potenciometria zeta pode também ser utilizado, no entanto, a secção transversal de dispersão destas partículas ultrasmall é muito pequena, e verificou-se que os resultados a partir de instrumentos comerciais não são reprodutíveis. Figura 5a mostra uma micrografia de epifluorescência esses cristais depositados numa lamela de vidro e animado com 545 nm de luz visível. Estes nanocristais são prontamente ó. Figura 5b bserved no nível de molécula única a 30 fotogramas por segundo, com uma câmara CCD de electrões multiplicação mostra que o número de partículas fluorescentes observados em cada quadro varia ao longo do tempo, com excitação contínua, o que é devido a uma combinação de piscar e fotodegradação . Piscando domina para o primeiro ~ 7 min antes de fotodegradação oxidativo lentamente se torna aparente.

Figura 1 Representação esquemática. Do processo de síntese de nanopartículas. (A) Os precursores de cádmio e selênio reagir para gerar nanocristais CdSe, que são tratados com mercúrio octanethiolate, induzindo parcial Cd → de permuta catiónica para produzir Hg Hg x Cd 1-X SE nanocristais ligas ternárias. Um escudo de Cd y Zn 1-y S é, então, cresceu no núcleo utilizando acetato de cádmio, acetato de zinco e enxofre. (B) Como synthesized, esses cristais são revestidos com ligantes orgânicos não polares (oleilamina). Para solubilizar estas partículas em tampões aquosos, os ligandos são substituídos com um ligante de polímero multidentado, que está covalentemente ligado a amino-PEG.

Figura 2. Propriedades ópticas de Hg x Cd 1-X SE / y Cd Zn nanocristais 1-y S. (A) Absorção (preto) e fluorescência de espectros (vermelho) de nanocristais CdSe núcleos, Hg x Cd núcleos 1-X SE após troca de cátions, e Hg x Cd 1-X SE / Cd y Zn 1-y S nanocristais após crescimento shell . Os espectros são compensados por espectros de clareza (b) A fluorescência de Hg x Cd 1-x Se / y Zn Cd 1-y S com diferentes quantidades relativas de incorporação de mercúrio. O espectro azul descreve núcleos com zero teor de mercúrio (x = 0, CdSe).

Figura 3. Micrografia electrónica de transmissão (a) e da distribuição de tamanho de partícula (b) de Hg x Cd 1-x Se / y Zn Cd 1-y nanocristais S, apresentando um diâmetro médio ± desvio padrão de 3,2 ± 0,6 nm.

Figura 4. Caracterização hidrodinâmica de Hg x Cd 1-x Se / y Zn Cd 1-y S QDs em solução aquosa. (A) cromatograma de exclusão por tamanhos de nanocristais revestidos em um polímero ligante multidentado antes (vermelha) e depois (azul) para a conjugação amino-PEG. Padrões proteicos de peso molecular estão indicados acima das parcelas. (B) electroforese em gel de agarose experiência dos QDs em tampão de borato de sódio (pH ~ 8,5) antes (esquerda) E após a conjugação (à direita) para amino-PEG. O poço é marcado com uma seta e as polaridades dos eléctrodos são indicados no lado direito, mostrando que antes da conjugação dos nanocristais migrar como partículas aniónicas e os nanocristais peguilado são electrostaticamente neutro.

Figura 5. Hg x Cd 1-x Se / y Zn Cd 1-y QDs S adsorvido sobre uma lamela de vidro em tampão fosfato, fotografada com microscopia de epifluorescência. (A) Imagem obtida em QD 33 quadros por segundo. A imagem é de 15 um x 15 um. (B) Número de QDs fluorescentes por campo de observação durante iluminação contínua durante 20 min com lâmpada de arco de mercúrio com 545 nm (30 nm passa-banda) de filtro de excitação e de 625 nm (20 nm passa-banda) de emissão de filtro e 100x 1,4 objectiva NA. As medições a partir de 3 campos de visão foram calculados em 20 min a 12,5 quadros por segundo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Em relação ao convencional pontos quânticos de CdSe, ternário liga Hg x CD nanocristais 1-X SE pode ser ajustado em tamanho e comprimento de onda de fluorescência de forma independente. O tamanho é primeiro seleccionado durante a síntese de núcleos CdSe nanocristais, e o comprimento de onda de fluorescência é escolhido de um passo secundário de troca de catiões de mercúrio, o que não altera substancialmente o tamanho dos nanocristais 9. É importante para permitir que o Hg purificado nanocristais x Cd 1-X SE a incubar à temperatura ambiente durante pelo menos 24 horas antes de nivelamento. Isto permite que alguns dos catiões de mercúrio fracamente adsorvidas a difundir na estrutura nanocristalina. Sem permitir que esse processo ocorra, uma segunda banda de fluorescência no infravermelho próximo é muitas vezes observada devido a nucleação homogênea de nanocristais de íons de mercúrio HgS dissociadas.
No exemplo mostrado neste trabalho, nós preparamos CdSe núcleos com uma dimensão de cerca de 2,3 nm, o que pode sersintonizado na fluorescência entre 550-800 nm após estabilização por alteração da quantidade de mercúrio incorporados na estrutura do núcleo. Com uma concha de monocamada de 2,5, o diâmetro final destes QDs estava próximo 3,2 nm, o que é, essencialmente, o menor tamanho de nanopartículas que se pode preparar, que é ao mesmo tempo suficientemente fotoestáveis e suficientemente brilhante para imagiologia de molécula única (coeficiente de extinção 350000 M -1 cm -1 a 400 nm eo rendimento quântico de cerca de 50% em água). Estes nanocristais são substancialmente mais brilhante e mais fotoestável de nanocristais descritos anteriormente, com tamanhos comparáveis que emitem acima desta faixa espectral (eg CdTe, InAs, InP). Como a maioria dos fluoróforos, a fluorescência a partir destas partículas no nível única molécula é intermitente (a piscar) 5,6.
Para algumas aplicações, pode ser benéfico usar nanocristais um pouco maiores. Ao utilizar uma maior CdSe nanocristais núcleo, a fluorescência bandwidth é mais estreito, depois de troca de cátions de mercúrio. Típicas largura dos picos de fluorescência para Hg x CD nanocristais 1-X SE com emissão na janela nm 600-650 são 50-70 nm para 2,3 nm e núcleos de 40-50 nm para 3,2 nm núcleos. Assim, nanocristais maiores permitir uma maior capacidade de multiplexação espectral. Além disso, o aumento do tamanho irá igualmente aumentar a absorção de secção transversal dos nanocristais. O aumento da espessura da camada de CdS shell intercalar também irá aumentar o brilho, e prolongar ainda mais a estabilidade durante a excitação de fluorescência. O tamanho do núcleo CdSe pode ser aumentada simplesmente por aumento da duração da síntese de núcleo CdSe, e monitorando o tamanho eficaz através de espectrofotometria de UV-Vis de absorção.
Descobrimos que QDs aquosas revestidas com ácidos carboxílicos são propensos a adsorção não específica às células e proteínas, e que a neutralização da sua forte carga negativa em tampões fisiológicos é critical para minimizar interacções não específicas 17. Nos exemplos aqui, foi utilizado PEG de cadeia curta, para neutralizar a carga da superfície e manter a estabilidade em água. PEG pode ser introduzida no esqueleto do polímero, quer antes da ligação aos QDs ou após o revestimento. Ambos os processos resultam em partículas quase neutros, mas aquelas revestidas primeiro com o grupo carboxilo do polímero é substancialmente menor, presumivelmente devido à interacção multidentado melhorada com a superfície. Por neutralização da superfície completa com PEG, verificou-se que a adição repetida de agentes de activação de ácido carboxílico é necessário devido à curta semi-vida das espécies reactivas. Usamos DMTMM no lugar de reagentes de carbodiimida mais comuns (por exemplo, EDC), devido à maior estabilidade de armazenamento e de DMTMM devido a uma eficiência melhorada da reacção em água 18.
Finalmente, é importante notar que os pontos quânticos e muitos outros tipos de nanocristais conterelementos citotóxicos 5. Íons cádmio e mercúrio pode afetar os processos normais de células e organismos vivos e podem ser cancerígenos 19-21. No entanto, a citotoxicidade de CdSe convencional / ZnS nanocristais tem sido amplamente estudada e tem sido relatado que os nanocristais robustamente revestidos com ligantes orgânicos estáveis não eliciar respostas abertamente citotóxicos em relação aos seus elementos constituintes, simplesmente porque os elementos tóxicos são eficientemente sequestered afastado de agentes oxidantes 5. Além disso, para aplicações de molécula única imagem, efeitos tóxicos são improváveis, devido às concentrações extremamente pequenas usadas para imagiologia (tipicamente de 1 nM ou menos), que são ordens de grandeza menor do que o aparecimento de efeitos tóxicos detectáveis (50-100 nM). A maioria das experiências molécula única aplicação QDs até à data têm utilizado comercialmente disponível CdSe / ZnS nanocristais, que são substancialmente maiores do que as aqui descritas. Ao minimizar o nanocrystal tamanho, o número total de átomos da superfície das partículas e por o número total de átomos de tóxicos por partícula são substancialmente reduzidos, reduzindo assim o potencial total de impacto toxicológico. A incorporação de mercúrio no nanocristais é esperado para reduzir ainda mais o potencial de toxicidade, tal como o mercúrio divalente é conhecida por ser menos tóxico do que o cádmio divalente em muitos tipos de células 19-21.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Não há conflitos de interesse declarados.
Acknowledgments
Os autores gostariam de agradecer ao Dr. Hong Yi no Núcleo de Microscopia da Universidade Emory Integrado de imagens de microscopia eletrônica. Este trabalho foi patrocinado pelo NIH (PN2EY018244, R01 CA108468, U54CA119338, e 1K99CA154006-01).
Materials
| Name | Company | Catalog Number | Comments |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercapt–thanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer's Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
|||
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. The Manipulation of Air-Sensitive Compounds. , 2nd edn, Wiley-Interscience. (1986).
- Errington, R. J. Advanced Practical Inorganic and Metalorganic Chemistry. , Blackie. (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).