Summary
Vattenhaltiga tvåfassystem användes för att samtidigt mönster flera populationer av celler. Denna snabb och enkel metod för cell-mönstring utnyttjar fasseparationen av vattenlösningar av dextran och polyetylenglykol och gränsytspänningen som finns mellan de båda polymerlösningarna.
Abstract
Cell mönstring teknik som är snabb, enkel att använda och prisvärd kommer att krävas för den framtida utvecklingen av höga analyser genomströmning cell, plattformar för att studera cell-cell interaktioner och vävnadstekniska system. Denna detaljerade protokoll beskriver en metod för att generera samkulturer av celler använda biokompatibla lösningar av dextran (DEX) och polyetylenglykol (PEG) som fasseparerar när de kombineras ovan tröskelkoncentrationer. Celler kan vara mönstrad i en mängd olika konfigurationer som använder denna metod. Cell uteslutning mönstring kan utföras genom tryckning droppar av DEX på ett substrat och täcka dem med en lösning av PEG-innehållande celler. Gränsytspänningen bildas mellan de två polymerlösningarna orsakar celler att falla runt utsidan av DEX droppen och bildar en cirkulär clearing som kan användas för migration analyser. Cellöar kan mönstras genom att fördela en cell-rik DEX fasen till en PEG-lösning eller genom att täcka DEXdroppe med en lösning av PEG. Samkulturer kan bildas direkt genom att kombinera celler uteslutning med DEX ö mönster. Dessa metoder är kompatibel med en mängd av flytande hantering strategier, inklusive manuell micropipetting, och kan användas med praktiskt taget alla vidhäftande celltyp.
Introduction
Vattenhaltiga tvåfassystem (ATPSs) form när lösningar av två inkompatibla polymerer blandas samman vid tillräckligt höga koncentrationer. Fasseparation påverkas av en mängd olika faktorer som inkluderar molekylvikten och polaritet av polymererna, temperaturen hos lösningar, pH och jonisk innehåll av det vattenhaltiga lösningsmedlet 1, 2. Den punkt vid vilken de två polymerlösningarna separata bestäms av de fysiokemiska egenskaperna hos det valda fassystemet, men sker i allmänhet vid låga polymerkoncentrationer (mindre än 20% vikt / vikt) under icke-denaturerande betingelser, så att ATPSs kan användas för bioteknik tillämpningar 3-9.
Den överlägset mest omfattande studerade ATPS är polyetylenglykol (PEG) / dextran (DEX)-system. De ATPS bildas av dessa billiga och biokompatibla polymerer beskrevs ursprungligen för rening av biomolekyler genom molekylär avskärmning 2, 10. Partitioneringuppstår när ytterligare molekyler eller partiklar som inte bidrar till fassystemet blandas med PEG och DEX. Baserat på deras relativa affiniteter för antingen DEX eller PEG, kommer molekylerna eller partiklarna uppehålla företrädesvis inom en av de två faserna eller vid gränsytan. En annan egenskap av PEG / DEX ATPS är förekomsten av ytspänningen mellan de två polymer faserna. ATPSs bildas av PEG och DEX visa generellt gränsytmedel spänningar som är mycket lägre än andra vätske-vätske tvåfassystem såsom olja och vatten, men gränsytespänningen krafter fortfarande utövar effekter på små partiklar såsom virus, celler och aggregat protein 2 , 11-13. Slutligen, eftersom högre molekylvikt PEG och DEX separat vid låga koncentrationer (mindre än 5% vikt / vikt för högmolekylära polymerer sorter) i närvaro av fysiologiska koncentrationer av salter, det finns få, om några skadliga effekter på däggdjursceller införlivas i dessa system14-16.
Nyligen har de gränsytmedel egenskaper och partitionering effekter av ATPSs tillämpats av vårt labb för cell mönstring 14, 16-20. Detta åstadkoms genom micropatterning en tätare DEX lösning på cellkultursubstrat i närvaro av PEG. När cellerna inkorporeras i PEG-fasen, är de uteslutna från att komma in DEX dropparna på grund PEG / DEX gränsytspänning 20. När celler är mönstrade i DEX fasen, de kvarhålles vid ytan av cellen odlingssubstratet genom gränsytspänning och partitionering 16, 17, 19.
I motsats till andra metoder för cell mönstring är ATPS cell mönster är lätt att lära sig och kräver endast rudimentära kunskaper om de polymerer själva och förmågan att utföra cellodling och använda en mikropipett. Andra metoder för cell-mönstring innebär ofta specialiserad utrustning och utbildning som inte är lätt översättas till the biovetenskap. Till exempel, vissa metoder (microcontact utskrift eller bläckstråleutskrifter) mönster celler indirekt genom att tillämpa mönster av biomolekyler cell lim till en kultur substrat som sedan fungerar som platser för cellvidhäftning 21, 22. Även indirekta metoder är användbara för vissa celltyper, kräver de en hög grad av användarens skicklighet och specialutrustning för att tillverka verktyget mönstring, och kan sakna specificitet beroende på den speciella celltyp / biomolekyl mönster. Alternativt kan celler deponeras med hög mönster specificitet genom direkta mönstring tillvägagångssätt som inkluderar laminärt flöde mönstring, stenciling och bläckstråleutskrifter 23-26. Dessa tekniker kräver också användaren expertis och specialutrustning, och kan skada celler under tryckprocessen. Även om dessa metoder i allmänhet producera exakta mönster av celler, för cell mönstring för att vara ett användbart verktyg inom livsvetenskaperna, måste det vara kostnadseffektivt ettnd enkel att genomföra.
Här rapporterar vi ett detaljerat protokoll för att generera mönstrade cellkulturer med hjälp av ATPSs beskrivs i våra tidigare publicerade applikationer. Med enbart mikropipetter kan användarna skapa zoner cell uteslutning eller öar cell för migration analyser. Detta uppnås med hjälp av PEG / DEX-gränsytspänning som antingen bibehåller celler i DEX fasen eller utesluter celler deponeras i PEG-fasen från DEX. Genom kamning dessa två grundläggande mönstring teknik är det möjligt att snabbt generera samkulturer av celler såsom lever-fibroblastcell samkulturer. Mönstring metoder, ATPS parametrar och förväntade resultat beskrivs i detalj.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Fas system Karaktärisering: Fastställande Tröskelvärden för fasseparation
- Bered lösningar innehållande PEG och DEX i den önskade bufferten eller cellodlingsmedium såsom visas i figur 1 (lila punkter) i 15 ml eller 50 ml koniska rör. Härefter kommer PEG och DEX avser 35 kDa PEG och 500 kDa DEX, men kommer kritiska koncentrationer ändras beroende på de använda två polymerer. Notera den totala massan av PEG och DEX i varje lösning. Hög koncentration polymerlösningar kan ta flera timmar att upplösas. Virvling kan användas för serum-fria lösningar. För medier som innehåller proteiner eller serum, placera rören på en gungande steg tills båda polymerer är helt upplöst. Notera vikten av media som används för att lösa upp polymererna och ta del av de ursprungliga koncentrationerna.
- När polymererna är helt löst, bör lösningarna grumliga. Detta är den första indikationen på att fasseparation har skett. För att bekräfta detta, låtpolymerlösningar att vila i ett vertikalt läge vid rumstemperatur i 20 minuter. Centrifugering vid 1.000 x g kan användas för att accelerera processen fasseparation. Den tätare undre fasen blir DEX-rika och den övre fasen kommer PEG-rik.
- Långsamt tillsätta ytterligare buffert eller medium till rören. Små ökningar bör användas så att inte överskridande punkten fasseparation.
- När lösningen blir klar och inte längre fas-separerar efter centrifugering, har tröskeln för fasseparation uppnåtts. Notera den slutliga vikten av röret.
- Använda tidigare inspelade vikterna för polymerer, tillsammans med slutvikten efter att ha lagt media bestämmer% vikt / vikt av varje de två polymerer vid vilken fasseparation inte längre förekommer.
- Rita dessa värden i% vikt / vikt PEG på y-axeln och% vikt / vikt DEX på x-axeln. Denna tomt, som kallas binodal kurvan, kan användas för att bestämma tröskelkoncentration för fasseparation för olika concentrations av PEG / DEX i en specifik cellodlingsmedium.
2. Konfiguration 1: Uteslutning mönstring (96-brunnars platta format)
- Bered separata lösningar av 5,0% vikt / vikt PEG och 12,8% vikt / vikt DEX i cellodlingsmedium. Använd ATPS lösningar minst dubbelt den kritiska punkten för att säkerställa att en ATPS kvarstår efter polymererna jämvikt i förhållande till varandra. Det finns en liten mängd flöde av DEX till PEG-rika fasen och vice versa, därför, arbetar alltför nära den kritiska koncentrationen kan resultera i förlust av fassystemet som koncentrationer sjunker under kritiska punkten. Likaså, kan överföra skålen cellkulturen till en fukt-och temperatur-kontrollerade inkubator ändra två-fas egenskaper och göra de två lösningarna biandbara. Obs: Vissa celler kan prestera bättre med andra ATPS formuleringar. Acceptabla formuleringar kan väljas baserat på de binodal kurvorna bestämda från del 1.
- Skörda cellerna som skall användas för uteslutning patterning. Fastställa det totala antalet / koncentration av celler tillgängliga. Valfritt: märka cellerna med CellTracker eller andra icke-cytotoxiska etiketter för fluorescensmikroskopi.
- Pellets cellerna och suspendera pelleten i en lämplig volym av 5,0% PEG för att uppnå det önskade antalet celler för uteslutning. Exempelvis kräver en brunn av en 96-brunnars platta 37.500 fibroblastceller kan återsuspenderas i 200 pl av PEG för att producera konfluens följande dag. Skala dessa siffror som är lämpligt för andra celltyper och kultur storlekar substrat.
- Med hjälp av en mikropipett, dispensera 0,5 pl droppar av DEX till en torr cellodling substrat. Större volym droppar ger större avgränsade områden. Droppar varierar i storlek från 0,1 till 1 pl rekommenderas för uteslutning micropatterning. Valfritt: DEX droppar kan avsättas 24 timmar i förväg och tilläts att dehydrera vid rumstemperatur. Detta kan ge renare mönster.
- Dispensera 200 pl av PEG cellsuspension till than väl att täcka DEX dropparna.
- Placera i en fuktad inkubator under 12 timmar vid 37 ° C, 5% CO 2. Se till att skålen inte lutas under hantering och att den är placerad på en nivå som inkubator hylla för att undvika att störa mönstren.
- Avlägsna PEG-lösningen och tvätta tre gånger med 200 pl odlingsmedium.
- Lägg färskt odlingsmedium och återgå till inkubatorn.
- Övervaka de kulturer regelbundet följa cellrörelse in uteslutning zonen.
3. Konfiguration 2: Ö mönstring (96-brunnars platta format)
- Bered lösningar av 5,0% vikt / vikt PEG och 12,8% vikt / vikt DEX i cellodlingsmedium, såsom ovan.
- Skörda cellerna som skall användas för ö mönstring. Fastställa det totala antalet / koncentration av celler tillgängliga.
- Pellets och återsuspendera cellerna i en lämplig volym av 12,8% DEX att uppnå den önskade koncentrationen av celler för öns mönstring. Koncentrationerna av 5.000 ceLLS / il eller mindre rekommenderas för starkt adherenta celltyper. För celler som har svårt att fästa eller celler som löst fäster, koncentrationer på upp till 10.000 celler / mikroliter kan övervägas.
- Arbetar snabbt för att undvika torkning, pipett 0,5 il droppar av DEX till en torr cellodlings-underlaget, såsom beskrivits ovan. Låt inte droppar torka. Valfritt: 200 pl av PEG-lösningen kan tillsättas till den i god tid. DEX droppar kan sedan deponeras i PEG-lösningen där de kommer att sjunka till botten och kontakta kulturen yta. Detta kan ge renare ö mönster.
- Täck DEX dropparna med 200 pl av PEG.
- Placera i en fuktad inkubator under 12 timmar vid 37 ° C, 5% CO 2. Se till att skålen inte lutas under hantering och att den är placerad på en nivå som inkubator hylla för att undvika att störa mönstren.
- Avlägsna PEG-lösningen och tvätta tre gånger med 200 pl odlingsmedium.
- Lägg färsk kulturmedium och återgå till inkubatorn.
- Övervaka de kulturer regelbundet följa cellens rörelse och utåt spridning från öarna.
4. Konfiguration 3: Uteslutning samkulturer (96-brunnars platta format)
- Bered lösningar av 5,0% vikt / vikt PEG och 12,8% vikt / vikt DEX i cellodlingsmedium, såsom ovan.
- Skörda cellerna som skall användas för uteslutning och ön mönstring. Fastställa det totala antalet / koncentration av celler tillgängliga för varje celltyp. Tillval: Vissa celler ihopkopplingar kan visa dramatiskt olika spridning index. För att förhindra de uteslutna cellerna från överbefolkar ön mönstrade celler (speciellt för långsiktiga kulturer), behandla de celler som används för uteslutning med mitomycin C i 2 timmar eller bestråla dem innan skörd. Detta kommer att förhindra spridning. Fluorescerande CellTracker färgämnen kan användas för att särskilja de två cellpopulationerna vid behov.
- Pellets cellerna och suspendera pelleten för exclusion mönstring i en lämplig volym av 5,0% PEG för att uppnå det önskade antalet celler, som ovan. Resuspendera pelleten för ön mönstring i en lämplig volym av 12,8% DEX att uppnå den önskade koncentrationen av celler, såsom ovan.
- Med hjälp av en mikropipett, dispensera 0,5 pl droppar av DEX cellsuspension på en torr cellodling substrat. Låt inte droppar torka.
- Täck DEX dropparna med 200 pl av PEG cellsuspension.
- Placera i en fuktad inkubator under 12 timmar vid 37 ° C, 5% CO 2. Se till att skålen inte lutas under hantering och att den är placerad på en nivå som inkubator hylla för att undvika att störa mönstren.
- Avlägsna PEG-lösningen och tvätta tre gånger i 200 pl odlingsmedium.
- Lägg färskt odlingsmedium och återgå till inkubatorn.
- Övervaka samkulturer att observera samspelet mellan cellpopulationer. Tillval: Kontroller kan beredas genom att utföra uteslutning eller ö mönstring INDIVidually, genom samodling celler som inte interagerar eller genom att blockera vägar av intresse i en eller båda cellpopulationer före eller efter mönstring.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
För att välja en lämplig kombination av PEG och DEX för cell mönstring är det viktigt att bestämma binodal kurvan. Denna kurva beskriver de punkter vid vilka en ATPS kan bilda och kan variera för en given uppsättning av polymerer baserade på temperatur, pH och jonisk innehåll. För odling av celler som kräver anpassade mediet formuleringar kan det vara nödvändigt att experimentellt bestämma binodal kurvan. Detta åstadkommes genom att generera en serie ATPSs som är långt från binodal och varierande i deras PEG och DEX innehåll (Figur 1, lila cirklar). När en ATPS är närvarande, kommer de polymera lösningarna grumliga när de blandas och jämvikt i separata faser om vänster ostört. Genom tillsats av ytterligare lösningsmedel för polymerblandningen, kommer ATPS närmar 0% PEG / 0% DEX. Vid någon punkt kommer blandningen inte längre fasseparera. PEG / DEX koncentration vid vilken detta inträffar representerar en punkt på kurvan binodal, ovanför denna punkt en ATPS kan bilda och under denna punkt kan det inte. Kurvorna i fig. 1 representerar binodals för tre vanliga cellodlingsmedier med och utan 10% fetalt bovint serum (FBS). De koncentrationer vid vilka en ATPS bildas är något högre i närvaro av FBS.
I våra tidigare rapporter, använde vi ATPSs baserad på en kritisk punkt (punkten på binodal där lika volymer av PEG och DEX form efter jämvikt) av 2,5% PEG 35 kDa/3.2% DEX 500 kDa. Resultaten från våra binodal data är i nära närhet till denna kritiska punkt värde. Vi testade nio fassystem kombinationer för mönstring, såsom visas i tabell 1. Eftersom rena lösningar av PEG och DEX jämvikt med avseende på deras polymerkoncentrationer efter att de kombineras, har några av dessa lösningar inte bilda stabila ATPSs, och var därför inte användbara för mönstring (tabell 1a, x märken). Andra polymera kombinationer producerade igenkännbara mönsterMen var inte enhetliga nog för experiment (tabell 1a x / ✓ märken). Användbara polymerformuleringar bildade avgränsade områden eller öar som var nästan saknar celler i de icke-mönstrade regioner (tabell 1a, ✓ märken).
Med 10% PEG, märkte vi att cellmorfologin var onormalt rund och spindel-liknande efter 24 timmar, med celler visar en minskad förmåga att fästa till kultur ytan (tabell 1b, x märken). Morfologi och fastsättning var normala för 2,5% och 5% PEG (Tabell 1b, ✓ märken). Vi observerade att serum utfälldes från odlingsmediet vid höga PEG-koncentrationer (Tabell 1c, x märken), vilket tyder på att onormal cellmorfologi och fastsättning i 10% PEG kan vara relaterade till problem med serum åtkomst. Dessutom är PEG känt att störa plasmamembran 27. Även om dessa effekter endast vid höga koncentrationer av låga molecular vikt PEG, är det bäst att använda den lägsta PEG-koncentrationen som ger tillförlitlig mönster.
Överensstämmer med våra tidigare rapporter drog vi slutsatsen att 5% PEG/6.4% DEX och 5% PEG/12.8% DEX var väl lämpad för cell mönstring, med 12,8% DEX producera mer likformiga mönster. Förväntade resultat tre mönstring format med Cell Tracker-märkta HeLa-celler visas i figur 2. Genom att följa varje mönstring tillvägagångssätt är det möjligt att skapa enhetliga mönster av varje typ, med mycket få celler utanför de mönstrade områdena.
Använda utanförskap och ön mönstring är det möjligt att bedöma spridning och migration av mönstrade celler (Figur 3). Under loppet av tre dagar, fyllde HeLa-celler för uteslutning zonerna (figurerna 3a-c). Ö-mönstrade celler expanderade utåt från de första mönster (figur 3d-f). Dessa förändringar kan kvantifieras med hjälpstandard ImageJ mätverktyg (figur 3 C, F). Det är viktigt att notera att när flera cellpopulationer är samodlas (figur 2, Format 3), kan en cellpopulation ut-proliferera och ersätta den andra. Uteslutning mönstring och ön mönstring kan vara användbara verktyg för att bedöma om detta kommer att vara ett problem. I situationer där dramatiska skillnader i proliferationsindex förekommer, rekommenderas det att en cellpopulation behandlas genom bestrålning eller kemiska faktorer att begränsa dess spridning. Detta är särskilt användbart i situationer där en celltyp används som en stödcell för en långsammare växande känsligare celltyp.
Vi demonstrerade denna princip genom odling HepG2-celler, en hepatocellulär karcinomcellinje som vanligtvis att modellera hepatocyt biologi används, med NIH 3T3-fibroblast som greps med mitomycin C (figur 4). Med tiden de HepG2-celler bibehåller sin lokalisering end koloni form (figur 4a). Genom att placera många droppar i samma platta och omge dem med fibroblaster är det möjligt att odla dessa celler i ett format som är potentiellt användbara för multiplexerade studier (figur 4b). Cell ö monokulturer kan användas med det här formatet som en kontroll för påverkan av parakrina faktorer (Figur 4c).
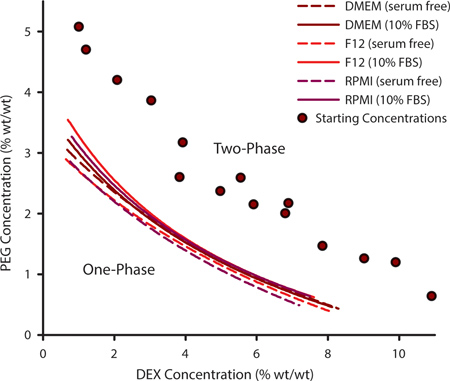
Figur 1. De polymerkoncentrationer vid vilken en ATPS kan bilda kan extrapoleras från experimentellt bestämda binodal kurvor. Denna binodal konstruerades med metoden grumlingspunkt genom att lägga till ytterligare lösningsmedel för att mäta de punkter där två-fas blandningar av varierande PEG / DEX koncentrationer (lila cirklar) inte längre kunde fas separating. Binodals bestämdes för DMEM, F12 och RPMI med och utan serum. Datapunkter försågs med en tre parametrar rationell funktion. N = 3 för varje datapunkt.

Figur 2. Genom fördelning ATPS lösningar på polystyrenplattor kan tre format för celler mönstring produceras. Förfarandet inleds genom att pipettera DEX droppar a) som sedan beläggs med PEG b). När cellerna fästa, kan ATPS lösningarna tvättas bort och ersättas med odlingsmedium (c, d). Fluorescens bilder för monokulturer färgades med CellTracker färgämnen efter mönstring. För samkulturer färgades cellerna separat med CellTracker färgämnen innan mönstring. HeLa-celler användes för att generera alla tre kultur format. 
Figur 3. Uteslutning mönstring och ön mönstring kan användas för att bedöma cellmigration och proliferation. 1 dag efter mönstring a) fråntagande mönstrade HeLa-celler. B) Uteslutning mönstrade HeLa-celler 3 dagar efter mönstringen. C) celler föröka sig och migrera, vilket avsevärt minskar storleken på säkerhetszon. d) Island-mönstrade HeLa-celler 1 dag efter mönstringen. e) Island-mönstrade HeLa-celler 3 dagar efter mönstringen. f) Celler föröka sig och migrera utåt, betydligt utöka storleken på ön. Bilder kvantifierades med ImageJ programvara för att mäta cellens clearing och cellområden ön före och efter migreringen. Staplarna representerar menar± SEM av åtminstone tre oberoende observationer.

Figur 4. Leverceller / fibroblastkulturer kan genereras med ATPS uteslutning samodling mönstring. A) Dessa kolonier behålla sin organisation i minst 4 dagar i odling. B) Flera öar kan klädd i en enda maträtt med potential för multiplex eller hög genomströmning analyser. c) Jämfört med icke-sam-odlade ö mönster, de co-odlade celler uppvisar något högre nivåer av albumin produktion (bruna fläckar) som framgår av kvalitativ jämförelse av albumin färgade samkulturer kontra monokulturer. Albumin är ett protein som produceras av leverceller. Därför, antyder detta resultat att funktionen av leverceller ökas när samodlas med fibroblast med ATPS.
| a) Mönster Bildas | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | X | X | X |
| PEG 5,0% | x / ✓ | ✓ | ✓ |
| PEG 10,0% | x / ✓ | ✓ | ✓ |
| b) Morfologi | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | & # X2713; |
| PEG 10,0% | X | X | X |
| c) Serum Nederbörd | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | ✓ |
| PEG 10,0% | X | X | X |
Tabell 1. A) ATPS formuleringar som kan användas för mönstring anges med bockar, de som inte kan visas med x märken. B) Formuleringar som behåller normal cell morfologi och egenskaper fastsättning anges By bockar, de som inte kan visas med x märken. c) formuleringar som resulterade i utfällning av serumproteiner anges med x märken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den ATPS celler micropatterning metod kräver väldigt lite kunskap bortom kunskaper i cellodlingstekniker och kan snabbt behärskar. Fördelarna med detta tillvägagångssätt är att det är billigt, snabbt och kompatibel med en mängd olika celltyper och format kultur. Av dessa skäl bör vi protokoll enkelt anta livet forskare, särskilt de som studerar cellproliferation, migration och kemotaxi, och påverkan av juxtacrine och parakrina interaktioner mellan cellpopulationer. Analyserna som presenteras här kan lätt kvantifieras på cellpopulationen nivån med standardförfaranden bildanalys finns i program som ImageJ.
Att generera konsekvent mönster vi rekommenderar följande försiktighetsåtgärder. Först bör pipettspetsen användes för att dispensera DEX lösningen bytas efter varje DEX droppe avsätts för att ge jämnare droppar volymer. Eftersom DEX lösningen är relativt viskösDet är också viktigt att undvika avsättning överskott DEX som kan finnas på den yttre ytan av pipettspetsen och för att säkerställa att hela volymen av DEX lämnar spetsen. Det andra, kan dropparna flytta om PEG tillsättes alltför kraftigt eller om skålen lutas. DEX störningar kan minimeras genom att hålla skålen på en plan yta och låta PEG-lösningen att gradvis täcka dropparna från ovan utan att stora krafter från PEG menisken för att lossa en del av droppen. Droplet störningar förekommer oftare med stora DEX droppar, så droppar av 0,5 pl eller mindre ska användas om möjligt. Bortsett från dessa tekniska aspekterna med droppspets lösningarna, det finns mycket få fallgropar förknippade med denna teknik, förutsatt att lämpliga polymermolekylvikter och koncentrationer som används.
Även ATPS mönstring kan lätt utföras med hjälp av en mikropipett (som presenteras här), det finns en mängd mer Sophisticated metoder som kan användas för att snabbt generera mönster av mer komplexa geometriska kedjor (t.ex. vattenfyllda hantering robotar och akustisk dropputstötning), som presenteras i våra tidigare studier 14, 15, 20. Det är också möjligt att alstra DEX droppar som är mycket mindre i volym med pneumatiskt mata DEX genom kapillära öppningar eller genom aktivering en öppning i en mikrokanal att producera flytande DEX droppar mantlade med PEG 19. Dessa metoder kan vara av intresse för dem som vill producera hög kapacitet eller multiplex samodling eller migrering analyser. Dessutom, med användning av mikrofluidiska tillvägagångssätt, är det möjligt att utföra experiment med ett litet antal celler eller med celler i en mikrokanal där effekterna av fluidflöde och ren kan undersökas. Emellertid är dessa avancerade metoder inte krävs för de flesta tillämpningar.
Vattenhaltig tvåfasig mönstring av celler är enkel och lätt anpassas till en typisk cellkultur inställning. Denna metod gör att alla forskare med tillgång till en typisk cellodling labb (tillgång till en huva, CO 2 inkubator och mikropipetter) och de ovannämnda polymererna att reproducerbart mönster celler i monokultur och co-kultur. Vårt laboratorium har visat denna förmåga genom att skriva matriser av celler för att studera cellmigration i sårläkning analys och att undersöka effekterna av juxtacrine och parakrina signalering i differentieringen av embryonala celler 16, 17, 20. Andra metoder, inbegripet mönstring av extracellulär matrix 28, bläckstråleutskrifter 29, och mönstring av laminärt flöde i mikrofluidiska anordningar 25, har 26 också använts för att lokalisera celler. Dessa andra metoder är effektiva metoder för att uppnå väldefinierade mönster av celler och kan ofta nå encelliga precision. Dessa metoder kräver också högt specialiserad utrustning och / eller tillgång till renrumsfaciliteter att tillverka stämplar som används vid print extracellulära matrix proteiner eller producerar mikrofluidik enheter. Deras anslutning till nätaggregat, pumpar sprutan och andra externa komponenter hindrar också genomförandet på grund av de kostnader som är förknippade med utrustningen och användaren skicklighet krävs för att driva den.
När det gäller framtida tillämpningar förväntar vi oss att vår metod kommer att vara användbar för att utveckla odlingssystem som möjliggör hög genomströmning analys av cell rörelse och spridning, samt utreda cell-cell interaktioner mellan flera cellpopulationer. Denna punkt har våra rapporter fokuserat på att undersöka samspelet mellan endast ett fåtal typer av mönstrade celler på en gång. Det är emellertid tänkbart att många subpopulationer av celler kunde odlas med en gemensam matarskikt att undersöka effekterna av parakrina och juxtacrine signalering av många celltyper odlas tillsammans i en enda cellkultur inställning. Slutligen, vävnadsteknik applikationer krävs ofta rumslig lokalisering aven eller flera celltyper. Det kan vara möjligt att göra vår teknik för användning i mönstring celler för att producera mer fysiologiskt relevanta vävnadstekniska sjukdomsmodeller eller mönster celler på implanterbara material för kliniska tillämpningar.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har inga konkurrerande ekonomiska intressen.
Acknowledgments
Detta arbete stöddes av Coulter Foundation, Beyster Foundation, Grundutbildning Research Opportunity (UROP) sommar program för ATA och en National Science Foundation Graduate Student Forskning Fellowship (Grant ingen DGE 0.718.128, ID:. 2010101926) för JBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



