Summary
מערכות מימיות שני שלבים שמשו בו זמנית לאוכלוסיות רבות הדפוס של תאים. השיטה מהירה וקלה זה עבור דפוסי תא מנצלת את הפרדת פאזות של תמיסות מימיות של גליקול dextran ופוליאתילן ומתח interfacial שקיים בין שני פתרוני הפולימרים.
Abstract
טכנולוגיות דפוסים סלולריים, כי הם מהירים, קלים לשימוש ובמחיר סבירים שתידרשנה לפיתוח העתידי של מבחני תפוקה גבוהות סלולריים, פלטפורמות לחקר אינטראקציות תא סלולריים ומערכות רקמות מהונדסות. פרוטוקול מפורט זה מתאר שיטה ליצירת שיתוף תרביות של תאים באמצעות פתרונות ביולוגיים של dextran (DEX) ופוליאתילן גליקול (PEG) ששלב נפרד בשילוב ריכוזים מעל סף. תאים יכולים להיות תבנית במגוון תצורות המשתמשות בשיטה זו. דפוסי הדרת תא יכולים להתבצע על ידי הדפסת טיפין של DEX על מצע ומכסה אותם עם תמיסה של תאים המכיל PEG. מתח interfacial נוצר בין שני פתרוני הפולימר גורם לתאים לנפול סביב החלק החיצוני של טיפת DEX וליצור קרחת עגולה שיכול לשמש למבחני הגירה. איים סלולריים יכולים להיות תבנית על ידי מחלק שלב DEX תא עשיר לפתרון PEG או על ידי כיסוי DEXאגל עם פתרון של PEG. עמיתים לתרבויות יכולות להיוצר באופן ישיר על ידי שילוב של הדרת תא עם דפוסי האי DEX. שיטות אלה הן תואמות עם מגוון רחב של גישות טיפול נוזל, כולל micropipetting הידני, וניתן להשתמש בו עם כמעט כל סוג תא חסיד.
Introduction
מערכות של שתי שכבות מימיות (ATPSs) טופס כאשר פתרונות של שני פולימרים אינם תואמים מעורבבים בריכוזים גבוהים מספיק. הפרדת שלב מושפע ממגוון של גורמים, הכוללים את המשקל המולקולרי וקוטביות של הפולימרים, הטמפרטורה של הפתרונים, pH והתוכן יוני של 1 הממס המימי, 2. הנקודה שבה שני פתרוני הפולימר הנפרדים נקבעים על ידי מאפייני physiochemical של מערכת השלב נבחר, אך בדרך כלל מתרחשת בריכוזי פולימר נמוכים (פחות מ 20% wt / wt) תחת הלא denaturing תנאים, המאפשרת ATPSs לשמש לביוטכנולוגיה יישומים 3-9.
עד כה, ATPS הנחקר ביותר בהרחבה היא מערכת dextran (DEX) פוליאתילן גליקול (PEG) /. את ATPS נוצר על ידי פולימרים זולים וביולוגיים אלה תואר במקור עבור הטיהור של ביומולקולות בדרך של חלוקה מולקולרית 2, 10. מחיצותמתרחש כאשר מולקולות נוספות או חלקיקים שאינם תורמים למערכת השלב מעורבבות עם PEG ו DEX. בהתבסס על הזיקות היחסיות שלהם לאו DEX או PEG, המולקולות או חלקיקים תהיינה מועדפות מתגוררות בתוך אחד משני השלבים או בממשק. מאפיין נוסף של PEG / DEX ATPS הוא קיומו של מתח interfacial בין שני שלבי הפולימרים. ATPSs נוצר על ידי PEG ו DEX בדרך כלל להציג מתחי interfacial כי הם נמוכים בהרבה ממערכות נוזל נוזל אחרות שני שלבים כמו שמן ומים, אולם כוחות מתח interfacial עדיין השפעות על חלקיקים קטנים כגון וירוסים, תאים ואגרגטים חלבון 2 , 11-13. לבסוף, מאחר שמשקל המולקולרי הגבוה וPEG DEX הנפרד בריכוזים נמוכים (wt / wt לזני פולימרי משקל מולקולריים גבוהים פחות מ 5%) בנוכחות ריכוזים פיסיולוגיים של מלחים, יש כמה, אם בכלל, השפעות מזיקות על תאי יונקים שולבו בתוך אלה מערכות14-16.
לאחרונה, את מאפייני interfacial ואפקטי חלוקת ATPSs יושמו על ידי המעבדה שלנו עבור דפוסי תא 14, 16-20. זו הושגה פתרון DEX צפוף על מצעי תרביות תאים בנוכחות PEG ידי micropatterning. כאשר תאים שולבו שלב PEG, הם מנועים מלהיכנס לטיפי דקס עקב מתח interfacial PEG / DEX 20. כאשר תאים הם בדוגמת בשלב DEX, הן נשמרות על פני השטח של מצע תרבית התאים במתח ובמחיצות 16, 17, 19 interfacial.
בניגוד לשיטות אחרות לדפוסי תא, תא דפוסי ATPS קלים ללימוד ודורשים ידע בסיסי על הפולימרים עצמם, והיכולת לבצע תרבית תאים ולהשתמש micropipettor בלבד. שיטות אחרות לדפוסי תא כרוך לעתים קרובות בציוד והכשרה מיוחדים שאינם מתורגמים בקלות לדואר מדעי חיים. לדוגמה, כמה שיטות (microcontact הדפסת הדפסה או הזרקת דיו) תאי דפוס בעקיפין על ידי יישום דפוסים של ביומולקולות הדבקה הסלולרית למצע תרבות שלאחר מכן ישמשו כאתרים לקובץ מצורף תא 21, 22. למרות גישות עקיפות שימושיות לכמה סוגי תאים, הם דורשים רמה גבוהה של מיומנות משתמש וציוד מיוחד כדי להמציא כלי הדפוסים, ויכולים חסרי ייחוד בהתאם לסוג הדפוס / biomolecule המסוים של התאים. לחלופין, ניתן להפקיד תאים עם סגוליות דפוס גבוהות בדרך של גישות דפוסים ישירים הכוללות מינרית זרימת דפוסים, שכפול והדפסת דיו 23-26. עם זאת, שיטות אלו דורשות גם מומחיות משתמש וציוד מיוחד, ויכולות לפגוע בתאים בתהליך ההדפסה. למרות שגישות אלו בדרך כלל לייצר דפוסים מדויקים של תאים, לדפוסי תא להיות כלי שימושי בתחום מדעי החיים, זה חייב להיות חסכוניnd פשוט ליישום.
כאן אנו מדווחים פרוטוקול מפורט ליצירת תרביות תאים בדוגמת באמצעות ATPSs המתואר ביישומים שלנו שפורסמו בעבר. שימוש micropipettors בלבד, משתמשים יכולים ליצור אזורים סלולריים הדרה או איים סלולריים עבור מבחני הגירה. זו מושגת בדרך של מתח interfacial PEG / DEX כי גם שומר תאים בשלב DEX או מוציא תאים הופקדו בשלב PEG מDEX. על ידי סריקת שתי טכניקות דפוסי יסוד אלה, ניתן במהירות כדי לייצר עמיתים לתרביות של תאים כמו תאי כבד פיברובלסטים שיתוף תרבויות. שיטות דפוסים, פרמטרי ATPS ותוצאות צפויות מתוארות בפירוט.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. אפיון מערכת שלב: ספים הקובע להפרדת שלב
- הכן את פתרונות המכילים PEG ו DEX במאגר הרצוי או בינוני תרבית תאים כפי שמוצגים באיור 1 (נקודות סגולות) ב15 מ"ל או 50 צינורות חרוטי מ"ל. להלן, PEG ו DEX יתייחסו לPEG 35 kDa ו 500 דקס kDa, אולם ריכוזים קריטיים ישתנו בהתאם לשני הפולימרים המשמשים. רשום את המסה של PEG ו DEX בכל פתרון. פתרוני פולימר-ריכוז גבוה עשויים להימשך מספר שעות כדי להמס. Vortexing יכול לשמש לפתרוני סרום חינם. לתקשורת המכילה חלבונים או סרום, הנח את הצינורות על במה רועדת עד ששני פולימרי המסה מלאה. רשום את המשקל של חומרים המשמשים להמסה של הפולימרים ולרשום את הריכוזים הראשוניים.
- לאחר הפולימרים הם התמוססו באופן מלא, את הפתרונים שאמורים להופיע מעוננים. זה הסימן הראשון שהפרדת פאזות התרחשה. כדי לאשר זאת, לאפשרפתרוני פולימר למנוחה במצב אנכי בטמפרטורת חדר למשך 20 דקות. צנטריפוגה ב 1000 XG ניתן להשתמש כדי להאיץ את תהליך הפרדת פאזות. השלב התחתון יהיה צפוף יותר DEX עשיר והשלב העליון יהיה PEG עשיר.
- לאט להוסיף חיץ או מדיה נוסף לחצוצרות. מרווחים קטנים יש להשתמש כדי שלא לעבור את נקודת הפרדת פאזות.
- כאשר התמיסה מתבהרת וכבר לא מפרידה בין שלב שאחרי צנטריפוגה, הסף להפרדת פאזות כבר הגיע. רשום את המשקל הסופי של הצינור.
- שימוש במשקולות נרשמו הקודמות לפולימרים, יחד עם המשקל הסופי לאחר הוספת תקשורת, לקבוע wt% / wt של כל שני פולימרים שבהפרדת השלב כבר לא מתרחשת.
- עלילת ערכים אלה כ% PEG wt / wt על ציר y ו% wt / wt DEX על ציר x. עלילה זו, המכונית עקומה binodal, ניתן להשתמש בו כדי לקבוע את ריכוז הסף להפרדת פאזות לconcentrati השונהתוספות של PEG / DEX במדיום תרבות תאים ספציפיים.
2. תצורת 1: דפוסי הרחקה (96 גם פורמט פלייט)
- הכן את הפתרונים נפרדים של 5.0% wt / wt PEG ו 12.8% wt / wt DEX במדיום תרבות תא. השתמש בפתרוני ATPS של לפחות פעמים בנקודה הקריטית כדי להבטיח שATPS נשאר לאחר הפולימרים לאזן בכבוד זה לזה. יש כמות קטנה של שטף של DEX לשלב PEG העשיר ולהיפך, לכן, משום שעבד בסמוך לריכוז הקריטי יכול לגרום לאובדן של מערכת השלב כירידת ריכוזים מתחת לנקודה קריטית. כמו כן, העברת צלחת תרבית תאים לחממה ולחות הטמפרטורה מבוקרת יכולה לשנות את מאפייני שני שלבים ולבצע את שני פתרוני בליל. הערה: תאים מסוימים עשויים לתפקד טובים יותר עם ניסוחי ATPS אחרים. ניסוחים מקובלים עשויים להיות נבחרו בהתבסס על עקומות binodal נקבעו מהחלק 1.
- לקצור את התאים שישמשו להדרת פאטrning. קבע את המספר / ריכוז הכולל של תאים זמינים. אופציונלי: לתייג את התאים עם CellTracker או תוויות שאינן ציטוטוקסיות אחרות למיקרוסקופ פלואורסצנטי.
- גלולת התאים וresuspend הגלולה בנפח מתאים של 5.0% PEG כדי להשיג את המספר הרצוי של תאים להדרה. לדוגמה, אחד טוב של 96-צלחת גם דורש 37,500 תאי פיברובלסטים להיות resuspended ב200 μl של PEG לייצר מפגש ביום המחרת. הרחב את המספרים הללו כמתאימים לסוגי תאים אחרים וגדלי מצע תרבות.
- שימוש micropipettor, לוותר על 0.5 טיפי μl של DEX על מצע תרבית תאים יבש. טיפי נפח גדולות יותר לייצר אזורי הדרה גדולות יותר. טיפין החל בגודל 0.1 עד μl 1 מומלצות לmicropatterning הדרה. אופציונלי: טיפי דקס ניתן להפקיד 24 שעות לפני הזמן ואפשרו להתייבשות בטמפרטורת חדר. זה יכול לייצר דפוסים נקיים יותר.
- לוותר 200 μl של השעית תא PEG לתוך tהוא גם כדי לכסות את טיפי דקס.
- מקום בחממת humidified עבור 12 שעות על 37 מעלות צלזיוס, 5% CO 2. ודא כי הספלון אינו מוטה במהלך טיפול ושהוא נמצא על מדף חממת רמה, כדי למנוע שיבוש הדפוסים.
- הסר את פתרון PEG ולשטוף שלוש פעמים עם 200 μl של מדיום התרבות.
- הוסף מדיום התרבות טרי ולחזור לחממה.
- לפקח על התרבויות מעת לעת כדי לבחון תנועת תא לאזור ההרחקה.
3. תצורת 2: דפוסי איילנד (פורמט פלייט 96-היטב)
- הכן את הפתרונים של 5.0% wt / wt PEG ו 12.8% wt / wt DEX במדיום תרבות תא, כאמור לעיל.
- לקצור את התאים שישמש לדפוסי אי. קבע את המספר / ריכוז הכולל של תאים זמינים.
- הגלולה וresuspend התאים בנפח מתאים של 12.8% DEX כדי להשיג את הריכוז הרצוי של תאים עבור דפוסי אי. ריכוזים של 5000 לסה"נLLS / μl או פחות מומלץ לסוגי תאים מאוד חסידים. לתאים שיש להם קושי או תאים שמצרפים באופן רופף לדבוק, ריכוזים של עד 10,000 תאים / μl יכולים להיחשב.
- עובד במהירות כדי למנוע התייבשות, פיפטה μl 0.5 טיפין של DEX על מצע תרבית תאים יבש, כמתואר לעיל. אל תאפשר טיפין לייבוש. אופציונלי: 200 μl של פתרון PEG ניתן להוסיף גם לפני הזמן. טיפי דקס אז יכולות להיות מופקדות בפתרון PEG שם הם שוקעים לתחתית ולפנות שטח התרבות. זה יכול לייצר דפוסי אי נקיים יותר.
- לכסות את טיפי דקס עם 200 μl של PEG.
- מקום בחממת humidified עבור 12 שעות על 37 מעלות צלזיוס, 5% CO 2. ודא כי הספלון אינו מוטה במהלך טיפול ושהוא נמצא על מדף חממת רמה, כדי למנוע שיבוש הדפוסים.
- הסר את פתרון PEG ולשטוף שלוש פעמים עם 200 μl של מדיום התרבות.
- הוסף תרבות טריהבינוני ולחזור לחממה.
- לפקח על התרבויות מעת לעת כדי לבחון תנועת תא והחוצה הפצה מהאיים.
4. תצורה 3: הדרת עמיתים לתרבויות (פורמט פלייט 96-היטב)
- הכן את הפתרונים של 5.0% wt / wt PEG ו 12.8% wt / wt DEX במדיום תרבות תא, כאמור לעיל.
- לקצור את התאים שישמשו להדרה ודפוסי אי. קבע את המספר / ריכוז הכולל של תאים זמינים לכל סוג תא. אופציונלי: כמה זיווגים סלולריים עשויים להציג מדדי הפצה שונים באופן דרמטי. כדי למנוע את התאים שהוצאו מoverpopulating תאי דוגמת האי (במיוחד לתרבויות לטווח ארוכות), טיפול בתאים המשמשים להרחקה עם mitomycin צלזיוס במשך 2 שעות או להקרין אותם לפני הקציר. זה ימנע התפשטות. צבעי ניאון CellTracker יכולים לשמש כדי להבדיל בין שתי אוכלוסיות תאים במידת צורך.
- גלולת התאים וresuspend הגלולה לexclusion דפוסים בנפח מתאים של PEG 5.0% כדי להשיג את המספר הרצוי של תאים, כאמור לעיל. Resuspend הגלולה לדפוסי האי בנפח מתאים של 12.8% DEX כדי להשיג את הריכוז הרצוי של תאים, כאמור לעיל.
- שימוש micropipettor, לוותר על 0.5 טיפי μl של השעית תא DEX על מצע תרבית תאים יבש. אל תאפשר טיפין לייבוש.
- לכסות את טיפי דקס עם 200 μl של השעית תא PEG.
- מקום בחממת humidified עבור 12 שעות על 37 מעלות צלזיוס, 5% CO 2. ודא כי הספלון אינו מוטה במהלך טיפול ושהוא נמצא על מדף חממת רמה, כדי למנוע שיבוש הדפוסים.
- הסר את פתרון PEG ולשטוף שלוש פעמים ב200 μl של מדיום התרבות.
- הוסף מדיום התרבות טרי ולחזור לחממה.
- לנטר את העמיתים לתרבויות להתבונן אינטראקציה בין אוכלוסיות תאים. אופציונלית: בקרה יכולה להיות מוכנה על ידי ביצוע הרחקה או האי הדפוסים individually, על ידי תאי שיתוף התרבות שאינו מתקשרים או על ידי חסימת מסלולים של עניין אחד או שתי אוכלוסיות תאים לפני או אחרי הדפוסים.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
כדי לבחור שילוב מתאים של PEG ו DEX עבור דפוסי תא זה חשוב כדי לקבוע את עקומת binodal. עקומה זו משרטטת את הנקודות בן כ ATPS יכול להיוצר ויכול להשתנות לקבוצת נתונה של פולימרים המבוססות על הטמפרטורה, pH ותוכן יוני. לתאי culturing שדורשים ניסוחים בינוניים אישית ייתכן שיהיה צורך בניסוי כדי לקבוע את עקומת binodal. המטרה זו מושגת על ידי יצירת סדרה של ATPSs רחוק מbinodal ומשתנה בתוכן דקס PEG ו( איור 1, עיגולים סגולים). כאשר ATPS הוא הווה, את פתרוני הפולימר יופיעו מעוננים כאשר מערבבים ולאזן לשלבים נפרדים, אם שמאל באין מפריע. על ידי הוספה נוספת ממס לתערובת הפולימר, ATPS יפנה PEG 0% / 0% DEX. בשלב מסוים, התערובת לא תהיה עוד שלב נפרדת. ריכוז PEG / DEX בבו זה מתרחש מייצג נקודה בעקומת binodal; מעל לנקודת ATנ.ב. יכול להיוצר ומתחת אותו רגע בכלל לא יכול. העקומות באיור 1 מייצגות binodals לשלוש תקשורת סלולרית תרבות משותפת עם ובלי סרום שור עוברי (10% FBS). הריכוזים בי ATPS נוצר הם מעט גבוהים יותר בנוכחות FBS.
בדוחות הקודמים שלנו, השתמש ATPSs מבוסס על נקודה קריטית (נקודה על binodal שבנפחים שווים של צורת PEG ו DEX לאחר איזון) של 2.5% 35% kDa/3.2 PEG 500 kDa דקס. התוצאות מנתוני binodal נמצאות בסמיכות לשווי נקודה קריטית זו. בדקנו שילובי מערכת 9 שלב לדפוסים, כפי שמוצג בטבלת 1. מאז פתרונות טהורים של PEG ו DEX לאזן ביחס לריכוזי הפולימר שלהם לאחר שהם משולבים, חלק מהפתרונים הללו לא נוצר ATPSs היציב, ולכן לא היו שימושיים עבור דפוסים (לוח 1 א, סימני x). שילובי פולימר אחרים מיוצרים דפוסים מוכרים, אבל לא היו אחידים מספיק לניסויים (לוח 1 א x / ✓ סימנים). ניסוחי פולימר שימושיים נוצרים אזורי הדרה או איים שהיו כמעט נטולים תאים באזורים שאינן בדוגמת (הלוח 1 א, ✓ סימנים).
עם PEG 10%, שם לב שהמורפולוגיה של תאים חריגים הייתה עגולה וכישור כמו אחרי 24 שעות, עם תאים מציגים יכולת ירודה לצרף אל פני שטח התרבות (לוח 1, סימני x). מורפולוגיה ומצורפת היו רגילות ל2.5% ו 5% PEG (לוח 1, ✓ סימנים). הבחנו כי זרז סרום מהתרבות הבינונית בריכוזים גבוהים PEG (הלוח 1 ג, סימני x), טוען כי מורפולוגיה תקינה של תאים ומצורפים בPEG 10% עשויות להיות קשורה לבעיות עם גישת סרום. בנוסף, PEG ידוע לשבש קרום פלזמה 27. למרות השפעות אלו נצפו רק בריכוזים גבוהים של mol הנמוךPEG המשקל ecular, הדרך טובה ביותר הוא להשתמש בריכוז הנמוך ביותר PEG שמייצר דפוסים אמינים.
עולה בקנה אחד עם הדיווחים הקודמים שלנו, הגיע למסקנה כי 5% PEG/6.4% DEX ו 5% PEG/12.8% DEX היו גם מתאים לדפוסי תא, עם 12.8% DEX לייצר דפוסים אחידים יותר. תוצאות צפויות לשלושה פורמטי דפוסים באמצעות סלולרי Tracker שכותרתו תאי הלה מוצגים באיור 2. על ידי ביצוע כל גישת דפוסים, ניתן ליצור דפוסים אחידים של כל סוג, עם מעט מאוד תאים שמחוץ לאזורי הדוגמת.
באמצעות הדרה ודפוסי אי זה ניתן להעריך את השגשוג והנדידה של תאים בדוגמת (איור 3). במשך שלושה ימים, תאי הלה מלאו את אזורי ההדרה (איורי 3 א, ג). תאי האי בדוגמת התרחבו החוצה מהדפוסים הראשוניים (איורי 3d-f). שינויים אלו ניתן לכמת באמצעותכלים הסטנדרטיים imageJ מדידה (איורים 3 ג, ו). חשוב לציין כי כאשר אוכלוסיות תאים מרובות הן שיתוף תרבותיות (איור 2, עיצוב 3), אוכלוסיית תא אחד עלולה מחוץ להתרבות ולהחליף את השני. דפוסי הדרה ודפוסי אי יכולים להיות כלי שימושי כדי להעריך אם זו תהיה בעיה. במצבים בם הבדלים דרמטיים במדד שגשוג מתרחשים, מומלץ שאוכלוסיית תא אחד להיות מטופלים על ידי גורמי קרינה או כימיים להגביל ההתפשטות שלה. זה שימושי במיוחד במצבים בם סוג תא אחד משמש כתא תמיכה בסוג תא איטי גובר רגיש יותר.
אנחנו הדגמנו את העיקרון הזה על ידי HepG2 תאי culturing, קו תא סרטן כבד שמשמש בדרך כלל לביולוגית hepatocyte מודל, עם פיברובלסטים 3T3 NIH שנעצרו באמצעות mitomycin C (איור 4). במשך זמן, את תאי HepG2 לשמור הלוקליזציהצורת המושבה ד (איור 4 א). על ידי נחת רבות טיפין באותה הצלחת ומקיפה אותם עם fibroblasts ניתן לגדל תאים אלה בתבנית שעשויה להיות שימושי ללימודי multiplexed (איור 4 ב). monocultures הסלולרי האי ניתן להשתמש בפורמט זה כביקורת על השפעת גורמי paracrine (איור 4 ג').
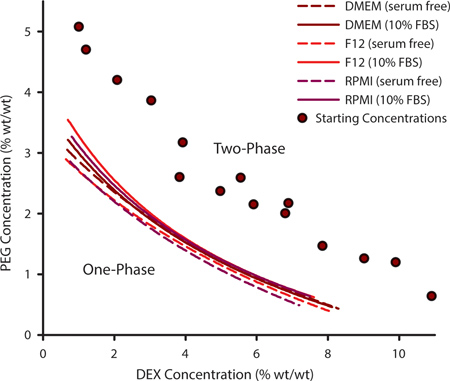
איור 1. ריכוזי הפולימר שבו כ ATPS יכול להיוצר ניתן להסיק מעקומות binodal נקבעו באופן ניסיוני. עקומת binodal זה נבנה בשיטת נקודת הענן על ידי הוספת ממס נוסף כדי למדוד את הנקודות בן תערובות של ריכוזים שונים PEG / DEX שני שלבים (הסגולות חוגים) כבר לא היו מסוגלים לשלב separating. Binodals נקבע לDMEM, F12 וRPMI עם וללא סרום. נקודתי נתונים היו מצוידות בפונקציה רציונלית 3 פרמטרים. N = 3 עבור כל נקודת נתונים.

איור 2. על ידי מחלק פתרוני ATPS על צלחות קלקר, שלושה פורמטים לדפוסי תא יכולים להיות מיוצר. ההליך מתחיל על ידי pipetting דקס טיפין) אז שהם מצופים עם PEG ב). ברגע שהתאים לצרף את פתרוני ATPS יכולים להיות נשטפו והוחלפו במדיום התרבות (ג, ד). תמונות פלואורסצנציה לmonocultures הוכתמו צבעי CellTracker אחרי דפוסים. לעמיתים לתרבויות, תאים הוכתמו בנפרד עם צבעי CellTracker לפני הדפוסים. תאי הלה שמשו כדי לייצר את כל שלושת פורמטי התרבות. 
איור 3. דפוסי הדרה ודפוסי אי ניתן להשתמש כדי להעריך את נדידת תאים והתרבות. תאים) הכללת דוגמת הלה 1 יום אחרי דפוסים. ב) תאי הכללת דוגמת הלה 3 ימים לאחר דפוסים. ג) תאים להתרבות ולהעביר, צמצום משמעותי בגודל של אזור הרחקה. ד) תאי הלה איילנד בדוגמת יום 1 אחרי דפוסים. ה) תאי האי בדוגמת הלה 3 ימים לאחר דפוסים. ו) תאים להתרבות ולהעביר החוצה, הרחיבו באופן משמעותי את גודלו של האי. תמונות היו לכמת באמצעות תוכנת ImageJ למדוד סליקה הסלולרית ואזורי אי סלולרי לפני ואחרי ההגירה. ברים מייצגים מתכוונים± SEM של לפחות שלוש תצפיות עצמאיות.

איור 4. תרביות תאי כבד / פיברובלסטים יכולות להיות שנוצרו באמצעות דפוסי הדרת ATPS שיתוף תרבות.) מושבות אלה לשמור על הארגון שלהם לפחות 4 ימים בתרבות. ב) איים מרובים ניתן ערוכים במנה אחת עם פוטנציאל לmultiplexed או תפוקה גבוהה מבחנים. ג) בהשוואה לדפוסי אי אינו שותף בתרבית, תאים בתרבית שיתוף להציג רמות מעט גבוהות יותר של ייצור אלבומין (כתמים חומים) כפי שעולים מהשוואה איכותית של מוכתם עמיתים לתרבויות לעומת monocultures אלבומין. אלבומין הוא חלבון המיוצר על ידי תאים כבדים. לכן, תוצאה זו מצביעה על כך שהתפקוד של תאי כבדו גובר כאשר משותף עם תרבית-פיברובלסטים באמצעות ATPS.
| א) תבנית נוצרה | DEX 3.2% | DEX 6.4% | 12.8% DEX |
| PEG 2.5% | x | x | x |
| PEG 5.0% | x / ✓ | ✓ | ✓ |
| PEG 10.0% | x / ✓ | ✓ | ✓ |
| ב) מורפולוגיה | DEX 3.2% | DEX 6.4% | 12.8% DEX |
| PEG 2.5% | ✓ | ✓ | ✓ |
| PEG 5.0% | ✓ | ✓ | & # X2713; |
| PEG 10.0% | x | x | x |
| ג) רטיבות סרום | DEX 3.2% | DEX 6.4% | 12.8% DEX |
| PEG 2.5% | ✓ | ✓ | ✓ |
| PEG 5.0% | ✓ | ✓ | ✓ |
| PEG 10.0% | x | x | x |
טבלה 1. א) ניסוחי ATPS שיכולים לשמש עבור דפוסים מסומנים על ידי סימני ביקורת, אלה שלא יכולים מסומנים על ידי סימני x. ב) ניסוחים השומרים על מורפולוגיה של תאים נורמליות ומאפיינים מצורפים מסומנים בסימני y סימון, אלה שלא יכולים מסומנים על ידי סימני x. ג) ניסוחים שגרמו למשקעים של חלבוני סרום מסומנים על ידי סימני x.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
שיטת micropatterning תא ATPS דורשת מומחיות מעט מאוד מעבר למיומנות בטכניקות תרביות תאים וניתן לשלוט במהירות. היתרונות של גישה זו הם שהוא זול, מהיר ותואם עם מגוון רחב של סוגי תאים ותבניות תרבות. מסיבות אלה, הפרוטוקול שלנו יש לאמץ בקלות על ידי מדעני חיים, במיוחד אלה שלומדים התפשטות תאים, הגירה וchemotaxis, ואת ההשפעה של אינטראקציות juxtacrine ואוטוקריני בין אוכלוסיות תאים. המבחנים שהוצגו כאן ניתן לכמת בקלות ברמת אוכלוסיית התא באמצעות נהלי ניתוח תמונה סטנדרטיות, זמינים בתוכנות כגון ImageJ.
כדי ליצור דפוסים עקביים, אנו ממליצים על אמצעי הזהירות הבא. ראשית, קצה פיפטה משמש לוותר פתרון DEX צריך להיות שונה לאחר כל טיפת DEX מופקדת לספק כרכי רביב עקביים יותר. מאז פתרון DEX הוא יחסית צמיג, חשוב גם להימנע מהפקדת DEX העודף שעשויה להיות על פני השטח החיצוניים של קצה פיפטה ועל מנת להבטיח שכל הנפח של יציאות דקס הקצה. שנית, את הטיפין יכולות לעבור אם PEG מתווסף נמרץ מדי, או אם המנה היא מוטה. שיבוש DEX ניתן למזער על ידי שמירה על הצלחת על משטח ישר ומאפשר פתרון PEG כדי לכסות את הטיפין מלמעלה בהדרגה מבלי לאפשר כוחות גדולים של PEG המניסקוס כדי לסלק חלק של רביב. שיבוש אגל מתרחש בתדירות גבוהה יותר עם טיפי דקס גדולות, ולכן יש להשתמש בטיפין של 0.5 μl פחות או אם זה אפשרי. מלבד הבעיות הטכניות אלה כרוכים בזה שהנפיק את הפתרונים, יש מעט מאוד חסרונות הקשורים בטכניקה זו, ובלבד שמשקלים מתאימים פולימר מולקולריים וריכוזים משמשים.
למרות שדפוסי ATPS ניתן לבצע בקלות באמצעות micropipette (כפי שהוצג כאן), יש מגוון רחב של sophi יותרגישות sticated שניתן להשתמש בם במהירות, כדי ליצור דפוסים של מערכים גיאומטריים מורכבים יותר (למשל רובוטים נוזליים לטיפול ולפליטת האגל אקוסטי), כפי שהוצגו במחקרים הקודמים שלנו 14, 15, 20. אפשר גם לייצר טיפי דקס שהם הרבה יותר קטנים בנפח של DEX פניאומטית ולהוציא דרך פתחי נימים או על ידי actuating פתח בmicrochannel לייצר טיפי דקס זורמים עטופות על ידי PEG 19. גישות אלה עשויות להיות עניין עבור אלו המבקשים לייצר שיתוף תרבות או הגירת מבחני תפוקה גבוהה או multiplexed. בנוסף, שימוש בגישות microfluidic, ניתן לבצע ניסויים עם מספר קטן של תאים, או עם תאים בmicrochannel שם ניתן לבחון את ההשפעות של זרימה ונוזל שקוף. עם זאת, שיטות מתקדמות אלה אינן נדרשות עבור רוב היישומים.
דפוסי שתי שכבות מימיים של תאים הם פשוטים ומותאם בקלות לתא טיפוסיהגדרת התרבות. שיטה זו מאפשרת לכל חוקר עם גישה למעבדה טיפוסית תא תרבות (גישה למכסה מנוע, CO 2 חממה, וmicropipettes) ופולימרים הנ"ל לreproducibly תאי דפוס בmonoculture ושיתוף תרבות. המעבדה שלנו הוכיחה יכולת זו על ידי הדפסת מערכים של תאים ללמוד נדידת תאים בבדיקת ריפוי פצע ולבחון את ההשפעות של איתות juxtacrine ואוטוקריני בהתמיינות של תאים עובריים 16, 17, 20. שיטות אחרות, כולל דפוסים של 28 מטריקס, הדפסת דיו 29, ודפוסים של זרימה למינרית במכשירי microfluidic 25, 26 להשתמש גם בתאים בתרגום. שיטות אחרות אלה הן גישות יעילות להשגת דפוסים מוגדרים של תאים, ולעתים קרובות ניתן להשיג דיוק מתא בודד. עם זאת, שיטות אלה גם דורשות ציוד ו /-מאוד מיוחד או גישה למתקני cleanroom לפברק את החותמות ששמשו ליחסי הציבורחלבונים תאיים int matrix או מייצרים מכשירים מיקרופלואידיקה. הקשר שלהם לספקי כוח, משאבות מזרק, ורכיבים חיצוניים אחרים גם מעכב את יישומן בשל עלויות הקשורות לציוד ומיומנות משתמש הדרוש להפעלתו.
במונחים של יישומים עתידיים אנו מצפים שהשיטה שלנו תהיה שימושית עבור פיתוח מערכות תרבות המאפשרות ניתוח תפוקה גבוהה של תנועת תא והתפשטותו, כמו גם אינטראקציות תא סלולארי חקירה בין אוכלוסיות תאים מרובות. לנקודה זו, הדוחות שלנו התמקדו בבדיקת אינטראקציה של רק כמה סוגים של תאים בדוגמת בבת אחת. עם זאת, ניתן לשער כי אוכלוסיות רבות של תאים יכולות להיות מתורבתות בשכבת מזין משותפת כדי לחקור את ההשפעה של איתות paracrine וjuxtacrine של סוגי תאים רבים גדלו יחד בהגדרת תרבות תא בודדה. לוקליזציה המרחבית לבסוף, יישומי הנדסת רקמות נדרשים לעתים קרובות שלאחד או יותר סוגי תאים. ייתכן שניתן יהיה להתאים את הטכניקה שלנו לשימוש בתאי דפוסים כדי לייצר יותר דגמי מחלות פיסיולוגיות מהונדסים רלוונטיים רקמות או תאים לדפוס על חומרים מושתלים ליישומים קליניים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים לא היו מתחרים אינטרסים כספיים.
Acknowledgments
עבודה זו נתמכה על ידי קרן קולטר, Beyster הקרן, הזדמנות מחקר לתואר הראשון (UROP) תכנית הקיץ לATA וקרן מדע בוגר תלמיד מחקר מלגה לאומית (גרנט לא dge 0718128; ID:. 2010101926) לJBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



