Summary
Vandige tofasesystemer blev anvendt til samtidigt mønster flere populationer af celler. Denne hurtig og nem fremgangsmåde til celle-mønsterdannelse udnytter faseseparation af vandige opløsninger af dextran og polyethylenglycol og grænsefladespændingen, der eksisterer mellem de to polymeropløsninger.
Abstract
Cell mønster teknologier, der er hurtig, nem at bruge og økonomisk overkommelig vil være nødvendige for den fremtidige udvikling af high throughput celleassays, platforme for at studere celle-celle interaktioner og manipuleret væv systemer. Denne detaljeret protokol beskriver en fremgangsmåde til generering af co-kulturer af celler under anvendelse af biokompatible opløsninger af dextran (DEX) og polyethylenglycol (PEG), at fase-adskilt ved kombination ovenfor tærskelkoncentrationer. Celler kan mønstret i en række forskellige konfigurationer på denne måde. Cell udelukkelse mønsterdannelse kan udføres ved at udskrive dråber af DEX på et substrat og dække dem med en opløsning af PEG, der indeholder celler. Den interfaciale spænding dannet mellem de to polymeropløsninger får cellerne til at falde omkring ydersiden af DEX dråbe og danner en cirkulær clearing, der kan anvendes til migration assays. Celle øer kan være mønstret ved at dispensere en celle-rige DEX fase i en PEG-opløsning eller ved at dække DEXdråbe med en opløsning af PEG. Co-kulturer kan dannes direkte ved at kombinere celle udelukkelse med DEX ø mønsterdannelse. Disse fremgangsmåder er kompatible med en række væskehåndteringssystemer fremgangsmåder, herunder manuelle micropipetting, og kan anvendes med praktisk talt enhver adhærent celletype.
Introduction
Vandige tofasesystemer (ATPSs) form, når opløsninger af to uforenelige polymerer blandes sammen ved tilstrækkeligt høje koncentrationer. Faseseparation påvirkes af en række faktorer, der omfatter den molekylære vægt og polaritet af polymererne, temperatur af opløsninger, pH og ionisk indhold af det vandige opløsningsmiddel 1, 2. Det punkt, hvor de to polymeropløsninger separate bestemmes af de fysisk-kemiske egenskaber af den valgte fase system, men generelt ved lave polymerkoncentrationer (mindre end 20% vægt / vægt) under ikke-denaturerende betingelser, således ATPSs skal anvendes til bioteknologiske applikationer 3-9.
Langt de mest ekstensivt undersøgte ATPS er polyethylenglycol (PEG) / dextran (DEX) system. De ATPS dannet af disse billige og biokompatible polymerer blev oprindeligt beskrevet til oprensning af biomolekyler ved hjælp af molekylær opdeling 2, 10. Partitioneringopstår, når flere molekyler eller partikler, der ikke bidrager til fasesystemet blandes med PEG og DEX. Baseret på deres relative affiniteter for enten DEX eller PEG, vil molekylerne eller partiklerne fortrinsvis ligge i én af de to faser eller ved grænsefladen. En anden egenskab af PEG / dex ATPS er eksistensen af grænsefladespændingen mellem de to polymerfaser. ATPSs dannet af PEG og DEX generelt udviser grænsefladespændinger, der er meget lavere end andre væske-væske tofasesystemer såsom olie og vand, men de grænsefladespændingsegenskaber kræfter stadig udøver virkninger på små partikler, såsom vira, celler og proteinaggregater 2 , 11-13. Endelig, da højere molekylvægt PEG og DEX adskilt ved lave koncentrationer (mindre end 5% vægt / vægt til polymerer med høj molekylvægt sorter) i nærvær af fysiologiske koncentrationer af salte, er der få eller ingen skadelige virkninger på pattedyrceller inkorporeret i disse systemer14-16.
For nylig har de grænsefladeegenskaber og adskillelser virkninger ATPSs blevet anvendt af vores laboratorium for celle mønster 14, 16-20. Dette blev opnået ved micropatterning en tættere DEX løsning på cellekultur-substrater i nærvær af PEG. Når celler inkorporeres i PEG-fasen, udelades de fra indtaste DEX smådråber på grund af PEG / dex-grænsefladespænding 20. Når cellerne er mønstret i DEX fase, er de tilbageholdes på overfladen af cellekulturen substratet ved grænsefladespænding og opdeling 16, 17, 19.
I modsætning til andre fremgangsmåder til celle-mønster, er ATPS celle mønsterdannelse let at lære og kræver kun rudimentært kendskab polymererne selv, og evnen til at udføre cellekultur og bruge en mikropipette. Andre metoder til celle mønster ofte involverer specialiseret udstyr og uddannelse, som ikke let oversættes til the biovidenskab. Fx. Nogle metoder (microcontact trykning eller inkjet-trykning) mønster celler indirekte ved at anvende mønstre af celleadhæsive biomolekyler til et dyrkningssubstrat, der efterfølgende virke som steder for cellebinding 21, 22 Indirekte fremgangsmåder er anvendelige til visse celletyper, der kræver en høj grad af brugerens dygtighed og specialiseret udstyr til fremstilling af mønstret værktøjet, og kan mangle specificitet afhængigt af den særlige celletype / biomolekyle mønster. Alternativt kan celler deponeres med høje mønster specificitet i form af direkte mønsterdannende fremgangsmåder, der omfatter laminar strømning mønster, stenciling og inkjetprint 23-26. Men disse teknikker også kræve brugerens ekspertise og specialudstyr, og du kan beskadige celler under udskrivningen. Selv om disse tiltag generelt producere præcise mønstre af celler, til celle mønster at være et nyttigt redskab i biovidenskab, skal det være omkostningseffektivt ennd enkel at anvende.
Her rapporterer vi en detaljeret protokol til at generere mønstrede cellekulturer ved hjælp af de ATPSs beskrevet i vores tidligere offentliggjorte ansøgninger. Brug kun micropipettors, kan brugerne generere celle eksklusionszoner eller celle øer for migration assays. Dette opnås ved hjælp af PEG / dex-grænsefladespænding, der enten bibeholder cellerne i DEX fase eller udelukker celler deponeret i PEG-fasen fra DEX. Ved at kombinere disse to grundlæggende mønsterdannende teknikker, er det muligt at hurtigt frembringe co-kulturer af celler, såsom lever-fibroblast-celler co-kulturer. Mønsterdannende metoder, ATP parametre og forventede resultater er beskrevet i detaljer.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Fase System Karakterisering: beslutte Tærskelværdier for faseseparation
- Fremstille opløsninger indeholdende PEG og DEX i den ønskede puffer eller celledyrkningsmedium som vist i figur 1 (lilla prikker) i 15 ml eller 50 ml koniske rør. Herefter vil PEG og DEX henvise til 35 kDa PEG og 500 kDa DEX, men vil kritiske koncentrationer ændres afhængigt af de to anvendte polymerer. Optag massen af PEG og DEX i hver opløsning. Høj koncentration polymeropløsninger kan tage flere timer at opløse. Vortexing kan anvendes til serumfrie løsninger. For medier, der indeholder proteiner eller serum, skal du placere rørene på en vuggende scene indtil begge polymerer er helt opløst. Man noterer vægten af de medier, der anvendes til at opløse polymererne og notere sig de oprindelige koncentrationer.
- Når polymererne er fuldt opløst, bør de løsninger forekomme uklar. Dette er den første indikation af, at sket en faseseparation. For at bekræfte dette, tilladerpolymeropløsninger til hvile i en lodret position ved stuetemperatur i 20 min. Centrifugering ved 1.000 x g kan anvendes til at fremskynde faseseparation processen. Jo tættere bund fase vil være DEX-rige og den øverste fase vil være PEG-rig.
- Langsomt tilsætte yderligere puffer eller medier til rørene. Små trin bør anvendes for ikke at overstige faseseparationen punkt.
- Når opløsningen bliver klar og ikke længere fase-separerer efter centrifugering, er grænsen for faseseparation nået. Optag den endelige vægt af røret.
- Ved hjælp af de tidligere registrerede vægte for polymererne sammen med slutvægt efter tilsætning medier,% vægt / vægt af hver af de to polymerer, hvor faseseparation ikke længere forekommer bestemme.
- Afbilde disse værdier i% vægt / vægt PEG på y-aksen og% vægt / vægt DEX på x-aksen. Dette plot, kendt som binodal kurve, kan anvendes til at bestemme den tærskelkoncentration til faseseparation af forskellige concentrations af PEG / dex i et bestemt celledyrkningsmedium.
2. Konfiguration 1: Udelukkelse Patterning (96-brønds pladeformat)
- Fremstille separate opløsninger af 5,0% vægt / vægt PEG og 12,8% vægt / vægt DEX i celledyrkningsmedium. Anvender ATP opløsninger af mindst to gange det kritiske punkt for at sikre, at en ATPS tilbage efter polymererne ækvilibrere i forhold til hinanden. Der er en lille mængde flux af DEX til PEG-rige fase og omvendt derfor arbejder også nær den kritiske koncentration kan resultere i tab af fasesystemet som koncentrationer falder under kritiske punkt. Ligeledes kan overførsel af cellekulturen skålen til en fugt-og temperaturreguleret inkubator ændre de tofasede egenskaber og gøre de to opløsninger blandes. Bemærk: Nogle celler kan klare sig bedre med andre ATP formuleringer. Acceptable formuleringer kan udvælges baseret på de binodal kurver bestemmes af del 1.
- Høste cellerne, der skal anvendes til udstødelse patterning. Bestemme det samlede antal / koncentration af celler til rådighed. Valgfrit: mærke cellerne med CellTracker eller andre ikke-cytotoksiske etiketter til fluorescensmikroskopi.
- Pelletere cellerne, og pellet resuspenderes i et passende volumen af 5,0% PEG for at opnå det ønskede antal celler til udstødelse. For eksempel kræver en brønd i en plade med 96 brønde 37500 fibroblastceller, der skal resuspenderet i 200 pi af PEG til fremstilling konfluens den følgende dag. Skalere disse numre er relevant for andre celletyper og Kultursubstrat størrelser.
- Under anvendelse af en mikropipette, dispensere 0,5 gl dråber af DEX på en tør cellekultur substrat. Større volumen dråber producerer større eksklusionszoner. Dråber spænder i størrelse fra 0,1 til 1 pi anbefales til udelukkelse micropatterning. Valgfrit: DEX smådråber kan deponeres 24 timer forud for tid og fik lov til at dehydrere ved stuetemperatur. Dette kan frembringe renere mønstre.
- Dispensér 200 pi af PEG cellesuspension i than godt til at dække de DEX dråber.
- Sted i en befugtet inkubator i 12 timer ved 37 ° C, 5% CO2. Sørg for, at skålen ikke er vippet under håndtering og at den er placeret på et niveau inkubator hylde for at undgå at forstyrre de mønstre.
- Fjern PEG-opløsningen og vaskes tre gange med 200 pi af dyrkningsmedium.
- Tilsættes frisk dyrkningsmedium og vende tilbage til inkubatoren.
- Overvåg kulturerne jævne mellemrum for at observere celle bevægelse ind i udelukkelse zone.
3. Konfiguration 2: Island Patterning (96-brønds pladeformat)
- Fremstille opløsninger af 5,0% vægt / vægt PEG og 12,8% vægt / vægt DEX i cellekulturmedium, som ovenfor.
- Høste cellerne, der skal anvendes til ø-mønsterdannelse. Bestemme det samlede antal / koncentration af celler til rådighed.
- Pellet og resuspender cellerne i et passende volumen af 12,8% DEX at opnå den ønskede koncentration af celler til ø-mønsterdannelse. Koncentrationer på 5.000 ceLLS / ul eller mindre anbefales til stærkt klæbende celletyper. For celler, der har svært ved fastgøre eller celler, der løst klæber, koncentrationer op til 10.000 celler / gl kan overvejes.
- Arbejder hurtigt for at undgå tørring, pipetteres 0,5 gl dråber af DEX på en tør cellekultur substrat, som beskrevet ovenfor. Ikke tillader smådråber tørre. Valgfrit: 200 pi af PEG-opløsning kan sættes til i god tid. DEX dråber kan derefter deponeres i PEG-opløsningen, hvor de vil synke til bunds og kontakte kulturen overflade. Dette kan producere renere ø mønstre.
- Dække DEX smådråberne med 200 pi PEG.
- Sted i en befugtet inkubator i 12 timer ved 37 ° C, 5% CO2. Sørg for, at skålen ikke er vippet under håndtering og at den er placeret på et niveau inkubator hylde for at undgå at forstyrre de mønstre.
- Fjern PEG-opløsningen og vaskes tre gange med 200 pi af dyrkningsmedium.
- Tilføj frisk kulturmedium og vende tilbage til inkubatoren.
- Overvåg kulturerne jævne mellemrum for at observere celle bevægelse og spredning udad fra øerne.
4. Konfiguration 3: Udelukkelse co-kulturer (96-brønds pladeformat)
- Fremstille opløsninger af 5,0% vægt / vægt PEG og 12,8% vægt / vægt DEX i cellekulturmedium, som ovenfor.
- Høste celler, der skal anvendes til udstødelse og ø-mønster. Bestemme det samlede antal / koncentration af celler til rådighed for hver celletype. Valgfrit: Nogle celle bindinger kan vise dramatisk forskellige spredning indeks. For at forhindre de udelukkede celler fra overbefolker øen mønstrede celler (især for langsigtede kulturer), behandle de celler, der anvendes til udelukkelse med mitomycin C i 2 timer eller bestråle dem før høst. Dette vil forhindre spredning. Fluorescerende CellTracker farvestoffer kan anvendes til at skelne mellem de to cellepopulationer om nødvendigt.
- Pelletere cellerne, og pellet resuspenderes i exclusion mønsterdannelse i et passende volumen 5,0% PEG for at opnå det ønskede antal celler, som ovenfor. Pelleten resuspenderes til ø-mønsterdannelse i et passende volumen af 12,8% DEX at opnå den ønskede koncentration af celler, som ovenfor.
- Under anvendelse af en mikropipette, dispensere 0,5 gl dråber af DEX cellesuspension på en tør cellekultur substrat. Ikke tillader smådråber tørre.
- Dække DEX smådråberne med 200 pi PEG cellesuspension.
- Sted i en befugtet inkubator i 12 timer ved 37 ° C, 5% CO2. Sørg for, at skålen ikke er vippet under håndtering og at den er placeret på et niveau inkubator hylde for at undgå at forstyrre de mønstre.
- Fjern PEG-opløsningen og vaskes tre gange i 200 pi kulturmedium.
- Tilsættes frisk dyrkningsmedium og vende tilbage til inkubatoren.
- Overvåg co-kulturer at observere samspillet mellem cellepopulationer. Valgfrit: Kontrol kan fremstilles ved at udføre udelukkelse eller ø mønster individually, ved co-dyrkning af celler, der ikke vekselvirker eller ved at blokere veje af interesse i en eller begge cellepopulationer før eller efter mønsterdannelse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
For at vælge en passende kombination af PEG og DEX for celle mønster, er det vigtigt at bestemme binodal kurve. Denne kurve skildrer de punkter, hvor en ATPS kan dannes og kan variere for et givet sæt af polymerer baseret på temperatur, pH og ionisk indhold. Til dyrkning af celler, der kræver tilpassede medium formuleringer kan det være nødvendigt at eksperimentelt bestemme binodal kurve. Dette opnås ved at generere en række ATPSs som er langt fra binodal og varierende i deres PEG og DEX indhold (figur 1, lilla cirkler). Når en ATPS er til stede, vil de polymeropløsninger synes uklar ved blanding og vil ækvilibrere i separate faser, hvis venstre uforstyrret. Ved tilsætning af yderligere opløsningsmiddel til polymerblandingen, vil ATPS nærme sig 0% PEG / 0% DEX. På et tidspunkt vil blandingen ikke længere faseseparere. PEG / dex koncentration, ved hvilken dette sker er et punkt på binodal kurven, over dette punkt en ATPS kan danne og under dette punkt kan det ikke. Kurverne i figur 1 repræsenterer binodals for tre almindelige celledyrkningsmedier med og uden 10% føtalt bovint serum (FBS). De koncentrationer, ved hvilke en ATPS dannes er en smule højere i nærvær af FBS.
I vores tidligere betænkninger, brugte vi ATPSs baseret på et kritisk punkt (det punkt på binodal, hvor lige store volumener af PEG og DEX form efter ækvilibrering) på 2,5% PEG 35 kDa/3.2% DEX 500 kDa. Resultaterne fra vores binodal data er i tæt nærhed til dette kritiske punkt værdi. Vi testede ni fasesystem kombinationer til mønsterdannelse, som vist i tabel 1. Da rene opløsninger af PEG og DEX ligevægt med hensyn til deres polymerkoncentrationer efter de er kombineret, har nogle af disse løsninger ikke danne stabile ATPSs, og var derfor ikke anvendelig til mønsterdannelse (tabel 1a, x-mærker). Andre polymerkombinationer fremstillet genkendelige mønstre, Men var ikke ensartet nok til eksperimenter (tabel 1a x / ✓ mærker). Nyttige polymerformuleringer dannede eksklusionszoner eller øer, der var næsten blottet for celler i de ikke-mønstrede regioner (tabel 1a, ✓ mærker).
Med 10% PEG bemærkede vi, at cellemorfologien var unormalt rund og spindel-lignende efter 24 timer, med celler viser en formindsket evne til at knytte til den kultur overflade (tabel 1b x-mærker). Morfologi og fastgørelse var normal for 2,5% og 5% PEG (tabel 1b ✓ varemærker). Vi observerede, at serum præcipiterede fra dyrkningsmediet ved høje PEG-koncentrationer (tabel 1c, x-mærker), hvilket antyder, at unormal celle morfologi og fastgørelse i 10% PEG kan være forbundet med problemer med serum adgang. Derudover er PEG kendt for at forstyrre plasmamembraner 27. Selv om disse virkninger kun observeres ved høje koncentrationer af lav molecular vægt PEG, er det bedst at bruge den laveste PEG-koncentration, der producerer pålidelig mønster.
I overensstemmelse med vores tidligere rapporter, konkluderede vi, at 5% PEG/6.4% DEX og 5% PEG/12.8% DEX godt passede til celle mønster, med 12,8% DEX producere mere ensartede mønstre. Forventede resultater for tre mønsterdannende formater ved hjælp Cell Tracker-mærkede HeLa-celler er vist i figur 2. Ved at følge hvert mønster fremgangsmåde er det muligt at tilvejebringe ensartede mønstre af hver type, med meget få celler uden for de mønstrede områder.
Brug af udstødelse og ø mønster er det muligt at vurdere proliferation og migrering af mønstrede celler (Figur 3). I løbet af tre dage, fyldte HeLa-celler det lukkede område (3a-c). Ø-mønstrede celler ekspanderes udad fra de første mønster (fig. 3d-f). Disse ændringer kan kvantificeres ved anvendelse afstandard imageJ måleværktøjer (fig. 3 c, f). Det er vigtigt at bemærke, at når flere cellepopulationer dyrkes sammen (figur 2, type 3), kan en cellepopulation ud-proliferere og erstatte den anden. Udelukkelse mønster og ø mønster kan være nyttige værktøjer til at vurdere, om dette vil være et problem. I situationer, hvor dramatiske forskelle i proliferation index forekommer, anbefales det, at en cellepopulation blive behandlet ved bestråling eller kemiske faktorer begrænse dets proliferation. Dette er især nyttigt i situationer, hvor en celletype anvendes som en bærecelle til en langsommere voksende mere følsom celletype.
Vi demonstrerede princippet ved dyrkning af HepG2-celler, et hepatocellulært carcinom cellelinje, der er almindeligt anvendt til model hepatocyt biologi, med NIH 3T3-fibroblast, der blev standset ved hjælp af mitomycin C (figur 4). Over tid, opretholde HepG2-celler deres lokalisering af end koloni form (figur 4a). Ved at placere mange smådråber i den samme plade og omgiver dem med fibroblaster er det muligt at dyrke disse celler i et format, der er potentielt anvendelige til multipleksede undersøgelser (figur 4b). Cell ø monokulturer kan anvendes med dette format som en kontrol for indflydelsen af parakrine faktorer (figur 4c).
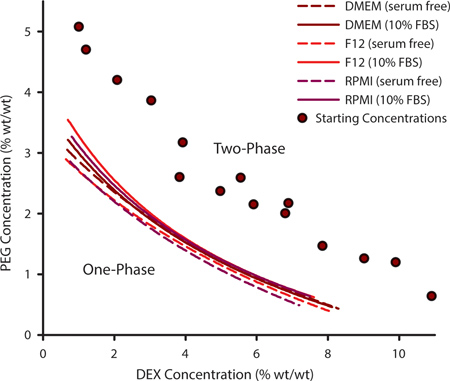
Figur 1. De polymerkoncentrationer, hvor en ATPS kan danne kan ekstrapoleres fra eksperimentelt bestemte binodal kurver. Denne binodal kurve blev konstrueret ved anvendelse uklarhedspunktet fremgangsmåde ved tilsætning af yderligere opløsningsmiddel for at måle de punkter, hvor tofasede blandinger af varierende PEG / dex-koncentrationer (lilla cirkler) ikke længere var i stand til fase separating. Binodals blev bestemt for DMEM, F12 og RPMI med og uden serum. Datapunkter blev udstyret med en tre parameter rationel funktion. N = 3 for hvert datapunkt.

Figur 2. Ved afgivelse ATPS løsninger på polystyrenplader kan tre formater for celle mønsterdannelse fremstilles. Proceduren begynder ved pipettering DEX dråber a), som derefter overtrukket med PEG b). Når cellerne vedhæfte, kan ATP opløsninger vaskes væk og erstattes med dyrkningsmedium (c, d). Fluorescens billeder til monokulturer blev farvet med CellTracker farvestoffer efter mønster. For co-kulturer blev celler farvet separat med CellTracker farvestoffer før mønster. HeLa-celler blev anvendt til at generere alle tre kultur formater. 
Figur 3. Udstødelse mønsterdannelse og ø-mønsterdannelse kan anvendes til at vurdere cellemigration og proliferation. A) Udelukkelseskriterier mønstrede HeLa-celler 1 dag efter mønsterdannelse. B) Udelukkelseskriterier mønstrede HeLa-celler 3 dage efter mønsterdannelse. C) Celler prolifererer og migrerer, hvilket reducerer størrelsen af udelukkelse zone. d) Island-mønstrede HeLa-celler 1 dag efter mønster. e) Island-mønstrede HeLa-celler 3 dage efter mønster. f) Celler deler sig og migrere udad, hvilket er betydeligt udvide størrelsen af øen. Billeder blev kvantificeret ved hjælp af ImageJ software til at måle celle clearing og celle ø områder før og efter migreringen. Søjler repræsenterer gennemsnit± SEM af mindst tre uafhængige observationer.

Figur 4. Levercelle / fibroblastkulturer kan genereres ved hjælp ATPS udelukkelse co-kultur mønster. A) Disse kolonier opretholde deres organisation i mindst 4 dage i kultur. B) Flere øer kan grupperes i en enkelt fad med potentiale for multiplex eller high-throughput assays. C) sammenlignet med ikke-co-dyrkede ø mønstre, de co-dyrkede celler viser lidt højere niveauer af albumin produktion (brun farvning) som det fremgår af kvalitativ sammenligning af albumin farvede co-kulturer kontra monokulturer. Albumin er et protein produceret af leverceller. Derfor er dette resultat antyder, at funktionen af leverceller øges ved samtidig dyrket med fibroblast hjælp ATPS.
| a) dannede mønster | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | x | x | x |
| PEG 5,0% | x / ✓ | ✓ | ✓ |
| PEG 10,0% | x / ✓ | ✓ | ✓ |
| b) Morfologi | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | & # X2713; |
| PEG 10,0% | x | x | x |
| c) Serum Precipitation | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | ✓ |
| PEG 10,0% | x | x | x |
Tabel 1. A) ATPS formuleringer, der kan anvendes til mønsterdannelse er angivet med markeringer, dem, der ikke er angivet med x-mærker. B) Formuleringer, der bevarer normal cellemorfologi og fastgørelse egenskaber er angivet by markeringer, dem, der ikke er angivet med x-mærker. c) formuleringer der resulterede i fældning af serumproteiner er angivet med x-mærker.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den ATPS celle micropatterning metode kræver meget lidt ekspertise over færdigheder i cellekulturteknikker og kan hurtigt mestrer. Fordelene ved denne tilgang er, at den er billig, hurtig og kompatibel med en række forskellige celletyper og kultur formater. Af disse grunde bør vores protokol let vedtaget af liv forskere, især dem, der studerer celleproliferation, migration og kemotaxi, og indflydelsen fra juxtacrine og parakrine interaktioner mellem cellepopulationer. Analyserne præsenteres her let kan kvantificeres på det cellepopulationen niveau ved hjælp af standard-billedanalyse procedurer til rådighed i software som ImageJ.
For at generere konsistente mønstre, vi anbefaler følgende forholdsregler. Først fører pipettespidsen anvendes til at dispensere den DEX opløsningen ændres efter hver DEX dråbe er deponeret at tilvejebringe mere ensartede dråber mængder. Eftersom DEX opløsningen er relativt viskosDet er også vigtigt at undgå aflejring overskydende DEX, som kan forekomme på den ydre overflade af pipettespidsen og sikre, at hele volumenet af DEX forlader spidsen. For det andet kan de små dråber bevæger sig, hvis PEG tilsættes for kraftigt, eller hvis skålen vippes. DEX forstyrrelser kan minimeres ved at holde skålen på en plan overflade og gør det muligt for PEG-opløsningen til gradvist at dække dråber fra oven uden at store kræfter fra PEG meniscus at fjerne en del af dråben. Droplet forstyrrelser forekommer hyppigere med store DEX dråber, så dråber af 0,5 gl eller derunder bør anvendes, hvis det er muligt. Bortset fra disse tekniske problemer forbundet med dispensering af opløsninger, der er meget få faldgruber forbundet med denne teknik, forudsat at passende polymermolekylvægte og koncentrationer anvendes.
Selvom ATPS mønsterdannelse kan let udføres under anvendelse af en mikropipette (som præsenteret her), der er en række af mere sophisticated fremgangsmåder, der kan anvendes til hurtigt at generere mønstre af mere komplekse geometriske arrays (f.eks væskehåndteringssystemer robotter og akustisk udstødning af dråber), som vist i vores tidligere undersøgelser 14, 15, 20. Det er også muligt at generere DEX smådråber, der er meget mindre i volumen ved pneumatisk skubbes DEX via kapillære åbninger eller ved at aktivere en åbning i en mikrokanalplade at producere strømmende DEX smådråber overtrukne af PEG 19. Disse tilgange kan være af interesse for dem, der søger at producere high-throughput eller multiplekset co-kultur eller migration assays. Derudover, ved anvendelse af mikrofluide fremgangsmåder er det muligt at udføre eksperimenter med et lille antal celler, eller celler i en mikrokanalplade hvor effekterne af fluidstrømning og ren kan undersøges. Men disse avancerede metoder ikke påkrævet for de fleste anvendelser.
Vandige tofasesystem mønsterdannelse af celler er enkel og let tilpasses til en typisk cellekultur indstilling. Denne metode giver enhver forsker med adgang til en typisk celle kultur lab (adgang til en hætte, CO 2 inkubator, og mikropipetter) og de ovennævnte polymerer til reproducerbart mønster celler i monokultur og co-kultur. Vores laboratorium har vist denne evne ved at udskrive arrays af celler til at studere celle migration på en sårheling assay og at undersøge virkningerne af juxtacrine og parakrine signalering i differentieringen af embryonale celler 16, 17, 20. Andre metoder, herunder mønsterdannelse af ekstracellulær matrix 28, inkjet-trykning 29, og mønsterdannelse ved laminar strømning i mikrofluidenheder 25 er 26 også anvendes til at lokalisere celler. Disse andre metoder er effektive metoder til at opnå veldefinerede mønstre af celler og kan ofte opnå encellede præcision. Men disse metoder kræver også højt specialiseret udstyr og / eller adgang til renrumsfaciliteter til at fremstille de anvendte stempler til print ekstracellulære matrixproteiner eller producerer MicroFluidics enheder. Deres forbindelse til strømforsyninger, sprøjtepumper, og andre eksterne komponenter hindrer også deres gennemførelse på grund af de omkostninger, der er forbundet med det udstyr og bruger dygtighed kræves for at betjene den.
I form af fremtidige anvendelser forventer vi, at vores metode vil være anvendelig til at udvikle dyrkningssystemer, der muliggør high-throughput analyse af cellebevægelse og proliferation samt undersøge celle-celle interaktioner mellem flere cellepopulationer. Til dette punkt har vores rapporter fokuseret på at undersøge samspillet af kun nogle få typer af mønstrede celler på én gang. Det er imidlertid tænkeligt, at mange subpopulationer af celler kunne dyrkes med en almindelig fødelag for at undersøge virkningen af parakrine og juxtacrine signalering af mange celletyper dyrkes sammen i en enkelt cellekultur setup. Endelig vævsdyrkningsapplikationer ofte nødvendigt rumlig lokalisering afen eller flere celletyper. Det kan være muligt at tilpasse vor teknik til anvendelse i mønstergivende celler for at producere mere fysiologisk relevante manipuleret væv sygdomsmodeller eller mønster celler i implanterbare materialer til kliniske anvendelser.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ingen konkurrerende finansielle interesser.
Acknowledgments
Dette arbejde blev støttet af Coulter Foundation, Beyster Foundation, Undergraduate Research Opportunity (UROP) sommer program for ATA og en National Science Foundation Graduate Student Research Fellowship (Grant ingen DGE 0.718.128, ID:. 2010101926) for JBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



