Summary
De duas fases aquosas sistemas foram usados para as populações em simultâneo múltiplos padrões de células. Este método fácil e rápido para a padronização de células tira vantagem da separação de fases de soluções aquosas de dextrano e polietileno glicol e a tensão interfacial que existe entre as duas soluções poliméricas.
Abstract
Padronização de tecnologias de células que são rápido, fácil de usar e acessível será necessário para o futuro desenvolvimento de ensaios de alto rendimento, plataformas de celulares para o estudo de interações célula-célula e sistemas de engenharia de tecidos. Este protocolo detalhado descreve um método para a geração de co-culturas de células utilizando soluções biocompatíveis de dextrano (DEX) e polietileno glicol (PEG), que separada da fase quando combinado acima das concentrações de limiar. As células podem ser estampados em uma variedade de configurações que usam este método. Patterning exclusão de células pode ser realizada através da impressão de gotículas de DEX sobre um substrato e cobrindo-os com uma solução de PEG que contêm as células. A tensão interfacial formada entre as duas soluções poliméricas de células faz com que a cair em torno do lado de fora da gotícula de DEX e formar uma clareira circular que pode ser usado para ensaios de migração. Ilhas de células pode ser modelado por meio da supressão de uma célula fase rica DEX em uma solução de PEG ou cobrindo o DEXgota com uma solução de PEG. Co-culturas podem ser formados directamente através da combinação de exclusão de células com DEX patterning ilha. Estes métodos são compatíveis com uma variedade de abordagens para manipulação de líquidos, incluindo micropipetting manual, e pode ser usado com virtualmente qualquer tipo de célula aderente.
Introduction
De duas fases aquosas sistemas (ATPSs) formam-se quando as soluções de dois polímeros incompatíveis são misturados em conjunto em concentrações suficientemente elevadas. A separação de fases é influenciada por uma série de factores que incluem o peso molecular e polaridade dos polímeros, a temperatura da solução, pH e teor iónico do solvente aquoso de 1, 2. O ponto em que as duas soluções poliméricas separadas, é determinada pelas propriedades físico-químicas do sistema de fase escolhida, mas geralmente ocorre em baixas concentrações de polímero (inferiores a 20% wt / wt), sob condições não desnaturantes, permitindo ATPSs a ser utilizado para a biotecnologia 3-9 aplicações.
De longe, os mais extensivamente estudados ATPS é o polietileno glicol (PEG) / dextrano sistema (DEX). Os ATPS formadas por estes polímeros de baixo custo e biocompatível foi originalmente descrita para a purificação de biomoléculas por meio de particionamento molecular de 2, 10. Particionamentoocorre quando as moléculas ou partículas adicionais que não contribuem para o sistema de fases são misturadas com PEG e DEX. Com base nas suas afinidades relativas para ou DEX ou PEG, as moléculas ou partículas será preferencialmente residir dentro de uma das duas fases, ou na interface. Outra propriedade do SDFA PEG / DEX é a existência de tensão interfacial entre as duas fases de polímero. ATPSs formados por PEG e DEX geralmente exibem as tensões interfaciais, que são muito mais baixos do que outras fases líquido-líquido e dois sistemas, tais como óleo e água, no entanto, as forças de tensão interfacial ainda exercem efeitos em pequenas partículas, tais como vírus, células e agregados de proteína 2 , 11-13. Finalmente, visto que um maior peso molecular de PEG e DEX separado em concentrações baixas (inferiores a 5% em peso / peso para polímeros de alto peso molecular variedades), na presença de concentrações fisiológicas de sais, há poucos ou nenhuns efeitos nocivos sobre as células de mamíferos incorporado dentro destas sistemas14-16.
Recentemente, as propriedades interfaciais e efeitos de particionamento de ATPSs foram aplicadas por nosso laboratório para padronização de células 14, 16-20. Isto foi conseguido por uma densa micropatterning solução DEX em substratos de cultura de células na presença de PEG. Quando as células são incorporados na fase de PEG, são excluídos de entrar nas gotículas de DEX, devido a PEG / DEX tensão interfacial 20. Quando as células são modelados na fase de DEX, eles são retidos na superfície do substrato de cultura de células por tensão interfacial e partição 16, 17, 19.
Em contraste com outros métodos de padronização celular, ATPS padronização celular é fácil de aprender e requer apenas conhecimentos rudimentares sobre os polímeros em si, e da capacidade de realização de cultura de células e usar uma micropipeta. Outros métodos para padronização de células muitas vezes envolvem equipamentos especializados e treinamento que não são facilmente traduzidos para poe ciências da vida. Por exemplo, alguns métodos (microcontact impressão ou impressão a jacto de tinta) células padrão indirectamente mediante a aplicação de padrões de biomoléculas adesivas de células a um substrato de cultura que, posteriormente, servir como locais para ligação de células 21, 22. Embora as abordagens indirectas são úteis para alguns tipos de células, elas requerem um elevado grau de destreza do utilizador e equipamento especializado para fabricar a ferramenta de modelação, e pode carecem de especificidade, dependendo do tipo específico de célula padrão / biomolécula. Alternativamente, as células podem ser depositadas com uma especificidade elevada padrão por meio de métodos de modelação directos, que incluem padrões de fluxo laminar stenciling, e impressão jacto de tinta 23-26. No entanto, essas técnicas também requerem perícia do utilizador e equipamento especializado e podem danificar as células durante o processo de impressão. Embora estes métodos geralmente produzem padrões precisos de células, para padronização célula para ser uma ferramenta útil nas ciências da vida, deve ser rentável umª simples de implementar.
Relatamos aqui um protocolo detalhado para a geração de culturas de células utilizando os estampados ATPSs descritos nos nossos pedidos anteriormente publicados-. Usando apenas micropipetas, os usuários podem gerar zonas de exclusão de células ou ilhas de células para os ensaios de migração. Isto é conseguido por meio de PEG / DEX tensão interfacial ou que retém as células na fase de DEX ou exclui células depositadas na fase de PEG de DEX. Combinando estas duas técnicas fundamentais de modelação, é possível gerar rapidamente co-culturas de células, tais como fibroblastos de células de fígado de co-culturas. Métodos de padronização, os parâmetros e os resultados esperados ATPS são descritos em detalhe.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Caracterização fase do sistema: Limiares determinante para a Separação de Fase
- Preparar soluções contendo PEG e DEX no tampão desejado, ou meio de cultura celular, como mostrado na Figura 1 (pontos roxos) em 15 ml ou 50 ml de tubos cónicos. Daqui por diante, o PEG e DEX se referirá a 35 kDa PEG e DEX 500 kDa, no entanto, concentrações críticas vão mudar dependendo dos dois polímeros usados. Registar a massa de PEG e DEX em cada solução. Soluções de alta concentração de polímeros pode levar várias horas para dissolver. Vórtice pode ser utilizado para as soluções isentas de soro. Para meios contendo soro ou proteínas, colocar os tubos em um estágio de balanço até que ambos os polímeros são completamente dissolvido. Registar o peso dos meios de comunicação utilizados para dissolver os polímeros e tomar nota das concentrações iniciais.
- Uma vez que os polímeros estão completamente dissolvidos, as soluções devem aparecer turva. Esta é a primeira indicação de que a separação de fases ocorreu. Para confirmar isso, permitir que osoluções de polímero a descansar numa posição vertical à temperatura ambiente durante 20 min. Centrifugação a 1000 xg pode ser utilizado para acelerar o processo de separação de fases. A fase inferior mais densa será DEX-rico e a fase de topo será PEG-rico.
- Lentamente, adicionar tampão adicional ou de mídia para os tubos. Pequenos incrementos deverá ser utilizado de modo a não ultrapassar o ponto de separação de fases.
- Quando a solução torna-se clara e não se separa da fase após a centrifugação, o limiar para a separação de fases foi atingido. Registar o peso final do tubo.
- Utilizando os pesos anteriores registadas para os polímeros, juntamente com o peso final após a adição de meios de comunicação, determinar a% em peso / peso de cada um dos dois polímeros em que a separação de fase não ocorre.
- Traçar estes valores como PEG% p / p sobre o eixo y e% wt / wt DEX sobre o eixo x. Esta trama, conhecido como a curva binodal, pode ser usado para determinar a concentração de limiar de separação de fases para Concentrati diferenteComplementos de PEG / DEX em um meio de cultura de células específico.
2. Configuração 1: Padronização de exclusão (formato de 96 poços Plate)
- Preparar soluções separadas de 5,0% p / p de PEG e 12,8% em peso / peso DEX em meio de cultura de células. Use ATPS soluções de pelo menos duas vezes o ponto crítico para assegurar que um ATPS permanece após os polímeros de equilibrar-se com respeito ao outro. Há uma pequena quantidade de fluxo de DEX para a fase rica em PEG e vice-versa, por isso, trabalhar muito perto da concentração crítica pode resultar em perda de fase do sistema em termos de concentração gota abaixo do ponto crítico. Da mesma forma, a transferência da placa de cultura de células para uma incubadora com humidade e temperatura controlada pode alterar as propriedades de duas fases e tornar as duas soluções miscíveis. Nota: Algumas células podem ter um melhor desempenho com outras formulações ATPs. Formulações aceitáveis podem ser seleccionados com base nas curvas de binodais determinados a partir da parte 1.
- Colheita das células a serem usadas para a exclusão patterning. Determinar o número total / concentração de células disponíveis. Opcional: rotular as células com CellTracker ou outros não-citotóxicos rótulos para microscopia de fluorescência.
- Agregar as células e ressuspender o sedimento em um volume apropriado de 5,0% de PEG para obter o número desejado de células por exclusão. Por exemplo, um poço de uma placa de 96 poços requer 37500 células de fibroblastos de ser ressuspensas em 200 ul de PEG para produzir confluência no dia seguinte. Dimensionar estes números como apropriado para outros tipos de células e tamanhos de substratos de cultura.
- Usando uma micropipeta, dispensar 0,5 ul de gotas de DEX sobre um substrato de cultura de células secas. Gotas maiores volumes maiores produzem zonas de exclusão. Que variam em tamanho de gotículas 0,1-1 ul são recomendados para micropatterning exclusão. Opcional: DEX gotículas podem ser depositados 24 hr antes do tempo permitido para desidratar e à temperatura ambiente. Isso pode produzir padrões mais limpas.
- Pipetar 200 ul de suspensão de células em PEG tele bem para cobrir as gotículas de DEX.
- Coloca-se num incubador humidificado durante 12 horas a 37 ° C, 5% CO 2. Certifique-se de que o prato não é inclinada durante o manuseio e que está colocado sobre uma prateleira incubadora nível para evitar a perturbação dos padrões.
- Remover a solução de PEG e lavar três vezes com 200 ul de meio de cultura.
- Adicionar meio de cultura fresco e de retorno para a incubadora.
- Monitorar as culturas periodicamente para observar a movimentação das células para a zona de exclusão.
3. Configuração 2: Padronização Island (formato de 96 poços Plate)
- Preparam-se soluções de 5,0% p / p de PEG e 12,8% em peso / peso DEX em meio de cultura de células, como descrito acima.
- Colheita das células a serem usadas para padronização ilha. Determinar o número total / concentração de células disponíveis.
- Pellet e ressuspender as células em um volume apropriado de 12,8% DEX para alcançar a concentração desejada de células por patterning ilha. As concentrações de 5000 cells / ul ou menos são recomendados para os tipos de células fortemente aderentes. Para as células que têm dificuldade em fixar ou células que aderem fracamente, concentrações de até 10.000 células / uL pode ser considerada.
- Trabalhar rapidamente, para evitar a secagem, as gotas de pipeta 0,5 ul de DEX sobre um substrato seco de células de cultura, como descrito acima. Não permitir que as gotas para secar. Opcional: 200 ul de solução de PEG pode ser adicionado ao poço antes do tempo. DEX gotículas pode então ser depositado na solução de PEG, onde irá afundar para o fundo e a superfície de contacto da cultura. Isso pode produzir padrões mais limpas da ilha.
- Cobrir as gotículas DEX com 200 uL de PEG.
- Coloca-se num incubador humidificado durante 12 horas a 37 ° C, 5% CO 2. Certifique-se de que o prato não é inclinada durante o manuseio e que está colocado sobre uma prateleira incubadora nível para evitar a perturbação dos padrões.
- Remover a solução de PEG e lavar três vezes com 200 ul de meio de cultura.
- Adicionar nova culturamédio e de retorno para a incubadora.
- Monitorar as culturas periodicamente para observar a movimentação das células e para fora de proliferação das ilhas.
4. Configuração 3: Exclusão Co-culturas (formato de 96 poços Plate)
- Preparam-se soluções de 5,0% p / p de PEG e 12,8% em peso / peso DEX em meio de cultura de células, como descrito acima.
- Colheita das células a serem usadas para a exclusão e padronização ilha. Determinar o número total / concentração de células disponíveis para cada tipo de célula. Opcional: Alguns pares de células podem exibir índices de proliferação significativamente diferentes. Para evitar que as células excluídas superpopular as células insulares estampados (especialmente para culturas de longo prazo), o tratamento das células utilizadas para a exclusão com mitomicina C, durante 2 horas ou irradiar-los antes da colheita. Isto irá evitar a proliferação. CellTracker corantes fluorescentes podem ser usadas para distinguir as duas populações de células, se necessário.
- Agregar as células e ressuspender o sedimento de exclusion padronização em um volume apropriado de 5,0% de PEG para obter o número desejado de células, como descrito acima. Ressuspender o sedimento em patterning ilha em um volume apropriado de 12,8% DEX para conseguir a concentração desejada de células, como descrito acima.
- Usando uma micropipeta, dispensar 0,5 ul de gotas de suspensão de células de DEX sobre um substrato de cultura de células secas. Não permitir que as gotas para secar.
- Cobrir as gotículas DEX com 200 ul de suspensão de células PEG.
- Coloca-se num incubador humidificado durante 12 horas a 37 ° C, 5% CO 2. Certifique-se de que o prato não é inclinada durante o manuseio e que está colocado sobre uma prateleira incubadora nível para evitar a perturbação dos padrões.
- Remover a solução de PEG e lavar três vezes em 200 ul de meio de cultura.
- Adicionar meio de cultura fresco e de retorno para a incubadora.
- Monitorar as co-culturas de observar a interação entre populações de células. Opcionais: Os controles podem ser preparados através da realização de exclusão ou ilha padronização individually, por co-cultura de células que não interagem ou bloqueando as vias de interesse em uma ou ambas as populações de células antes ou depois da modelação.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Para selecionar uma combinação apropriada de PEG e DEX para padronização de células é importante para determinar a curva binodal. Esta curva de delineia os pontos em que se podem formar um ATPS e pode variar para um dado conjunto de polímeros com base em temperatura, pH e teor iónico. Para a cultura de células que requerem formulações médias personalizadas que podem ser necessários para determinar experimentalmente a curva binodal. Isto é conseguido através da geração de uma série de ATPSs que estão longe do binodal e variando no seu conteúdo de PEG e DEX (Figura 1, círculos de cor púrpura). Quando um ATPS estiver presente, as soluções de polímeros irá aparecer turva quando misturado e irá equilibrar-se em fases separadas, se deixada intacta. Ao adicionar solvente adicional à mistura de polímeros, as ATPS abordará PEG 0% / 0% DEX. Em algum ponto, a mistura já não separação de fase. A concentração de PEG / DEX em que isto ocorre representa um ponto na curva binodal; acima desse ponto um ATPS pode formar e abaixo desse ponto não pode. As curvas da Figura 1 representam binodals de três meios de cultura de células comuns com e sem 10% de soro fetal bovino (FBS). As concentrações em que é formado um ATPS são ligeiramente mais elevados na presença de FBS.
Nos nossos relatórios anteriores, utilizou-se ATPSs base em um ponto crítico (o ponto no qual binodal em volumes iguais de PEG e DEX forma, após o equilíbrio) de 2,5% de PEG 35% kDa/3.2 DEX 500 kDa. Os resultados dos nossos dados binodais estão em estreita proximidade com este valor de ponto crítico. Testamos nove combinações de sistemas de fase de modelação, como se mostra na Tabela 1. Uma vez que as soluções puras de PEG e DEX equilibrar-se com respeito à concentração de seus polímeros depois de serem combinados, algumas destas soluções não formaram ATPSs estáveis e, portanto, não eram úteis para padronização (Tabela 1a, marcas X). Outras combinações de polímero produzido padrões reconhecíveis, Mas não eram suficientemente uniforme para a experimentação (Tabela 1a x / ✓ marcas). As formulações úteis de polímero formadas zonas de exclusão ou ilhas que eram quase desprovida de células em regiões não modeladas (Tabela 1a, ✓ marcas).
Com PEG 10%, percebemos que a morfologia das células era anormalmente redonda e fusiforme após 24 horas, com células exibindo uma capacidade diminuída para anexar à superfície de cultura (Quadro 1b, marcas x). Morfologia e apego eram normais para 2,5% e PEG 5% (Tabela 1B, ✓ marcas). Observou-se que precipitou soro do meio de cultura em concentrações de PEG elevadas (Tabela 1c, marcas X), o que sugere que a morfologia celular anormal e fixação em solução de PEG a 10% pode estar relacionado com problemas com o acesso de soro. Além disso, o PEG é conhecido por romper as membranas de plasma 27. Embora esses efeitos só são observadas em altas concentrações de mol baixoPEG de peso ecular, o melhor é utilizar a menor concentração de PEG, que produz padrões de confiança.
Consistente com os nossos relatórios anteriores, concluiu-se que 5% PEG/6.4% DEX e 5% PEG/12.8% DEX foram bem adequado para padronização de células, com 12,8% DEX produzir padrões mais uniformes. Os resultados esperados para três formatos de modelação utilizando células marcadas com Controlador de células HeLa são mostrados na Figura 2. Seguindo cada abordagem padronização, é possível a criação de um padrão uniforme de cada tipo, com muito poucas células fora das áreas estampadas.
Usando exclusão e padronização ilha é possível avaliar a proliferação e migração de células padronizadas (Figura 3). Ao longo de três dias, as células HeLa encheu as zonas de exclusão (Figuras 3a-c). Ilha estampados células expandidas para fora a partir dos padrões iniciais (Figuras 3d-f). Essas mudanças podem ser quantificados utilizandopadrão ImageJ ferramentas de medição (Figuras 3 c, f). É importante notar que, quando as populações de células múltiplas são co-cultivadas (Figura 2, Tipo 3), uma população de células podem proliferar-out e substituir o outro. Padronização exclusão e padronização ilha podem ser ferramentas úteis para avaliar se isso vai ser um problema. Em situações em que as diferenças dramáticas em índice de proliferação ocorrer, recomenda-se que uma população de células é tratada com factores de irradiação ou químicos para limitar a sua proliferação. Isto é particularmente útil em situações em que um tipo de célula é utilizada como uma célula de suporte para um tipo de célula mais lento crescimento mais sensível.
Demonstramos este princípio por cultura de células HepG2, uma linha de células de carcinoma hepatocelular que é comumente utilizada para a biologia modelo hepatócito, com fibroblastos NIH 3T3 que foram presas com mitomicina C (Figura 4). Ao longo do tempo, as células HepG2 manter a sua localização de umd forma de colónias (Figura 4a). Colocando gotículas muitos na mesma placa e rodeando-os com fibroblastos que é possível para crescer estas células em um formato que é potencialmente útil para estudos de multiplexagem (Figura 4b). Monoculturas de células da ilha podem ser usados com este formato como um controlo para a influência dos factores parácrinos (Figura 4c).
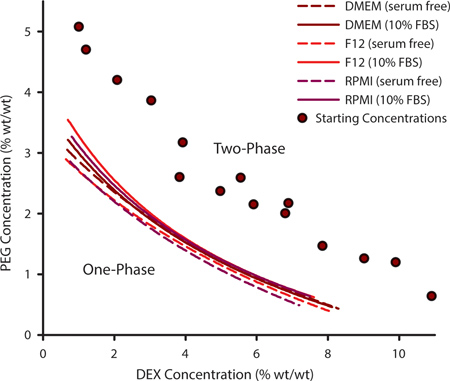
Figura 1. As concentrações de polímero em que uma ATPS podem formar podem ser extrapoladas a partir de curvas de determinados experimentalmente binodais. Esta curva binodal foi construído utilizando o método de ponto de turvação por adição de solvente adicional para medir os pontos em que duas fases diferentes misturas de PEG / DEX concentrações (roxo círculos) já não eram capazes de fase separating. Binodals foram determinados por DMEM, F12 e meio RPMI com e sem soro. Os pontos de dados foram ajustados a uma função de três parâmetros racional. N = 3 para cada ponto de dados.

Figura 2. Dispensando as soluções em placas de poliestireno ATPS, três formatos para padronização da célula pode ser produzida. O procedimento começa pipetando gotículas de DEX a) que são então revestidos com PEG b). Uma vez que as células de anexar, as soluções ATPS podem ser lavados e substituídos com meio de cultura (c, d). Imagens de fluorescência para as monoculturas foram coradas com corantes CellTracker após padronização. Para co-culturas, as células foram marcadas separadamente com corantes CellTracker antes de padronização. As células HeLa foram utilizados para gerar todos os três formatos de cultura. 
Figura 3. Patterning exclusão e padronização ilha pode ser usado para avaliar a migração e proliferação celular. Uma exclusão) células HeLa estampados 1 dia após a padronização. B) células HeLa estampados de exclusão de 3 dias depois. Patterning c) células proliferam e migram, reduzindo significativamente o tamanho do zona de exclusão. d) células HeLa Island-modelado um dia depois de padronização. e) células HeLa Island-modelado 3 dias após a padronização. f) As células proliferam e migram para o exterior, aumentando significativamente o tamanho da ilha. As imagens foram quantificados utilizando software ImageJ para medir a compensação celular e áreas insulares celulares antes e depois da migração. Barras representam média± SEM de, pelo menos, três observações independentes.

Figura 4. Células de fígado / fibroblasto culturas podem ser gerados usando exclusão ATPS patterning co-cultura. A) Essas colónias manter a sua organização durante pelo menos 4 dias em cultura. B) ilhas múltiplas podem ser dispostos em um único prato com potencial para multiplexado ou de alto rendimento ensaios. C) em comparação aos padrões não-co-cultura da ilha, as células co-cultivadas apresentam níveis ligeiramente mais elevados de produção de albumina (coloração marrom), como é evidente a partir da comparação qualitativa manchado albumina co-culturas contra monoculturas. Albumina é uma proteína produzida pelas células do fígado. Portanto, este resultado sugere que a função das células do fígado é aumentada quando co-cultivadas com fibroblastos utilizando SAB.
| a) padrão formado | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | x | x | x |
| PEG 5,0% | x / ✓ | ✓ | ✓ |
| PEG 10,0% | x / ✓ | ✓ | ✓ |
| b) Morfologia | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | & # X2713; |
| PEG 10,0% | x | x | x |
| c) Precipitação Serum | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | ✓ |
| PEG 10,0% | x | x | x |
Tabela 1. Formulações de ATPS) que podem ser utilizados para a modelação são indicados pelas marcas de verificação, as que não podem, estão indicadas pelas marcas X. B) Formulações que retêm a morfologia celular normal e as propriedades de ligação são indicados bmarcas de verificação y, as que não podem, estão indicadas por marcas de x. c) As formulações que resultou na precipitação de proteínas do soro são indicados pelas marcas X.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
A ATPS método micropatterning célula exige conhecimentos muito pouco além de proficiência em técnicas de cultura de células e podem ser rapidamente dominado. As vantagens desta abordagem são que é barato, rápido e compatível com uma variedade de tipos de células e formatos de cultura. Por estas razões, o nosso protocolo deve ser adotada facilmente por cientistas da vida, particularmente aqueles que estudam a proliferação celular, migração e quimiotaxia, e da influência de interações juxtacrine e parácrina entre populações de células. Os ensaios aqui apresentados podem ser facilmente quantificadas ao nível da população celular, utilizando procedimentos de imagem padrão de análise disponíveis no software, tais como ImageJ.
Para gerar padrões consistentes aconselhamos as seguintes precauções. Em primeiro lugar, a ponta da pipeta utilizada para distribuir a solução DEX deve ser substituído após cada gotícula DEX é depositado para proporcionar volumes de gota mais consistentes. Uma vez que a solução é relativamente viscoso DEX, É também importante para evitar a deposição de DEX excesso que possa estar presente na superfície exterior da ponta de pipeta e para assegurar que todo o volume das saídas de DEX a ponta. Em segundo lugar, as gotículas se podem mover PEG é adicionado demasiado vigorosa, ou se o prato for inclinado. Perturbação DEX pode ser minimizada mantendo o prato sobre uma superfície plana e permitindo que a solução de PEG para gradualmente cobrir as gotículas a partir de cima, sem permitir que as forças grandes do menisco PEG para desalojar parte da gotícula. Interrupção gota ocorre mais freqüentemente com grandes gotas DEX, então gotículas de 0,5 ul ou menos deve ser usado, se possível. Para além destes problemas técnicos ligados com a distribuição das soluções, existem muito poucas armadilhas associadas com esta técnica, desde que os pesos apropriados de polímeros moleculares e as concentrações são utilizadas.
Embora patterning ATPS pode ser facilmente realizada por meio de uma micropipeta (como aqui apresentado), há uma variedade de mais sophisticated abordagens que podem ser utilizadas para rapidamente gerar padrões de matrizes geométricos mais complexos (por exemplo, os robôs de manipulação de líquidos e de ejecção de gotículas acústico), tal como apresentado nos nossos estudos anteriores 14, 15, 20. Também é possível gerar gotículas DEX que são muito menores em volume por DEX pneumaticamente através de orifícios de ejecção de capilaridade ou por accionamento de um orifício num microcanal para produzir gotas que fluem DEX embainhadas por PEG 19. Estas abordagens podem ser de interesse para aqueles que procuram produzir produtos de alta taxa de transferência ou multiplexadas ensaios de co-cultura ou a migração. Além disso, utilizando abordagens microfluídicos, é possível realizar experiências com um pequeno número de células, ou com as células de um microcanal, onde os efeitos do fluxo de fluido e pura pode ser examinado. No entanto, estes métodos avançados não são necessárias para a maioria das aplicações.
Padronização de duas fases aquosas de células é simples e facilmente adaptada a uma célula típicaconfiguração de cultura. Este método permite que qualquer investigador com acesso a um laboratório de cultura de células normal (acesso a um exaustor, incubadora de CO 2, e micropipetas) e os polímeros acima referidos para as células de forma reprodutível padrão em monocultura e co-cultura. O nosso laboratório demonstrou esta capacidade, imprimindo matrizes de células a estudar a migração das células num ensaio de cicatrização de feridas e para examinar os efeitos de sinalização juxtacrine e parácrino na diferenciação de células embrionárias 16, 17, 20. Outros métodos, incluindo padrões de matriz extracelular 28, a impressão a jacto de tinta 29, e pela padronização de fluxo laminar em dispositivos microfluídicos 25, 26 também têm sido utilizados para localizar as células. Estes métodos são outras abordagens eficazes para alcançar bem definidos padrões de células e muitas vezes podem atingir de uma única célula de precisão. No entanto, estes métodos requerem também altamente especializado de equipamentos e / ou acesso a instalações de salas limpas para fabricar os carimbos utilizados para print proteínas da matriz extracelular ou produzem dispositivos microfluidics. Sua conexão com fontes de alimentação, bombas de seringa, e outros componentes externos também dificulta a sua implementação devido aos custos associados com o equipamento e habilidade do usuário necessária para operá-lo.
Em termos de aplicações futuras espera-se que o nosso método será útil para o desenvolvimento de sistemas de cultura que permitem a análise de alto rendimento de movimento e proliferação celular, bem como investigar interacções célula-célula entre as populações de células múltiplas. Até este ponto, os nossos relatórios têm-se centrado na análise de interação de apenas alguns tipos de células com padrões de uma vez. No entanto, é concebível que muitas subpopulações de células podem ser cultivadas com uma camada de alimentação comum para investigar o impacto da sinalização parácrinos e juxtacrine de muitos tipos de células cultivadas em conjunto numa configuração única de cultura de células. Finalmente, as aplicações de engenharia de tecidos frequentemente necessário localização espacial deum ou mais tipos de células. Pode ser possível adaptar a técnica para utilização em células de padronização, a fim de produzir mais fisiologicamente relevante modelos de doenças do tecido de engenharia ou de células padrão em materiais implantáveis para aplicações clínicas.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm concorrência de interesses financeiros.
Acknowledgments
Este trabalho foi financiado pela Fundação Coulter, Fundação Beyster, a oportunidade de Pesquisa de Graduação (UROP) programa de verão para ATA e um National Science Foundation Graduate Student Research Fellowship (Grant DGE não 0718128; ID:. 2010101926) para JBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



