Summary
Waterige tweefasensysteem systemen werden gebruikt om gelijktijdig meerdere patroon populaties van cellen. Deze snelle en gemakkelijke methode voor patroonvorming cel maakt gebruik van de fasenscheiding van waterige oplossingen van dextran en polyethyleenglycol en de grensvlakspanning die tussen de twee polymeeroplossingen.
Abstract
Cell patronen technologieën die snel, makkelijk te gebruiken en betaalbaar zal zijn voor de toekomstige ontwikkeling van high-throughput cel assays, platforms voor het bestuderen van cel-cel interacties en weefselmanipulatieproducten systemen. Deze gedetailleerde protocol beschrijft een werkwijze voor het co-kweken van cellen met biocompatibele oplossingen van dextran (DEX) en polyethyleenglycol (PEG) die fase-gescheiden combinatie boven de drempel concentraties. Cellen kunnen worden patroon in verschillende configuraties met deze methode. Cell uitsluiting patroon kan worden uitgevoerd door het afdrukken druppels DEX op een substraat en ze te bedekken met een oplossing van PEG bevattende cellen. De grensvlakspanning gevormd tussen de twee polymeeroplossingen veroorzaakt cellen vallen rond de buitenkant van de DEX druppel en een cirkelvormige clearing die voor migratie assays vormen. Cell eilanden kunnen patroon door het afgeven van een cellenrijke DEX fase in een PEG oplossing of door het bedekken van DEXdruppeltje met een oplossing van PEG. Co-culturen direct gevormd worden door het combineren van cel uitsluiting met DEX eiland patronen. Deze methoden zijn compatibel met verschillende liquid handling benaderingen, waaronder handmatige micropipetting, en kan worden gebruikt met vrijwel alle aanhangend celtype.
Introduction
Waterige tweefasensysteem systemen (ATPSs) vormen wanneer oplossingen van twee incompatibele polymeren worden gemengd in voldoende hoge concentraties. Fasescheiding wordt beïnvloed door een aantal factoren dat het molecuulgewicht en de polariteit van de polymeren, de temperatuur van de oplossingen, pH en ionische inhoud van het waterige oplosmiddel 1, 2 omvatten. Het punt waar de twee afzonderlijke polymeeroplossingen wordt bepaald door de fysisch-chemische eigenschappen van de gekozen fase systeem, maar gebeurt meestal bij lage polymeerconcentraties (minder dan 20% wt / wt) onder niet-denaturerende omstandigheden, waardoor ATPSs worden gebruikt voor biotechnologie toepassingen 3-9.
Verreweg de meest uitgebreid bestudeerde ATPS is het polyethyleenglycol (PEG) / dextran (DEX) systeem. De ATPS gevormd door deze goedkoop en biocompatibele polymeren werd beschreven voor de zuivering van biomoleculen door middel van moleculaire verdeling 2, 10. Partitionerenontstaat wanneer aanvullende moleculen of deeltjes die niet bijdragen aan het fasensysteem gemengd met PEG en DEX. Basis van hun relatieve affiniteiten voor zowel DEX of PEG, de moleculen of deeltjes bij voorkeur bevinden in een van de twee fasen of aan het grensvlak. Andere eigenschap van het PEG / DEX ATPS het bestaan van grensvlakspanning tussen de twee fasen polymeer. ATPSs gevormd door PEG en DEX algemeen weergegeven grensvlak spanningen die veel lager zijn dan andere vloeistof-vloeistof tweefasen systemen zoals olie en water, maar de grensvlakspanning krachten nog effecten uitoefenen op kleine deeltjes zoals virussen, cellen en eiwitaggregaten 2 , 11-13. Tot slot, aangezien hoger molecuulgewicht PEG en DEX gescheiden in lage concentraties (minder dan 5% wt / wt voor hoogmoleculaire polymeren soorten) in aanwezigheid van fysiologische zoutconcentraties, weinig of geen nadelige effecten op zoogdiercellen opgenomen in deze systemen14-16.
Onlangs hebben de grensvlak eigenschappen en partitioneren effecten van ATPSs toegepast door ons lab voor cel patronen 14, 16-20. Dit werd bereikt door een dichter micropatterning DEX oplossing op celculturen substraten in aanwezigheid van PEG. Wanneer cellen worden opgenomen in de PEG fase, worden ze niet deelnemen aan de DEX druppeltjes door PEG / DEX grensvlakspanning 20. Wanneer cellen worden gevormd in de DEX fase zijn zij gehouden op het oppervlak van het substraat door celkweek grensvlakspanning en verdeling 16, 17, 19.
In tegenstelling tot andere methoden voor cel patronen, ATPS cel patroon is eenvoudig te leren en vraagt slechts rudimentaire kennis van de polymeren zelf, en de mogelijkheid om celkweek uitvoeren en een micropipettor. Andere methoden voor cel patronen vaak sprake van gespecialiseerde apparatuur en opleiding die niet eenvoudig kunnen worden vertaald naar ee life sciences. Bijvoorbeeld, sommige methoden (microcontact afdrukken of inkjet) patroon cellen indirect door toepassing van cel lijm patronen biomoleculen aan een cultuur substraat die vervolgens dienen als plaatsen voor celhechting 21, 22. Hoewel indirect benaderingen zijn bruikbaar voor sommige celtypen, ze vereisen een hoge graad van vaardigheid en user gespecialiseerde apparatuur voor de patroon gereedschap fabriceren en kunnen missen specificiteit afhankelijk van de specifieke celtype / biomolecule patroon. Als alternatief kunnen cellen worden gedeponeerd bij een hoge specificiteit patroon door middel van een directe patronen benaderingen die laminaire stroming patronen, sjabloneren en inkjet printing 23-26 op te nemen. Deze technieken zijn echter ook gebruiker vereist deskundigheid en gespecialiseerde apparatuur en kunnen cellen beschadigen tijdens het drukproces. Hoewel deze benaderingen produceren in het algemeen nauwkeurige patronen van cellen, voor cel patronen een nuttig instrument in de life sciences zijn, moet het rendabel zijn eennd eenvoudig te implementeren.
Hier rapporteren we een gedetailleerd protocol voor het genereren van een patroon celculturen met behulp van de ATPSs beschreven in ons eerder gepubliceerde aanvragen. Met alleen micropipettors, kunnen gebruikers cel uitsluiting zones of cel eilanden voor migratie assays. Dit wordt bereikt door middel van PEG / DEX grensvlakspanning die ofwel cellen behouden in de DEX fase of uitsluit cellen gedeponeerd in de PEG fase van DEX. Door kammen deze twee fundamentele patronen technieken is het mogelijk om spoedig co-celkweken zoals lever-fibroblast cell co-culturen. Patronen methoden, ATPS parameters en verwachte resultaten worden beschreven in detail.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Fase Systeem Karakterisering: Het bepalen van Drempels voor fasescheiding
- Bereid oplossingen die PEG en DEX in de gewenste buffer of celkweekmedium zoals getoond in Figuur 1 (paarse stippen) in 15 ml of 50 ml conische buizen. Hierna zal PEG en DEX zie 35 kDa PEG en 500 kDa DEX, maar kritische concentraties verandert afhankelijk van de gebruikte twee polymeren. Noteer de massa van PEG en DEX in elke oplossing. Hoge concentratie polymeer oplossingen kan enkele uren duren om op te lossen. Vortex kan worden gebruikt voor serum-vrije oplossingen. Voor media met eiwitten of serum, plaats de buisjes op een rockende podium totdat beide polymeren worden volledig is opgelost. Noteer het gewicht van de media gebruikt om de polymeren op te lossen en kennis te nemen van de oorspronkelijke concentraties.
- Zodra de polymeren zijn volledig opgelost, dienen de oplossingen lijkt troebel. Dit is de eerste aanwijzing dat fasescheiding is opgetreden. Om dit te bevestigen, zodat depolymeeroplossingen te rusten in een verticale positie bij kamertemperatuur gedurende 20 minuten. Centrifugeren bij 1000 xg kan worden gebruikt om de fasescheiding versnellen. De dichtere onderste fase zal DEX-rijk en de bovenste fase wordt PEG-rijk.
- Voeg langzaam aanvullende buffer of media aan de buizen. Kleine stappen moeten worden gebruikt niet wordt overschreden fasescheiding punt.
- Wanneer de oplossing helder wordt en niet langer fase scheidt na centrifugeren werd de drempel voor fasescheiding is bereikt. Noteer de uiteindelijke gewicht van de buis.
- Met de eerder opgenomen gewichten voor de polymeren, met het eindgewicht na toevoeging media, bepalen% wt / wt van elk van de twee polymeren waarbij fasescheiding niet meer optreedt.
- Plotten deze waarden in% w / w PEG op de y-as en% gew / gew DEX op de x-as. Deze curve zogenaamde binodaal curve kan worden gebruikt om de drempelwaarde voor fasescheiding voor verschillende concentrati bepalenons van PEG / DEX in een specifieke celkweekmedium.
2. Configuratie 1: Uitsluiting Patterning (96-well plaat formaat)
- Bereid afzonderlijke oplossingen van 5,0% wt / wt PEG en 12,8% w / w DEX in celkweekmedium. Gebruik ATPS oplossingen ten minste tweemaal de kritische punt te zorgen dat een ATPS overblijft na de polymeren evenwicht ten opzichte van elkaar. Er is een kleine hoeveelheid flux van DEX in de PEG-fase en vice versa derhalve werkzaam te dicht bij de kritische concentratie kan leiden tot verlies van de fase systeem concentraties vallen onder de kritische punt. Evenzo kan de overdracht van de celkweekschaal met een vochtigheid-en temperatuur-beheerste incubator weg tweefasige eigenschappen en maken de twee oplossingen mengbaar. Opmerking: Sommige cellen kunnen beter presteren met andere ATPS formuleringen. Aanvaardbare formuleringen worden geselecteerd op basis van de binodaal curves uit deel 1.
- Oogst de cellen worden gebruikt voor uitsluiting patterning. Bepaal het aantal / concentratie van cellen beschikbaar. Optioneel: labelen van de cellen met CellTracker of andere niet-cytotoxische labels voor fluorescentiemicroscopie.
- Pelleteren van de cellen en resuspendeer de pellet in een geschikt volume van 5,0% PEG om het gewenste aantal cellen bereiken voor uitsluiting. Bijvoorbeeld een putje van een 96-well plaat heeft 37.500 fibroblast cellen worden geresuspendeerd in 200 pi PEG tot confluentie produceren volgende dag. Schaal deze nummers zo nodig voor andere celtypes en cultuur substraat maten.
- Met behulp van een micropipettor, afzien 0,5 pi druppeltjes van DEX op een droge celkweek substraat. Groter volume druppels produceren grotere uitsluiting zones. Druppeltjes variërend in grootte 0,1 tot 1 ul aanbevolen voor uitsluiting micropatterning. Optioneel: DEX druppeltjes worden afgezet 24 uur van tevoren en mag drogen bij kamertemperatuur. Dit kan leiden tot schonere patronen.
- Doseer 200 pl PEG celsuspensie in thij goed op de DEX druppels te dekken.
- In een bevochtigde incubator gedurende 12 uur bij 37 ° C, 5% CO2. Zorg ervoor dat de antenne niet gekanteld tijdens hantering en dat het op een vlakke plank incubator te voorkomen dat de patronen.
- Verwijder de PEG oplossing en was driemaal met 200 pl kweekmedium.
- Voeg vers kweekmedium en terug te keren naar de incubator.
- Regelmatig te monitoren, de culturen naar cel beweging te observeren in de verboden zone.
3. Configuratie 2: Island Patterning (96-well plaat formaat)
- Bereid oplossingen van 5,0% wt / wt PEG en 12,8% w / w DEX in celkweekmedium, zoals hierboven.
- Oogst de cellen worden gebruikt voor eiland patroon. Bepaal het aantal / concentratie van cellen beschikbaar.
- Pellet en resuspendeer de cellen in een geschikt volume van 12,8% DEX de gewenste concentratie van cellen voor eiland patroonvorming te bereiken. Concentraties van 5.000 ceLLS / ul of minder worden aanbevolen voor sterk klevende celtypes. Voor cellen die moeilijkheden verbonden of cellen die losjes hechten hebben concentraties tot 10.000 cellen / ul worden overwogen.
- Snel werken om uitdroging te voorkomen, pipet 0,5 pl druppels van DEX op een droge ondergrond celkweek, zoals hierboven beschreven. Niet mogelijk druppels drogen. Optioneel: 200 pl PEG oplossing wordt toegevoegd aan de goed van tevoren. DEX druppels kunnen vervolgens worden gestort in de PEG-oplossing waar ze naar de bodem zinken en contact kweekoppervlak. Dit kan leiden tot schonere eiland patronen.
- Bedek de DEX druppeltjes met 200 pl PEG.
- In een bevochtigde incubator gedurende 12 uur bij 37 ° C, 5% CO2. Zorg ervoor dat de antenne niet gekanteld tijdens hantering en dat het op een vlakke plank incubator te voorkomen dat de patronen.
- Verwijder de PEG oplossing en was driemaal met 200 pl kweekmedium.
- Voeg verse cultuurmedium en terug te keren naar de incubator.
- Regelmatig te monitoren, de culturen naar cel beweging en proliferatie naar buiten van de eilanden te observeren.
4. Configuratie 3: Uitsluiting Co-culturen (96-well plaat formaat)
- Bereid oplossingen van 5,0% wt / wt PEG en 12,8% w / w DEX in celkweekmedium, zoals hierboven.
- Oogst de cellen worden gebruikt voor uitsluiting en eiland patronen. Bepaal het aantal / concentratie van cellen voor elk celtype. Optioneel: Sommige mobiele koppelingen kunnen worden weergegeven dramatisch anders proliferatie indices. De uitgesloten cellen voorkomen overpopulating het eiland patroon cellen (vooral voor kweken op lange termijn), behandelen cellen voor uitsluiting met mitomycine C gedurende 2 uur bestralen of ze voor de oogst. Dit voorkomt proliferatie. Fluorescerende CellTracker kleurstoffen kunnen worden gebruikt om de twee celpopulaties onderscheiden indien nodig.
- Pellet de cellen en resuspendeer de pellet voor exclusion patroonvorming in een geschikt volume van 5,0% PEG om het gewenste aantal cellen bereiken, zoals hierboven. Resuspendeer de pellet voor eiland patroonvorming in een geschikt volume van 12,8% DEX om de gewenste concentratie van cellen te bereiken, zoals hierboven.
- Met een micropipettor, afgezien 0,5 pl druppels DEX celsuspensie op een droge ondergrond celkweek. Niet mogelijk druppels drogen.
- Bedek de DEX druppeltjes met 200 pl PEG celsuspensie.
- In een bevochtigde incubator gedurende 12 uur bij 37 ° C, 5% CO2. Zorg ervoor dat de antenne niet gekanteld tijdens hantering en dat het op een vlakke plank incubator te voorkomen dat de patronen.
- Verwijder de PEG oplossing en was driemaal in 200 pl kweekmedium.
- Voeg vers kweekmedium en terug te keren naar de incubator.
- Bewaken van de co-culturen van de wisselwerking tussen celpopulaties te observeren. Optioneel: Controles kunnen worden bereid door het uitvoeren van uitsluiting of eiland patronen individually door co-cultuur cellen die niet reageren of blokkering wegen plaats in een of beide celpopulaties voor of na patroonvorming.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Het selecteren van een geschikte combinatie van PEG en DEX voor cel patroon is belangrijk om de binodaal curve. Deze curve schetst de punten waar een ATPS kan vormen en kan variëren voor een gegeven set van polymeren op basis van temperatuur, pH en ionische inhoud. Voor het kweken van cellen die aangepast medium formuleringen nodig kan het nodig om experimenteel bepalen binodaal curve. Dit wordt bereikt door het genereren van een reeks ATPSs die ver van de binodaal en variërend in de PEG en DEX inhoud (figuur 1 paars cirkels). Wanneer een ATPS aanwezig is, zal de polymeeroplossingen lijkt troebel bij menging en evenwicht in afzonderlijke fasen als ongestoord gelaten. Door toevoeging van extra oplosmiddel tot het polymeermengsel, de ATPS benaderen 0% PEG / 0% DEX. Op een bepaald moment zal het mengsel niet meer fasescheiding. De PEG / DEX concentratie waarbij dit gebeurt is een punt op de curve binodaal, boven dit punt een ATPS kunnen vormen en onder dat punt niet kan. De curves in figuur 1 zijn drie gemeenschappelijke binodals celkweekmedia met en zonder 10% foetaal bovine serum (FBS). De concentraties waarbij een ATPS gevormd zijn iets hoger in aanwezigheid van FBS.
In onze vorige verslagen, gebruikten we ATPSs op basis van een kritisch punt (het punt op de binodaal waar gelijke volumes van PEG en DEX vorm bij evenwicht) van 2,5% PEG 35 kDa/3.2% DEX 500 kDa. De resultaten van onze binodaal gegevens in de nabijheid van deze kritische puntwaarde. We negen fasen systeem combinaties getest patronen, zoals weergegeven in tabel 1. Aangezien hier oplossingen van PEG en DEX evenwicht met betrekking tot hun polymeerconcentraties nadat ze worden gecombineerd, hebben sommige van deze oplossingen geen stabiele ATPSs en waren derhalve niet bruikbaar voor de patroonvorming (Tabel 1a x marks). Andere polymeercombinaties geproduceerd herkenbare patronen, Maar waren niet uniform genoeg voor experimenten (Tabel 1a x / ✓ punten). Nuttige polymeerformuleringen gevormd verboden gebieden of eilanden die bijna zonder cellen in het niet-patroon gebieden (Tabel 1a ✓ punten).
Met 10% PEG, merkten we dat de celmorfologie was abnormaal rond en spindel-achtige na 24 uur, met cellen die een verminderd vermogen om te hechten aan de cultuur oppervlak (tabel 1b, x punten). Morfologie en bevestiging waren normaal 2,5% en 5% PEG (tabel 1b ✓ punten). Waargenomen dat serum neergeslagen uit het kweekmedium hoge PEG concentraties (Tabel 1c, x punten), hetgeen suggereert dat abnormale celmorfologie en bevestiging in 10% PEG kan worden gerelateerd aan problemen met serum toegang. Bovendien is bekend dat PEG verstoren plasmamembranen 27. Hoewel deze effecten worden alleen waargenomen bij hoge concentraties laag molecular gewicht PEG, is het het beste om te gebruiken de laagste PEG concentratie die betrouwbare patronen produceert.
In overeenstemming met onze eerdere verslagen, hebben we geconcludeerd dat 5% PEG/6.4% DEX en 5% PEG/12.8% DEX goed geschikt waren voor cel patronen, met 12,8% DEX productie van meer uniforme patronen. Verwachte resultaten voor drie patronen formats met Cell Tracker-gemerkte HeLa cellen worden getoond in Figuur 2. Door na elke patroon benadering is het mogelijk om uniforme patronen van elk type te maken, met zeer weinig cellen buiten het patroon gebieden.
Met uitsluiting eiland patroon is mogelijk om de proliferatie en migratie van gevormde cellen (Figuur 3). Gedurende drie dagen, HeLa cellen gevuld uitsluiting zones (Figuur 3a-c). Eiland-cellen geëxpandeerd patroon naar buiten uit de eerste patronen (figuren 3d-f). Deze veranderingen kunnen worden gekwantificeerd metstandaard ImageJ meetinstrumenten (figuren 3 c, f). Het is belangrijk op te merken dat wanneer meerdere celpopulaties zijn samen gekweekt (Figuur 2, Format 3), een celpopulatie kan uit-prolifereren en de andere te vervangen. Uitsluiting patronen en eiland patroonvorming kan nuttig zijn instrumenten om te beoordelen of dit een probleem zijn. In situaties waarin dramatische verschillen in proliferatie-index voorkomen, wordt aanbevolen dat een celpopulatie worden behandeld door bestraling of chemische factoren zijn proliferatie te beperken. Dit is bijzonder nuttig in situaties waarin een celtype wordt gebruikt als een drager voor een cel langzamer groeiende gevoeliger celtype.
Wij toonden dit principe kweken HepG2 cellen, een hepatocellulaire carcinoma cellijn die gewoonlijk wordt gebruikt om model hepatocyte biologie, NIH 3T3 fibroblast die werden aangehouden met mitomycine C (Figuur 4). Tijd, de HepG2 cellen behouden hun lokalisatie eend kolonie vorm (figuur 4a). Door vele druppeltjes in dezelfde plaat en ze te omgeven met fibroblasten is mogelijk deze cellen groeien in een formaat dat potentieel bruikbaar voor gemultiplexte studies (figuur 4b). Cell eiland monoculturen kan met dit formaat als controle voor de invloed van paracriene factoren (figuur 4c).
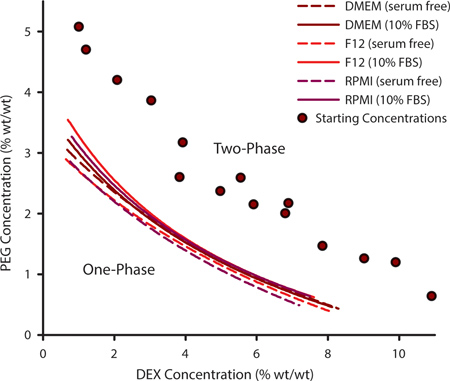
Figuur 1. De polymeerconcentraties waarbij een ATPS kan vormen kan worden afgeleid uit experimenteel bepaald binodaal curves. Binodaal Deze curve werd geconstrueerd volgens de methode troebelingspunt door extra oplosmiddel om de punten waar twee fasen mengsels van verschillende PEG / DEX concentraties (paars meten cirkels) niet langer konden fase separating. Binodals werden bepaald DMEM, F12 en RPMI met en zonder serum. Datapunten werden uitgerust met een drie-parameter rationale functie. N = 3 voor elk gegevenspunt.

Figuur 2. Door het afgeven van ATPS oplossingen op polystyreen platen, kunnen drie formaten voor mobiele patronen worden geproduceerd. De procedure begint met het pipetteren DEX druppels a) die vervolgens worden bekleed met PEG b). Zodra de cellen hechten, kan de ATPS oplossingen worden weggewassen en vervangen door kweekmedium (c, d). Fluorescentie beelden voor monoculturen werden gekleurd met CellTracker kleurstoffen na patronen. Voor co-culturen werden de cellen afzonderlijk gekleurd met CellTracker kleurstoffen voor patronen. HeLa cellen werden gebruikt om alle drie kweek te genereren. 
Figuur 3. Uitsluiting patronen en eiland patroon kan worden gebruikt om celmigratie en proliferatie te beoordelen. A) Uitsluiting patroon HeLa cellen 1 dag na patroon. B) Uitsluiting patroon HeLa cellen 3 dagen na patroon. C) cellen prolifereren en migreren, neemt de grootte van de verboden zone. d) Island-patroon HeLa cellen 1 dag na patroon. e) Island-patroon HeLa cellen 3 dagen na patroon. f) cellen prolifereren en migreren naar buiten, aanzienlijk uitbreiden van de grootte van het eiland. Beelden werden gekwantificeerd met behulp van ImageJ software om de cel clearing-en cel-eilanden te meten voor en na de migratie. Bars vertegenwoordigen betekenen± SEM van ten minste drie onafhankelijke waarnemingen.

Figuur 4. Levercel / fibroblastculturen kan worden gegenereerd met behulp ATPS uitsluiting co-cultuur patroon. A) Deze kolonies behouden hun organisatie tenminste 4 dagen in cultuur. B) meerdere eilanden zijn gerangschikt in een schotel met potentieel voor gemultiplexte of high-throughput assays. c) In vergelijking met niet-co-gekweekte eiland patronen, de co-gekweekte cellen vertonen iets hogere niveaus van albumine productie (bruine vlekken) zoals blijkt uit kwalitatieve vergelijking van albumine gekleurde co-culturen versus monoculturen. Albumine is een eiwit dat door levercellen. Daarom Dit resultaat suggereert dat de functie van levercellen wordt versterkt wanneer samen gekweekt met behulp fibroblast ATPS.
| a) gevormd patroon | 3,2% DEX | DEX 6,4% | DEX 12,8% |
| 2,5% PEG | x | x | x |
| 5,0% PEG | x / ✓ | ✓ | ✓ |
| PEG 10,0% | x / ✓ | ✓ | ✓ |
| b) morfologie | 3,2% DEX | DEX 6,4% | DEX 12,8% |
| 2,5% PEG | ✓ | ✓ | ✓ |
| 5,0% PEG | ✓ | ✓ | & # X2713; |
| PEG 10,0% | x | x | x |
| c) Serum Precipitation | 3,2% DEX | DEX 6,4% | DEX 12,8% |
| 2,5% PEG | ✓ | ✓ | ✓ |
| 5,0% PEG | ✓ | ✓ | ✓ |
| PEG 10,0% | x | x | x |
Tabel 1. A) ATPS formuleringen die kunnen worden gebruikt voor patroonvorming worden aangeduid met vinkjes die niet kunnen worden aangegeven door x merken. B) Formuleringen die normale celmorfologie en bevestiging eigenschappen behouden zijn aangegeven by vinkjes, die niet kunnen worden aangegeven door x merken. c) Formuleringen die resulteerde in precipitatie van serumeiwitten worden aangeduid met x merken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De ATPS cel micropatterning methode vereist zeer weinig expertise buiten vaardigheid in celkweek technieken en kan snel worden beheerst. De voordelen van deze benadering zijn dat het goedkoop, snel en compatibel met verschillende celtypes en cultuur formaten. Om deze redenen moeten ons protocol gemakkelijk worden overgenomen door het leven wetenschappers, met name degenen die een studie cel proliferatie, migratie en chemotaxis, en de invloed van juxtacrine en paracriene interacties tussen celpopulaties. De assays hier gepresenteerde kan gemakkelijk worden gekwantificeerd aan de celpopulatie niveau met behulp van standaard beeldanalyse procedures die beschikbaar zijn in de software zoals ImageJ.
Om een consistente patronen te genereren adviseren wij de volgende voorzorgsmaatregelen in acht. Ten eerste moet de pipetpunt gebruikt om de DEX oplossing afgifte worden gewijzigd na elke druppel DEX afgezet om consistentere druppel volumes zijn. Aangezien de DEX oplossing relatief viskeuzeHet is ook belangrijk te voorkomen deponeren dan DEX die aanwezig kunnen zijn op het buitenoppervlak van de pipetpunt en dat de gehele hoeveelheid DEX verlaat de tip waarborgen. Ten tweede kan de druppeltjes bewegen als PEG te krachtig toegevoegd of als de schotel wordt bewogen. DEX verstoring kan geminimaliseerd worden door de schotel op een vlakke ondergrond en waarbij de PEG oplossing geleidelijk de druppels van boven bestrijken zonder dat grote krachten van de PEG meniscus een deel van de druppel te verwijderen. Droplet verstoring optreedt vaker met grote druppels DEX, zodat druppeltjes 0,5 pl of minder worden gebruikt indien mogelijk. Naast deze technische problemen betrokken bij het afgeven van de oplossingen er weinig valkuilen in verband met deze techniek, mits geschikte polymeer molecuulgewichten en concentraties gebruikt.
Hoewel ATPS patroon kan gemakkelijk worden uitgevoerd met een micropipet (zoals hier uiteengezet), zijn er een aantal meer Sophisticated benaderingen die kunnen worden gebruikt om snel genereren patronen van meer complexe geometrische arrays (bijv. vloeistofverwerking robots en akoestische druppeluitwerping), zoals voorgesteld in onze eerdere studies 14, 15, 20. Het is ook mogelijk te genereren DEX druppels die veel kleiner in volume pneumatisch uitwerpen DEX zijn door capillaire openingen of door het indrukken van een opening in een microkanaal aan stromend DEX druppeltjes ommanteld door PEG 19 produceren. Deze benaderingen van belang kan zijn voor degenen die high-throughput of gemultiplexte co-cultuur of migratie testen te produceren. Bovendien met microfluïdische benaderingen, is het mogelijk om experimenten uit te voeren met een klein aantal cellen of cellen in een microkanaal waar de effecten van stromingen pure kunnen worden onderzocht. Echter, deze geavanceerde methoden niet vereist voor de meeste toepassingen.
Waterige tweefasensysteem patroon van cellen is eenvoudig en gemakkelijk worden aangepast aan een typische celcultuur instelling. Deze methode kan een onderzoeker met toegang tot een typische celkweek lab (toegang tot een kap, CO2 incubator en micropipetten) en de bovengenoemde polymeren reproduceerbaar patroon cellen in monocultuur en co-culture. Ons laboratorium aangetoond deze mogelijkheid door het afdrukken arrays van cellen om celmigratie bestuderen in een wondgenezende assay en de effecten van juxtacrine en paracriene signalering onderzocht in de differentiatie van embryonale cellen 16, 17, 20. Andere methoden, zoals patroonvorming van extracellulaire matrix 28, inkjetdruk 29, en patroonvorming door laminaire stroming in microfluïdische inrichtingen 25 zijn 26 ook gebruikt voor het lokaliseren cellen. Deze andere methoden effectieve benaderingen bereiken welbepaalde patronen van cellen en kunnen vaak bereiken eencellige precisie. Echter, deze methoden vereisen ook zeer gespecialiseerde apparatuur en / of de toegang tot cleanroom faciliteiten om de stempels gebruikt om pr te fabricerenint extracellulaire matrix eiwitten of produceren microfluidics apparaten. Hun verbinding met voedingen, spuit pompen en andere externe componenten belemmert ook de uitvoering ervan door de kosten in verband met de apparatuur en de gebruiker vaardigheid nodig is om hem te bedienen.
Bij toekomstige toepassingen verwachten we dat onze methode nuttig voor de ontwikkeling van kweeksystemen die high-throughput analyse van celbeweging en proliferatie, evenals onderzoek cel-cel interacties tussen meerdere celpopulaties mogelijk. Om dit punt, hebben onze rapporten betrekking op het onderzoek interactie van slechts een paar soorten van patroon cellen in een keer. Het is echter denkbaar dat veel subpopulaties van cellen kunnen worden gekweekt met een gemeenschappelijke voedingslaag het effect van paracriene en juxtacrine signalering van veel celtypen in een enkele celkweek gegroeid setup onderzoeken. Tot slot, tissue engineering toepassingen vaak nodig ruimtelijke lokalisatie vaneen of meer celtypen. Het kan mogelijk zijn onze techniek voor gebruik in patroonvorming cellen aangepast om meer fysiologisch relevant tissue engineered ziektemodellen produceren of patroon cellen op implanteerbare voor klinische toepassingen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben geen concurrerende financiële belangen.
Acknowledgments
Dit werk werd ondersteund door de Coulter Foundation, Beyster Foundation, de Undergraduate Research Opportunity (UROP) zomerprogramma voor ATA en een National Science Foundation Graduate Student Research Fellowship (Grant geen DGE 0718128; ID:. 2010101926) voor JBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



