Summary
水性二相系が細胞のパターンを同時に複数の集団に使用されていました。セルパターニングのためのこの迅速かつ簡単な方法は、デキストランとポリエチレングリコールと2ポリマー溶液との間に存在する界面張力の水溶液の相分離を利用しています。
Abstract
、速く、使いやすく、手頃な価格であり、細胞パターニング技術は、ハイスループット細胞アッセイ、細胞間相互作用や組織工学システムを研究するためのプラットフォームの将来の発展のため必要となります。この詳細なプロトコルは、閾値濃度の上に組み合わせた相分離することデキストラン(DEX)とポリエチレングリコール(PEG)の生体適合性のソリューションを用いて細胞の共培養を生成する方法を説明します。細胞は、このメソッドを使用して、さまざまな構成でパターニングすることができる。セルの除外パターニングは、基板上にDEXの滴を印刷して、PEGを含有する細胞のソリューションでそれらをカバーすることによって行うことができる。 2ポリマー溶液との間に形成される界面張力はDEXの液滴の外側に落下してマイグレーションアッセイに使用することができる円形のクリアを形成する細胞が発生。細胞島はPEG溶液に細胞が豊富なDEXフェーズを分配することによって、またはDEXを覆うことによりパターニングすることができるPEGの溶液を用いて滴。共培養はDEX島パターニングによる細胞除外を組み合わせることによって直接形成することができる。これらの方法は、マニュアルmicropipetting含む液体処理アプローチの様々な互換性があり、実質的に任意の接着細胞タイプで使用することができます。
Introduction
水性二相系(ATPSs)互換性のない2つのポリマーの溶液は十分に高い濃度で一緒に混合される形。相分離は、ポリマー、溶液の温度、pH、および水性溶媒、1,2のイオン含有量の分子量と極性を含む様々な要因に影響されます。 2ポリマー溶液が別々にある点は、選択された相系の物理化学的特性によって決まりますが、一般に、非変性条件下で低いポリマー濃度(20%未満の重量/重量)で発生し、ATPSsはバイオテクノロジーを使用することができるようにすることですアプリケーション3-9。
これまでで最も広範囲に研究ATPSは、ポリエチレングリコール(PEG)/デキストラン(DEX)のシステムです。これらの安価で、生体適合性ポリマーによって形成ATPSはもともと分子ショニング2、10を介して生体分子の精製の ために記述されていた。分割相系に寄与しない付加的な分子や粒子をPEGとDEXと混合している場合に発生します。 DEXまたはPEGのどちらかのためにそれらの相対的な親和性に基づいて、分子や粒子が優先的に二つの相の一つの中に、またはインターフェイスに属します。 PEG / DEX ATPSの別のプロパティには、2つのポリマー相の間の界面張力の存在である。 PEGとDEXによって形成ATPSsは、一般的に、水と油のような他の液-液二相系よりもはるかに低い界面張力を表示していますが、界面張力軍はまだそのようなウイルスは、細胞やタンパク質凝集体2のような小さな粒子に効果を発揮、11月13日 。哺乳類細胞上の任意の有害な影響は、これらの内に組み込まれた場合は最後に、塩の生理的濃度の存在下で低濃度(高分子量ポリマーの品種のための5%未満の重量/重量)で、より高い分子量のPEGとDEXが個別以来、いくつかありますシステム14から16。
最近では、界面特性とATPSsのパーティショニング効果が細胞パターニング14、16から20のための私達の研究室で適用されている。これは、PEGの存在下で細胞培養基板上に微細緻密なDEXのソリューションによって達成された。細胞は、PEG相に組み込まれている場合、それらは、PEG / DEX界面張力20によるDEX滴に入るから除外されます。細胞はDEXのフェーズにパターニングされている場合、それらは界面張力とパーティション16、17、19で細胞培養基板の表面に保持されます。
セルパターニングのための他の方法とは対照的に、ATPS細胞のパターニングは、学ぶことは簡単であり、唯一のポリマー自体、および細胞培養を行い、マイクロピペッターを使用する機能に関する初歩的な知識を必要とします。セルパターニングのための他の方法は、多くの場合、簡単に目に翻訳されていない特殊な機器と訓練を伴う電子生命科学。たとえば、いくつかの方法(マイクロコンタクト印刷やインクジェット印刷)間接的に続いて細胞接着21,22のための部位としての役割を果たす培養基質への細胞接着性生体分子のパターンを適用することにより、パターンセル。間接的なアプローチには、いくつかの細胞型のために有用であるが、それらはユーザスキルとパターニングツールを製作するための特殊な装置の高度を必要とし、特定の細胞型/生体分子のパターンに応じて特異性を欠くことができます。あるいは、細胞を層流パターニング、ステンシルやインクジェット印刷23から26を含むダイレクトパターニングのアプローチの方法によって高いパターン特異性で成膜することができる。しかしながら、これらの技術はまた、ユーザーの専門知識と特殊な装置を必要とし、印刷処理中に細胞を損傷することがあります。これらのアプローチは一般に、細胞パターニングのための生命科学分野の有用なツールであることが、細胞の正確なパターンを生成するが、それは費用対効果がなければなりません実装が簡単でND。
ここで我々は、以前に公開された出願に記載されてATPSsを用いてパターン化培養細胞を生成するための詳細なプロトコルを報告している。 micropipettorsのみを使用して、ユーザーは移動アッセイのための細胞除外ゾーンまたはセルの島を生成することができます。これはどちらかDEX期における細胞を保持またはDEXからのPEG相に堆積セルを除外PEG / DEX界面張力の方法によって達成される。これら2つの基本的なパターニング技術を組み合わせることによって、それは急速にそのような肝臓の線維芽細胞の共培養などの細胞の共培養を生成することが可能である。パターニング方法、ATPSパラメータと期待される結果を詳細に説明されています。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1。位相システムの特性解析:相分離のための決定しきい値
- 目的のバッファまたは細胞培養培地15 mlまたは50 mlコニカルチューブに図1(紫ドット)に示すようにPEGとDEXを含む溶液を調製します。以下、PEGとDEXは35 kDaのPEGおよび500kDaのDEXを参照しますが、臨界濃度は、使用される2つのポリマーに応じて変化します。各溶液中のPEGとDEXの質量を記録する。高濃度ポリマー溶液は、溶解するために数時間かかることがあります。ボルテックスは、無血清のソリューションを使用することができます。両方のポリマーが完全に溶解するまでのタンパク質または血清を含有する培地については、ロッキングステージにチューブを置きます。ポリマーを溶解し、初期濃度のメモを取るために使用されるメディアの重量を記録する。
- ポリマーが完全に溶解したら、溶液は濁って見えるはずです。これは、相分離が発生したことを最初の兆候です。これを確認するには、許可ポリマー溶液を20分間室温で垂直位置で休ませる。 1,000×gで遠心分離し、相分離のプロセスを加速するために使用できます。より高密度下相はDEX-リッチになり、上相は、PEG-リッチになります。
- ゆっくり管に、追加のバッファーまたはメディアを追加します。少しずつではなくシュート相分離点をするように使用されるべきである。
- 溶液は遠心分離後に明らかになると、もはや、相分離した場合、相分離のためのしきい値に達しました。チューブの最終重量を記録します。
- メディアを追加した後、相分離が発生しなくなったときのそれぞれの二つのポリマーの重量%/重量を決定する最終的な重量と一緒に、ポリマーのための前に記録した重みを使用して。
- これらの値をプロットし、x軸、y軸および%重量/重量%、DEXで重量/重量PEGなど。 binodal曲線として知られているこのプロットは、異なるconcentratiための相分離のための閾値濃度を決定するために使用することができます特定の細胞培養培地中のPEG / DEXのアドオン。
2。構成1:除外パターニング(96ウェルプレートフォーマット)
- 5.0パーセント重量/重量PEGおよび細胞培養培地の12.8%重量/重量DEXの別個の溶液を調製する。ポリマーは互いに対して平衡化した後ATPSが残っていることを確認するために二回少なくとも臨界点のATPSソリューションを使用しています。 PEG-rich相とその逆にDEXの少量のフラックス量があるため、臨界点以下の濃度の低下などの相系が失われる可能性が臨界濃度近く過ぎて働き。同様に、湿度と温度制御されたインキュベーターに細胞培養皿を転送するには、2つの位相特性を変更し、2つの溶液を混和することができます。注:一部の細胞は他のATPS製剤でパフォーマンスが向上する場合があります。許容される製剤は、第1部から決定binodal曲線に基づいて選択することができる。
- 除外パットに使用される細胞を回収rning。利用できる細胞の総数/濃度を決定する。オプション:CellTrackerや蛍光顕微鏡法のための他の非細胞毒性のラベルで細胞を標識する。
- 細胞をペレット化と排除のための細胞の必要な数を達成するために、5.0%のPEGの適切な音量でペレットを再懸濁します。例えば、96ウェルプレートのウェル1は37,500線維芽細胞は翌日合流を生成するために、PEGを200μlに再懸濁されている必要があります。他のタイプの細胞と培養基板サイズのため、必要に応じてこれらの数値をスケーリングします。
- マイクロピペッターを用いて、乾燥した細胞培養基板上にDEXの0.5μlの液滴を分注する。大きな体積の液滴が大きく除外ゾーンを作り出す。 0.1から1μlまでの範囲のサイズの液滴は除外微細化のために推奨されています。オプション:DEX滴が前もって24時間を堆積させ、室温で脱水させることができる。これは、掃除機のパターンを生成することができます。
- トンへのPEGの細胞懸濁液200μLを分注し彼はよくDEX滴をカバーする。
- 37℃で12時間加湿インキュベーター℃、5%CO 2の場所。皿は取扱い中に傾いていないこと、それはパターンの中断を避けるために、レベルインキュベーターの棚に置かれていることを確認します。
- のPEG溶液を除去し、培地200μlで3回洗浄する。
- 新鮮な培地とインキュベーターへの復帰を追加します。
- 除外ゾーンに細胞の動きを観察するために定期的な文化を監視します。
3。構成2:島のパターニング(96ウェルプレートフォーマット)
- 上記のように、細胞培養培地は5.0%重量/重量PEGおよび12.8パーセント重量/重量DEXの溶液を調製する。
- 島のパターニングに使用される細胞を回収する。利用できる細胞の総数/濃度を決定する。
- ペレットと島のパターニングのための細胞の所望の濃度を達成するために、12.8パーセントDEXの適切な音量で細胞を再懸濁します。 5000 CEの濃度LLS /μL以下を強く接着細胞型に対して推奨されています。難易アタッチまたは緩く付着した細胞を有する細胞は、最大10,000細胞/μlの濃度を考慮してもよい。
- 上述のように、乾燥した細胞培養基板上に、DEXのピペット0.5μlの液滴の乾燥を避けるために迅速に取り組んでいます。液滴が乾燥させないでください。オプション:PEG溶液200μlを前もってウェルに添加することができます。 DEXの液滴は、それらが底に沈むと文化面をご連絡いたしPEG溶液中に堆積させることができる。これはクリーナー島パターンを生成することができます。
- PEGの200μlとDEX滴をカバーしています。
- 37℃で12時間加湿インキュベーター℃、5%CO 2の場所。皿は取扱い中に傾いていないこと、それはパターンの中断を避けるために、レベルインキュベーターの棚に置かれていることを確認します。
- のPEG溶液を除去し、培地200μlで3回洗浄する。
- 新鮮な培養を追加中規模およびインキュベーターに戻ります。
- 島からの細胞の移動と増殖を外側に観察するために定期的な文化を監視します。
4。構成3:除外共培養(96ウェルプレートフォーマット)
- 上記のように、細胞培養培地は5.0%重量/重量PEGおよび12.8パーセント重量/重量DEXの溶液を調製する。
- 除外と島のパターニングに使用される細胞を回収する。各細胞型のために利用できる細胞の総数/濃度を決定する。オプション:いくつかのセルの組み合わせは劇的に異なる増殖指標を表示することがあります。島パターン化細胞(特に長期の培養用)overpopulatingから除外細胞を防ぐために、2時間のためにマイトマイシンCを除外するために使用した細胞を治療したり、収穫前にそれらを照射します。これは増殖を防ぐことができます。蛍光CellTracker色素は、必要に応じて2つの細胞集団を区別するために使用することができます。
- 細胞をペレット化し、exclusioためのペレットを再懸濁上記のように、細胞の必要な数を達成するために5.0%のPEGの適切な音量にnパターニング。上記のように、細胞の所望の濃度を達成するために、12.8パーセントDEXの適切なボリュームで、島のパターニングにペレットを再懸濁する。
- マイクロピペッターを用いて、乾燥した細胞培養基板上にDEXの細胞懸濁液0.5μlの液滴を分注する。液滴が乾燥させないでください。
- PEGの細胞懸濁液200μlとDEX滴をカバーしています。
- 37℃で12時間加湿インキュベーター℃、5%CO 2の場所。皿は取扱い中に傾いていないこと、それはパターンの中断を避けるために、レベルインキュベーターの棚に置かれていることを確認します。
- のPEG溶液を除去し、培地を200μlで3回洗浄する。
- 新鮮な培地とインキュベーターへの復帰を追加します。
- 細胞集団の間の相互作用を観察するために共培養を監視します。オプション:コントロールが除外または個人ラージヒル島パターニングを行うことにより調製することができるidually、相互作用しない共培養細胞によるまたはパターニング前または後のいずれかまたは両方の細胞集団への関心の経路を遮断することによって。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
セルパターニングのためのPEGとDEXの適切な組み合わせを選択するには、それはbinodal曲線を決定することが重要です。この曲線はATPSが形成でき、温度、pHおよびイオン内容に基づいて、ポリマーの特定のセットで異なる場合がありますする点を区別します。カスタマイズされた培地の処方を必要とする細胞を培養するためには、実験的にbinodal曲線を決定する必要があるかもしれません。これは、はるかにbinodalとそのPEGとDEXの内容で変化する( 図1、紫の円)からですATPSsのシリーズを生成することによって達成されます。 ATPSが存在する場合、ポリマー溶液を混合したときに曇って表示され、左側の邪魔されない場合は、別のフェーズに平衡状態になります。ポリマー混合物に追加の溶媒を添加することによって、ATPSは、PEG / 0%DEX 0%に近づきます。どこかの時点で、混合物は相分離しなくなります。これが発生したPEG / DEX濃度がbinodal曲線上の点を表します。そのポイント以上でPSはそれができない点を形成し、下記のことができます。 図1の曲線は、10%ウシ胎児血清(FBS)となしの3つの一般的な細胞培養培地のためbinodalsを表しています。 ATPSが形成された濃度は、FBSの存在下でわずかに高くなっています。
我々の以前の報告書では、kDa/3.2%DEX 500kDaの2.5%の臨界点(平衡化した後で、PEGとDEXの等量がフォームbinodal上の点)に基づいて、PEG 35 ATPSsを使用していました。当社binodalデータからの結果は、この臨界点値に近接している。 表1に示すように、我々は、パターニングのための9つの位相システムの組み合わせをテストした。それらが組み合わされた後、PEGとDEXの純粋なソリューションが彼らのポリマー濃度に対する平衡ので、これらのソリューションのいくつかは安定ATPSsを形成し、従ってパターニング( 表1a、×印)には役立ちませんでしたいませんでした。他のポリマーの組み合わせは、認識可能なパターンを作り出したしかし、実験のための十分な均一ではなかった( 表1a、X /✓マーク)。有用なポリマー製剤は除外ゾーンまたは非パターン領域( 表1a、✓マーク)中の細胞のほとんどを欠いていた島を形成した。
10%PEGを用いて、我々は、細胞の形態に気づいた細胞が培養表面に付着する能力の低下( 表1b、xマーク)を表示すると、紡錘状24時間後に異常にラウンドだったと。形態および添付ファイルは、2.5%と5%のPEG( 表1b、✓マーク)のは正常であった。我々は10%のPEGにおける異常細胞の形態や添付ファイルが血清アクセスの問題に関連しているかもしれないことを示唆し、高PEG濃度( 表1c、×印)での培養培地からその血清沈降を観察した。また、PEGは27プラズマ膜を破壊することが知られている。これらの効果はごく低いモルの高い濃度で観察されていますがecular量のPEGは、それが信頼性の高いパターニングを実現できる最小のPEG濃度を使用するのが最適です。
我々の以前の報告と一致して、我々は5%PEG/6.4%、DEX、5%PEG/12.8%DEXがうまく12.8パーセントDEXはより均一なパターンを生成すると、細胞のパターニングに適していたと結論づけた。携帯トラッカー標識HeLa細胞を用いて3パターニング形式のため期待した結果を図2に示します。各パターニングのアプローチに従うことによって、それがパターン化された領域の外側の非常に少数の細胞を用いて、各タイプの均一なパターンを作成することが可能です。
除外と島のパターニングを使用すると、それがパターン化された細胞の増殖と移動します ( 図3)を評価することが可能である。 3日間のコースで、HeLa細胞は除外ゾーン( 図3a-c)を満たした。島模様の細胞が初期パターン( 図3D-f)から外側に向かって拡大した。これらの変更は、使用して定量化することができる標準ImageJの測定ツール( 図3 C、F)。複数の細胞集団( 図2、書式3)を共培養する場合には、一つの細胞集団がアウト増殖し、他を置き換えることができることに注意することが重要です。除外パターニングと島のパターニングは、これが問題になるかどうかを評価するための有用なツールとなることができます。増殖指数の劇的な違いが発生する状況では、それは1つの細胞集団は、その増殖を制限する放射線照射または化学的要因によって治療されることをお勧めします。これは、特定の1つの細胞型が遅い成長より敏感な細胞型のための支持細胞として使用されている場合に便利です。
我々は、培養HepG2細胞は、一般的にマイトマイシンC( 図4)を使用して逮捕されたNIH 3T3線維芽細胞で、肝細胞生物学をモデル化するために使用される肝細胞癌細胞株によって、この原則を明らかにした。時間が経つにつれて、HepG2細胞はそれらの局在を維持dのコロニーの形状( 図4a)。同じプレートに多くの小滴を配置し、線維芽細胞とそれらを囲むことにより、多重化された研究( 図4b)のために有用である可能性がある形式で、これらの細胞を成長させることができる。セル島モノカルチャーはパラクリン因子の影響( 図4c)のためのコントロールとして、この形式で使用することができます。
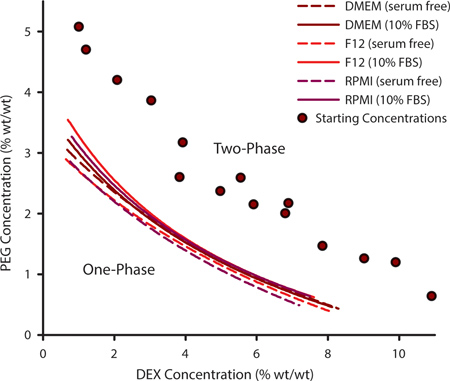
図1。 ATPSを形成することができるでポリマー濃度は、実験的に決定binodal曲線から外挿することができる。このbinodal曲線をPEG / DEX濃度(紫を変化させた時、二相混合物がポイントを測定するために、追加の溶媒を添加することによって、クラウド·ポイント法を用いて構築したサークル)は、もはや位相separatiすることができたんNG。 Binodalsは、血清を含まないDMEMと、F12とRPMIについて決定した。データポイントは、3つのパラメータの有理関数でフィッティングした。各データ点に対して、N = 3。

図2。ポリスチレンプレートにATPSソリューションを分配することによって、細胞をパターニングするための3つのフォーマットを作成することができる。手順はDEXの滴を)当時)、PEG bでコーティングされていることをピペッティングすることから始まります。細胞が付着したら、ATPSソリューションは洗い流され、培地(C、D)に置き換えることができます。単一栽培のための蛍光画像をパターニングした後CellTracker染料で染色した。共培養のために、細胞をパターニング前CellTracker染料で別々に染色した。 HeLa細胞は、すべての3つの文化形式を生成するために使用された。 
図3。除外パターニングと島のパターニングは、細胞遊走および増殖を評価するために使用することができます)除外パターン化されたHeLa細胞をパターニングした後1日であり、b)除外パターン化されたHeLa細胞は、パターニング後の3日間。c)細胞が増殖と移行し、大幅のサイズを小さくする除外ゾーンますd)アイランド柄のHeLa細胞パターニング後1日。e)の島模様のHeLa細胞を3日間パターニングした後、F)細胞は著しく、島の大きさを拡大し、増殖し、外側に移行します。画像は、移行前と移行後の細胞清算および細胞島嶼地域を測定するために、ImageJのソフトウェアを用いて定量した。バーは平均を表す少なくとも3つの独立した観測値の±SEMである。

図4。肝細胞/線維芽細胞培養はATPS除外共培養パターニングを用いて生成することができる。)これらのコロニーは培養液中で少なくとも4日間彼らの組織を維持する。b)複数の島が多重化や高スループットの可能性を持つ単一の皿に配列することができるアッセイc)は非共培養島のパターンと比較して、共培養細胞はアルブミンステンド共培養対単一栽培の定性的な比較から明らかなようにアルブミン産生のわずかに高いレベル(ブラウン染色)を表示します。アルブミンは、肝臓の細胞によって産生される蛋白質である。したがって、この結果はATPSを使用して線維芽細胞と共培養したときに肝細胞の機能が強化されていることを示唆している。
| a)のパターンを形成 | DEX 3.2パーセント | DEX 6.4パーセント | DEX 12.8パーセント |
| PEGの2.5パーセント | X | X | X |
| PEGの5.0% | X /✓ | ✓ | ✓ |
| PEGの10.0パーセント | X /✓ | ✓ | ✓ |
| b)の形態 | DEX 3.2パーセント | DEX 6.4パーセント | DEX 12.8パーセント |
| PEGの2.5パーセント | ✓ | ✓ | ✓ |
| PEGの5.0% | ✓ | ✓ | ✓ |
| PEGの10.0パーセント | X | X | X |
| c)の血清の降水 | DEX 3.2パーセント | DEX 6.4パーセント | DEX 12.8パーセント |
| PEGの2.5パーセント | ✓ | ✓ | ✓ |
| PEGの5.0% | ✓ | ✓ | ✓ |
| PEGの10.0パーセント | X | X | X |
表1。)パターニングに使用することができますATPS製剤はチェックマーク、×印で示されていることができないもので示されています。b)通常、細胞の形態や添付ファイルのプロパティを保持した製剤は、bに示されているyのチェックマーク、×印で示されていることができないものであり、c)血清タンパク質が沈殿した製剤は、×印で示されます。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ATPSセルの微細化方法は、細胞培養技術における習熟度を超えて非常に少ない専門知識を必要とし、速やかに習得することができます。このアプローチの利点は、それが、安価で迅速かつ細胞型および文化の様々なフォーマットと互換性があることです。これらの理由から、我々のプロトコルは、簡単に、特に生命科学、細胞の増殖、遊走および走化性、および細胞集団の間でjuxtacrineおよびパラクリン相互作用の影響を研究する人々によって採択されるべきである。ここで紹介するアッセイは簡単にそのようなImageJのようなソフトウェアで利用可能な標準的な画像解析の手順を使用して細胞集団レベルで定量することができる。
一貫性のあるパターンを生成するために、我々は以下の注意事項をアドバイスします。各DEXの液滴がより一貫した液滴ボリュームを提供するように堆積された後、最初にDEXのソリューションを分配するために使用するピペットチップを変更する必要があります。 DEXのソリューションは、比較的粘性であるため、は、ピペットチップの外側表面上に存在するかもしれないとDEX出口のボリューム全体先端ことを保証するために過剰なDEXを堆積避けることも重要です。 PEGがあまりに激しく追加された場合、または皿が傾いている場合、第二に、液滴が移動することができます。 DEXの破壊は、水平な床面上に皿を保ち、PEG溶液を徐々に滴の一部を取り除くために、PEGメニスカスから大きな力を許可せずに上から液滴をカバーできるようにすることで最小限に抑えることができます。液滴の乱れは、可能であれば、0.5μlの以下の液滴が使用されるべきであるので、大規模なDEXの液滴とより頻繁に発生します。別に解決策を小出しに関わるこれらの技術的な問題から、この技術に関連する非常に少数の落とし穴は、適切なポリマー分子量と濃度が使用されていれば、あります。
ATPSパターニングが容易にマイクロピペットを(ここで紹介する)を使用して実行できますが、よりsophiのものが用意されてい急速に、より複雑な幾何学的な配列( 例えば、液体ハンドリングロボットと音響滴吐出)のパターンを生成するために使用することができsticatedアプローチは、私たちのように先行研究14、15、20に提示した。それは、毛細管オリフィスを通してまたはPEG 19によって覆わ流れるDEXの液滴を生成するマイクロ流路にオリフィスを作動させることにより空気圧で噴射するのDEXによってボリュームにはるかに小さいですDEX液滴を生成することも可能である。これらのアプローチは、高スループットまたは多重共培養または遊走アッセイを生成しようとする者のために興味があるかもしれません。また、マイクロ流体アプローチを用いて、それが細胞の小さな番号を持つ、または流体の流れと薄手の効果を調べることができますどこにマイクロチャネル内の細胞を用いて実験を行うことが可能である。しかし、これらの先進的な方法は、ほとんどのアプリケーションでは必要ありません。
細胞の水性二相パターニングは単純であり、簡単に一般的なセルに適応カルチャ設定。この方法は、モノカルチャーと共培養における再現性パターンセルへの典型的な細胞培養実験室(フード、CO 2インキュベーター、及びマイクロピペットへのアクセス)と前述のポリマーへのアクセス権を持つすべての研究者を可能にします。私たちの研究室では、創傷治癒アッセイにおいて、細胞遊走を勉強すると胚細胞16、17、20の分化にjuxtacrineおよびパラクリンシグナリングの効果を調べるためにセルのアレイを印刷することにより、この能力を実証してきました。細胞外マトリックス28、インクジェット29のパターニングおよびマイクロ流体デバイス25、26の層流によるパターニングを含めた他の方法は、また、細胞をローカライズするために使用されている。これらの他の方法は、細胞の明確なパターンを達成するための効果的なアプローチであり、多くの場合、単一セルの精度を達成することができます。しかし、これらの方法はまた、高度に専門化された機器および/またはクリーンルーム施設へのアクセスは、PRに使用済み切手を製作するために必要int型の細胞外マトリックスタンパク質またはマイクロ流体デバイスを製造。電源装置、シリンジポンプ、およびその他の外部コンポーネントへの接続は、それを動作させるために必要な機器やユーザのスキルに関連するコストのために、その実施を妨げている。
将来のアプリケーションの面では、我々の方法は、細胞の運動と増殖のハイスループット分析だけでなく、複数の細胞集団の間で調査し、細胞間相互作用を可能にする培養システムを開発するために有用であろうことを期待しています。この時点まで、当社のレポートには、一度にパターン化された細胞のわずかな種類の相互作用を調べることに焦点を当てている。しかし、それは細胞の多くの亜集団が単一細胞培養セットアップで一緒に成長し、多くの種類の細胞のパラクリンとjuxtacrineシグナリングの影響を調査するために、共通のフィーダー層を用いて培養することができると考えられる。の最後に、組織工学アプリケーションが頻繁に必要となる空間的局在1以上の細胞タイプ。それは、より生理学的に関連する組織工学の疾患モデルを生成するか、臨床応用のための移植可能な材料でパターンセルにするために、パターン化細胞で使用するための我々の技術を適応することが可能である。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者らは、経済的利益を競っていない。
Acknowledgments
JBWための:;この作品は、コールター財団、Beysterファウンデーション、学部研究の機会(UROP)ATAおよび全米科学財団大学院学生研究フェローシップ(2010101926。番号グラントないDGE 0718128)のためのサマープログラムによってサポートされていました。
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



