Summary
Aqueuses systèmes biphasiques ont été utilisés pour les populations de motif simultanément de multiples cellules. Cette méthode est simple et rapide pour un patron de cellules tire parti de la séparation de phases de solutions aqueuses de glycol de polyéthylène et de dextrane et la tension interfaciale qui existe entre les deux solutions de polymères.
Abstract
Technologies patron de cellules qui sont rapides, faciles à utiliser et abordables seront nécessaires pour le développement futur des hauts dosages de cellules débit, plates-formes pour l'étude des interactions cellule-cellule et des systèmes de l'ingénierie tissulaire. Ce protocole détaillé décrit une méthode pour générer des co-cultures de cellules en utilisant des solutions biocompatibles de dextrane (DEX) et de polyéthylène glycol (PEG) que phase séparée lorsqu'ils sont combinés au-dessus des seuils de concentration. Cellules peut être configurée en une variété de configurations en utilisant ce procédé. Un motif d'exclusion de cellules peut être réalisée par des gouttelettes d'impression DEX sur un substrat et à les recouvrir avec une solution de PEG contenant des cellules. La tension interfaciale entre la solution formée polymère provoque deux cellules de tomber à l'extérieur de la gouttelette DEX et former un dégagement circulaire qui peut être utilisé pour les essais de migration. Îlots de cellules peut être modelée par la distribution d'une phase riche en cellules DEX dans une solution de PEG ou en recouvrant le DEXde gouttelettes avec une solution de PEG. Co-cultures peuvent être formées directement par la combinaison d'exclusion de cellules avec DEX île de motifs. Ces méthodes sont compatibles avec une variété d'approches de manipulation des liquides, y compris micropipetage manuel, et peut être utilisé avec n'importe quel type de cellules adhérentes.
Introduction
Aqueuses systèmes à deux phases (ATPSs) se forment lorsque des solutions de deux polymères incompatibles sont mélangés à des concentrations suffisamment élevées. Séparation de phase est influencée par divers facteurs, dont la masse moléculaire et la polarité des polymères, la température de la solution, le pH et la composition ionique de la solution aqueuse de solvant 1, 2. Le point où les deux solutions de polymère séparés est déterminée par les propriétés physico-chimiques du système de phase choisi, mais se produit généralement à des concentrations faibles de polymère (moins de 20% en poids / poids) sous des conditions non dénaturantes, permettant ATPSs à être utilisé pour la biotechnologie applications 3-9.
De loin, l'ATPS plus étudiés est le polyéthylène glycol (PEG) / dextran (DEX) du système. Les ATPS formés par ces polymères biocompatibles et peu coûteux a été décrit pour la purification de biomolécules au moyen de partitionnement moléculaire 2, 10. Partitionnementse produit lorsque les molécules ou particules supplémentaires qui ne contribuent pas au système de phase sont mélangés avec du PEG et DEX. Sur la base de leurs affinités relatives pour chaque DEX ou PEG, les molécules ou particules seront de préférence résider dans une des deux phases ou à l'interface. Une autre propriété de l'ATPS PEG / DEX est l'existence de la tension interfaciale entre les phases polymères deux. ATPSs formés par PEG et DEX affichent généralement des tensions interfaciales qui sont beaucoup plus bas que les autres liquide-liquide à deux phases des systèmes tels que le pétrole et l'eau, mais les forces de tension interfaciale encore exercer des effets sur de petites particules telles que les virus, les cellules et les agrégats de protéines 2 , 11-13. Enfin, depuis le plus haut poids moléculaire du PEG et DEX séparé à de faibles concentrations (moins de 5% en poids / poids de polymères de haut poids moléculaire variétés) en présence de concentrations physiologiques de sels, il ya peu ou pas d'effets délétères sur les cellules de mammifères incorporé au sein de ces systèmes14-16.
Récemment, les propriétés interfaciales et des effets de partitionnement de ATPSs ont été appliquées par notre laboratoire pour 14 patron de cellules, 16-20. Cela a été accompli par micromodelage une solution plus dense DEX sur des substrats de culture cellulaire en présence de PEG. Lorsque les cellules sont incorporées dans la phase PEG, ils sont exclus de pénétrer dans les gouttelettes de DEX en raison de PEG / DEX tension interfaciale 20. Lorsque les cellules sont en motif dans la phase DEX, ils sont conservés à la surface du substrat de culture cellulaire par tension interfaciale et de cloisonnement 16, 17, 19.
Contrairement à d'autres méthodes pour la modélisation cellulaire, patron de cellules ATPS est facile à apprendre et ne nécessite que des connaissances rudimentaires sur les polymères eux-mêmes, et la possibilité d'effectuer une culture cellulaire et d'utiliser une micropipette. D'autres méthodes pour la modélisation cellulaire impliquent souvent un équipement spécialisé et de formation qui ne sont pas facilement convertis en ee sciences de la vie. Par exemple, certaines méthodes (microcontact impression ou impression jet d'encre), les cellules motif indirectement par l'application de modèles de biomolécules d'adhésion cellulaire à un substrat de culture que par la suite servir de sites de fixation 21 cellules, 22. Bien que les approches indirectes sont utiles pour certains types de cellules, elles exigent un haut degré de compétences de l'utilisateur et de l'équipement spécialisé pour la fabrication de l'outil de structuration, et peuvent manquer de spécificité en fonction du type de cellule / biomolécules modèle particulier. Alternativement, les cellules peuvent être déposés auprès de la spécificité modèle haut au moyen d'approches de structuration directs qui comprennent flux laminaire motifs, pochoirs et 23-26 impression jet d'encre. Cependant, ces techniques nécessitent en outre l'expertise des utilisateurs et des équipements spécialisés, et peuvent endommager les cellules au cours du processus d'impression. Bien que ces approches produisent généralement des modèles précis de cellules, de patron de cellules pour être un outil utile dans les sciences du vivant, il doit être rentable unee simple à mettre en œuvre.
Nous rapportons ici un protocole détaillé pour la production des cultures de cellules en utilisant les motifs ATPSs décrits dans nos applications précédemment publiées. Utilisation Micropipettes seulement, les utilisateurs peuvent générer des zones d'exclusion de cellules ou des îles de cellules pour des essais de migration. Ce résultat est obtenu au moyen de PEG / DEX tension interfaciale qui conserve soit des cellules dans la phase DEX ou exclut les cellules déposées dans la phase PEG de DEX. En combinant ces deux techniques de dessin fondamentales, il est possible de générer rapidement des co-cultures de cellules comme les fibroblastes de cellules de foie co-cultures. Méthodes de structuration, les paramètres de l'ATPS et les résultats attendus sont décrits en détail.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Caractérisation Phase System: seuils déterminant pour la séparation de phase
- Préparer des solutions contenant du PEG et DEX dans le tampon désiré ou milieu de culture cellulaire comme le montre la figure 1 (points violets) dans 15 ml ou 50 ml tubes coniques. Ci-après, le PEG et DEX se référeront à 35 kDa PEG et 500 kDa DEX; cependant, les concentrations critiques vont changer en fonction des deux polymères utilisés. Noter la masse de PEG et de DEX dans chaque solution. Forte concentration des solutions de polymères peut prendre plusieurs heures à se dissoudre. Vortex peuvent être utilisées pour des solutions sans sérum. Pour les médias contenant des protéines ou du sérum, placer les tubes sur une scène à bascule jusqu'à ce que les deux polymères sont complètement dissous. Noter le poids des médias utilisés pour dissoudre les polymères et prendre note des concentrations initiales.
- Une fois que les polymères sont complètement dissous, les solutions doivent apparaître nuageux. C'est la première indication que la séparation de phase a eu lieu. Pour confirmer cela, permettre à l'des solutions de polymère au repos dans une position verticale à la température ambiante pendant 20 min. Centrifugation à 1000 xg peut être utilisé pour accélérer le processus de séparation de phase. La phase inférieure dense sera DEX-riche et la phase supérieure sera PEG-riche.
- Ajouter lentement tampon supplémentaire ou un support pour les tubes. Petits incréments doivent être utilisés de manière à ne pas dépasser le point de séparation des phases.
- Lorsque la solution devient limpide et non plus en phase sépare après centrifugation, le seuil de séparation de phase a été atteint. Enregistrer le poids final du tube.
- En utilisant les pondérations précédentes enregistrées dans les polymères, en même temps que le poids final après ajout de médias, déterminer le% en poids / poids de chacun des deux polymères au cours de laquelle la séparation de phase ne se produit plus.
- Tracer ces valeurs en% en poids / poids de PEG sur l'axe des y et% en poids / poids DEX sur l'axe des abscisses. Cette courbe, appelée courbe binodale, peut être utilisé pour déterminer la concentration de seuil de séparation de phase pour différentes concentrations dModules de PEG / DEX dans un milieu de culture cellulaire spécifique.
2. Configuration 1: Modélisation Exclusion (96 puits Format de plaque)
- Préparer des solutions séparées de 5,0% en poids / poids de PEG et de 12,8% en poids / poids DEX en milieu de culture cellulaire. Utiliser des solutions de l'ATPS au moins deux fois le point critique pour s'assurer que l'ATPS reste après que les polymères s'équilibrer par rapport à l'autre. Il ya une petite quantité de flux de DEX dans la phase riche en PEG et vice-versa, par conséquent, travailler trop près de la concentration critique peut entraîner la perte du système de phase en baisse des concentrations inférieures à point critique. De même, le transfert de la boîte de culture cellulaire à un incubateur à humidité et à température contrôlée peut modifier les propriétés de deux phases et de faire les deux solutions miscibles. Note: Certaines cellules peuvent être plus efficaces avec les formulations de l'ATPS autres. Formulations acceptables peuvent être choisis en fonction des courbes binodale déterminées à partir de la partie 1.
- Récolter les cellules à utiliser pour l'exclusion patterning. Déterminer le nombre total / concentration de cellules disponibles. En option: marquer les cellules avec CellTracker ou d'autres non-cytotoxiques étiquettes pour la microscopie de fluorescence.
- Sédimenter les cellules et resuspendre le culot dans un volume approprié de 5,0% PEG pour atteindre le nombre désiré de cellules d'exclusion. Par exemple, un puits d'une plaque de 96 puits nécessite 37.500 cellules de fibroblastes d'être remis en suspension dans 200 ul de PEG pour produire confluence le jour suivant. L'échelle de ces chiffres en fonction de d'autres types cellulaires et tailles substrat de culture.
- Utiliser une micropipette, distribuer 0,5 pi de gouttelettes DEX sur un substrat de culture cellulaire sec. Gouttelettes plus grand volume de production plus grandes zones d'exclusion. Gouttelettes dont la taille varie de 0,1 à 1 ul sont recommandés pour micromodelage exclusion. En option: DEX gouttelettes peuvent être déposées 24 heures à l'avance et laisse se déshydrater à la température ambiante. Cela peut produire des modèles plus propres.
- Distribuer 200 l de suspension cellulaire PEG dans til en bonne santé pour couvrir les gouttelettes DEX.
- Placer dans un incubateur humidifié pendant 12 heures à 37 ° C, 5% de CO 2. Assurez-vous que le plat n'est pas incliné lors de la manipulation et qu'il est placé sur une étagère niveau incubateur pour éviter de perturber les habitudes.
- Retirer la solution de PEG et laver trois fois avec 200 ul de milieu de culture.
- Ajouter milieu de culture frais et revenir à l'incubateur.
- Surveiller les cultures périodiquement pour observer le mouvement des cellules dans la zone d'exclusion.
3. Configuration 2: Modélisation Island (Format de plaque de 96 puits)
- Préparer des solutions de 5,0% en poids / poids de PEG et de 12,8% en poids / poids DEX en milieu de culture cellulaire, comme ci-dessus.
- Récolter les cellules à utiliser pour des motifs île. Déterminer le nombre total / concentration de cellules disponibles.
- Granulés et remettre en suspension les cellules dans un volume approprié de 12,8% DEX pour obtenir la concentration désirée de cellules pour la modélisation île. Les concentrations de 5000 CElls / ul ou moins sont recommandées pour les types de cellules fortement adhérentes. Pour les cellules qui ont de la difficulté de fixer ou de cellules qui adhèrent faiblement, les concentrations de jusqu'à 10.000 cellules / ul peut être envisagée.
- En travaillant rapidement pour éviter le dessèchement, Pipeter 0,5 pi de gouttelettes DEX sur un substrat de culture cellulaire sec, tel que décrit ci-dessus. Ne pas laisser sécher les gouttelettes. En option: 200 pi de solution de PEG peut être ajouté à la bien à l'avance. DEX gouttelettes peuvent alors être déposés dans la solution de PEG où ils se déposent au fond et contact avec la surface de culture. Cela peut produire des modèles plus propres îles.
- Couvrir les gouttelettes DEX avec 200 ul de PEG.
- Placer dans un incubateur humidifié pendant 12 heures à 37 ° C, 5% de CO 2. Assurez-vous que le plat n'est pas incliné lors de la manipulation et qu'il est placé sur une étagère niveau incubateur pour éviter de perturber les habitudes.
- Retirer la solution de PEG et laver trois fois avec 200 ul de milieu de culture.
- Ajouter culture fraîchemoyen et retour à l'incubateur.
- Surveiller les cultures périodiquement pour observer le mouvement vers l'extérieur des cellules et la prolifération des îles.
4. Configuration 3: Exclusion des co-cultures (format plaque de 96 puits)
- Préparer des solutions de 5,0% en poids / poids de PEG et de 12,8% en poids / poids DEX en milieu de culture cellulaire, comme ci-dessus.
- Récolter les cellules à utiliser pour l'exclusion et de motifs île. Déterminer le nombre total / concentration de cellules disponibles pour chaque type de cellule. En option: Certaines paires de cellules peuvent afficher des indices de prolifération radicalement différents. Pour éviter que les cellules exclus de la surpopulation des cellules insulaires configuration (en particulier pour les cultures à long terme), le traitement des cellules utilisées pour l'exclusion de la mitomycine C pendant 2 heures ou les irradier avant la récolte. Cela permettra d'éviter la prolifération. Colorants fluorescents CellTracker peut être utilisé pour distinguer les deux populations de cellules si nécessaire.
- Sédimenter les cellules et remettre en suspension le culot de exclusion de motifs dans un volume approprié de PEG 5,0% pour atteindre le nombre désiré de cellules, comme ci-dessus. Reprendre le culot pour la modélisation île dans un volume approprié de 12,8% DEX pour obtenir la concentration désirée de cellules, comme ci-dessus.
- Utiliser une micropipette, distribuer 0,5 gouttelettes ul de suspension cellulaire DEX sur un substrat de culture cellulaire sec. Ne pas laisser sécher les gouttelettes.
- Couvrir les gouttelettes DEX avec 200 pi de suspension cellulaire PEG.
- Placer dans un incubateur humidifié pendant 12 heures à 37 ° C, 5% de CO 2. Assurez-vous que le plat n'est pas incliné lors de la manipulation et qu'il est placé sur une étagère niveau incubateur pour éviter de perturber les habitudes.
- Retirer la solution de PEG et laver trois fois dans 200 pi de milieu de culture.
- Ajouter milieu de culture frais et revenir à l'incubateur.
- Surveiller les co-cultures d'observer l'interaction entre les populations de cellules. En option: Les contrôles peuvent être préparés en effectuant l'exclusion ou de la modélisation île individually, par co-culture des cellules qui n'interagissent pas ou en bloquant les voies d'intérêt dans une ou les deux populations de cellules avant ou après formation de motif.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Pour sélectionner une combinaison appropriée de PEG et de DEX pour la modélisation cellulaire, il est important de déterminer la courbe binodale. Cette courbe délimite les points au niveau desquels peuvent se former une ATPS et peut varier d'un ensemble donné de polymères sur la base de la température, le pH et la teneur ionique. Pour la culture de cellules qui nécessitent formulations de milieu personnalisés, il peut être nécessaire de déterminer expérimentalement la courbe binodale. Ceci est accompli en générant une série de ATPSs qui sont loin de la binodale et variées dans leur contenu et de PEG DEX (figure 1, cercles violets). Quand un ATPS est présent, les solutions de polymères apparaîtra trouble lorsqu'il est mélangé et s'équilibrer en phases séparées si elle n'est pas tranquille. Par addition de solvant supplémentaire au mélange de polymères, les ATPS approchera PEG 0% / 0% DEX. À un certain moment, le mélange ne sera plus une séparation de phase. La concentration de PEG / DEX auquel ceci se produit représente un point de la courbe binodale; une au-dessus de ce point APS peuvent se former et dessous de ce point il ne peut pas. Les courbes de la figure 1 représentent binodals pour trois communes milieux de culture cellulaire avec et sans 10% de sérum de veau fœtal (FBS). Les concentrations auxquelles un ATPS est formés sont légèrement plus élevée en présence de SVF.
Dans nos rapports précédents, nous avons utilisé ATPSs basée sur un point critique (le point sur la binodale au cours de laquelle des volumes égaux de forme et de PEG DEX après équilibrage) de 2,5% de PEG 35% kDa/3.2 DEX 500 kDa. Les résultats de nos données binodale sont à proximité de cette valeur du point critique. Nous avons testé les combinaisons de systèmes neuf phases de structuration, comme indiqué dans le tableau 1. Depuis solutions pures de PEG et de DEX s'équilibrer par rapport à leurs concentrations en polymère après ils sont combinés, certaines de ces solutions ne font pas ATPSs stables, et ne sont donc pas utiles pour la modélisation (tableau 1a, les marques de x). D'autres combinaisons de polymères produites motifs reconnaissables, Mais ils n'étaient pas assez uniforme pour l'expérimentation (tableau 1a / x ✓ points). Utiles formulations de polymères formées des zones d'exclusion ou des îles qui étaient pratiquement dépourvu de cellules dans les régions sans configuration (tableau 1a, ✓ points).
Avec PEG 10%, nous avons remarqué que la morphologie des cellules était anormalement rond et du type broche au bout de 24 h, avec des cellules affichant une diminution de la capacité à joindre à la surface de culture (tableau 1b, marques x). Morphologie et d'attachement était normal pour 2,5% et 5% PEG (tableau 1B, ✓ points). Nous avons observé que le sérum précipité du milieu de culture à des concentrations élevées (PEG Tableau 1c, marques x), ce qui suggère que la morphologie cellulaire anormale et l'attachement au PEG 10% pourrait être liée à des problèmes d'accès sérum. En outre, le PEG est connu pour perturber les membranes plasmiques 27. Bien que ces effets sont observés qu'à des concentrations élevées de mol basPEG de poids ecular, il est préférable d'utiliser la plus faible concentration de PEG qui produit des motifs fiable.
Conformément à nos rapports précédents, nous avons conclu que 5% PEG/6.4% et 5% DEX PEG/12.8% DEX étaient bien adaptés pour la modélisation cellulaire, avec 12,8% DEX produire des modèles plus uniformes. Les résultats attendus pour trois formats de motifs à l'aide de cellules marquées Téléchargeurs cellules HeLa sont présentés dans la figure 2. En suivant chaque approche de structuration, il est possible de créer des modèles uniformes de chaque type, avec très peu de cellules en dehors des zones à motifs.
Utilisation d'exclusion et de motifs île, il est possible d'évaluer la prolifération et la migration des cellules motifs (figure 3). Au cours de trois jours, les cellules HeLa ont rempli les zones d'exclusion (figures 3a-c). Île-cellules motifs élargie à l'extérieur à partir des modèles initiaux (figures 3d-f). Ces changements peuvent être quantifiés à l'aidestandards ImageJ outils de mesure (figures 3 c, f). Il est important de noter que lorsque plusieurs populations de cellules sont co-cultivées (figure 2, type 3), une population de cellules peuvent proliférer et hors remplacer l'autre. Motifs d'exclusion et de structuration île peuvent être des outils utiles pour évaluer si ce sera un problème. Dans les situations où des différences spectaculaires dans l'index de prolifération se produisent, il est recommandé une population cellulaire être traités par des facteurs d'irradiation ou de produits chimiques pour limiter sa prolifération. Ceci est particulièrement utile dans les situations où un type de cellule est utilisée comme une cellule de support pour une croissance plus lente de type cellule plus sensible.
Nous avons démontré ce principe par culture de cellules HepG2, une lignée cellulaire de carcinome hépatocellulaire qui est couramment utilisé pour la biologie modèle hépatocyte, avec les NIH 3T3 de fibroblastes qui ont été arrêtés en utilisant la mitomycine C (figure 4). Au fil du temps, les cellules HepG2 maintenir leur localisation d'unforme d colonie (figure 4a). En plaçant de nombreuses gouttelettes dans la même assiette et les entourer avec des fibroblastes il est possible de cultiver ces cellules dans un format qui est potentiellement utile pour les études multiplexés (figure 4b). Monocultures de cellules insulaires peuvent être utilisés avec ce format comme un contrôle de l'influence des facteurs paracrines (figure 4c).
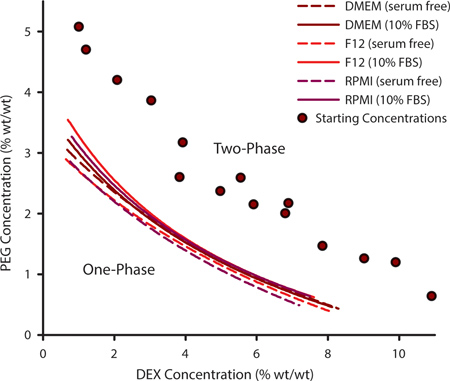
Figure 1. Les concentrations en polymère au cours de laquelle un ATPS peuvent former peuvent être extrapolées à partir des courbes déterminées expérimentalement binodale. Cette courbe binodale a été construite selon la méthode de point de trouble par ajout d'un solvant additionnel pour mesurer les points auxquels les deux phases des mélanges de différents PEG / DEX concentrations (pourpre cercles) n'étaient plus capables de la phase separating. Binodals ont été déterminées pour DMEM, RPMI F12 et avec et sans sérum. Les points de données ont été équipés d'une fonction de trois paramètres rationnelle. N = 3 pour chaque point de données.

Figure 2. Par la distribution de solutions ATPS sur des plaques de polystyrène, trois formats de patron de cellules peuvent être produites. La procédure commence par pipetage gouttelettes DEX a) qui sont ensuite enrobés avec PEG b). Une fois que les cellules s'attachent, les solutions ATPS peut être emporté et remplacé par du milieu de culture (c, d). Images de fluorescence pour les monocultures ont été colorés avec des colorants CellTracker après les motifs. Pour les co-cultures, les cellules ont été colorées avec des teintures CellTracker séparément avant de structuration. Des cellules HeLa ont été utilisés pour générer les trois formats de culture. 
Figure 3. Motifs d'exclusion et de structuration île peut être utilisée pour évaluer la migration et la prolifération cellulaire. Une exclusion) motifs des cellules HeLa 1 jour après structuration. B) Exclusion motifs des cellules HeLa 3 jours après structuration. C) Les cellules prolifèrent et migrent, réduisant considérablement la taille de l' zone d'exclusion. d) l'île aux motifs des cellules HeLa 1 jour après structuration. e) l'île aux motifs des cellules HeLa 3 jours après les motifs. f) Les cellules prolifèrent et migrent vers l'extérieur, élargissant considérablement la taille de l'île. Les images ont été quantifiés à l'aide du logiciel ImageJ pour mesurer le dégagement des cellules et des zones insulaires cellulaires avant et après la migration. Bars représentent la moyenne± SEM d'au moins trois observations indépendantes.

Figure 4. Cellules du foie / fibroblastes cultures peut être généré à l'aide d'exclusion ATPS co-culture de motifs. A) Ces colonies maintenir leur organisation pendant au moins 4 jours de culture. B) îles multiples peuvent être répartis dans un plat unique avec un potentiel de multiplexé ou à haut débit dosages. c) Par rapport aux modèles île non co-cultivées, les cellules co-cultivées affichent des niveaux légèrement plus élevés de la production d'albumine (coloration brune) comme le montre une comparaison qualitative des vitraux albumine co-cultures contre les monocultures. L'albumine est une protéine produite par des cellules du foie. Par conséquent, ce résultat suggère que la fonction des cellules du foie est augmentée en cas de co-cultivées avec des fibroblastes en utilisant l'ATPS.
| a) motif formé | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | x | x | x |
| PEG 5,0% | x / ✓ | ✓ | ✓ |
| PEG 10,0% | x / ✓ | ✓ | ✓ |
| b) Morphologie | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | & # X2713; |
| PEG 10,0% | x | x | x |
| c) Précipitations Sérum | DEX 3,2% | DEX 6,4% | DEX 12,8% |
| PEG 2,5% | ✓ | ✓ | ✓ |
| PEG 5,0% | ✓ | ✓ | ✓ |
| PEG 10,0% | x | x | x |
Tableau 1. Une formulation ATPS) qui peuvent être utilisés pour un motif sont indiquées par des coches, celles qui ne sont signalées par des repères x. B) Formulations qui conservent la morphologie des cellules normales et des propriétés de fixation sont indiqués bcoches y, ceux qui ne peuvent pas sont indiquées par des marques de x. c) Formulations qui ont abouti à la précipitation des protéines sériques sont indiquées par des marques de x.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La méthode de l'ATPS micromodelage cellule nécessite une expertise très peu au-delà de la maîtrise des techniques de culture cellulaire et peut être rapidement maîtrisé. Les avantages de cette approche est qu'elle est peu coûteuse, rapide et compatible avec une variété de types de cellules et les formats de la culture. Pour ces raisons, notre protocole devrait être facilement adoptée par les sciences de la vie, en particulier ceux qui étudient la prolifération cellulaire, la migration et la chimiotaxie, et l'influence des interactions juxtacrine et paracrine entre les populations de cellules. Les analyses présentées ici peuvent être facilement quantifiés au niveau de la population cellulaire en utilisant les procédures standard d'analyse d'images disponibles dans un logiciel tel que ImageJ.
Pour générer des schémas cohérents, nous conseillons les précautions suivantes. Tout d'abord, la pointe de la pipette utilisée pour distribuer la solution DEX doit être changée après chaque gouttelette DEX est déposé pour fournir des volumes des gouttelettes plus cohérentes. Comme la solution DEX est relativement visqueux, Il est également important d'éviter les excès de dépôt DEX qui pourraient être présentes sur la surface externe de l'embout de la pipette et de s'assurer que la totalité du volume des sorties DEX la pointe. Deuxièmement, les gouttelettes peuvent se déplacer si le PEG est ajouté trop vigoureusement ou si le plat est incliné. Perturbation DEX peut être minimisé en gardant le plat sur une surface plane et permettant à la solution de PEG pour couvrir progressivement les gouttelettes d'en haut sans laisser de grandes forces du ménisque PEG pour déloger le cadre de la gouttelette. Perturbation gouttelettes se produit plus fréquemment avec des gouttelettes DEX grandes, donc des gouttelettes de 0,5 pi ou moins doit être utilisé si possible. En dehors de ces aspects techniques liés à la distribution des solutions, il ya des pièges très peu associés à cette technique, pourvu que des masses moléculaires des polymères et des concentrations sont utilisées.
Bien que l'ATPS structuration peut être facilement réalisée en utilisant une micropipette (tel que présenté ici), il existe une variété de plus sophiapproches sticated qui peuvent être utilisés pour générer rapidement des modèles de tableaux géométriques plus complexes (par exemple des robots de manipulation de liquides et d'éjection des gouttelettes acoustique), tel que présenté dans nos études antérieures 14, 15, 20. Il est également possible de générer des gouttelettes DEX qui sont beaucoup plus petits en volume par voie pneumatique à travers des orifices d'éjection de DEX capillaires ou par l'actionnement d'un orifice dans un microcanal pour produire des gouttelettes s'écoulant DEX gainées par PEG 19. Ces approches peuvent être d'intérêt pour ceux qui cherchent à produire à haut débit ou multiplexés tests de co-culture ou de la migration. En outre, en utilisant des approches microfluidiques, il est possible de réaliser des expériences avec un petit nombre de cellules, ou avec des cellules dans un microcanal où les effets de l'écoulement du fluide et pure peut être examiné. Cependant, ces méthodes avancées ne sont pas nécessaires pour la plupart des applications.
Aqueuse à deux phases de motif de cellules est simple et facilement adaptable à une cellule typiquemise en culture. Cette méthode permet à tout chercheur ayant accès à un laboratoire de culture cellulaire typique (accès à une hotte, incubateur à CO 2, et micropipettes) et les polymères précités aux cellules motif reproductible dans la monoculture et la co-culture. Notre laboratoire a démontré cette capacité en imprimant des matrices de cellules pour étudier la migration cellulaire dans un test de guérison des plaies et pour examiner les effets de la signalisation juxtacrine et paracrine dans la différenciation des cellules embryonnaires 16, 17, 20. D'autres méthodes, y compris la structuration de la matrice extracellulaire 28, impression jet d'encre 29, et la structuration de l'écoulement laminaire dans des dispositifs microfluidiques 25, 26 ont également été utilisés pour localiser les cellules. Ces autres méthodes sont des méthodes efficaces pour atteindre bien définis modèles de cellules et peut souvent obtenir une seule cellule de précision. Cependant, ces méthodes nécessitent également hautement spécialisé des équipements et / ou de l'accès aux installations de salles blanches pour la fabrication des cachets utilisés pour print protéines de la matrice extracellulaire ou produisent des dispositifs microfluidiques. Leur lien avec les alimentations, pompes à seringue, et d'autres composants externes entrave également leur mise en œuvre en raison des coûts liés à l'équipement et les compétences d'utilisateur requis pour le faire fonctionner.
En termes d'applications futures, nous prévoyons que notre méthode sera utile pour développer des systèmes de culture qui permettent analyse à haut débit de circulation et la prolifération cellulaire, ainsi que l'enquête interactions cellule-cellule au sein des populations cellulaires multiples. Pour ce point, nos rapports ont porté sur l'examen de l'interaction seulement quelques types de cellules motifs à la fois. Toutefois, il est concevable que nombreuses sous-populations de cellules peuvent être cultivées avec une couche d'alimentation commun pour étudier l'impact de la signalisation paracrine et juxtacrine de nombreux types de cellules cultivées ensemble dans une configuration de culture cellulaire unique. Enfin, les applications de génie tissulaire souvent nécessaire localisation spatiale desun ou plusieurs types de cellules. Il peut être possible d'adapter notre technique pour une utilisation dans les cellules de structuration afin de produire plus de modèles de tissus physiologiquement pertinents de maladies d'ingénierie ou à des cellules de motifs sur des matériaux implantables pour des applications cliniques.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n'ont aucun conflit d'intérêts financiers.
Acknowledgments
Ce travail a été soutenu par la Fondation Coulter, Beyster Fondation, l'opportunité recherche de premier cycle (PIRPC) programme d'été pour ATA et la National Science Foundation des étudiants diplômés de la bourse de recherche (subvention no 0718128 DGE; Identification:. 2010101926) pour JBW.
Materials
| Name | Company | Catalog Number | Comments |
| Dextran 500,000 kDa | Pharmacosmos, Denmark | ||
| Polyethylene Glycol 35,000 kDa | Sigma-Aldrich, St. Louis, MO | ||
| Hela | ATCC, Manassas, VA | ||
| HepG2 C3A | ATCC, Manassas, VA | ||
| NIH 3T3 | ATCC, Manassas, VA | ||
| Cell Tracker | Invitrogen, Carlsbad, CA | ||
| DMEM | Gibco, Carlsbad, CA | ||
| RPMI | Gibco, Carlsbad, CA | ||
| F12 | Gibco, Carlsbad, CA | ||
| Fetal Bovine Serum | Gibco, Carlsbad, CA |
References
- Hatti-Kaul, R. Aqueous two-phase systems : methods and protocols. Methods in biotechnology. xiii, Humana Press. 440 (2000).
- Albertsson, P. A. k Partition of cell particles and macromolecules: separation and purification of biomolecules, cell organelles, membranes, and cells in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. , 3rd ed, Wiley. 346 (1986).
- Yamada, M., et al. Continuous cell partitioning using an aqueous two-phase flow system in microfluidic devices. Biotechnol. Bioeng. 88 (4), 489-494 (2004).
- Soohoo, J. R., Walker, G. M. Microfluidic aqueous two phase system for leukocyte concentration from whole blood. Biomed. Microdevices. 11 (2), 323-329 (2009).
- Hahn, T., Hardt, S. Concentration and size separation of DNA samples at liquid-liquid interfaces. Anal. Chem. 83 (14), 5476-5479 (2011).
- Hatti-Kaul, R. Aqueous two-phase systems. A general overview. Mol. Biotechnol. 19 (3), 269-277 (2001).
- Hustedt, H., Kroner, K. H., Menge, U., Kula, M. -R. Protein recovery using two-phase systems. Trends in Biotechnology. 3 (6), 139-144 (1985).
- Keating, C. D. Aqueous Phase Separation as a Possible Route to Compartmentalization of Biological Molecules. Acc Chem. Res. 45 (12), 2114-2124 (2012).
- Helfrich, M. R., et al. Partitioning and assembly of metal particles and their bioconjugates in aqueous two-phase systems. Langmuir. 21 (18), 8478-8486 (2005).
- Diamond, A. D., Hsu, J. T. Prote. Partitioning in PEG/Dextran Aqueous Two-Phase Systems. AIChE Journal. 36 (7), 1017-1024 (1990).
- Y-T,, Zhu, Z. -Q. Modeling of interfacial tension of aqueous two-phase systems. Chemical Engineering Science. 54 (4), 433-440 (1999).
- Liu, Y., Lipowsky, R., Dimova, R. Concentration dependence of the interfacial tension for aqueous two-phase polymer solutions of dextran and polyethylene glycol. Langmuir. 28 (8), 3831-3839 (2012).
- Rha, C. Interfacial Tension of Polyethylene Glycol/Potassium Phosphate Aqueous Two-Phase Systems. Physics and Chemistry of Liquids: An International Journal. 38 (1), 25-34 (2000).
- Fang, Y., et al. Rapid Generation of Multiplexed Cell Cocultures Using Acoustic Droplet Ejection Followed by Aqueous Two-Phase Exclusion Patterning. Tissue Eng. Part C. Methods. 18 (9), 647-657 (2012).
- Tavana, H., et al. Nanolitre liquid patterning in aqueous environments for spatially defined reagent delivery to mammalian cells. Nat. Mater. 8 (9), 736-741 (2009).
- Tavana, H., Mosadegh, B., Takayama, S. Polymeric aqueous biphasic systems for non-contact cell printing on cells: engineering heterocellular embryonic stem cell niches. Adv. Mater. 22 (24), 2628-2631 (2010).
- Tavana, H., et al. Microprinted feeder cells guide embryonic stem cell fate. Biotechnol. Bioeng. , (2011).
- Tavana, H., Takayama, S. Aqueous biphasic microprinting approach to tissue engineering. Biomicrofluidics. 5 (1), 13404 (2011).
- Frampton, J. P., et al. Precisely targeted delivery of cells and biomolecules within microchannels using aqueous two-phase systems. Biomed. Microdevices. 13 (6), 1043-1051 (2011).
- Hossein Tavana, K. K., Bersano-Begey, T., Luker, K. E., Luker, G. D., Takayama, S. Rehydration of Polymeric, Aqueous, Biphasic System Facilitates High Throughput Cell Exclusion Patterning for Cell Migration Studies. Advanced Functional Materials. 21 (15), 2920-2926 (2011).
- Falconnet, D., et al. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Lim, J. Y., Donahue, H. J. Cell sensing and response to micro- and nanostructured surfaces produced by chemical and topographic patterning. Tissue Eng. 13 (8), 1879-1891 (2007).
- Ringeisen, B. R., et al. Jet-based methods to print living cells. Biotechnol. J. 1 (9), 930-948 (2006).
- Wright, D., et al. Generation of static and dynamic patterned co-cultures using microfabricated parylene-C stencils. Lab Chip. 7 (10), 1272-1279 (2007).
- Takayama, S., et al. Patterning cells and their environments using multiple laminar fluid flows in capillary networks. Proc. Natl. Acad. Sci. U.S.A. 96 (10), 5545-5548 (1999).
- Berthier, E., et al. Pipette-friendly laminar flow patterning for cell-based assays. Lab Chip. 11 (12), 2060-2065 (2011).
- Davidson, R. L., O'Malley, K. A., Wheeler, T. B. Polyethylene glycol-induced mammalian cell hybridization: effect of polyethylene glycol molecular weight and concentration. Somatic Cell Genet. 2 (3), 271-280 (1976).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Moon, S., Lin, P., Keles, H. O., Yoo, S., Demirci, U. Title Cell Encapsulation by Droplets. J. Vis. Exp. (8), e316 (2007).



