Summary
未修饰的和磷酸化的tau蛋白以两种体外聚集测定中使用以显示磷酸化依赖快速聚合动力学。这些测定铺路用于可调节tau蛋白的倾向,以形成背后阿尔茨海默氏病的进展纤丝化合物未来画面。
Introduction
阿尔茨海默氏病(AD)是一个大的集合称为tau蛋白病的神经变性疾病中的一种。典型的病理Tau蛋白病的基本是神经原纤维缠结,在神经元,星形胶质细胞和小胶质细胞1-4。在NFT密度与认知功能障碍3,5和神经元丢失6。 NFT主要含有高度磷酸化tau蛋白(简称为“P-tau蛋白”此后),其形成直链或成对螺旋纤丝(PHF)7,8。头被认为是有利于轴突运输的是神经信号和贩运9,10必不可少的微管相关蛋白。每个tau蛋白分子含有2〜3磷酸盐在正常脑,而是由几个折叠的磷含量的增加在τ病变的患者11。多激酶可能有助于tau蛋白包括GSK3β(糖原合酶激酶3β)和CDK5(细胞周期素德依赖激酶5)12,13,但直接触发的病理磷酸化仍然遥遥无期14。异常磷酸化中或附近的微管结合基序上解离的tau从微管15,并且使头误定位到somatodendritic隔室,其中p-tau蛋白寡聚成直链或成对螺旋丝,可以最终聚合成NFT的内含物。 tau蛋白磷酸化,NFT形成与神经变性之间的紧密联系导致普遍的假设是p-tau蛋白缠结引起的凋亡和其他细胞毒性反应,因此是对神经变性τ病变16,17的根本原因。基于这个前提药物屏幕和早期临床试验已经启动18。然而,这种假设面临的挑战19,20。例如,圣克鲁斯等人表明,转基因小鼠的认知功能可以通过抑制突变体的表达来改进人类tau蛋白,即使NFTS继续形成从现有的tau蛋白分子21。在果蝇模型,NFT显示出螯合的有毒胞质tau蛋白以保护下面的神经元细胞22,23。显然,NFT的发病中的作用,如果有的话,将极大地影响τ病变治疗剂的发展方向。
在高浓度的,重组的或正常脑τ蛋白自发但慢慢地聚合成PHF状结构体外 ,通过几个β折叠优选荧光染料,电子显微镜和光散射光谱24-27的结合所指示的。添加肝素或花生四烯酸,丰富的脂肪酸在人类的大脑,大大加速了PHF形成头isoform-和诱导浓度依赖性28-32。有趣的是,tau蛋白纯化从AD大脑或体外磷酸化反应制得面面俱到一ggregates更快,更高效地26,33-35。这些结果与对 - tau蛋白的病理性作用良好的协议。 体外基于对tau的聚集系统可以因此用作一个强大的工具用于AD药物筛选。
定在发现的药物可控制的tau聚集在上升的兴趣的tau聚集和AD的渐进的神经变性之间的密切联系,以及在药物开发的最新故障靶向Aβ斑块,公元36-38的另一个重要的组织学标志物。事实上,几个小组已经在不同的通量开始药物屏幕,使用体外的tau聚集反应作为主要测定法。被发现的一些化学品的展示在体外 39-42对tau聚集的抑制或逆转的活动。但是,目前所有的tau蛋白聚集调节屏幕使用未经修改的头说错过荧光粉的主要病理标记ylation,提高用于在公元治疗使用这些化合物的特异性和功效的关注。
一个发展中的聚集试验的生化特性和AD药物筛选的主要障碍是生产足够数量的病理生理学相关tau蛋白的蛋白质。使用拉链辅助催化系统,其中tau蛋白的同种型1N4R和GSK-3β激酶共表达在大肠杆菌中的大肠杆菌亮氨酸拉链融合蛋白,我们已经克服了这个挑战(穗等人 ,提交;请参阅tau蛋白和P-tau蛋白的最终产品图1;另见43 P-tau蛋白的初步质谱鉴定)。从特异性针对tau的不同磷酸化位点9的抗体的面板,阳性信号出现在八个位置(数据未示出)。下面,我们描述的协议及仪器能够区分的聚集动力学ð未修改的tau蛋白和P-tau蛋白物种之间ifferences。这些检测是从公布的协议,可测得硫代黄素T(ThT的)或硫代黄素S(THS)的荧光的增加对淀粉样蛋白(tau聚集)结合26修改。在第一个“终端”,无染料的方法,聚合反应被组装并孵育在不存在淀粉样蛋白染料。在不同时间点,每个反应的等分试样被去除,并与含的ThT缓冲器的等体积混合,以阻止聚集和允许的ThT结合tau聚集。荧光是由IAP FluoroMax-2荧光计测量。在第二“与染料”持续监控测定法,或ThT的THS被包括在聚合反应。荧光可以连续地在整个实验手动测量或使用多板读数器。此外,我们描述了在连续测量莫使用的tau和对tau的一个近生理浓度的聚集的测定德。磷酸化的效果仍然易被察觉。下面,我们将描述一步一步的操作的程序,并显示这些分析的代表性结果。讨论一些每种方法的利弊,以及潜在的药物筛选的应用将随之而来。
以高浓度,tau蛋白聚集成淀粉样蛋白样结构自发。然而,在实验室中,tau蛋白纤维化典型地通过例如诱导肝素(平均分子量6000克/摩尔)和花生四烯酸加速。本文所示的例子包括30μM肝素。 tau蛋白的淀粉样蛋白聚集体的形成是通过从淀粉通过硫磺素T(ThT的)或硫磺素S(THS)结合而产生的荧光进行监测。结合后tau聚集,ThT的表现出红移荧光(激发:450纳米;峰值发射:485纳米)。 THS,而另一方面,具有弱发射在之前结合淀粉样蛋白为510nm(激发在450nm处),但这种fluorescencë增加显著中淀粉样蛋白的存在,如聚集的τ44。这两种染料的检测tau蛋白和P-tau蛋白聚集工作。因为的ThT( 见图2)的强和相对宽的发光峰的,只有30在荧光单元减少在510nm%。为方便起见,我们使用的激发/发射波长( 即 450纳米/ 510纳米)同样的组合来监控头聚集在使用任何染料。
头聚合所用的染料的存在或不存在下进行,这取决于测定的目的和τ蛋白的可用性。反应的两种模式如下所示。此外,我们证明了两种不同的仪器操作 - 单样本荧光计(ISA-SPEX FluoroMax-2)和多板酶标仪(Spectramax M2)。读者应该能够适应这些协议,以满足他们的特定需求和仪器的可用性。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1.试剂的配制
- 制备聚合缓冲液(20mM的Tris,pH值7.4,100mM的氯化钠,1mM EDTA)中。存储在室温下,稳定了几个月。补充使用前1 mM的二硫苏糖醇(DTT)。
注:一个HEPES基缓冲液(10mM HEPES,pH为7.5,0.1毫摩尔EDTA,5毫DTT)也产生在tau蛋白聚集了类似的结果。 - 制备硫磺素T或硫磺素的股票溶液(3毫米,溶解在聚合缓冲液中),并过滤通过0.22μm的无菌过滤器单元。储存在-20℃下在覆盖的铝箔,稳定数月的管。
- 制备肝素原液(300μM,溶解在聚合缓冲液)。储存在-20℃下,稳定数月。
- 准备二硫苏糖醇(DTT)的股票(1M,溶于水)。分装成1.5毫升管。存储在-20℃。前聚合测定法,解冻在RT的1M溶液。从这个1000倍的股票,准备100毫米的工作股票用去离子水等分。离开冰直到准备。
- -80去除头℃的冰柜。冰上解冻。调整头至规定浓度与聚合缓冲区。旋在微量在20800×g离心10分钟,在4℃以除去预先形成大的聚集体。该预纺丝步骤增加一致性每批的蛋白质制备的随后荧光测定。将上清液转移至另一管中;离开冰上,直到准备组装聚集反应。
2.无染,终端分析
注:该测定的聚合反应是在不存在的荧光染料进行。混合所有组分之后,使反应进行到预定的时间点。等分试样然后取出聚合反应,并用的ThT或THS为淀粉样蛋白的荧光读数之前结合混合。聚合反应的初始体积取决于所需要的时间点的数量。这种方法可能requIRE大量tau蛋白,但是快速,简单,并且可以在荧光计或一个多孔板读数器(见讨论)来实现。下面是一步一步的操作,使用ISA SPEX FluoroMax-2紧凑分光光度计进行荧光定量。
- 设置在1.5ml的Eppendorf管中的聚合混合物,如表1,每列代表所需的100微升反应,这是足够的一次性点测量的成分。调节量的基础上所需要的特定的实验时间点的整个聚合混合物。添加额外的10%的各组分给房间取样误差。此处示出的典型的含反应肝素可以通过花生四烯酸或聚集缓冲器被替换。添加DTT至1mM到反应混合物中。如果整个反应持续超过一天,补充新鲜的DTT每天(1毫米),以确保一个还原环境。
- 反转管几次混合。解放军CE在一个37℃的恒温箱或水浴每个反应。搅拌不需要用于tau蛋白聚集。
- 前测量荧光,在分光光度计打开(灯先,然后计算机)。
注:氙弧灯,可用于马上。然而,对于最佳的结果允许机器读取荧光之前预热约10分钟。 - 启动计算机上的软件。
- 选择实时显示模式下仪表控制中心 ,设置激发波长为450纳米(狭缝到2纳米),发射波长为510纳米(狭缝5纳米)。关闭实时显示模式窗口,返回到仪器控制中心 。
- 选择恒波长分析 ,按添加>>键上部框架添加波长集。 标准误差设置采集参数为1, 最大试验到3,然后单击添加 。 单击GO!打开数据显示窗口。
- 在数据显示窗口中,单击开始ACQ打开新样品对话框 。选择“未知” 样品类型 。
- 以每100微升聚集混合,加入98微升聚合缓冲区和2微升3毫米硫黄素T.吸取几次,以混合。
- 将整个混合物转移到反应杯(FCA3,外部尺寸,wxlxh = 12.5Hz毫米×12.5毫米×45毫米)。放置在样品室中的样品保持器的反应杯,并盖上盖子。单击运行收集荧光数据。记录数据。
- 取出试管,倒出溶液。冲洗的反应杯由蒸馏水3次。干燥通过在与反应杯外送风。
3.用染料,连续模式测定法上的SpectraMax M2酶标仪
注:此试验不同于前一个,所述荧光染料的ThT或THS被包括在aggrega化反应。这允许相同的一组反应的连续测量。由于重复使用的反应,这种方法是更好地与一个自动多板读数器进行(如所示的SpectraMax M2的操作下)。一个普通的荧光也适用,但快速聚合反应测量的频率是比较有限的,由于操作的手动性质。
- 设置的聚集混合物在96孔板(96孔黑色实心板,以及体积360微升,平底),如表2,每列代表所需的200微升反应,这是足够的1的成分时间点测量。吹打几次拌匀。在整个实验过程中补充新鲜的1mM的DTT每一天。
- 孵育96孔板在37℃。
- 在荧光测定之前,每个时间点,打开多模式酶标仪和计算机。留出足够的时间马折角稳定,约10分钟。
- 启动计算机上的软件。设定温度至37℃,并选择荧光强度(FI-顶读取)模式,设定激发波长450nm和发射波长在510纳米。
- 插入的96孔板进抽屉,并按下READ键开始测量。
- 看完后,取出板然后将其返回到37℃培养箱。数据复制并粘贴到Excel电子表格进行数据分析和绘图。
4.染料,连续模式测定法上的紧凑型荧光光谱仪
- 设置在1.5ml的Eppendorf管中的聚合混合物,如表3,每列代表所需的200微升反应,这是足够的一次性点测量的成分。
- 反转管几次混合。
- 打开分光光度计和软件设定为在步骤2.3和2.4。
- 传送整个混合物吨OA比色皿。放置在样品室中的样品保持器的反应杯,并盖上盖子。单击运行收集荧光数据。记录数据。
- 继续在适当的间隔通过点击运行并记录数据读取。如果聚合是在一个较高的频率( 例如 ,每30或60秒),以进行监测,留在反应杯,并在机器的反应,直到测量完成时,或当有足够的时间来交换反应或比色皿。
- 取出试管,倒出溶液。冲洗的反应杯由蒸馏水3次。干燥通过在与反应杯外送风。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
使用重组tau蛋白和对tau蛋白( 图1),我们建立了两个不同的协议进行比较的tau和对tau的聚集的动力学,在结合到amyloidal蛋白聚集体采取的ThT和THS的强荧光发射的优点,其中包括头和对tau蛋白( 图2)。具有或不具有在聚合反应中的荧光染料,我们通过磷酸化( 图3-5)观测到的tau聚集的一致增强。这种刺激是独立肝素的(数据未示出)。减缓显著( 图3和5),与对tau蛋白在整个实验过程中表现出更高的荧光单位之前的典型反应中,tau蛋白和对tau蛋白低聚在快速速率在 头30分钟内。包括的ThT在聚合反应导致在聚集速率( 图4)显著相位差。这两种亚型走近高原反应后,淡160小时已经开始。 THS,另一方面,不引起凝集( 图5)的明显放缓。

图1.纯化tau蛋白和tau蛋白(对-头)在本研究中。样品通过在10%SDS-PAGE凝胶上分辨,并且通过考马斯亮蓝R250(左)染色或通过抗tau蛋白的单克隆抗体探测(右用面板)。泳道M,分子量标记;泳道1和3中,未磷酸化的tau; lane2和4,tau蛋白。

图2.发射光谱的ThT(30μM)有或无约束力的tau聚集。收购排放呈S ,激发在450nm处;从460纳米至600纳米(0.1秒积分,为5nm狭缝宽度为1nm增量)罐头。 tau聚集分别通过使50μM的tau蛋白的聚合,从而在37℃的CO / N(见方案2的详细信息)获得。
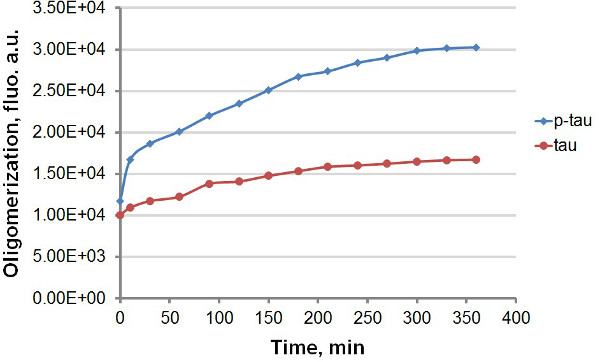
聚集50μM 图3.聚集曲线tau蛋白和P-tau蛋白的终端检测。tau蛋白和P-tau蛋白与30μM肝素诱导完成。在反应开始后的不同时间,将100μl的反应除去,并用60微米的ThT荧光测定前相同体积混合。荧光测定在450nm激发,510nm处发射。 “金”,任意单位。需要注意的是时间尺度是在分钟。
“图4”SRC =“/文件/ ftp_upload / 51537 / 51537fig4highres.jpg”/>
图4.聚合曲线的ThT单独,tau蛋白和对tau蛋白中的ThT的存在下连续测量模式下,每个反应包括0或50μM的tau蛋白或对tau蛋白,30μM的肝素,和30微米的ThT在聚合缓冲区。反应在一个96孔板在37℃。在不同时间点,将板从培养箱中取出,并装载到板读数器对荧光读数(激发450纳米,发射510纳米)。读数之间,将板保持在培养箱没有搅拌下的盖。的ThT的存在显著放慢汇聚,但是,重要的是,tau蛋白仍然显示出更快的速率聚合的比没有它的未修饰对应物。注意,时间的尺度是在小时。
PLOAD / 51537 / 51537fig5highres.jpg“/>
图中THS存在5.小规模tau蛋白聚集检测。6μMtau蛋白和P-tau蛋白在体外肝素诱导聚集在连续测量模式进行了评估与硫黄素S作指示剂染料。除了蛋白质,各反应含有30μM的肝素和20μM的THS在HEPES聚合缓冲液(10mM HEPES pH为7.5,5mM的DTT,0.1mM的EDTA)中。除了肝素所有成分混合并且平衡在室温。添加肝素后,将反应物转移到试管,并放置在样品架。荧光立即被记录为T 0,并持续约2小时,或直至荧光增加放缓至接近零。由于相对短的反应时间,整个进行反应在RT下在相同的反应杯中。
| 头 | P-tau蛋白 | |
| 60 - 100μM头 | 50微升 | 0微升 |
| 60 - 100微米的P-tau蛋白 | 0微升 | 50微升 |
| 300μM肝素 | 10微升 | 10微升 |
| 聚合缓冲区 | 39微升 | 39微升 |
| 100毫米DTT | 1微升 | 1微升 |
表1.聚集的混合物组分无染,终端检测。
| 头 | P-tau蛋白 | 仅染料 | |
| 60 - 100μM头 | 50微升 | 0微升 | 0微升 |
| 60 - 100微米的P-tau蛋白 | 0微升 | 50微升 | |
| 300μM肝素 | 20微升 | 20微升 | 20微升 |
| 3毫米硫磺素T | 2微升 | 2微升 | 2微升 |
| 聚合缓冲区 | 126微升 | 126微升 | 176微升 |
| 100毫米DTT | 2微升 | 2微升 | 2微升 |
表2.聚合混合物组分与染料,在读板器连续测定。
| 头 | P-tau蛋白 | 仅染料 | |
| 60 - 100μM头 | 5微升 | 0微升 | 0微升 |
| 60 - 100微米的P-tau蛋白 | 0微升 | 5微升 | 01,L |
| 300μM肝素 | 20微升 | 20微升 | 20微升 |
| 3毫米硫黄素S | 1.5微升 | 1.5微升 | 1.5微升 |
| 聚合缓冲区 | 171.5微升 | 171.5微升 | 176.5微升 |
| 100毫米DTT | 2微升 | 2微升 | 2微升 |
表3.聚合混合物组分与染料,在一个紧凑的分光光度计连续测定。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
该协议证明了不同的检测条件和检测磷酸化依赖的快速tau蛋白的聚集动力学的仪器。在终端测定中,荧光染料的ThT加到从主混合物在每个时间点除去反应的一部分。结合淀粉样蛋白诱导的荧光,然后测量26。在第二,与染料模式,tau蛋白聚集是在的ThT或THS的存在下,使这种类型的适合的tau聚集物的生长的实时自动评估反应。每种方法都有其优点和缺点。
终端模式反应仅与那些需要的tau聚集成份进行。稀释和混合用硫磺素T将反应急剧减慢的荧光增加的速率,基本上停止对荧光定量该反应。这种方法因此也与手动操作兼容。然而,因为reaction为后的ThT此外几乎终止时,可能需要大量的tau的用于绘图的聚集曲线。此方法的另一个潜在的条件是频繁访问到反应混合物中可能引入微生物或蛋白水解污染,或蛋白质氧化。与此相反,在用染料模式允许在的ThT或THS的存在淀粉样蛋白的产生。聚集的进步是可以持续而没有干扰的反应进行监测。建立一个自动化的检测平台时,此功能特别有吸引力。然而,不同的染料可能会引起特定的反应。实际上,延迟的ThT tau蛋白和对tau蛋白聚集显著,但THS具有小的影响(比较图3和5)。还有其他一些荧光染料,包括刚果红和噻嗪,其已被用于组织学和细胞生物学的研究为PHF的形成。至少有一个报告指出,一些染料可诱导组织tau蛋白聚集培养细胞45。因此,选择这些化合物对淀粉样蛋白的动力学的研究时,谨慎应当实行,并且不同的染料可能不得不进行比较。
相对于仪器的选择上,在第一种方法中所用的单样本荧光计是高度可靠的,但操作可以是费力当超过几个反应进行比较。使用多个反应杯可以帮助避免反应之间的交叉污染,尽管这些脆弱石英比色皿的费用可能是过高的一些。相反地,在多井酶标仪可以检查在同一时间的多个反应。使用一次性96孔板的是有利的,也是如此。有加热元件,酶标仪可以是专用设备,用于监视多个反应在37℃下在延长的时间周期。然而,蒸发可能是一个问题。 DiNitto 等。用矿物油覆盖一个类似的反应,以防止蒸发46。
一些预防措施是应采取的上述协议,以确保一致的和定量的结果。首先,tau蛋白和对tau蛋白自发形成的淀粉样蛋白聚集物随着时间的推移,特别是当以高浓度。因此当务之急是冻结的蛋白质 - 准备所有的等分,并解冻只有实验前所需的量。即便如此,一些聚集物,包括颗粒状中间体可检测通过的ThT 47可能已经重组蛋白质的制备过程中形成的。一个典型的聚合反应的实质初始荧光读数因此普遍。然而,增加一个预纺丝步骤和转移上清液至一个单独的管中,即使没有可见蛋白质沉淀,可降低,并保持相同的批次的tau蛋白和对tau蛋白制备的一致,初始荧光。其次,的ThT的工作原液( 即 ,60微米)是稳定的,在室温下不到一周日之前Ë荧光减弱。因此,建议重新做60μM的ThT每隔数天。
一个突出的原因,根本的P-tau蛋白聚集研究是新颖的AD诊断和治疗的发展。抑制或还原重组tau蛋白聚集的化合物已确定从高通量筛选和有针对性的测试18,40,41,48。这些化合物的p-tau蛋白聚集的疗效仍有待澄清。这些画面进行在终端模式被分配一个共用聚合混合物没有染料个别多片孔具有不同的化合物。之后通常O / N培养,ThT的或THS针对荧光测量补充,揭示许多化合物的抑制力量。在与染料的方法如上所述与由兰等人 49还没有被并入到高通量筛选。现在,随着tau蛋白可用于配对动能和制药研究螺旋丝形成,阿耳茨海默氏病的药物发现是可能提前更远。
最后,值得注意的是,对 - tau蛋白聚集的研究是至关重要的,不仅τ病变,也可能会影响一个甚至更广泛的人群。例如,有报道说,在神经原纤维缠结是可检测在慢性创伤性脑病,一些患者如专业美式足球和拳击运动员50-52。类似的相关性也有报道用于单次或重复的创伤性脑损伤患者,包括兵53。因此在这项工作中所描述的协议可能有助于靶向对tau聚集在神经元细胞的新的治疗剂的发现和开发。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



