Summary
Использование оригинальной и гиперфосфорилированного белки тау были использованы в двух в пробирке агрегации анализов, чтобы выявить гиперфосфорилирование зависит от быстро агрегации кинетики. Эти анализы проложить путь для будущих экранов для соединений, которые могут модулировать склонность гиперфосфорилированного тау с образованием фибриллы, которые лежат в основе прогрессирования болезни Альцгеймера.
Introduction
Болезнь Альцгеймера (AD) является одним из большой коллекции нейродегенеративных расстройств, известных как тауопатий. Квинтэссенцией патология, лежащая в основе Таупатия является нейрофибриллярные путать, NFTs, в нейронах, астроциты и микроглии 1-4. NFT плотность коррелирует с когнитивными нарушениями 3,5 и нейронов потери 6. NFT содержит первую очередь гиперфосфорилированного тау-белка (обозначаемого как "P-тау" Отныне), который формирует прямые или парные спиральные нити (Phf) 7,8. Тау ассоциированный с микротрубочками белок думал, чтобы облегчить аксонов транспорт, который имеет важное значение для нейронов сигнализации и торговли 9,10. Каждая молекула тау содержит от 2 до 3 фосфатов в нормальном мозге, но фосфорильные возрастает в несколько складок контента в Таупатия пациентов 11. Несколько киназ, вероятно, внести свой вклад в тау-гиперфосфорилированию в том числе GSK3β (гликоген-синтазы-киназы 3β) и CDK5 (циклин-деКулон-киназы 5) 12,13, но непосредственный спуск для патологического фосфорилирования остается неясным 14. Аномальные фосфорилирование в пределах или вблизи микротрубочек связывания мотивов диссоциирует тау из микротрубочек 15, и вызывает неправильное тау локализацию в somatodendritic отсеке, где р-тау oligomerizes в прямой или спаренных спиральных нитей, которые в конечном итоге может полимеризовать в NFT включений. Тесная связь между тау гиперфосфорилированию, NFT образования и нейродегенеративные привело к преимущественному гипотезы, что р-тау связок вызывают апоптоза и другие цитотоксические реакции, и, таким образом, основной причиной для Таупатия нейродегенерацией 16,17. Экраны наркотиков и ранние клинические тесты, основанные на этой предпосылке были начаты 18. Тем не менее, эта гипотеза сталкивается с проблемами 19,20. Например, SantaCruz и др. Показали, что когнитивные функции трансгенных мышей может быть улучшена за счет подавления экспрессии мутантногочеловек тау, хотя NFTs продолжал формироваться из существующих молекул 21 тау. В модели дрозофилы, NFT было показано, что секвестр токсичных цитозольную тау, чтобы защитить основные нейронные клетки 22,23. Очевидно, что патогенез роль NFT, если таковые имеются, будет в значительной степени влиять на направление развития Таупатия терапии.
В высоких концентрациях, рекомбинантного или нормального белка мозг тау спонтанно, но медленно полимеризуется в PHF-подобную структуру в пробирке, как указано связывания нескольких β-листов предпочтительных флуоресцентных красителей, электронная микроскопия, и рассеяния света спектроскопии 24-27. Добавление гепарина или арахидоновая кислота, в изобилии жирных кислот в мозге человека, резко ускоряет образование PHF в тау-isoform- и индукторы концентрации зависит от манеры 28-32. Интересно, что гиперфосфорилированного тау очищенный от мозга объявление или подготовлен исчерпывающий в пробирке реакций фосфорилированияggregates быстрее и более эффективно 26,33-35. Эти результаты находятся в хорошем согласии с патологической ролью р-тау. Система в пробирке на основе обобщения р-тау таким образом, может служить в качестве мощного инструмента для скрининга AD наркотиков.
Учитывая тесную связь между тау агрегации и прогрессивного нейродегенерацией объявление, а также недавнего провала в разработке лекарств, нацеленную на Ар налет, еще один ключевой гистологический маркер 36-38 н.э., то интерес к обнаружены наркотики, которые контролируют агрегации тау растет. Действительно, несколько групп уже начали экраны наркотиков в разное пропускной способности, используя в пробирке реакций агрегации тау в качестве основного анализа. Количество химических веществ были обнаружены проявлять тормозящее или разворота деятельности на агрегацию тау в пробирке 39-42. Тем не менее, все текущие экраны регулятор агрегации тау использовать неизмененный тау, что упускается самый главный патологический знак фосфораylation, поднимая заботу о специфике и эффективности использования этих соединений в лечении БА.
Одним из основных препятствий развития агрегации анализы для биохимического характеристики и скрининга AD наркотиков производство достаточных количеств патофизиологически соответствующей гиперфосфорилированного тау-белка. Использование катализа системы молнии при содействии, в котором 1N4R изоформы тау и GSK-3β киназы которые ко-экспрессируются в E. палочки, как слитых белков лейцин молнии, мы преодолели эту проблему (. Sui и др, представленный; рис 1 для конечных продуктов тау и р-тау; также см 43 для предварительного масс-спектрометрии характеристики р-тау). Из панели из девяти антител, специфичных для различных сайтов фосфорилирования тау, положительные сигналы были замечены в восемь позиций (данные не показаны). Ниже мы опишем протоколов и контрольно-измерительные приборы, которые могут дифференцироваться агрегации кинетическую Differences между неизмененном тау и р-тау-нейтрино. Эти анализы были изменены из опубликованных протоколов, которые измеряли рост флуоресценции тиофлавина Т (ТНТ) или тиофлавина S (тыс) По амилоидных (тау агрегатов) связывание 26. В первом «терминал», подход не краситель, агрегации реакции собирают и инкубировали в отсутствие амилоидного красителя. В различные моменты времени, аликвоту каждой реакции удаляют и смешивают с равным объемом в ThT-содержащего буфера для остановки агрегации и позволить THT связывать тау агрегатов. Измеряют флуоресценцию с помощью ИФА FluoroMax-2 флуорометре. Во втором "с красителем" постоянное анализ мониторинга, ThT или тыс входит в реакциях агрегации. Флуоресценции может быть измерена непрерывно в течение всего эксперимента вручную или с помощью читателю многодисковой. Кроме того, мы опишем анализ, который использует почти-физиологические концентрации тау и р-тау для агрегации в постоянном измерения месде. Эффект фосфорилирования остается легко обнаружить. Ниже мы опишем шаг за шагом процедуры эксплуатации и показать репрезентативные результаты этих анализов. Обсуждение некоторые плюсы и минусы каждого подхода, а также возможности применения скрининга лекарственных препаратов будет следовать.
При высокой концентрации, тау агрегирует в амилоидных структур, подобных спонтанно. Тем не менее, в лаборатории, тау fibrillization обычно ускоряется таких индукторов, как гепарин (средняя молекулярная масса, 6000 г / моль) и арахидоновой кислоты. Примеры, приведенные здесь, включают 30 мкМ гепарин. Образование амилоидных тау агрегатов контролируется флуоресценции в результате амилоида связывания тиофлавина T (ТНТ) или тиофлавина S (тыс). После связывания с тау агрегатов, ThT демонстрирует красное смещение в флуоресценции (возбуждение: 450 нм; пик излучения: 485 нм). Тыс, а с другой стороны, имеет слабую эмиссию при 510 нм (возбуждение при 450 нм) до амилоида связывания, но это fluorescencе значительно возрастает в присутствии амилоидного белка, такие как агрегированный тау 44. Оба красителя хорошо работать в обнаружении тау и р-тау агрегации. Из-за сильного и относительно широкий пик эмиссии ThT (рисунок 2), есть только 30% снижение в блоке флуоресценции при 510 нм. Для удобства, мы используем ту же самую комбинацию длин волн возбуждения / эмиссии (т.е. 450 нм / 510 нм) для наблюдения агрегацию тау при использовании либо краситель.
Тау агрегации может быть сделано в присутствии или в отсутствие красителя, в зависимости от цели анализа, а также наличие тау-белка. Оба режима реакций представлены ниже. Кроме того, мы демонстрируем работу двух разных инструментов - одноместный образец флуорометр (ISA-SPEX FluoroMax-2) и многодисковой читателю (SpectraMax м2). Читатели должны быть в состоянии адаптировать эти протоколы с учетом их конкретных потребностей и наличия инструмента.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Подготовка реагентов
- Подготовка агрегации буфер (20 мМ Трис, рН 7,4, 100 мМ NaCl, 1 мМ ЭДТА). Хранить при комнатной температуре, стабилен в течение месяцев. Дополнение 1 мМ дитиотреитола (DTT) перед использованием.
Примечание: HEPES-буфер на основе (10 мМ HEPES, рН 7,5, 0,1 мМ ЭДТА, 5 мМ ДТТ) также производит аналогичные результаты в агрегации тау. - Подготовка тиофлавина T или S тиофлавина исходного раствора (3 мМ, растворенного в буфере агрегации), и фильтр по 0,22 мкм стерильного фильтра. Хранить при -20 ° С в трубке, покрытой алюминиевой фольгой, стабильной в течение нескольких месяцев.
- Подготовка исходного раствора гепарина (300 мкМ, растворенные в агрегации буфер). Хранить при -20 ° С, стабильны в течение нескольких месяцев.
- Подготовка дитиотреитола (DTT) наличие (1 М, растворенного в воде). Алиготе в 1,5 мл пробирки. Хранить при -20 ° С. Перед агрегации анализов, оттепель 1 М раствор при комнатной температуре. С этой 1,000x складе, подготовить аликвоту 100 мм Рабочая акции с деионизированной водой. Оставить на льдуне до готовности.
- Удалить тау от -80 ° C морозильнике. Оттепель на льду. Отрегулируйте Тау заданной концентрации с буфером агрегирования. Спин в микроцентрифуге при 20800 х г в течение 10 мин при 4 ° С для удаления предварительно сформированные крупные агрегаты. Этот шаг предварительного формования увеличивает консистенцию в последующем измерении флуоресценции каждой партии белка преп. Передача супернатант в другую пробирку; не выйти на лед, пока все готово для сборки реакцию агрегации.
2. Нет-красителя, Терминал Анализ
Примечание: Реакция агрегации этом анализе делается в отсутствие флуоресцентного красителя. После смешивания всех компонентов, реакционную смесь, чтобы приступить к заранее определенных временных точках. Аликвоты затем вынимают из реакции агрегации и смешивают с ThT или тыс для связывания амилоида до флуоресценции чтения. Начальный объем реакции агрегации зависит от количества точек времени, необходимого. Этот подход может RequIRE большое количество тау-белка, но очень быстро, просто, и может быть сделано в флуорометре или нескольких а планшет-ридере (обсуждение см). Ниже шаг за шагом операция, с помощью ISA SPEX FluoroMax-2 компактный спектрофлуориметре флуоресцентной количественной оценке.
- Настройка агрегации смеси в 1,5 мл пробирки Эппендорф, как в таблице 1. Каждый столбец представляет компоненты, необходимые для реакции 100 мкл, что достаточно для одного измерения времени точки. Регулировка количества для всей смеси агрегации на основе временных точек, необходимых для конкретного эксперимента. Добавить дополнительные 10% каждого компонента, чтобы дать место для пипетки ошибку. Типичная реакция, содержащий гепарин показано здесь может быть заменена арахидоновой кислоты или агрегации буфера. Добавить DTT до 1 мМ в реакционную смесь. Если весь реакционный длится больше чем один день, в дополнение свежий DTT ежедневно (1 мм), чтобы обеспечить восстановительную среду.
- Переверните пробирку несколько раз перемешать. Пласе каждый реакцию в инкубаторе или водяной бане при 37 ° C. Агитация не требуется для агрегации тау.
- Перед измерением флуоресценции, включите спектрофлуорометра (лампы, а затем компьютер).
ПРИМЕЧАНИЕ: ксеноновая лампа дуга, которая может быть использована сразу. Тем не менее, для получения наилучших результатов позволяют машине прогреться в течение примерно 10 мин, прежде чем читать флуоресценции. - Запустите программу на компьютере.
- Выберите режиме реального времени дисплея на приборной Control Center, установите длину волны возбуждения 450 нм (щель в 2 нм) и длину волны излучения до 510 нм (щель до 5 нм). Закрыть режиме реального времени Окно дисплея, чтобы вернуться в Центр управления инструментом.
- Выберите постоянной длине волны Анализ, нажмите Добавить >> ключ в верхней рамке, чтобы добавить длины волн наборы. Установите параметры сбора стандартной ошибки к 1 и максимально испытания, чтобы 3, затем нажмите кнопку Добавить. Нажмите Go! Чтобы открыть дисплей данныхОкно.
- В окне отображения данных, нажмите Пуск Зн, чтобы открыть диалоговое поле образцов новых. Выберите "неизвестно" для типа образца.
- Для каждого 100 мкл агрегации смеси, добавить 98 мкл агрегации буфера и 2 мкл 3 мМ тиофлавина Т. Внесите несколько раз перемешать.
- Перевести всю смесь в кювету (FCA3, внешний измерение, ШхДхВ = 12,5 мм х 12,5 мм х 45 мм). Поместите кювету в держатель образца в образце-купе и закройте крышку. Нажмите кнопку Выполнить для сбора данных флуоресценции. Запись данных.
- Удалить кювету и слейте раствор. Промойте кювету дистиллированной водой 3 раза. Сухой путем продувки воздуха внутри и вне кюветы.
3. С-красителя, Постоянное Режим анализа на ридере SpectraMax M2
ПРИМЕЧАНИЕ: Данный анализ отличается от предыдущего тем, что флуоресцентный краситель ThT или тыс входит в aggregaреакция излучения. Это позволяет непрерывное измерение и тот же набор реакций. Из-за повторного использования реакции, этот метод лучше сделать с помощью автоматического устройства мульти-луночного планшета (как показано ниже операции SpectraMax М2). Стабильный флуориметр также работает, но частота измерения быстрых реакций агрегации несколько ограничен из-за ручного характера операции.
- Настройка агрегации смесь в 96-луночный планшет (96-а черное твердое вещество пластины, а объему 360 мкл, плоское дно), как и в таблице 2. Каждый столбец представляет компоненты, необходимые для реакции 200 мкл, что достаточно для одного временной точке измерения. Все хорошо перемешать с помощью пипетки несколько раз. Дополнение свежий 1мМ DTT каждый день на протяжении всего эксперимента.
- Инкубируйте 96-луночного планшета при 37 ° С.
- В каждый момент времени перед измерением флуоресценции, включите многорежимный микроплаты и компьютером. Обеспечьте достаточное время для маChine стабилизироваться, около 10 мин.
- Запустите программу на компьютере. Установите температуру до 37 ° С и выбрать интенсивность флуоресценции (FI-Top для чтения) режим, установите длину волны возбуждения при 450 нм и длина волны излучения в 510 нм.
- Вставьте 96-луночного планшета в ящик и нажмите клавишу READ, чтобы начать измерение.
- После прочтения удалить пластину и вернуть его обратно к 37 ° C инкубатора. Скопируйте данные и вставить в Excel таблицу для анализа данных и печати.
4. С-красителя, Постоянное Режим анализа на Compact спектрофлуорометра
- Настройка агрегации смеси в 1,5 мл пробирки Эппендорф, как в таблице 3. Каждый столбец представляет компоненты, необходимые для реакции 200 мкл, что достаточно для одного измерения времени точки.
- Переверните пробирку несколько раз перемешать.
- Включите спектрофлуорометра и установить программное обеспечение, как на этапах 2.3 и 2.4.
- Передача всей смеси тО. кювета. Поместите кювету в держатель образца в образце-купе и закройте крышку. Нажмите кнопку Выполнить для сбора данных флуоресценции. Запись данных.
- Продолжить чтение через соответствующие промежутки времени, нажав Выполнить и записи данных. Если агрегация должна контролироваться с высокой частотой (например, каждые 30 или 60 секунд), не оставляют реакцию в кювете и в машине, пока либо измерение закончено, или когда есть достаточно времени, чтобы обменять реакции или кювет.
- Удалить кювету и слейте раствор. Промойте кювету дистиллированной водой 3 раза. Сухой путем продувки воздуха внутри и вне кюветы.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Использование рекомбинантного тау и Р-тау (рис 1), мы создали разные протоколы для сравнения кинетики агрегации тау и р-тау, воспользовавшись сильной флуоресцентное излучение ThT и тыс при связывании с амилоида белковые агрегаты, в том числе тау и р-тау (Рисунок 2). С или без флуоресцентного красителя в реакции агрегации, мы наблюдали последовательное повышение агрегации тау по гиперфосфорилирования (фиг.3-5). Это возбуждение не зависит от гепарина (данные не показаны). В типичной реакции, тау и р-тау олигомеризоваться быстрыми темпами в течение первых 30 мин до замедления значительно (рис 3 и 5), с р-тау, обладающие большей единицы флуоресценции на протяжении всего эксперимента. В том числе ТНТ в реакциях агрегации вызывает значительное замедление в скорости агрегации (рисунок 4). Оба изоформы подошел наличникиEau 160 ч после реакции началось. Тыс, с другой стороны, не вызывает заметного замедления агрегации (рисунок 5).

Рисунок 1. Очищенный и тау-тау гиперфосфорилированного (п-тау), используемый в данном исследовании. Образцы были решены с помощью 10% SDS-PAGE гель и окрашивали кумасси синим R250 (слева) или зондируют с помощью моноклонального антитела анти-тау (справа панель). Lane M, маркер молекулярной массы; дорожки 1 и 3, нефосфорилированным тау; lane2 и 4, гиперфосфорилированного тау.

Рисунок 2. Спектры излучения для ThT (30 мкМ) с или без привязки тау агрегатов. На приобретение излучение с консервы из 460 нм до 600 нм (1 нм прироста, интеграция 0,1 сек, 5 нм ширина щели), при возбуждении на 450 нм. Тау агрегаты были получены, позволяя агрегации тау 50 мкМ протекать при 37 ° CO / N (см протокол 2 для деталей).
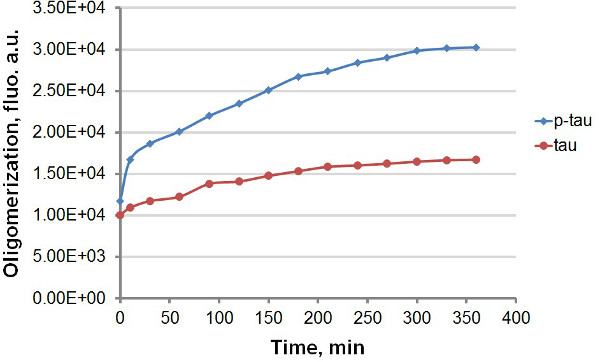
Рисунок 3. агрегации кривые для тау и р-тау в терминальной анализа. Агрегация 50 мкм тау и р-тау был завершен с 30 мкМ гепарина в качестве индуктора. В различные моменты времени после начала реакции, 100 мкл реакционной смеси удал ют и смешивают с таким же объемом 60 мкМ ThT перед измерением флуоресценции. Флуоресценции измеряли при 450 нм возбуждение, 510 нм излучения. "Au", условные единицы. Обратите внимание, что масштаб времени в минутах.
"Рисунок 4" SRC = "/ файлы / ftp_upload / 51537 / 51537fig4highres.jpg" />
Рисунок 4. Кривые агрегации только ThT, тау и п-тау в режиме непрерывного измерения в присутствии ThT. Каждую реакционную состоит из 0 или 50 мкМ тау или п-тау, 30 мкМ гепарина и 30 мкМ ThT в агрегации буфера , Реакции инкубировали при 37 ° С в 96-луночный планшет с. В различные моменты времени, планшет вынимали из инкубатора и загружают в планшет-ридере для чтения флуоресценции (возбуждение 450 нм, излучение 510 нм). Между показаниями, планшет выдерживали в инкубаторе без перемешивания под крышкой. Наличие ThT значительно замедлился агрегацию, но, главное, гиперфосфорилированного тау-прежнему демонстрировали более высокую скорость агрегации, чем сделал его исходной коллегу. Обратите внимание, что шкала времени в часах.
pload / 51537 / 51537fig5highres.jpg "/>
Рисунок 5. Небольшие агрегации тау анализы в присутствии тыс. В пробирке гепарин-индуцированной агрегации 6 мкм тау и п-тау оценивали в режиме непрерывного измерения с тиофлавина S в качестве индикатора красителя. В дополнение к белка, каждая реакция содержала 30 мкМ гепарин и 20 мкМ тыс в HEPES агрегации буфера (10 мМ HEPES рН 7,5, 5 мМ ДТТ, 0,1 мМ ЭДТА). Все ингредиенты, кроме гепарина смешивают и уравновешивают при комнатной температуре. После добавления гепарина, реакционную смесь переносили в кювету и помещают в держатель образца. Флуоресценции был записан сразу же, как Т 0, и продолжалась около 2 часов или до увеличения флуоресценции замедлился почти до нуля. Из-за относительно короткий период реакции, все реакции провод т при комнатной температуре в той же кювете.
| тау | р-тау | |
| 60 - 100 мкм тау | 50 мкл | 0 мкл |
| 60 - 100 мкм р-тау | 0 мкл | 50 мкл |
| 300 мкМ гепарин | 10 мкл | 10 мкл |
| агрегации буфер | 39 мкл | 39 мкл |
| 100 мМ ДТТ | 1 мкл | 1 мкл |
Таблица 1. Объединение компонентов смеси для не-красителя, терминал для анализа.
| тау | р-тау | Краска в одиночку | |
| 60 - 100 мкм тау | 50 мкл | 0 мкл | 0 мкл |
| 60 - 100 мкм р-тау | 0 мкл | 50 мкл | |
| 300 мкМ гепарин | 20 мкл | 20 мкл | 20 мкл |
| 3 мм тиофлавина T | 2 мкл | 2 мкл | 2 мкл |
| Объединение буфер | 126 мкл | 126 мкл | 176 мкл |
| 100 мМ ДТТ | 2 мкл | 2 мкл | 2 мкл |
Таблица компоненты 2. Объединение смесь для с-красителя, постоянной анализа на ридере.
| тау | р-тау | Краска в одиночку | |
| 60 - 100 мкм тау | 5 мкл | 0 мкл | 0 мкл |
| 60 - 100 мкм р-тау | 0 мкл | 5 мкл | 01, л |
| 300 мкМ гепарин | 20 мкл | 20 мкл | 20 мкл |
| 3 мм тиофлавина S | 1,5 мкл | 1,5 мкл | 1,5 мкл |
| Объединение буфер | 171.5 мкл | 171.5 мкл | 176.5 мкл |
| 100 мМ ДТТ | 2 мкл | 2 мкл | 2 мкл |
Таблица компоненты 3. Объединение смесь для с-красителя, постоянной анализа на компактной спектрофлуорометра.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Этот протокол демонстрирует различные условия анализа и инструменты, которые обнаруживают фосфорилирования зависит от быстро тау агрегации кинетики. В терминальной анализа флуоресценции красителей ThT добавляют к части реакции удаляют из основной смеси в каждый момент времени. Амилоида связывание-индуцированной флуоресценции Затем измеряют 26. Во-вторых, с красителем-режиме, агрегации тау осуществляется в присутствии или ThT тыс, что делает этот тип реакции, подходящей для реального времени автоматического оценки роста тау агрегатов. Каждый из этих методов имеет свои плюсы и минусы.
Реакция терминала в режиме ведется только с теми ингредиентов, необходимых для агрегации тау. Разбавлять и смешивания реакцию с тиофлавина Т резко замедляет темпы роста флуоресценции, по существу, останавливает реакцию флуоресценции количественной оценке. Этот метод, таким образом, также совместим с ручным управлением. Тем не менее, поскольку reactioп практически прекращается при ThT того, большое количество тау может потребоваться для построения кривой агрегации. Другой потенциальный предостережение для этого метода является то, что частый доступ к реакционной смеси может ввести микробного загрязнения или протеолитическую или окисление белка. В отличие от этого, режим с красителем-позволяет генерировать амилоида в присутствии ThT или тыс. Продвижение агрегации можно наблюдать непрерывно без когда-либо нарушения реакцию. Эта функция особенно привлекательным при создании автоматизированной анализа платформу. Тем не менее, различные красители могут вызывать конкретные ответы. Действительно, ThT значительно замедляет тау и р-тау агрегацию, но тыс имеет мало влияния (сравните Рисунки 3 и 5). Есть несколько другие красители, флуоресцентные, в том числе с конго красным и тиазины, которые были использованы в гистологических и клеточной биологии, исследований для формирования PHF. По крайней мере, один сообщении указано, что некоторые из этих красителей может вызвать агрегацию тау в тканикультура клетки 45. Таким образом, при выборе данных соединений для амилоидогенеза кинетики исследований, осторожность должна быть осуществлено и что различные красители могут иметь для сравнения.
Что касается выбора инструмента, одного образца флуориметр используется в первый подход обладает высокой надежностью, но операция может быть трудоемким, если больше, чем несколько реакций могут быть сравнены. Использование нескольких кюветы может помочь избежать перекрестного загрязнения между реакциями, хотя стоимость этих хрупких кварцевых кюветах может быть непомерно для некоторых. С другой стороны, микропланшет-ридера нескольких также может рассмотреть несколько реакций, в то же время. Использование одноразовых 96-луночных является предпочтительным, а также. С нагревательным элементом, микропланшет-ридера может быть выделенным устройством для мониторинга нескольких реакций при 37 ° С в течение длительного периода времени. Однако, испарение может быть проблемой. DiNitto др. Накладывается аналогичную реакцию с минеральным маслом, чтобы предотвратитьиспарения 46.
Некоторые меры предосторожности должны быть приняты для вышеупомянутых протоколов, обеспечивающих последовательную и количественные результаты. Во-первых, тау и п-тау спонтанно образуют амилоидные агрегаты с течением времени, особенно, если в высокой концентрации. Поэтому крайне важно, чтобы заморозить все аликвоты белка Preps, и таять только необходимый объем до экспериментов. Тем не менее, некоторые агрегаты, в том числе сыпучих промежуточных детектируемых ThT 47 может быть сформирован в ходе подготовки рекомбинантных белков. Значительная начальная флуоресценция чтение типичной реакции агрегации, таким образом, общие. Тем не менее, добавление стадию предварительной прядения и передачи супернатант в отдельную пробирку, даже без видимого гранулы белка, может уменьшить и поддерживать последовательную, начальный флуоресценции той же партии тау и п-тау преп. Во-вторых, работает маточный раствор ThT (т.е. 60 мкм) является стабильным при комнатной температуре в течение менее чем за неделю до гое флуоресценции уменьшается. Таким образом, рекомендуется повторно сделать 60 мкМ ThT каждые несколько дней.
Один из видных причина, лежащая исследования агрегации р-Тау развитие новых диагностических объявление и терапии. Соединения, которые ингибируют или вернуться рекомбинантный агрегацию тау были выявлены на высокой пропускной экранов и целевых испытаний 18,40,41,48. Эффективность этих соединений для агрегации р-тау еще предстоит выяснить. Эти экраны были проведены в терминальном режиме, раздавая общую статистическую смесь без красителя отдельных многодисковое скважин с различными соединениями. Обычно после O / N инкубации ThT или тыс добавляется для измерения флуоресценции, показывая ингибирующее силу многих соединений. С красителем-Подход упоминалось выше и Ранкина и др. 49 еще не включен в экранах высокой пропускной. Теперь с гиперфосфорилированного тау, доступных для кинетических и фармацевтических исследований в пареформирование спиральное волокно, лекарств болезнь Альцгеймера, скорее всего, для продвижения дальше.
Наконец, стоит отметить, что исследование агрегации р-тау имеет решающее значение не только тауопатий, но также может повлиять на еще более широкие группы населения. Например, есть сведения, что нейрофибриллярные сплетения обнаруживаются в некоторых пациентов хронической травматическая энцефалопатия, таких как профессиональные американских футболистов и боксеров 50-52. Аналогичная корреляция также сообщил, для одного или повторяющихся травматических пациентов с повреждениями мозга, включая солдат 53. Протоколы, описанные в этой работе может таким образом помочь открытие и разработку новых терапевтических, направленных р-тау агрегатов в нервных клетках.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



