Summary
Omodifierade och hyperfosforylerat tau-proteiner användes i två in vitro aggregeringsanalyser att avslöja hyperfosforylering beroende snabb aggregering kinetik. Dessa analyser banar väg för framtida skärmar för föreningar som kan modulera benägenhet hyperfosforylerat tau att bilda fibriller som ligger bakom utvecklingen av Alzheimers sjukdom.
Introduction
Alzheimers sjukdom (AD) är en av en stor samling av neurodegenerativa sjukdomar som kallas tauopatier. Den egentliga patologi underliggande tauopathy är de nystan, NFT, i neuron, astrocyter och mikroglia 1-4. NFT densitet korrelerar med kognitiv svikt 3,5 och neuron förlust 6. NFT innehåller främst hyperfosforylerat tau-protein (kallad "p-tau" hädan) som bildar raka eller parade spiralfilament (PHF) 7,8. Tau är en mikrotubuli associerat protein antas underlätta axonal transport som är nödvändig för neuronal signalering och människohandel 9,10. Varje tau-molekylen innehåller 2 till 3 fosfater i normal hjärna, men fosforylgrupper innehåll ökar med flera veck i tauopathy patienter 11. Flera kinaser kommer sannolikt att bidra till tau hyperfosforylering inklusive GSK3p (glykogensyntaskinas 3β) och CDK5 (cyklin-deroende kinas 5) 12,13, men den direkta utlösande faktorn för den patologiska fosforylering fortfarande instabil 14. Onormal fosforylering i eller i närheten av mikrotubuli-bindande motiv dissocierar tau från mikrotubuli 15, och orsakar tau mis-lokalisering till somatodendritisk utrymmet, där p-tau oligomerizes i raka eller parade spiralfilament som så småningom kan polymeriseras i NFT inneslutningar. Den nära kopplingen mellan tau hyperfosforylering, NFT bildning, och neurodegeneration ledde till en utbredd hypotesen att p-tau trassel framkalla apoptotiska och andra cytotoxiska reaktioner, och därmed är den bakomliggande orsaken till tauopathy neurodegeneration 16,17. Drog skärmar och tidiga kliniska tester baserade på denna premiss har lanserats 18. Dock står inför denna hypotes utmaningar 19,20. Till exempel, Santacruz et al. Visade att kognitiva funktioner av transgena möss kan förbättras genom att undertrycka expression av en mutantmänskligt tau, trots NFT fortsatte att bilda från befintliga tau molekyler 21. I en Drosophila modell, var NFT visat att binda den giftiga cytosoliska tau att skydda de underliggande neuron cellerna 22,23. Tydligt, patogenesen roll NFT, om någon, kommer att kraftigt påverka riktningen för tauopathy therapeutics utveckling.
I höga koncentrationer, rekombinant eller normal hjärn tau-protein spontant men långsamt polymeriserar i en PHF-liknande struktur in vitro, såsom indikeras genom bindningen av flera β-sheet föredragna fluorescerande färgämnen, elektronmikroskopi, och ljusspridningsspektroskopi 24-27. Lägga heparin eller arakidonsyra, en riklig fettsyra i människans hjärna, accelererar kraftigt PHF bildning i tau isoform- och inducerar koncentrationsberoende sätt 28-32. Fängslande, renat hyperfosforylerat tau från AD hjärnor eller framställas genom uttömmande in vitro fosforyleringsreaktioner enggregates snabbare och mer effektivt 26,33-35. Dessa resultat är i utmärkt överens med de patologiska roller p-tau. En in vitro-system baserat på aggregering av p-tau kan därmed fungera som ett kraftfullt verktyg för AD drogscreening.
Med tanke på den nära samarbete mellan tau aggregering och den progressiva neurodegeneration av AD, liksom den senaste tidens misslyckande i läkemedelsutveckling inriktning Ap plack, en annan viktig histologisk markör för AD 36-38, intresset för att upptäcka narkotika som styr tau aggregering ökar. I själva verket har flera grupper redan börjat drogskärmar vid olika genomströmning, med användning av in vitro-tau-aggregation reaktioner som den primära analysen. Ett antal kemikalier befanns uppvisa hämmande eller återföring aktiviteter på tau aggregering in vitro 39-42. Men alla aktuella tau sammanläggning regulatorskärmar använder omodifierad tau som missar den viktigaste patologiska märke fosforylation, höja en oro för specificitet och effekten av att använda dessa föreningar i AD behandling.
En av de stora hindren för att utveckla aggregeringsanalyser för biokemisk karakterisering och AD drogscreening är produktion av tillräckliga mängder av patofysiologiskt relevant hyperfosforylerat tau-protein. Använda Blixtlås assisterade Katalys system där 1N4R isoformen av tau och GSK-3β kinas är co-uttrycks i E. coli som leucinblixtlås fusionsproteiner, har vi övervinna denna utmaning (. Sui et al, lämnat, se figur 1 för slutprodukterna av tau och p-tau, se även 43 för preliminär masspektrometri karakterisering av p-tau). Från en panel av nio antikroppar specifika för olika fosforyleringssäten av tau, var positiva signaler ses i åtta lägen (data ej visade). Nedan beskriver vi protokoll och instrumentationer som kan differentiera sammanläggning kinetiska differences mellan omodifierad tau och p-tau arter. Dessa analyser ändrades från publicerade protokoll som mäter ökningen av fluorescens av tioflavin T (ThT) eller Thioflavin S (THS) vid amyloid (tau aggregat) bindande 26. I den första "terminal", nr-färgämne tillvägagångssätt är aggregering reaktioner monteras och inkuberades i frånvaro av amyloid färgämne. Vid olika tidpunkter, är en alikvot av varje reaktion avlägsnades och blandades med lika stor volym av den THT-innehållande buffert för att stoppa aggregation och tillåta ThT binda tau aggregat. Fluorescens mäts av en lAP FluoroMax-2 fluorometer. I den andra "med-dye" kontinuerlig övervakning analys är ThT eller THS räknats in i summerreaktioner. Fluorescens kan mätas kontinuerligt under hela experimentet manuellt eller med användning av en multi-plattläsare. Dessutom beskriver vi en analys som använder en nära-fysiologisk koncentration av tau och p-tau för aggregering i ständig mätning mode. Effekten av fosforylering förblir lätt kan upptäckas. Nedan kommer vi att beskriva steg-för-steg-driftprocedurer, och visar representativa resultaten av dessa analyser. Diskussion om några av de fördelar och nackdelar med varje metod, samt potentiella drogscreening applikationer kommer att följa.
Vid en hög koncentration, aggregat tau i amyloidliknande strukturer spontant. Emellertid, i laboratoriet, tau fibrillization typiskt accelereras av sådana inducerare såsom heparin (medelmolekylvikt, 6000 g / mol) och arakidonsyra. Exempel som visas häri innefattar 30 pM heparin. Bildandet av tau amyloidaggregat övervakas av fluorescens följd av amyloid bindande genom tioflavin T (ThT) eller Thioflavin S (THS). Vid bindning till tau aggregat, ThT uppvisar en röd förskjutning i fluorescens (excitation: 450 nm, peak emission: 485 nm). Ths, å andra sidan, har svag emission vid 510 nm (excitation vid 450 nm) före amyloid bindande, men denna fluorescence ökar betydligt i närvaro av en amyloidprotein såsom den aggregerade tau 44. Båda färgämnena fungerar bra i att detektera tau och p-tau-aggregation. På grund av den starka och relativt bred emissionstopp av ThT (se figur 2), finns det bara 30% minskning i fluorescensenheten vid 510 nm. För enkelhets skull använder vi samma kombination av excitation / emissionsvåglängder (dvs 450 nm / 510 nm) för att övervaka tau-aggregation vid användning av antingen färgämne.
Tau-aggregation kan göras i närvaro eller frånvaro av färgämnet, beroende på syftet med analysen och tillgängligheten av tau-protein. Båda typer av reaktioner visas nedan. Dessutom visar vi driften av två olika instrument - ett enda prov fluorometer (ISA-SPEX FluoroMax-2) och en multi-plattläsare (SpectraMax M2). Läsare bör kunna anpassa dessa protokoll för att passa deras specifika behov och instrument tillgänglighet.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Beredning av reagens
- Förbered aggregering buffert (20 mM Tris, pH 7,4, 100 mM NaCl, 1 mM EDTA). Förvara vid RT, stabil i månader. Supplement 1 mM ditiotreitol (DTT) före användning.
OBS: a HEPES baserad buffert (10 mM HEPES, pH 7,5, 0,1 mM EDTA, 5 mM DTT) producerar också liknande resultat i tau aggregering. - Förbered Thioflavin T eller Thioflavin S stamlösning (3 mM, upplöst i aggregering buffert), och filter med 0,22 um sterilfilterenhet. Förvara vid -20 ° C i ett rör täckt med aluminiumfolie, stabil i månader.
- Bered heparinstamlösning (300 | iM, upplösta i aggregering buffert). Förvara vid -20 ° C, stabilt i månader.
- Förbered ditiotreitol (DTT) lager (1 M, löst i vatten). Alikvotera i 1,5 ml rör. Förvara vid -20 ° C. Före aggregeringsanalyser, tina en M lösning vid RT. Från denna 1,000x lager, förbereda en alikvot av 100 mm Arbets lager med avjoniserat vatten. Lämna på istills redo.
- Ta tau från -80 ° C frys. Tina på is. Justera tau till förutbestämda koncentrationen med aggregering bufferten. Spin i en mikrocentrifug vid 20.800 xg under 10 minuter vid 4 ° C för att avlägsna förformade stora aggregat. Denna pre-spinning steg ökar konsekvens i den efterföljande fluorescens mätningen av varje sats av proteinet prep. Överför supernatanten till ett annat rör; lämna på is tills redo att montera sammanläggning reaktionen.
2. Nej-dye, Terminal analys
OBS: aggregering reaktion av denna analys görs i frånvaro av det fluorescerande färgämnet. Efter blandning av samtliga komponenter, är reaktionen tilläts fortskrida till förutbestämda tidpunkter. Portioner tas sedan ut ur aggregering reaktionen och blandas med ThT eller THS för amyloid bindande före fluorescens läsning. Den ursprungliga volymen för aggregationen reaktionen beror på antalet tidpunkter som krävs. Detta tillvägagångssätt kan require en stor mängd av tau-protein, men är snabb, enkel, och kan göras i en fluorometer eller en flerbrunnsplattläsare (se diskussion). Nedan följer steg-för-steg-drift, med hjälp av ISA SPEX FluoroMax-2 kompakt spektrofluorometer för fluorescens kvantifiering.
- Ställ upp aggregering blandningen i 1,5 ml Eppendorf-rör som i tabell 1. Varje kolumn representerar de ingredienser som behövs för en 100 pl reaktion, vilket är tillräckligt för en tid-punktsmätning. Justera mängden för hela aggregering mix utifrån de tidpunkter som krävs för den specifika experimentet. Lägg till ytterligare 10% av varje komponent för att ge utrymme för pipettering fel. Den typiska reaktion innehållande heparin visas här kan ersättas av arakidonsyra eller aggregering buffert. Lägg DTT till 1 mM till reaktionsblandningen. Om hela reaktionen varar mer än en dag, komplettera färsk DTT vardag (1 mM) för att säkerställa en reducerande miljö.
- Vänd röret ett par gånger för att blanda. Place varje reaktion i en 37 ° C inkubator eller vattenbad. Behövs ej Omröring för tau-aggregation.
- Innan mäta fluorescens, slå på spektrofluorometer (lampan först, sedan datorn).
OBS: xenonbåglampa som kan användas direkt. Men för bästa resultat gör att maskinen värma upp i ca 10 min innan du läser fluorescens. - Starta programmet på datorn.
- Välj Real Time Display-läget i instrument Control Center, ställa excitationsvåglängd till 450 nm (spalt till 2 nm) och emissionsvåglängd till 510 nm (skåran och 5 nm). Nära realtid Visningsläge fönstret för att återgå till Instrument Control Center.
- Välj Konstant Wavelength Analysis, trycker du på Lägg >> nyckeln i den övre ramen för att lägga våglängder uppsättningar. Ställ ackvisitionsparametrar av standardavvikelse till 1 och Max Trials till 3, klicka på Lägg till. Klicka åk! För att öppna data Displayfönster.
- I Data Display, klicka på Start Acq att öppna dialogrutan Ny Sample ruta. Välj "okända" för provtypen.
- Till varje 100 ^ aggregering blandning, lägga 98 l aggregering buffert och 2 pl 3 mM Thioflavin T. Pipet flera gånger för att blanda.
- Överför hela blandningen till en kyvett (FCA3, yttre dimension, BxLxH = 12,5 mm x 12,5 mm x 45 mm). Placera kyvetten i provhållaren i provet-facket och stäng locket. Klicka på Kör för att samla in fluorescensdata. Registrera data.
- Avlägsna kyvetten och dekan lösningen. Skölj kyvetten genom destillerat vatten tre gånger. Torr genom att blåsa luft i och utanför kyvetten.
3. Med-dye, Kontinuerligt läge analys på en SpectraMax M2 Plate Reader
OBS: Denna analys skiljer sig från tidigare en av att det fluorescerande färgämnet ThT eller THS ingår i aggregationsreaktionen. Detta möjliggör kontinuerlig mätning av samma uppsättning reaktioner. På grund av den repetitiva användningen av reaktionen är denna metod bättre gjort med en automatisk flerbrunnsplattläsare (såsom visas nedan driften av SpectraMax M2). En vanlig fluorometer fungerar också, men frekvensen av mätning av snabba aggregering reaktioner är något begränsad, på grund av den manuella verksamhetens art.
- Sätt upp aggregering mixen i en 96-brunnar (96 brunnar svart fast platta, väls volym 360 l, plan botten) som i tabell 2. Varje kolumn representerar de ingredienser som behövs för en 200 pl reaktion, vilket är tillräckligt för en tid-punktsmätning. Blanda väl genom att pipettera flera gånger. Komplettera färska 1 mM DTT varje dag under hela experimenten.
- Inkubera 96-brunnars platta vid 37 ° C.
- Vid varje tidpunkt före fluorescensmätning, slå på multi-mode mikroplattläsare och datorn. Ge tillräcklig tid för machine stabiliseras, ca 10 min.
- Starta programmet på datorn. Ställ temperaturen till 37 ° C och välj Fluorescens Intensitet (FI-Top Läs) läget inställt excitationsvåglängd på 450 nm och emissionsvåglängd på 510 nm.
- Sätt i 96-brunnar i lådan och tryck på READ-knappen för att starta mätningen.
- Efter att ha läst, ta bort plattan och returnera den tillbaka till 37 ° C inkubator. Kopiera data och klistra in i ett Excel-ark för dataanalys och plottning.
4. Med-dye, Kontinuerligt läge analys på en Compact spektrofluorometer
- Ställ upp aggregering blandningen i 1,5 ml Eppendorf-rör som i tabell 3. Varje kolumn representerar de ingredienser som behövs för en 200 pl reaktion, vilket är tillräckligt för en tid-punktsmätning.
- Vänd röret ett par gånger för att blanda.
- Slå på spektrofluorometer och ställa mjukvaran som i steg 2.3 och 2.4.
- Överför hela blandningen toa kyvett. Placera kyvetten i provhållaren i provet-facket och stäng locket. Klicka på Kör för att samla in fluorescensdata. Registrera data.
- Fortsätt läsa vid lämpliga intervall genom att klicka på Kör och registrera data. Om sammanläggning ska övervakas vid en hög frekvens (t.ex. var 30 eller 60 sek), låt reaktionen i kyvetten och i maskinen tills antingen mätningen är klar, eller när det finns tillräckligt med tid att byta reaktioner eller kyvetter.
- Avlägsna kyvetten och dekan lösningen. Skölj kyvetten genom destillerat vatten tre gånger. Torr genom att blåsa luft i och utanför kyvetten.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Använda rekombinant tau och p-tau (Figur 1), etablerade vi två olika protokoll för att jämföra kinetiken för sammanläggning av tau och p-tau, dra nytta av den starka fluorescens utsläpp av ThT och THS vid bindning till amyloidal proteinaggregat, inklusive tau och p-tau (Figur 2). Med eller utan fluorescerande färgämne i aggregering reaktionen, observerade vi konsekvent förbättring av tau aggregering av hyperfosforylering (figurerna 3-5). Denna stimulering är oberoende av heparin (data visas ej). I en typisk reaktion, tau och p-tau oligomerisera vid höga priser inom den första 30 min innan den saktar ner avsevärt (figur 3 och 5), med p-tau uppvisar högre fluorescensenheter under hela experimentet. Inklusive ThT i aggregering reaktioner orsakar betydande utvecklingsstörning i hastigheten av aggregering (Figur 4). Båda isoformer närmade plateau 160 timmar efter reaktionerna hade börjat. Ths, å andra sidan, inte orsakar märkbar nedgång av aggregering (Figur 5).

Figur 1. Renat tau och hyperfosforylerat tau (p-tau) användes i denna studie. Prover upplöstes genom en 10% SDS-PAGE-gel och färgades med Coomassie-blått R250 (vänster) eller sonderades med en anti-tau-monoklonal antikropp (höger panel). Lane M, molekylviktsmarkör; spår 1 och 3, ofosforylerat tau; lane2 och 4, hyperfosforylerat tau.

Figur 2. Utsläpp spektra för ThT (30 ^ M) med eller utan bindande tau aggregat. Emissions förvärvet var s konserverad från 460 nm till 600 nm (1 nm inkrement; 0,1 sek integrering, 5 nm spaltbredd), excitation vid 450 nm. Tau aggregat erhölls genom att låta 50 iM tau aggregering fortgå vid 37 ° CO / N (se protokoll 2 för detaljer).
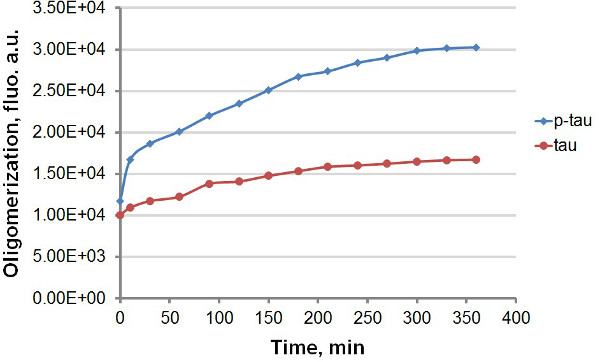
Figur 3. Aggregation kurvor för tau och p-tau i terminal analys. Sammanläggning av 50 iM tau och p-tau avslutades med 30 ^ M heparin som inducerare. Vid olika tidpunkter efter starten av reaktionen tillsattes 100 ul av reaktions avlägsnades och blandades med samma volym av 60 | iM ThT före fluorescensmätning. Fluorescens mättes vid 450 nm excitation, 510 nm emission. "au", godtyckliga enheter. Observera att tidsskalan är i minuter.
"Figur 4" src = "/ filer / ftp_upload / 51.537 / 51537fig4highres.jpg" />
Figur 4. Aggregeringsfunktioner kurvor för ThT ensam, tau och p-tau i den kontinuerliga mätläge i närvaro av ThT. Varje reaktion bestod av 0 eller 50 pM tau eller p-tau, 30 pM heparin och 30 | iM ThT i aggregering buffert . Reaktioner inkuberades vid 37 ° C i en 96-brunnars platta. Vid olika tidpunkter, plattan avlägsnades från inkubatorn och laddas till plattläsaren för fluorescens behandlingen (excitation 450 nm, emission 510 nm). Mellan avläsningar, plattan hålls i inkubatorn utan omrörning under en lucka. Förekomsten av ThT saktade markant ner aggregering, men, viktigare, den hyperfosforylerat tau fortfarande uppvisade en snabbare takt om sammanläggning än gjorde sitt omodifierade motsvarighet. Observera att skalan av tiden är i timmar.
pload / 51.537 / 51537fig5highres.jpg "/>
Figur 5. Småskaliga tau aggregeringsanalyser i närvaro av THS. In vitro heparininducerad aggregering av 6 iM tau och p-tau bedömdes i den kontinuerliga mätningsläget med tioflavin S som indikator färgämnet. Förutom proteinet, varje reaktion innehöll 30 pM heparin och 20 | iM THS i HEPES aggregering buffert (10 mM HEPES pH 7,5, 5 mM DTT, 0,1 mM EDTA). Alla ingredienser utom heparin blandades och ekvilibrerades vid RT. Efter tillsats av heparin, utfördes reaktionen överfördes till kuvetten och placerades i provhållaren. Fluorescens registrerades omedelbart som T 0, och fortsatte i ca 2 timmar eller tills fluorescens ökningen avtog till nära noll. På grund av den relativt korta reaktionsperioden, var hela utförs reaktionen vid RT i samma kyvett.
| tau | p-tau | |
| 60-100 iM tau | 50 | il | 0 il |
| 60-100 pM p-tau | 0 il | 50 | il |
| 300 pM heparin | 10 | il | 10 | il |
| aggregering buffert | 39 | il | 39 | il |
| 100 mM DTT | 1 il | 1 il |
Tabell 1. Aggregation blandningskomponenter för no-dye, terminal analys.
| tau | p-tau | Dye ensam | |
| 60-100 iM tau | 50 | il | 0 il | 0 il |
| 60-100 pM p-tau | 0 il | 50 | il | |
| 300 pM heparin | 20 | il | 20 | il | 20 | il |
| 3 mM Thioflavin T | 2 | il | 2 | il | 2 | il |
| Aggregering buffert | 126 | il | 126 | il | 176 | il |
| 100 mM DTT | 2 | il | 2 | il | 2 | il |
Tabell 2. Sammanläggning blandningskomponenter för med-dye, kontinuerlig analys på en plattläsare.
| tau | p-tau | Dye ensam | |
| 60-100 iM tau | 5 pl | 0 il | 0 il |
| 60-100 pM p-tau | 0 il | 5 pl | 01; l |
| 300 pM heparin | 20 | il | 20 | il | 20 | il |
| 3 mM Thioflavin S | 1,5 | il | 1,5 | il | 1,5 | il |
| Aggregering buffert | 171,5 | il | 171,5 | il | 176,5 | il |
| 100 mM DTT | 2 | il | 2 | il | 2 | il |
Tabell 3. Sammanläggning blandningskomponenter för med-dye, kontinuerlig analys på en kompakt spektrofluorometer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Detta protokoll visar olika analysförhållanden och instrument som detekterar fosforyleringskinetiken beroende snabbt tau sammanläggning kinetik. I terminalanalysen fluorescensen färgämnet ThT sättes till en del av reaktionen avlägsnas från masterblandningen vid varje tidpunkt. Amyloid bindning-inducerad fluorescens mäts sedan 26. I den andra, med-dye-läge, är tau sammanläggning genomföras i närvaro av ThT eller THS, vilket gör denna typ av reaktion som lämpar sig för realtids automatisk bedömning av tillväxten av tau aggregat. Var och en av dessa metoder har sina för- och nackdelar.
Terminalen-mode reaktionen utföres med endast de ingredienser som behövs för tau-aggregation. Utspädning och blandning av reaktionen med tioflavin T drastiskt saktar ner takten i fluorescensökning, i huvudsak stoppar reaktionen för fluorescens kvantifiering. Denna metod är således även kompatibel med manuell drift. Men eftersom reaction är praktiskt avslutas på ThT Dessutom kan en stor mängd tau krävas för att plotta en sammanläggning kurva. En annan potentiell varning för denna metod är att frekvent tillgång till reaktionsblandningen kan introducera mikrobiell eller proteolytisk kontamination eller proteinoxidation. I motsats härtill tillåter den med-dye läge generering av amyloid i närvaro av ThT eller THS. Att främja sammanläggning kan övervakas kontinuerligt utan att någonsin störa reaktionen. Den här funktionen är särskilt attraktiv när du upprättar en automatiserad analysplattform. Dock kan olika färgämnen framkalla specifika svar. Faktum ThT retards tau och p-tau-aggregation signifikant, men THS har små effekter (jämför figurerna 3 och 5). Det finns flera andra fluorescens färgämnen, inklusive Kongo röda och tiaziner, som har använts i histologiska och cellbiologiska studier för PHF bildning. Minst en rapport uppgav att vissa av dessa färgämnen kan framkalla tau aggregering i vävnadkulturceller 45. När man ska välja dessa föreningar för amyloidogenesis kinetik studier, försiktighet skall praktiseras och att olika färgämnen kan behöva jämföras.
När det gäller valet av instrument, är den enda prov fluorometer som användes i den första metoden mycket tillförlitliga, men operationen kan vara mödosamt när mer än några reaktioner ska jämföras. Använda flera kyvetter kan bidra till att undvika korskontaminering mellan reaktionerna, även om kostnaden för dessa sköra quartzkuvetter kan vara oöverkomliga för vissa. Omvänt kan flera brunnar mikroplattläsare undersöka multipla reaktioner samtidigt. Användningen av engångs 96-brunnars plattor är fördelaktig också. Med ett värmeelement, kan en mikroplattläsare vara en dedicerad enhet för övervakning av multipla reaktioner vid 37 ° C under en längre tidsperiod. Dock kanske avdunstning vara ett bekymmer. DiNitto et al., Överlagras en liknande reaktion med mineralolja för att förhindraindunstning 46.
Vissa försiktighetsåtgärder som skall vidtas för ovanstående protokoll för att säkerställa konsekventa och kvantitativa resultat. För det första, tau och p-tau bildar spontant amyloidaggregat med tiden, särskilt när den är i en hög koncentration. Det är därför absolut nödvändigt att frysa alla portioner av protein preps och tina endast den behövs volymen innan experimenten. Trots detta kan vissa aggregat, inklusive de granulära mellan detekterbara genom ThT 47 har bildats under framställningen av rekombinanta proteiner. En betydande initial fluorescens läsning av en typisk aggregering reaktion är alltså vanligt. Ändå, lägga en pre-spinning steg och överföra supernatanten till ett separat rör, även utan en synlig proteinpellet, kan minska, och bibehålla en konsekvent, initial fluorescens av samma parti av tau och p-tau prep. För det andra (dvs, 60 M) är den arbetsstamlösning av ThT stabil vid RT för mindre än en vecka innan the fluorescens minskar. Det är således tillrådligt att åter göra 60 iM ThT var flera dagar.
En framträdande orsak underliggande studier av p-tau aggregering är utveckling av nya AD diagnostik och terapi. Föreningar som hämmar eller återgå rekombinant tau aggregering har identifierats från hög genomströmning skärmar och riktade tester 18,40,41,48. Effekten av dessa föreningar för p-tau-aggregation står att klargöras. Dessa skärmar utfördes i terminalläge genom att fördela en gemensam aggregering mix utan färgämnet till enskilda flertallriks brunnar med olika föreningar. Vanligtvis efter O / N inkubation ThT eller THS till för fluorescensmätning, avslöjar den hämmande kraften i många föreningar. Den med-dye synsätt som nämns ovan och genom Rankin et al. 49 har ännu inte införlivats i hög kapacitet skärmar. Nu med hyperfosforylerat tau för kinetiska och läkemedelsstudier av paradespiralformade filamentbildning, kommer sannolikt att avancera längre Alzheimers sjukdom läkemedelsutveckling.
Slutligen är det värt att notera att studiet av p-tau aggregering är av avgörande betydelse för inte bara tauopatier, men kan också påverka ett ännu bredare befolkningen. Till exempel, det finns rapporter om att de nystan är detekterbara hos vissa patienter med kronisk traumatisk encefalopati, såsom professionella amerikanska fotbollsspelare och boxare 50-52. Liknande samband har också rapporterats för enstaka eller upprepade traumatisk hjärnskada patienter inklusive soldater 53. Protokoll som beskrivs i detta arbete kan därmed bidra till forskning och utveckling av nya läkemedel inriktade p-tau aggregat i nervceller.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



