Summary
Ongemodificeerde en hypergefosforyleerd tau-eiwitten werden twee in vitro aggregatie-assays om de hyperfosforylering afhankelijke snelle aggregatie kinetiek onthullen. Deze assays weg effenen voor toekomstige schermen voor verbindingen die de neiging van hypergefosforyleerde tau kan moduleren fibrillen die de progressie van de ziekte van Alzheimer ten grondslag vormen.
Introduction
De ziekte van Alzheimer (AD) is één van een grote collectie van neurodegeneratieve aandoeningen bekend als tauopathieen. De typische pathologie onderliggende tauopathie is de tangles, NFTs, in neuronen, astrocyten en microglia 1-4. De NFT dichtheid correleert met cognitieve stoornissen 3,5 en neuron verlies 6. NFT bevat voornamelijk hypergefosforyleerde tau-eiwit (aangeduid als "p-tau" voortaan) die recht of gepaarde helixvormige filamenten (PHF) 7,8 vormt. Tau is een microtubuli geassocieerde eiwit dacht bij axonale transport, dat is onontbeerlijk voor de neuronale signalering van en handel 9,10 vergemakkelijken. Elke tau molecuul 2-3 fosfaten in normale hersenen, maar de fosforylgroep gehalte toeneemt door verscheidene vouwen in tauopathie patiënten 11. Meerdere kinases zijn waarschijnlijk bijdragen tot tau hyperfosforylatie inclusief GSK3P (glycogeensynthasekinase 3β) en CDK5 (cycline-dekelijke kinase 5) 12,13, maar de directe aanleiding voor de pathologische fosforylering blijft ongrijpbaar 14. Abnormale fosforylatie in of nabij de microtubuli bindende motieven dissocieert tau de microtubule 15, en veroorzaakt tau mis-lokalisatie aan het somatodendritische compartiment waar p-tau oligomerizes in rechte of gepaarde spiraalvormige filamenten die uiteindelijk kunnen polymeriseren in NFT insluitsels. De nauwe band tussen tau hyperfosforylatie, NFT vorming, en neurodegeneratie leidde tot een heersende hypothese dat p-tau klitten ontlokken apoptotische en andere cytotoxische reacties, en daarmee is de onderliggende oorzaak voor tauopathie neurodegeneratie 16,17. Drug schermen en vroege klinische tests op basis van dit uitgangspunt zijn gelanceerd 18. Echter, deze hypothese wordt geconfronteerd met uitdagingen 19,20. Bijvoorbeeld SantaCruz et al. Toonden aan dat cognitieve functies van transgene muizen kunnen worden verbeterd door het onderdrukken van de expressie van een mutantmenselijke tau, hoewel NFT blijven vormen bestaande tau moleculen 21. In een Drosophila model, werd aangetoond dat de NFT toxische cytosolische tau sekwestreren de onderliggende zenuwcellen 22,23 beschermen. Duidelijk de pathogenese rol van NFT eventuele sterk zal beïnvloeden richting tauopathie therapeutische ontwikkeling.
In hoge concentraties recombinant of normale hersenen tau-eiwit spontaan maar langzaam polymeriseert in een PHF-achtige structuur in vitro, zoals aangegeven door de binding van verschillende β-sheet voorkeur fluorescente kleurstoffen, elektronenmicroscopie en lichtverstrooiing spectroscopie 24-27. Het toevoegen van heparine of arachidonzuur, een overvloedige vetzuur in menselijke hersenen, drastisch versnelt PHF formatie tau isoform- en inductor concentratieafhankelijke manieren 28-32. Intrigerend hypergefosforyleerde tau gezuiverd van AD hersenen of door uitputtend in vitro bereid fosforyleringsreacties eenggregates sneller en efficiënter 26,33-35. Deze resultaten zijn in uitstekende overeenkomst met de pathologische rol van p-tau. Een in vitro systeem gebaseerd op de aggregatie van p-tau kan dus dienen als een krachtig hulpmiddel voor AD drug screening.
Gezien de nauwe samenwerking tussen tau-aggregatie en de progressieve neurodegeneratie van AD, evenals de recente mislukking in de ontwikkeling van geneesmiddelen gericht op de AP-plaque, een andere belangrijke histologische marker van AD 36-38, de belangstelling voor het ontdekken van geneesmiddelen die controle tau aggregatie stijgt. Inderdaad hebben verscheidene groepen al begonnen drug schermen op verschillende verwerkingscapaciteit hand van in vitro tau aggregatie reacties als primaire assay. Een aantal chemische stoffen bleken remmende of omkering activiteiten op tau aggregatie vertonen in vitro 39-42. Echter, alle huidige tau aggregatie regulator schermen gebruiken ongewijzigde tau dat de belangrijkste pathologische kenmerk van fosfor mistylering, verhogen een zorg voor de specificiteit en de werkzaamheid van deze verbindingen bij AD behandeling.
Een van de belangrijkste hindernissen ontwikkelen aggregatie assays voor biochemische karakterisering en AD drug screening is de productie van voldoende hoeveelheden van het pathofysiologisch relevante hypergefosforyleerd tau-eiwit. Met behulp van de ritsen geassisteerde katalyse systeem waarin de 1N4R isoform van tau en de GSK-3β kinase gelijktijdig worden gebracht in E. coli leucine zipper fusie-eiwitten hebben we deze uitdaging overwinnen (. Sui et al, ingediend; zie Figuur 1 voor de eindproducten van tau en p-tau, zie ook 43 een voorlopige massaspectrometrie karakterisering van p-tau). Uit een panel van negen antilichamen specifiek voor verschillende fosforylatieplaatsen van tau werden positieve signalen waargenomen in acht posities (gegevens niet getoond). Hieronder beschrijven we protocollen en instrumentaties die kunnen onderscheiden van de aggregatie kinetische differences tussen ongewijzigde tau en p-tau soorten. Deze testen werden gewijzigd ten opzichte van gepubliceerde protocollen dat de toename van de fluorescentie van thioflavine T (ThT) of thioflavin S (THS) op amyloid (tau aggregaten) binding 26 gemeten. In de eerste "terminal", geen kleurstof benadering aggregatie reacties worden samengevoegd en geïncubeerd in de afwezigheid van de amyloïde kleurstof. Op verschillende tijdstippen is een monster van elke reactie verwijderd en gemengd met een gelijk volume van de ThT bevattende buffer aggregatie stoppen en laat ThT tau aggregaten binden. Fluorescentie wordt gemeten door een IAP FluoroMax-2 fluorometer. In de tweede "met kleurstof" continue bewaking test ThT of THS is bij de aggregatie reacties. Fluorescentie kan manueel continu gemeten gedurende het gehele experiment of een multi-plaatlezer. Verder beschrijven we een test die een bijna fysiologische concentratie van tau en p-tau gebruikt voor aggregatie in de continue meting mode. Het effect van fosforylering steeds gemakkelijk detecteerbaar. Hieronder wordt stap voor stap bedieningsprocedures beschrijven en tonen representatieve resultaten van deze assays. Bespreking van een aantal van de voor-en nadelen van elke benadering, evenals de mogelijke drug discovery programma's zullen volgen.
Bij een hoge concentratie, tau aggregaten in amyloïd-achtige structuren spontaan. In het laboratorium, tau fibrillization wordt gewoonlijk versneld door inductoren zoals heparine (gemiddeld molecuulgewicht 6000 g / mol) en arachidonzuur. Voorbeelden hierin zijn inclusief 30 uM heparine. De vorming van tau amyloïde aggregaten wordt door de fluorescentie verkregen uit amyloïde binden door thioflavine T (ThT) of Thioflavin S (THS). Na binding aan tau aggregaten, ThT vertoont een rode verschuiving in fluorescentie (excitatie: 450 nm; piekemissie: 485 nm). THS, daarentegen, heeft zwakke emissie bij 510 nm (excitatie bij 450 nm) voordat amyloïde binden, maar dit fluorescence significant in aanwezigheid van amyloïde eiwit toeneemt als de geaggregeerde tau 44. Beide kleurstoffen werken goed in het opsporen van tau en p-tau-aggregatie. Vanwege de sterke en relatief brede emissiepiek van ThT (zie figuur 2), is er slechts 30% verlaging van de fluorescentie-eenheid bij 510 nm. Gemakshalve gebruiken we dezelfde combinatie van excitatie / emissie golflengten (bijvoorbeeld 450 nm / 510 nm) tau aggregatie controleren wanneer met behulp van kleurstof.
Tau aggregatie kan in aanwezigheid of afwezigheid van de kleurstof, afhankelijk van het doel van de test en de beschikbaarheid van tau-eiwit. Beide modi van reacties worden hieronder weergegeven. Verder tonen we de werking van twee verschillende instrumenten - één monster fluorometer (ISA-SPEX FluoroMax-2) en een multi-plate reader (SpectraMax M2). Lezers moeten in staat zijn om deze protocollen aan te passen aan hun specifieke behoeften en beschikbaarheid instrument aan te passen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Bereiding van reagentia
- Bereid aggregatie buffer (20 mM Tris, pH 7,4, 100 mM NaCl, 1 mM EDTA). Bewaar bij RT, stabiel maanden. Supplement 1 mM dithiothreitol (DTT) vóór gebruik.
OPMERKING: een HEPES-gebaseerde buffer (10 mM HEPES, pH 7,5, 0,1 mM EDTA, 5 mM DTT) produceert dezelfde resultaten tau aggregatie. - Bereid thioflavin T of thioflavin S stockoplossing (3 mM, opgelost in aggregatie buffer) en filter door 0,22 pm steriele filter unit. Bewaren bij -20 ° C in een buis onder aluminiumfolie, stabiel maanden.
- Bereid heparine stockoplossing (300 uM, opgelost in aggregatie buffer). Bewaren bij -20 ° C, stabiel gedurende maanden.
- Bereid dithiotreïtol (DTT) voorraad (1 M, opgelost in water). Aliquot in 1,5 ml buizen. Bewaren bij -20 ° C. Voor aggregatietesten ontdooien de 1 M oplossing bij kamertemperatuur. Vanaf deze 1000x voorraad, bereiden een portie van 100 mM werkvoorraad met gedemineraliseerd water. Laat het ijstot klaar.
- Verwijder tau van -80 ° C vriezer. Ontdooien op ijs. Pas tau aan vooraf bepaalde concentratie met de aggregatie buffer. Spin in een microcentrifuge bij 20.800 xg gedurende 10 min bij 4 ° C staan voorgebakken grote aggregaten te verwijderen. Deze pre-spinning stap vergroot de samenhang van de daaropvolgende fluorescentie meting van elke partij van het eiwit prep. Breng het supernatans naar een andere buis; vertrekken op ijs pas klaar voor de aggregatie reactie monteren.
2. No-kleurstof, Terminal Assay
OPMERKING: De aggregatie reactie van deze test geschiedt bij afwezigheid van de fluorescente kleurstof. Na het mengen van alle componenten wordt de reactie om naar vooraf bepaalde tijdstippen. Monsters worden vervolgens uit de aggregatie reactie en gemengd met ThT of THS voor amyloïde binden voordat fluorescentie lezen. Het beginvolume van de aggregatie reactie hangt af van het aantal tijdstippen nodig. Deze aanpak kan requIre een grote hoeveelheid tau-eiwit, maar is snel, eenvoudig en kan in een fluorometer of een multi-well plaatlezer (zie bespreking). Hieronder is de stap voor stap, gebruikmakend van het ISA SPEX FluoroMax-2 spectrofluorometer compact fluorescentie voor kwantificering.
- Stel de aggregatie mengsel in 1,5 ml Eppendorf buisjes zoals in tabel 1. Elke kolom geeft de ingrediënten voor een 100 ui reactie, wat genoeg is voor een tijdpunt meting. Pas het bedrag voor de gehele aggregatie mix gebaseerd op de tijdstippen die nodig is voor dat experiment. Voeg nog 10% van elke component om ruimte te maken voor pipetteerfout. De typische reactie die heparine hier worden vervangen door arachidonzuur of aggregatie buffer. Voeg aan 1 mM DTT aan het reactiemengsel. Als de gehele reactie duurt meer dan een dag, als aanvulling verse DTT alledaagse (1 mm) tot een reducerend milieu te waarborgen.
- Keer de buis een paar keer om te mengen. Place elke reactie in een 37 ° C incubator of waterbad. Roeren is niet noodzakelijk voor tau aggregatie.
- Voordat het meten van de fluorescentie, zet de spectrofluorometer (lamp eerst, dan de computer).
OPMERKING: De xenon arc lamp die direct kunnen worden gebruikt. Echter, voor het beste resultaat kunt u het apparaat opwarmen ongeveer 10 minuten vóór het lezen van fluorescentie. - Start de software op de computer.
- Kies Real Time modus Display in Instrument Control Center, ingesteld excitatie golflengte tot 450 nm (spleet tot 2 nm) en emissie golflengte tot 510 nm (spleet tot 5 nm). Sluiten Real Time Display modus venster om terug te keren naar het Instrument Control Center.
- Kies Constant Golflengte Analyse, drukt u op Toevoegen >> sleutel in het bovenste frame golflengten sets toe te voegen. Stel acquisitie parameters van Standard Error op 1 en maximaal Trials tot 3, klik op Toevoegen. Klik op Go! Om de gegevens weer te openenraam.
- In het Data Display, klikt u op Start Acq om het dialoogvenster Nieuwe Sample openen. Kies "onbekend" voor soort monster.
- Om elke 100 ul aggregatie mengsel, voeg 98 ul aggregatie buffer en 2 pi 3 mM thioflavin T. pipet enkele malen om te mengen.
- Breng het gehele mengsel aan een cuvet (FCA3, buitenkant dimensie, bxlxh = 12,5 mm x 12,5 mm x 45 mm). Plaats de cuvette in de monsterhouder in de steekproef-compartiment en sluit het deksel. Klik op Uitvoeren om de fluorescentie gegevens te verzamelen. Noteer de gegevens.
- Verwijder de cuvet en wordt de oplossing. Spoel de cuvet met gedestilleerd water 3 keer. Droog door te blazen lucht in en buiten de cuvette.
3. Met-dye, Continue Mode Assay op een SpectraMax M2 Plate Reader
Opmerking: Deze test verschilt van de vorige doordat de fluorescente kleurstof ThT of ths opgenomen in de aggregatie reactie. Dit maakt continue meting van dezelfde set van reacties. Door het herhaald gebruik van de reactie wordt deze werkwijze beter uitgevoerd met een automatische multiwell-plaatlezer (zoals onder de werking van SpectraMax M2). Een regelmatige fluorimeter werkt ook maar de meetfrequentie van snelle aggregatie reactie is enigszins beperkt vanwege de handmatige aard van de operatie.
- Stel de aggregatie mix in een plaat met 96 putjes (96 putjes zwarte vaste plaat, goed volume 360 pl, vlakke bodem) volgens tabel 2. Elke kolom geeft de ingrediënten voor een 200 gl reactie, die genoeg is voor een tijd-punts meting. Meng goed door meerdere malen pipetteren. Supplement verse 1mM DTT elke dag in de loop van de experimenten.
- Incubeer de plaat met 96 putjes bij 37 ° C.
- Op elk tijdstip vóór fluorescentiemeting, zet de multi-mode microplaat reader en de computer. Voldoende tijd voor de machine te stabiliseren, ongeveer 10 min.
- Start de software op de computer. Stel de temperatuur tot 37 ° C en kies fluorescentie- intensiteit (FI-Top lezen) modus ingesteld excitatie golflengte bij 450 nm en emissie golflengte bij 510 nm.
- Plaats de plaat met 96 putjes in de lade en druk LEES toets om de meting te starten.
- Na het lezen, verwijder de plaat en stuur het terug naar de 37 ° C incubator. Kopieer de gegevens en plakken in een Excel-spreadsheet voor data-analyse en plotten.
4. Met-dye, Continue Mode Assay op een Compact Spectrofluorometer
- Stel de aggregatie mengsel in 1,5 ml Eppendorf buisjes zoals in tabel 3. Elke kolom geeft de ingrediënten voor een 200 gl reactie, die genoeg is voor een tijdpunt meting.
- Keer de buis een paar keer om te mengen.
- Zet de spectrofluorometer en zet de software als in de stappen 2.3 en 2.4.
- Breng het gehele mengsel to een cuvet. Plaats de cuvette in de monsterhouder in de steekproef-compartiment en sluit het deksel. Klik op Uitvoeren om de fluorescentie gegevens te verzamelen. Noteer de gegevens.
- Lees verder op geschikte tijdstippen door te klikken op Uitvoeren en het opnemen van de gegevens. Als de aggregatie wordt gecontroleerd op een hoge frequentie (bijvoorbeeld elke 30 of 60 seconden), laat de reactie in de cuvet en in het apparaat totdat de meting is voltooid, of wanneer er voldoende tijd is om reacties of cuvettes wisselen.
- Verwijder de cuvet en wordt de oplossing. Spoel de cuvet met gedestilleerd water 3 keer. Droog door te blazen lucht in en buiten de cuvette.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Met behulp van recombinant tau en p-tau (Figuur 1), hebben we twee verschillende protocollen om de kinetiek van aggregatie van tau en p-tau vergelijken, profiteren van de sterke fluorescentie emissie van ThT en THS na binding aan proteïneaggregaten amyloidal, waaronder tau en p-tau (Figuur 2). Met of zonder de fluorescente kleurstof in de aggregatie reactie zagen we consistente verhoging van tau aggregatie door hyperfosforylering (figuren 3-5). Deze stimulatie is onafhankelijk van heparine (gegevens niet getoond). In een typische reactie, tau en p-tau oligomeriseren bij hoge percentages binnen de eerste 30 min voor vertragen significant (figuren 3 en 5), met p-tau vertonen hogere fluorescentie-eenheden in de loop van het experiment. Waaronder ThT in de aggregatie reacties veroorzaakt aanzienlijke vertraging in het tempo van de aggregatie (figuur 4). Beide isovormen benaderd plateau 160 uur na de reacties was begonnen. THS, anderzijds, veroorzaakt geen merkbare vertraging van aggregatie (figuur 5).

Figuur 1. Gezuiverd tau en tau hypergefosforyleerd (p-tau) in dit onderzoek. De monsters werden gescheiden door 10% SDS-PAGE gel en gekleurd met Coomassie blauw R250 (links) of gesondeerd met een anti-tau monoklonale antilichaam (rechts paneel). Laan M, molecuulgewichtsmerker; lanen 1 en 3, gefosforyleerd tau; lane2 en 4, gehyperfosforyleerd tau.

Figuur 2. Emissie spectra voor ThT (30 uM) met of zonder bindende tau aggregaten. Emission overname was s blik van 460 nm tot 600 nm (1 nm increment 0,1 sec integratie, 5 nm spleetwijdte), excitatie bij 450 nm. Tau aggregaten werden verkregen doordat 50 uM tau aggregatie verlopen bij 37 ° CO / N (zie protocol 2 voor details).
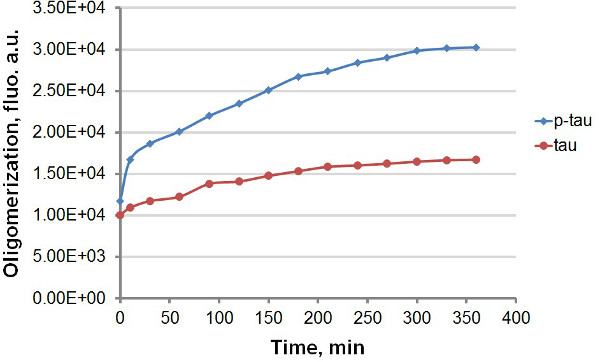
Figuur 3. Aggregatie curven voor tau en p-tau in terminal assay. Aggregatie van 50 uM tau en p-tau werd aangevuld met 30 uM héparine als inductor. Op verschillende tijdstippen na het begin van de reactie werd 100 ui van het reactiemengsel werd verwijderd en gemengd met hetzelfde volume van 60 uM ThT voor fluorescentiemeting. De fluorescentie werd gemeten bij 450 nm excitatie, 510 nm emissie. "Au", willekeurige eenheden. Merk op dat de tijdschaal is in minuten.
"Figuur 4" src = "/ files / ftp_upload / 51537 / 51537fig4highres.jpg" />
Figuur 4. Aggregatie curves voor ThT alleen tau en p-tau in de continue meetmodus in aanwezigheid van ThT. Elke reactie bestond uit 0 of 50 uM tau en p-tau, 30 uM héparine, en 30 uM ThT in aggregatie buffer . De reacties werden geïncubeerd bij 37 ° C in een 96-well plaat. Op verschillende tijdstippen werd de plaat verwijderd uit de incubator geplaatst om de plaatlezer voor fluorescentieaflezing (excitatie 450 nm, emissie 510 nm). Tussen metingen werd de plaat in de incubator gehouden zonder roeren onder een afdekking. De aanwezigheid van ThT aanzienlijk vertraagd aggregatie, maar, belangrijker nog, de hypergefosforyleerde tau nog vertoonden een sneller tempo van aggregatie dan deed zijn originele tegenhanger. Merk op dat de omvang van de tijd in uren.
= Upload / 51537 / 51537fig5highres.jpg "/>
Figuur 5. Kleinschalig tau aggregatie assays in aanwezigheid van THS. In vitro-heparine geïnduceerde aggregatie van 6 uM tau en p-tau werd bepaald in de continue meetmodus met thioflavine S als indicatorkleurstof. Naast het eiwit, elke reactie bevatte 30 uM héparine en 20 uM THS in de HEPES aggregatie buffer (10 mM HEPES pH 7,5, 5 mM DTT, 0,1 mM EDTA). Alle ingrediënten behalve heparine werden gemengd en geëquilibreerd bij kamertemperatuur. Na toevoeging van heparine werd het reactiemengsel overgebracht naar de cuvet en geplaatst in de monsterhouder. Fluorescentie werd onmiddellijk in T 0, en gedurende ongeveer 2 uur of totdat de fluorescentietoename vertraagd tot bijna nul. Vanwege de relatief korte reactieperiode werd de gehele reactie bij kamertemperatuur uitgevoerd in dezelfde cuvet.
| tau | p-tau | |
| 60-100 uM tau | 50 gl | 0 pi |
| 60-100 pM p-tau | 0 pi | 50 gl |
| 300 uM héparine | 10 gl | 10 gl |
| aggregatie buffer | 39 pi | 39 pi |
| 100 mM DTT | 1 pi | 1 pi |
Tabel 1. Samenvoeging mengsel componenten voor no-dye, terminal test.
| tau | p-tau | Dye alleen | |
| 60-100 uM tau | 50 gl | 0 pi | 0 pi |
| 60-100 pM p-tau | 0 pi | 50 gl | |
| 300 uM héparine | 20 gl | 20 gl | 20 gl |
| 3 mM thioflavine T | 2 pi | 2 pi | 2 pi |
| Aggregatie buffer | 126 ul | 126 ul | 176 ul |
| 100 mM DTT | 2 pi | 2 pi | 2 pi |
Tabel 2. Samenvoeging mengsel componenten voor met-dye, continue test op een bord lezer.
| tau | p-tau | Dye alleen | |
| 60-100 uM tau | 5 gl | 0 pi | 0 pi |
| 60-100 pM p-tau | 0 pi | 5 gl | 01, l |
| 300 uM héparine | 20 gl | 20 gl | 20 gl |
| 3 mM Thioflavin S | 1.5 ul | 1.5 ul | 1.5 ul |
| Aggregatie buffer | 171,5 pi | 171,5 pi | 176,5 pi |
| 100 mM DTT | 2 pi | 2 pi | 2 pi |
Tabel 3. Samenvoeging mengsel componenten voor met-dye, continue test op een compacte spectrofluorometer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dit protocol toont verschillende testomstandigheden en instrumenten die de fosforylering-afhankelijke snel tau aggregatie kinetiek detecteren. In de terminal assay, wordt de fluorescentie kleurstof ThT toegevoegd aan een deel van het reactiemengsel uit de master mix op elk tijdstip. Amyloid binding geïnduceerde fluorescentie wordt vervolgens gemeten 26. In de tweede, met kleurstof modus tau aggregatie in aanwezigheid van ThT of THS uitgevoerd, zodat dit type reactie geschikt voor real-time automatische beoordeling van de groei van tau aggregaten. Elk van deze methoden heeft zijn voor- en nadelen.
De terminal-mode reactie wordt uitgevoerd met alleen de ingrediënten voor tau aggregatie. Verdunnen en mengen van de reactie met thioflavin T drastisch vertraagt de snelheid van de fluorescentie te verhogen, stopt wezen de reactie voor fluorescentie kwantificering. Deze methode is dus ook compatibel met handmatige bediening. Omdat de keuze reactietijdn is praktisch beëindigd na ThT Bovendien kan een grote hoeveelheid tau vereist voor het plotten van een aggregatie curve. Een ander potentieel nadeel van deze methode is dat veelvuldig toegang tot het reactiemengsel microbiële contaminatie of proteolytische of eiwit oxidatie kan invoeren. In tegenstelling, de met kleurstof modus kan de productie van amyloïde in de aanwezigheid van ThT en THS. De vooruitgang van de aggregatie kan doorlopend worden gecontroleerd, zonder ooit de reactie storen. Deze functie is vooral aantrekkelijk bij de vaststelling van een geautomatiseerde test platform. Echter, kunnen verschillende kleurstoffen specifieke reacties uitlokken. Inderdaad, ThT vertraagt tau en p-tau aggregatie significant, maar THS heeft weinig effect (vergelijk figuren 3 en 5). Er zijn verschillende andere fluorescentie kleurstoffen, zoals Congo rood en thiazinen, die zijn gebruikt in histologische en celbiologische voor PHF vorming. Tenminste één verslag waren sommige van deze kleurstoffen tau aggregatie in weefsel kan veroorzakencultuur cellen 45. Daarom is bij het kiezen van deze verbindingen voor amyloïdogenese kinetiek studies, voorzichtigheid dienen te worden geoefend en dat verschillende kleurstoffen kunnen moeten worden vergeleken.
Wat de keuze van het instrument, de één monster fluorometer gebruikt voor de eerste benadering is zeer betrouwbaar, maar de werking kan omslachtig wanneer meer dan een paar reacties te vergelijken. Het gebruik van meerdere cuvetten kunnen helpen kruisbesmetting tussen de reacties te vermijden, hoewel de kosten van deze kwetsbare kwartscuvetten onbetaalbaar voor sommige kunnen zijn. Omgekeerd kan de multi-well microplaat reader meerdere reacties tegelijkertijd onderzocht. Het gebruik van wegwerp 96-well platen is voordelig ook. Een verwarmingselement, een microplaat lezer een speciaal apparaat voor het bewaken van meerdere reacties bij 37 ° C gedurende langere tijd. Het is echter mogelijk verdamping een zorg zijn. DiNitto et al. Overlay een soortgelijke reactie met minerale olie te voorkomenverdamping 46.
Enkele voorzorgsmaatregelen moeten worden genomen voor de bovenstaande protocollen om consistente en kwantitatieve resultaten te garanderen. Allereerst tau en p-tau spontaan amyloïde aggregaten tijd, vooral wanneer een hoge concentratie. Het is dus noodzakelijk om de hoeveelheden van eiwit preps bevriezen en ontdooien alleen het benodigde volume voor de experimenten. Toch kunnen sommige aggregaten, waaronder granulaire tussenproducten detecteerbaar met ThT 47 zijn gevormd tijdens de bereiding van recombinante eiwitten. Een aanzienlijke initiële fluorescentie lezing van een typische aggregatie reactie daarom vaststaan. Niettemin toevoegen van een pre-spinstap en overdracht van de supernatant aan een aparte buis, zelfs zonder zichtbare eiwitpellet, kan verminderen, en constant hoge initiële fluorescentie van dezelfde partij tau en p-tau prep. Ten tweede, de werkvoorraadoplossing van ThT (dwz 60 uM) is stabiel bij kamertemperatuur gedurende minder dan een week voor the fluorescentie vermindert. Het wordt dus aangeraden om opnieuw te maken van de 60 uM ThT om de paar dagen.
Een belangrijke reden onderliggende studies van p-tau aggregatie is de ontwikkeling van nieuwe AD diagnostica en therapeutica. Verbindingen die recombinant tau aggregatie remmen of terug zijn geïdentificeerd uit high-throughput-schermen en gerichte testen 18,40,41,48. De werkzaamheid van deze verbindingen voor p-tau aggregatie nog worden opgehelderd. Deze schermen werden uitgevoerd in de terminal modus uitgevoerd door het afgeven van een gemeenschappelijke aggregatie mix zonder de kleurstof aan individuele multiplate putten met verschillende verbindingen. Typisch na O / N incubatie, ThT of THS wordt toegevoegd fluorescentiemeting, waaruit de remmende kracht van vele verbindingen. De met kleurstof benadering boven en Rankin et al vermeld. 49 nog een grote verwerkingscapaciteit schermen worden opgenomen. Nu met hypergefosforyleerde tau beschikbaar voor kinetische en farmaceutische studies van gepaardespiraalvorm filament, Alzheimer drug discovery waarschijnlijk verdergaan.
Tenslotte zij opgemerkt dat de studie van p-tau aggregatie is van cruciaal belang niet alleen tauopathieën, maar factoren ook een nog bredere populatie. Bijvoorbeeld, er zijn berichten dat de tangles zijn detecteerbaar bij sommige patiënten van chronische traumatische encefalopathie, zoals professionele American football spelers en boksers 50-52. Soortgelijke correlatie eveneens gerapporteerd enkele of herhaalde traumatisch hersenletsel patiënten waaronder soldaten 53. Protocollen in dit werk beschreven kan dus helpen bij de ontdekking en ontwikkeling van nieuwe therapieën gericht p-tau aggregaten in neuronale cellen.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



