Summary
Unmodifizierten und hyperphosphoryliertem Tau-Proteine wurden in zwei In-vitro-Aggregationstests verwendet, um die Hyperphosphorylierung abhängige schnell Aggregationskinetik offenbaren. Diese Assays ebnen den Weg für weitere Bildschirme für Verbindungen, die die Neigung von hyperphosphoryliertem Tau modulieren kann zur Bildung von Fibrillen, die das Fortschreiten der Alzheimer-Krankheit zugrunde bilden.
Introduction
Alzheimer-Krankheit (AD) ist eine von einer großen Sammlung von neurodegenerativen Erkrankungen wie Tauopathien bekannt. Die Quintessenz der zugrunde liegenden Pathologie Tauopathie um die Neurofibrillen, NFTs, in Neuronen, Astrozyten und Mikroglia 1-4. Die NFT Dichte korreliert mit kognitiver Beeinträchtigung 3,5 und Verlust von Nervenzellen 6. NFT enthält in erster Linie hyperphosphoryliertem Tau-Protein (im Folgenden als "p-tau" fortan genannt), die direkt oder gepaarten helikalen Filamenten (PHF) 7,8 bildet. Tau ist ein Mikrotubuli-assoziierten Protein vermutlich axonalen Transport, die für neuronale Signalübertragung und den Handel 9,10 ist zu erleichtern. Jedes tau Molekül 2-3 Phosphate im normalen Gehirn, sondern die Phosphoryl-Gehalt steigt um mehrere Falten in Tauopathie Patienten 11. Mehrere Kinasen sind wahrscheinlich zu Tau-Hyperphosphorylierung beitragen einschließlich GSK3 & bgr; (Glykogensynthasekinase 3β) und CDK5 (cyclin-dehängig Kinase 5) 12,13, aber der direkte Auslöser für die pathologischen Phosphorylierung weiter Ferne 14. Abnormalen Phosphorylierung in oder in der Nähe der Mikrotubulus-Bindungsmotive distanziert tau vom Filament 15, und bewirkt tau Fehllokalisierung zu der somatodendritischen Faches, p-tau oligomerisiert in gerader oder gepaarte helikale Filamente, die schließlich in NFT Einschlüsse polymerisieren kann. Die enge Verbindung zwischen Tau-Hyperphosphorylierung, NFT-Bildung und Neurodegeneration zu einer vorherrschenden Annahme, dass p-tau Tangles hervorrufen apoptotischen und andere zytotoxische Reaktionen, und damit ist die zugrunde liegende Ursache für Tauopathie Neurodegeneration 16,17. Drogen-Bildschirme und frühen klinischen Tests, die auf dieser Prämisse wurden eingeleitet 18. , Gibt es bei diesem Hypothese Herausforderungen 19,20. Zum Beispiel Santacruz et al. Zeigten, dass die kognitiven Funktionen von transgenen Mäusen kann durch Unterdrücken der Expression eines mutierten verbessernhumanem tau, obwohl NFTs weiterhin von bestehenden tau Moleküle 21 bilden. In einem Drosophila Modell NFT wurde gezeigt, dass die toxische zytosolische Tau-Sequestrierung, die zugrunde liegenden Nervenzellen 22,23 schützen. Offensichtlich ist die Pathogenese Rolle NFT, falls vorhanden, stark beeinflussen die Richtung Tauopathie Therapeutika Entwicklung.
In hohen Konzentrationen rekombinanten oder normale Gehirn tau Protein spontan, sondern langsam polymerisiert in ein PHF-ähnliche Struktur in vitro, wie durch die Bindung mehrerer β-Faltblatt bevorzugt Fluoreszenzfarbstoffe, elektronenmikroskopischen und Lichtstreuungsspektroskopie 24-27 angegeben. Hinzufügen von Heparin oder Arachidonsäure, eine reichliche Fettsäuren im menschlichen Gehirn, drastisch beschleunigt PHF-Bildung in tau isoform- und Induktor konzentrationsabhängigen Weise 28-32. Interessanterweise hyperphosphoryliertem tau gereinigt von AD-Gehirnen oder vollständig in vitro Phosphorylierungsreaktionen a vorbereitetggregates schneller und effizienter 26,33-35. Diese Ergebnisse sind in hervorragender Übereinstimmung mit der pathologischen Rolle von p-tau. Ein in vitro-System auf der Grundlage der Aggregation von p-tau kann somit als ein leistungsfähiges Werkzeug für AD Wirkstoff-Screening dienen.
Angesichts der engen Verbindung zwischen Tau-Aggregation und die fortschreitende Neurodegeneration von AD, sowie die letzten Fehler in der Medikamentenentwicklung zur Förderung der Aß-Plaques eine andere Taste histologische Marker der AD 36-38, das Interesse an der Entdeckung Drogen, die steuern, Tau-Aggregation steigt. In der Tat, einige Gruppen haben bereits Drogen-Bildschirme mit unterschiedlichen Durch begonnen, mit In-vitro-Tau-Aggregation Reaktionen als primäre Assay. Eine Reihe von Chemikalien wurden als hemmend oder Umkehrung Aktivitäten auf Tau-Aggregation in vitro 39-42 aufweisen. Allerdings werden alle aktuellen Tau-Aggregation Regler Bildschirme verwenden unmodifizierten tau, die den Schlüssel pathologischen Kennzeichen Phosphor vermisstlierung und hob eine Sorge um die Spezifität und Wirksamkeit der Verwendung dieser Verbindungen bei AD-Behandlung.
Eines der Haupthindernisse für die Entwicklung Aggregationsassays zur biochemischen Charakterisierung und AD Wirkstoff-Screening ist die Herstellung von ausreichenden Mengen des pathophysiologisch relevanten hyperphosphoryliertem Tau-Protein. Verwendung des Zippers Assisted Catalysis System, in dem die 1N4R Isoform von tau und der GSK-3β-Kinase in E. coexprimiert coli als Leucin-Zipper-Fusionsproteine, haben wir diese Herausforderung zu meistern (. Sui et al, eingereicht; siehe Abbildung 1 für die Endprodukte von Tau und p-tau; siehe auch 43 Vorab Massenspektrometrie Charakterisierung von p-tau). Aus einem Panel von für unterschiedliche Phosphorylierungsstellen von Tau neun Antikörper wurden positive Signale in acht Positionen gesehen (Daten nicht gezeigt). Im Folgenden beschreiben wir, Protokolle und Besetzungen, die die Aggregation kinetische d unterscheiden kannifferences zwischen unmodifizierten tau und p-tau-Arten. Diese Assays wurden aus veröffentlichten Protokollen, die den Anstieg der Fluoreszenz von Thioflavin T (ThT) oder Thioflavin S (ThS) auf Amyloid (tau Aggregate) Bindung 26 gemessen modifiziert. In der ersten "Endgerät", keine Farbstoffansatz Aggregationsreaktionen werden zusammengebaut und in der Abwesenheit des Amyloid-Farbstoff inkubiert. Zu verschiedenen Zeitpunkten wird ein Aliquot jeder Reaktion entnommen und mit einem gleichen Volumen des ThT-haltigen Puffer gemischt, um eine Aggregation schalten und THT tau Aggregate binden. Fluoreszenz wird von einem IAP FluoroMax-2-Fluorometer gemessen. In der zweiten "mit Farbstoff" kontinuierliche Überwachung Assay ThT oder ThS in den Aggregationsreaktionen enthalten. Fluoreszenz kann kontinuierlich während des gesamten Experiments manuell oder unter Verwendung eines Mehrplatten-Lesegeräts gemessen werden. Darüber hinaus beschreiben wir einen Test, der eine nahezu physiologische Konzentration von Tau und p-tau für die Aggregation in der kontinuierlichen Messung mo verwendetde. Die Wirkung der Phosphorylierung bleibt leicht nachweisbar. Im Folgenden werden wir Schritt-für-Schritt-Betrieb wird beschrieben, und zeigen repräsentative Ergebnisse dieser Tests. Diskussion über einige der Vor-und Nachteile der einzelnen Ansätze sowie potenzielle Wirkstoff-Screening-Anwendungen werden folgen.
In einer hohen Konzentration, aggregiert tau amyloidartigen Strukturen spontan. Jedoch im Labor tau Fibrillenbildung wird typischerweise durch solche Induktoren wie Heparin (mittleres Molekulargewicht 6000 g / mol) und Arachidonsäure beschleunigt. Beispiele hier gezeigten sind 30 uM Heparin. Die Bildung von Tau Amyloidaggregaten durch die Fluoreszenz von Amyloid-Bindung durch Thioflavin T (ThT) oder Thioflavin S (ThS) resultierenden überwacht. Nach Bindung an Tau-Aggregaten weist ThT eine Rotverschiebung der Fluoreszenz (Anregung: 450 nm; Spitzenemission: 485 nm). ThS andererseits eine schwache Emission bei 510 nm (Anregung bei 450 nm) vor Amyloid-Bindung, aber dies fluorescence steigt signifikant in Gegenwart eines Amyloid Protein wie das aggregierte tau 44. Beide Farbstoffe funktionieren gut bei der Aufdeckung von Tau und p-Tau-Aggregation. Aufgrund des starken und relativ breite Emissionsspitze von ThT (siehe Abbildung 2), gibt es nur 30% ige Reduktion der Fluoreszenz-Einheit bei 510 nm. Der Bequemlichkeit halber verwenden wir die gleiche Kombination von Anregungs- / Emissionswellenlängen (das heißt, 450 nm / 510 nm), um Tau-Aggregation zu überwachen, wenn entweder Farbstoff.
Tau-Aggregation kann in Gegenwart oder Abwesenheit des Farbstoffs durchgeführt werden, abhängig von dem Zweck des Tests und Verfügbarkeit der Tau-Protein. Beide Arten der Reaktionen sind unten dargestellt. Darüber hinaus zeigen wir, den Betrieb von zwei verschiedenen Instrumenten - eine Einzelprobe Fluorometer (ISA-SPEX FluoroMax-2) und eine Multi-Plattenlesegerät (SpectraMax M2). Die Leser sollten in der Lage, diese Protokolle anzupassen, um ihre spezifischen Bedürfnisse und Verfügbarkeit Instrument zu entsprechen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Vorbereitung der Reagenzien
- Bereiten Aggregationspuffer (20 mM Tris, pH 7,4, 100 mM NaCl, 1 mM EDTA). Lagern Sie bei RT, über Monate stabil. Supplement 1 mM Dithiothreitol (DTT) vor dem Gebrauch.
HINWEIS: a HEPES-basierten Puffer (10 mM HEPES, pH 7,5, 0,1 mM EDTA, 5 mM DTT) erzeugt auch ähnliche Ergebnisse in Tau-Aggregation. - Bereiten Thioflavin T oder Thioflavin S-Stammlösung (3 mM, in Aggregationspuffer) und Filter von 0,22 um sterile Filtereinheit. Bei -20 ° C in einem Röhrchen mit Aluminiumfolie abgedeckt, über Monate stabil.
- Bereiten Heparin-Stammlösung (300 & mgr; M in Aggregationspuffer). Lagerung bei -20 ° C, für Monate stabil.
- Bereiten Dithiothreitol (DTT) Lager (1 M, gelöst in Wasser). Aliquot in 1,5-ml-Röhrchen. Lagerung bei -20 ° C. Vor Aggregationstests, tauen die 1M Lösung bei RT. Von diesem 1,000x Lager, bereiten eine aliquote Menge von 100 mM Arbeits Lager mit VE-Wasser. Lassen Sie auf dem Eisbis bereit.
- Entfernen tau von -80 ° C Tiefkühltruhe. Tauwetter auf Eis. Passen tau zu vorbestimmten Konzentration mit der Aggregationspuffer. In einer Mikrozentrifuge bei 20.800 × g für 10 min bei 4 ° C auf vorgeformte große Aggregate zu entfernen. Diese Pre-Spinnschritt erhöht die Konsistenz in der anschließenden Fluoreszenz-Messung von jeder Charge des Proteins prep. Den Überstand in ein anderes Röhrchen; lassen auf Eis, bis bereit, die Aggregationsreaktion zu montieren.
2. No-Farbstoff, Terminal Assay
HINWEIS: Der Aggregationsreaktion dieses Assays wird in Abwesenheit des fluoreszierenden Farbstoffs erfolgt. Nach dem Vermischen aller Komponenten wird das Reaktionsgemisch auf vorbestimmten Zeitpunkten fort. Aliquote werden dann aus der Aggregationsreaktion aufgenommen und mit ThT oder ThS für Amyloid Bindung vor Fluoreszenzmess gemischt. Das Anfangsvolumen der Aggregationsreaktion hängt von der Anzahl von Zeitpunkten benötigt. Dieser Ansatz kann require eine große Menge von Tau-Protein, aber schnell, einfach, und kann in einem Fluorometer oder einem Multiwell-Plattenleser (siehe Diskussion) erfolgen. Unten ist die Schritt-für-Schritt-Betrieb mit Hilfe der ISA SPEX FluoroMax-2 Kompakt Spektrofluorometer für Fluoreszenz Quantifizierung.
- Einrichten des Aggregatmischung in 1,5 ml-Eppendorf-Röhrchen, wie in Tabelle 1. Jede Säule repräsentiert die Zutaten für einen 100 & mgr; l-Reaktion, die für einen Zeitpunktmessung ausreichend ist notwendig. Stellen Sie die Anzahl für das Aggregations Mischung auf der Basis der Zeitpunkte für das jeweilige Experiment benötigt. Fügen Sie zusätzliche 10% der einzelnen Komponenten, um Platz für das Pipettieren Fehler geben. Die hier gezeigte typische Reaktion, die Heparin kann durch Arachidonsäure oder Aggregationspuffer ersetzt werden. Hinzufügen DTT 1 mM zu dem Reaktionsgemisch. Wenn die gesamte Reaktion dauert mehr als einen Tag, ergänzen frischem DTT Alltags (1 mM), um eine reduzierende Umgebung zu gewährleisten.
- Das Röhrchen ein paar Mal, um zu mischen. Place jede Reaktion in einem 37 ° C Brutschrank oder Wasserbad. Das Rühren wird für Tau-Aggregation notwendig.
- Vor der Messung der Fluoreszenz, schalten Sie den Spektrofluorometer (Lampe, dann Computer).
HINWEIS: Die Xenon-Bogenlampe, die sofort verwendet werden kann. Für die besten Ergebnisse lassen jedoch die Maschine zum Aufwärmen für etwa 10 Minuten vor dem Lesen Fluoreszenz. - Starten der Software auf dem Computer.
- Wählen Sie Echtzeit-Anzeige-Modus im Instrument Control Center eingestellt Anregungswellenlänge von 450 nm (Schlitz bis 2 nm) und Emissionswellenlänge auf 510 nm (Spalt bis 5 nm). Schließen Echtzeit Anzeigemodus-Fenster, um das Instrument Control Center zurückzukehren.
- Wählen Constant Wellenlänge Analyse, drücken Sie auf Hinzufügen >> Taste im oberen Rahmen auf Wellenlängen-Sets hinzuzufügen. Stellen Erfassungsparameter der Standardfehler um 1 und Maximum Trials bis 3, dann auf Hinzufügen. Klicken Sie auf Los! Um die Datenanzeige zu öffnenFenster.
- Im Datenanzeigefenster, klicken Sie auf Start, um das Dialog Acq Musterkiste Neu öffnen. Wählen Sie "unbekannt" für die Probentyp.
- Zu jeder 100 ul Aggregation Mischung, fügen Sie 98 ul Aggregationspuffer und 2 ul 3 mM Thioflavin T. Pipettieren mehrmals, um zu mischen.
- Übertragen Sie die gesamte Mischung in eine Küvette (FCA3, Außenabmessung, BxLxH = 12,5 mm x 12,5 mm x 45 mm). Setzen Sie die Küvette in den Probenhalter in den Probenraum und den Deckel schließen. Klicken Sie auf Ausführen, um die Fluoreszenz-Daten zu sammeln. Notieren Sie die Daten.
- Entfernen Sie die Küvette und dekantiert die Lösung. Spülen Sie die Küvette mit destilliertem Wasser 3-mal. Trocken durch Einblasen von Luft in und außerhalb der Küvette.
3.-Farbstoff, kontinuierliche Modus Probe mit SpectraMax M2 Plate Reader
Hinweis: Dieses Assay unterscheidet sich von der vorhergehenden dadurch, dass der fluoreszierende Farbstoff ThT oder ThS im aggrega enthaltention Reaktion. Dies ermöglicht eine kontinuierliche Messung der gleiche Satz von Reaktionen. Aufgrund der wiederholten Verwendung der Reaktion ist dieses Verfahren besser mit einem automatischen Multiwell Plattenlesegerät durchgeführt (wie nachfolgend den Betrieb SpectraMax M2 gezeigt). Eine regelmäßige Fluorometer funktioniert auch, aber die Häufigkeit der Messung des schnellen Aggregationsreaktionen etwas begrenzt ist, aufgrund der manuellen Natur des Vorgangs.
- Richten Sie die Aggregation Mischung in einer 96-Well-Platte (96-Loch-schwarzen Festplatte, gut Volumen 360 ul, flacher Boden), wie in Tabelle 2. Jede Spalte steht die Zutaten für eine 200 ul-Reaktion, die für eine ausreichend ist erforderlich Zeit-Punkt-Messung. Gut mischen durch Pipettieren mehrmals. Ergänzen frischer 1 mM DTT jeden Tag im Verlauf der Experimente.
- Inkubiere die Platte mit 96 Vertiefungen bei 37 ° C.
- Zu jedem Zeitpunkt vor der Fluoreszenzmessung, schalten Sie den Multimode-Mikroplatten-Reader und den Computer ein. Lassen Sie ausreichend Zeit für die maschine zu stabilisieren, ca. 10 min.
- Starten der Software auf dem Computer. Temperatur auf 37 ° C und wählen Fluoreszenzintensität (FI-Top Read) Modus eingestellt Anregungswellenlänge bei 450 nm und Emissionswellenlänge bei 510 nm.
- Legen Sie die Platte mit 96 Vertiefungen in die Schublade und drücken Sie die READ-Taste, um die Messung zu starten.
- Nach der Lektüre, entfernen Sie die Platte aus und senden es zurück zu der 37 ° C-Inkubator. Kopieren Sie die Daten und fügen Sie ihn in eine Excel-Tabelle für die Datenanalyse und Plotten.
4.-Farbstoff, kontinuierliche Modus Assay auf einer Compact Spectrofluorometer
- Richten Sie die Aggregation Mischung in 1,5 ml Eppendorf-Röhrchen wie in Tabelle 3. Jede Spalte steht die Zutaten für eine 200 ul-Reaktion, die für eine Zeit-Punkt-Messung genug ist notwendig.
- Das Röhrchen ein paar Mal, um zu mischen.
- Schalten Sie die Spektrofluorometer und stellen Sie die Software wie in den Schritten 2.3 und 2.4.
- Übertragen Sie die gesamte Mischung toa Küvetten. Setzen Sie die Küvette in den Probenhalter in den Probenraum und den Deckel schließen. Klicken Sie auf Ausführen, um die Fluoreszenz-Daten zu sammeln. Notieren Sie die Daten.
- Lesen in angemessenen Abständen, indem Sie auf Ausführen und Aufzeichnen der Daten auf Weiter. Wenn die Aggregation bei einer hohen Frequenz (beispielsweise alle 30 oder 60 Sekunden) überwacht werden soll, lassen die Reaktion in der Küvette und in der Maschine, bis entweder die Messung beendet ist, oder, wenn genügend Zeit vorhanden ist, um Reaktionen oder Küvetten vertauschen.
- Entfernen Sie die Küvette und dekantiert die Lösung. Spülen Sie die Küvette mit destilliertem Wasser 3-mal. Trocken durch Einblasen von Luft in und außerhalb der Küvette.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Unter Verwendung rekombinanter tau und p-tau (Abbildung 1), haben wir zwei verschiedene Protokolle, die Kinetik der Aggregation von Tau und p-tau zu vergleichen, unter Ausnutzung der starken Fluoreszenzemission ThT THS bei Bindung an amyloide Protein-Aggregate, einschließlich tau und p-tau (Abbildung 2). Mit oder ohne dem Fluoreszenzfarbstoff in der Aggregationsreaktion beobachteten wir konsequente Weiterentwicklung der Tau-Aggregation durch Hyperphosphorylierung (Figuren 3-5). Diese Stimulierung ist unabhängig von Heparin (Daten nicht gezeigt). In einer typischen Reaktion tau und p-tau oligomerisieren schnelle Raten innerhalb der ersten 30 min vor wesentliche Abschwächung (3 und 5), mit p-tau, die höhere Fluoreszenzeinheiten im gesamten Verlauf des Experiments. Einschließlich ThT in der Aggregationsreaktionen verursacht signifikante Verzögerung in der Rate der Aggregation (Figur 4). Beide Isoformen näherte plateau 160 Stunden nach der Reaktion begonnen hatte. ThS andererseits verursacht keine nennenswerte Abschwächung der Aggregation (Figur 5).

Abbildung 1. Gereinigtes tau und hyperphosphoryliertem tau (p-tau) in dieser Studie. Die Proben wurden durch ein 10% SDS-PAGE-Gel aufgetrennt und durch Coomassie-Blau R250 (l) gefärbt oder sondiert durch einen anti-tau-Antikörper (rechts verwendet Panel). Lane M, Molekulargewichtsmarker; Bahnen 1 und 3, nicht phosphorylierten tau; lane2 und 4 hyperphosphoryliertem tau.

Abbildung 2: Emissionsspektren für ThT (30 uM) mit oder ohne Bindung Tau-Aggregaten. Emissions Akquisition war s , Anregung bei 450 nm, von 460 nm bis 600 nm (0,1 s Integration, 5 nm Spaltbreite von 1 nm Schrittweite) in Dosen. Tau-Aggregate wurden, indem 50 & mgr; Tau-Aggregation bei 37 ° CO / N (siehe Protokoll 2 für Details) gehen erhalten.
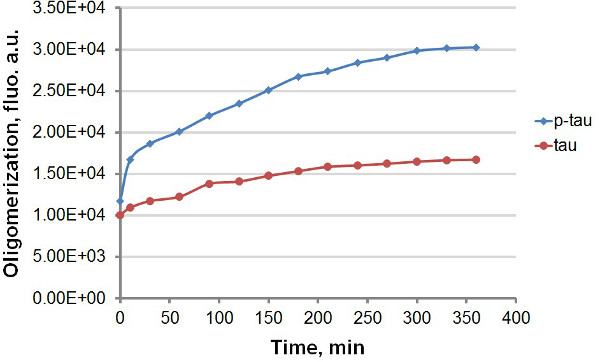
Abbildung 3. Aggregation Kurven für Tau und p-tau in Terminal-Test. Die Aggregation von 50 uM tau und p-tau wurde mit 30 & mgr; M Heparin als Induktor abgeschlossen. Zu verschiedenen Zeiten nach dem Beginn der Reaktion wurden 100 & mgr; l der Reaktion entfernt und mit dem gleichen Volumen von 60 & mgr; M ThT vor der Fluoreszenzmessung gemischt. Die Fluoreszenz wurde bei 450 nm Anregung, 510 nm Emission gemessen. "Au", willkürlichen Einheiten. Beachten Sie, dass die Zeitskala ist in wenigen Minuten.
"4" src = "/ files / ftp_upload / 51.537 / 51537fig4highres.jpg" />
Abbildung 4. Aggregation Kurven allein ThT, Tau und p-tau in dem kontinuierlichen Messungsmodus in Gegenwart von ThT. Jede Reaktion bestand aus 0 oder 50 uM tau oder p-tau, 30 & mgr; M Heparin und 30 uM ThT in Aggregationspuffer . Die Reaktionen wurden bei 37 ° C in einer Platte mit 96 Vertiefungen inkubiert. Zu verschiedenen Zeitpunkten wurde die Platte aus dem Inkubator entfernt und mit dem Plattenlesegerät für Fluoreszenzlese (Anregung 450 nm, Emission 510 nm) geladen. Zwischen den Ablesungen wurde die Platte in den Inkubator ohne Rühren unter einer Abdeckung gehalten wird. Die Anwesenheit von ThT deutlich verlangsamt Aggregation, aber, wichtiger, die hyperphosphoryliertem Tau noch zeigten eine Beschleunigung der Aggregation, als ihre unmodifizierten Gegenstück. Man beachte, dass der Umfang der Zeit in Stunden.
pload / 51.537 / 51537fig5highres.jpg "/>
Abbildung 5. Kleines tau Aggregationsassays in Gegenwart ThS. In vitro Heparin-induzierte Aggregation von 6 uM tau und p-tau wurde in den kontinuierlichen Messungsmodus beurteilt mit Thioflavin S als Indikatorfarbstoff. Zusätzlich zu dem Protein, wobei jede Reaktion enthielt 30 & mgr; M Heparin und 20 uM ThS im HEPES Aggregationspuffer (10 mM HEPES pH 7,5, 5 mM DTT, 0,1 mM EDTA). Alle Bestandteile mit Ausnahme von Heparin wurden gemischt und bei RT äquilibriert. Nach der Zugabe von Heparin, wurde die Reaktion auf die Küvette überführt und im Probenhalter platziert. Fluoreszenz wurde sofort als T 0 aufgezeichnet und wird für etwa 2 Stunden oder bis die Fluoreszenzzunahme verlangsamt auf nahe Null. Aufgrund der relativ kurzen Reaktionszeit, die gesamte Reaktion wurde bei RT in der gleichen Küvette durchgeführt.
| tau | p-tau | |
| 60-100 uM tau | 50 & mgr; | 0 & mgr; |
| 60 bis 100 & mgr; p-tau | 0 & mgr; | 50 & mgr; |
| 300 & mgr; M Heparin | 10 & mgr; | 10 & mgr; |
| Aggregationspuffer | 39 & mgr; | 39 & mgr; |
| 100 mM DTT | 1 & mgr; | 1 & mgr; |
Tabelle 1 Aggregation Mischungskomponenten für no-Farbstoff, Terminal-Assay.
| tau | p-tau | Farbstoff allein | |
| 60-100 uM tau | 50 & mgr; | 0 & mgr; | 0 & mgr; |
| 60 bis 100 & mgr; p-tau | 0 & mgr; | 50 & mgr; | |
| 300 & mgr; M Heparin | 20 & mgr; | 20 & mgr; | 20 & mgr; |
| 3 mM Thioflavin T | 2 & mgr; | 2 & mgr; | 2 & mgr; |
| Aggregation Puffer | 126 & mgr; | 126 & mgr; | 176 & mgr; |
| 100 mM DTT | 2 & mgr; | 2 & mgr; | 2 & mgr; |
Tabelle 2. Aggregation Mischungskomponenten für die mit Farbstoff, kontinuierlichen Assay auf einem Plattenlesegerät.
| tau | p-tau | Farbstoff allein | |
| 60-100 uM tau | 5 & mgr; | 0 & mgr; | 0 & mgr; |
| 60 bis 100 & mgr; p-tau | 0 & mgr; | 5 & mgr; | 01; l |
| 300 & mgr; M Heparin | 20 & mgr; | 20 & mgr; | 20 & mgr; |
| 3 mM Thioflavin S | 1,5 ul | 1,5 ul | 1,5 ul |
| Aggregation Puffer | 171,5 ul | 171,5 ul | 176,5 ul |
| 100 mM DTT | 2 & mgr; | 2 & mgr; | 2 & mgr; |
Tabelle 3. Aggregation Mischungskomponenten für die mit Farbstoff, kontinuierlichen Assay auf einem kompakten Spektrofluorometer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dieses Protokoll zeigt unterschiedliche Assaybedingungen und Instrumente, die phosphorylierungsabhängige schnell tau Aggregationskinetik erkennen. Im Terminal Assay wird der Fluoreszenzfarbstoff ThT zu einem Teil der Reaktionsmischung aus dem Master zu jedem Zeitpunkt entfernt, hinzugefügt. Amyloid-bindende-induzierte Fluoreszenz wird gemessen 26. In der zweiten, mit Farbstoff Modus Tau-Aggregation in Gegenwart von ThT oder ThS geführt, wodurch diese Art von Reaktion geeignet für automatischen Echtzeit-Beurteilung des Wachstums von Tau-Aggregaten. Jede dieser Methoden hat ihre Vor- und Nachteile.
Der Terminal-Mode Reaktion nur mit den Zutaten für die Tau-Aggregation erforderlich durchgeführt. Verdünnen und Mischen der Reaktion mit Thioflavin T drastisch verlangsamt die Rate der Fluoreszenzerhöhung, im wesentlichen stoppt die Reaktion zur Fluoreszenzquantifizierung. So ist auch diese Methode mit manueller Bedienung kompatibel. Da jedoch der reaction ist praktisch auf ThT Zugabe beendet ist, kann eine große Menge von Tau zum Plotten einer Aggregationskurve erforderlich. Eine weitere potenzielle Einschränkung für dieses Verfahren ist, dass häufig Zugang zu der Reaktionsmischung kann mikrobiellen oder proteolytische Verunreinigung oder Proteinoxidation einzuführen. Im Gegensatz dazu ermöglicht die mit Farbstoff-Modus die Erzeugung von Amyloid in Gegenwart von ThT oder ThS. Die Weiterentwicklung der Aggregation kann kontinuierlich, ohne jemals die Reaktion stören überwacht werden. Diese Funktion ist besonders attraktiv, wenn über ein automatisiertes Testplattform. Jedoch können verschiedene Farbstoffe spezifische Antworten hervorrufen. Tatsächlich verlangsamt ThT tau und p-Tau-Aggregation deutlich, aber ThS hat wenig Wirkung (vergleiche Figuren 3 und 5). Es gibt mehrere andere Fluoreszenzfarbstoffe, einschließlich Kongorot und Thiazine, die in histologischen und Zellbiologie Untersuchungen für PHF-Bildung eingesetzt wurden. Mindestens ein Bericht festgestellt, dass einige dieser Farbstoffe können Tau-Aggregation in Gewebe zu induzierenKulturzellen 45. Bei der Wahl dieser Verbindungen zur Amyloidogenese Kinetik Untersuchungen muss Vorsicht ausgeübt werden, und dass verschiedene Farbstoffe können verglichen werden müssen.
In Bezug auf die Auswahl des Instruments ist die Single-Probe Fluorometer in dem ersten Ansatz verwendet sehr zuverlässig, aber der Vorgang kann mühsam sein, wenn mehr als ein paar Reaktionen verglichen werden sollen. Die Verwendung mehrerer Küvetten hilft Kreuzkontamination zwischen Reaktionen zu vermeiden, obwohl die Kosten dieser zerbrechlichen Quarzküvetten prohibitiv zu einigen. Umgekehrt kann die Multi-Well-Mikrotiterplatten-Lesegerät mehrere Reaktionen gleichzeitig zu untersuchen. Die Verwendung von Einweg-96-Well-Platten ist von Vorteil, als auch. Mit einem Heizelement kann ein Mikroplattenleser eine dedizierte Vorrichtung zum Überwachen mehrerer Reaktionen bei 37 ° C für eine längere Zeitdauer sein. Allerdings könnte Verdunstung ein Anliegen sein. DiNitto et al. Überlagert eine ähnliche Reaktion mit Mineralöl zu verhindernEindampfen 46.
Einige Hinweise sind für die oben genannten Protokolle ergriffen werden, um konsistente und quantitative Ergebnisse zu gewährleisten. Erstens tau und p-tau spontan Amyloidaggregaten über die Zeit, insbesondere wenn es in einer hohen Konzentration. Es ist daher zwingend notwendig, um alle Teilmengen von Protein preps einfrieren und auftauen nur das benötigte Volumen vor den Experimenten. Dennoch können einige Aggregate einschließlich der körnigen Zwischenprodukte durch ThT 47 nachweisbar bei der Herstellung von rekombinanten Proteinen gebildet haben. Ein erheblicher Anfangsfluoreszenz Lesen eines typischen Aggregationsreaktion ist somit gemeinsam. Dennoch Zugabe einer vorgeSpinnSchritt und zum Übertragen der Überstand in ein getrenntes Röhrchen, auch ohne eine sichtbare Proteinpellet, reduzieren kann, und eine konsistente, Anfangsfluoreszenz der gleichen Charge von Tau und p-tau prep. Zweitens ist der Arbeitsstammlösung von ThT (dh 60 uM) ist stabil bei Raumtemperatur für weniger als eine Woche vor the Fluoreszenz abnimmt. Es wird daher empfohlen, neu machen das 60 uM ThT alle paar Tage.
Ein prominentes zugrunde liegenden Grund Studien von p-Tau-Aggregation ist die Entwicklung neuartiger AD Diagnostika und Therapeutika. Verbindungen, hemmen oder zurück rekombinanten Tau-Aggregation wurden von Hochdurchsatz und gezielte Tests 18,40,41,48 identifiziert. Die Wirksamkeit dieser Verbindungen zur p-Tau-Aggregation noch aufgeklärt werden. Diese Bildschirme wurden in der Terminal-Modus durch Abgeben eines gemeinsamen Aggregatmischung ohne den Farbstoff zu einzelnen Lamellen Vertiefungen mit unterschiedlicher Verbindungen durchgeführt wird. In der Regel nach O / N Inkubation wird ThT oder ThS für Fluoreszenzmessung aufgenommen und enthüllt die hemmende Kraft der vielen Verbindungen. Die mit Farbstoff-Ansatz vor und nach Rankin et al erwähnt. 49 ist noch nicht auf Hochdurchsatz integriert werden. Jetzt mit hyperphosphoryliertem tau für kinetische und pharmazeutischen Studien der gekoppelten verfügbarSpiralfaser Aufstellung ist die Alzheimer-Krankheit Drug Discovery wahrscheinlich weiter voranzutreiben.
Schließlich ist es erwähnenswert, dass das Studium der p-Tau-Aggregation ist von entscheidender Bedeutung, nicht nur Tauopathien, sondern kann auch Auswirkungen auf eine noch breitere Bevölkerung. Zum Beispiel gibt es Berichte, dass die Neurofibrillen sind bei einigen Patienten von chronisch traumatische Enzephalopathie, nachweisbar wie professionelle Spieler des amerikanischen Fußballs und Boxer 50-52. Ähnliche Korrelation wurde auch für einzelne oder wiederholte traumatischen Hirnverletzungen Patienten darunter Soldaten 53 berichtet. In dieser Arbeit beschriebenen Protokolle können so dazu beitragen, die Entdeckung und Entwicklung neuer Therapeutika für p-Tau-Aggregaten in neuronalen Zellen.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



