Introduction
이 길이와 수명이의 질 모두 향상을 제공하는 세계적으로 말기 신부전 환자를위한 혁신적인 치료되었다 이후 신부전의 치료에 성공적으로 신장 이식은 먼저 일란성 쌍생아 일 사이 1955에 기술되었다. 그러나 장기 이식 생존율은 만성 동종 이식 손상 3의 결과 병리학 적 과정의 무리에 의해 방해되었다.
인간에 이식 된 신장의 거부는 immunosupporessive 요법에서 상당한 개선에도 불구하고 사망률의 주요 원인이 남아있다. 신장 이식 마우스 모델을 개발하는 목적은 밀접 인간 신장 이식 4에서 발견 과정과 병리를 복제하는 것이다. Skoskiewicz 외는. 제 1973 5 신장 이식 마우스 모델을 설명했다. 미세 첨단 기술이 요구되고 있지만, 그것은 유용한 t이며여러 가지 이유로 OOL : 마우스 게놈이 잘 특징 및 실험 방법 및 마우스 연구에 사용할 기술의 큰 다양성이있다.
신장 이식 마우스 모델을 이용하여 많은 그룹은 그러나 실험 4의 기간 동안 현장에 남아있는 다른 연구와 수신자 마우스의 기본 신장의 우리의 기술 방법 하나, 생명 유지 장기로 이식 된 신장을 사용했다. 이점은 마우스함으로써 마우스 이환율과 두번째 절차에서 사망의 위험을 감소시키는 하나의 마취 및 동작을 겪는다는 것이다. 또한 마우스가 점진적으로 신장 장애의 부작용으로 고생하지 않습니다.
동종 거부의 모델은 심장과 피부와 같은 다른 장기에 존재하지만, 이들은 항상 신 이식에 직접 관련이 없습니다. 이 모델은 다양한 모드와 DY을 유도한다는 증거가있다거부 namics, 예를 들어 심장 동종 이식 신장 이식 거부 반응에서의 타임 코스는 특정 스트레인 조합 6 크게 다르다. 우리는 비 형질 전환 FVB / NJ 마우스로 BALB / C 기증자에 급성 신장 이식 거부 반응 패턴을 기술 한이 모델은 T 세포와 대 식세포 (7)의 축적과 세포 매개 부상을 보였다. 이 마우스가 하나의 MHC 클래스 II 궤적 잘못을 특징으로 또는 우리는 또한 간질 섬유화와 세뇨관 위축을 나타내는 만성 동종 이식 손상의 모델을 기술 한이, C57BL / 6 수신자로 C57BL에서 / 6 BM12 기증자 신장 이식의 결과 -match 8.
이식의 여러 측면들은 급성 거부 반응, 세포 및 체액 제거율, 허혈 재관류 손상, 및 신규 한 치료제를 포함 trialing에 신장 이식 마우스 모델을 이용하여 연구되었다. 우리는 수술 t을 수정 한echnique는 작동 시간을 감소시키고 수술의 용이성을 향상시킬 수있다. 특히 우리는 동시 기증자와받는 사람의 준비와 연속 대동맥 패치 문합을 이용하여 단순화 된 혈관 문합 기술을 설명했다. 이 영상과 원고는이 기술의 확립에 도움이 핵심 포인트를 제공합니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
해당 국가 및 지역의 기관 윤리는 동물 실험을 수행하기 전에 장소에 있어야합니다. 받는 사람 외과 의사가 2.1 2.8로 수행하면서 특히 영국에서 다음과 같은 실험은 기증자의 의사가 수행해야이 microsurgeons가 동시에 작동 할 수있는 동물 (과학적인 절차) 법 1986에 따라 수행되었으며, 1.1-1.16 다음 3.1-3.5 단계 . 하나의 연산자를 들어 단계가 순서대로 수행 할 수 있습니다.
1 기부자 준비
참고 : 여기에 제시된 절차는 기증자 C57BL / 6 BM12 사람과받는 사람 20g보다 더 큰 체중과 8~16주 된 세 사이의 C57BL / 6 수컷 마우스입니다. 그러나이 과정은 재현성 마우스 균주의 다양한 수행 될 수있다. 대표적인 결과 섹션에 제시된 데이터는 C57BL / 6, C57BL / 6 BM12 및 BALB / c 마우스로부터 얻은 것입니다.
- 행동 절차 날기목적과 g 멸균 수술기구 및 소모품 (오토 클레이브)는, 가능한 한 무균 영역을 유지한다. 이 외과 의사를 사용할 수있는 경우받는 사람의 준비와 동시에 기증자 준비를 수행합니다.
- medetomidine (0.5 ㎎ / ㎏)와 케타민 하이드로 클로라이드 (/ kg 200 mg)을의 복강 내 주사 (31G 바늘)와 마우스를 마취. 전체 절차를 위해 충분한 시간을 제공하여 4 시간 동안 유지 마취 평면에서이 결과를 실시한다. 보충 마취는 필요하지 않습니다.
- 마우스가 (발가락 핀치에 대한 응답)를 마취되지 않는지 확인합니다.
- 마우스의 복부를 면도하고 끈적 끈적한 테이프로 느슨한 머리를 제거합니다.
- 무균 드레이프 온수 매트에 그 뒷면에 마우스를 놓고 느슨하게 멸균 마스킹 테이프로 팔다리를 고정시킨다.
- 열 화상 절차를 통해 마우스를 모니터링합니다. 가능하면 비 전기 열원을 사용합니다.
- 눈 윤활제 및 SA를 적용희석 된 요오드 용액을 복벽 nitize.
- 복강를 입력 3cm 돋움 복부 견인기를 삽입 할 수있는 복부 정중선 절개를합니다.
- 촉촉한 장 및 수술 영역을 유지하고 내장을 불필요하게 건조를 방지하기 따뜻하게 식염수를 적용합니다.
- 무균 드레이프와 마우스를 덮고 대동맥, 대정맥과 왼쪽 신장을 노출 작업자의 왼쪽 (마우스의 오른쪽)에 장내를 이동합니다.
- 위장 높였다 forcep을 적용하고 완전히 주요 혈관과 왼쪽 신장을 노출 빼어냅니다. 거리와 같은 간 엽 (叶), 정낭, 그리고 장과 수술 영역에서 조직을 철회 복부에 멸균 면봉 (2mm X 2mm)를 젖은 포장하십시오.
- 주변 adventia, 지방과 퉁명스럽게 좋은 팁 집게를 사용하여 결합 조직을 해부하여 복강의 왼쪽 부신에서 왼쪽 신장을 분리합니다. 북동 지역 사이의 포셉의 폐쇄 팁을 놓고에드 분리 천천히 forcep 팁 공간을 해부 열 수합니다.
- 결찰 한 후 9 / O 나일론 부신 정맥과 왼쪽 성선 정맥 왼쪽을 분할하여 왼쪽 신장 정맥을 분리합니다. 신장 정맥에 가까운 봉합사를 놓습니다.
- 결찰 및 봉합을 떠나 방광에 가까운 7 / O 실크 봉합사와 요관을 분할 긴 끝납니다. 신장 수확 및 ureteric 문합에 필요한 경우 롱 봉합 끝이 사용됩니다.
- 동원 완전히 신장 동맥에 우량하고 열등한 대동맥과 대정맥을 해부하고 퉁명스럽게 선박의 전면과 측면에서 림프 혈관과 지방을 해부 좋은 팁 집게를 사용하여 정맥.
- 대동맥과 대정맥 천천히 확산 집게 사이의 조직면을 찾아보십시오. 천천히 최소한의 외상 조직을 확산하기 위해 뾰족한 집게의 끝을 엽니 다.
- 각진 벌금을 전달하여 신장 동맥 우수하고 열등 대동맥 주위 느슨한 7 / O 실크 타이팁 포셉 용기의 뒷면 주위 통해 봉합 도면. 이러한 봉합 위스콘신 대학의 솔루션의 역 행성 관류를 허용하도록 신장 검색 이전에 체결됩니다.
2받는 사람 준비
기증자 준비 후속에 따라 1.8에 1.2 단계를 반복합니다.
- 대동맥, 대정맥을 노출 작업자의 오른쪽 (마우스의 왼쪽)에 장내를 이동합니다. 멸균 식염수에 적신 면봉으로 장을 커버.
- 오른쪽 신장 동맥을 결찰하여 우측 신장 절제술을 수행하고 7/0 실크 봉합사와 함께 정맥 다음 나눕니다.
- 7 / O 실크 봉합사와 분열과 오른쪽 요관을 결찰.
- 동원 단계 1.14 및 1.15에 설명 된대로 완전히 신장 동맥과 정맥 열등 대동맥과 대정맥을 해부하다. 대동맥과 대정맥이 완벽하게 해부를 확인합니다. 대정맥과 aort에 전방을 실행하는 내부 고환 동맥을 유지하기 위해주의림프 번들과 함께.
- 척추에 대정맥과 정맥의 복막에서 실행 요추 선박을 식별 연속성 9 / O 실크 결찰, 혈관을 분할 할 필요가 없습니다.
- 혈관 문합을위한 사이의 공간 미세 혈관 클램프를 배치 할 수있는 충분한 공간을 확인합니다.
- 지느러미 음경 정맥을 통해 정맥 내 헤파린 (5 단위)를 관리합니다.
3 기증자의 신장 검색
동맥 순환의 신장을 분리 열등한 우수한 대동맥 주위에 배치 된 7 / O 실크 넥타이를 조입니다.
- 대동맥에 바늘 (31G)와 위스콘신 대학의 용액을 0.5 ml의 - 역행 차가운 0.2 달이다.
- 봉합 내 대동맥을 나누고 신장과 대동맥의 길이와 신장 동맥을 제거하기 위해 대정맥과의 교차점에 신장 정맥을 나눕니다. (있는 경우) w, 대동맥에서 발생하는 요추 선박을 나눈다ithout 결찰.
- 배양 접시에 멸균 된 면봉에 차가운 식염수의 신장을 놓습니다.
- 자궁 전위에 의해 기증자 마우스를 안락사.
4 신장 이식 - 신장 준비
- 신장 동맥 맞은 편에 길이 방향으로 직접 대동맥 벽을 분할하여 대동맥 패치를 만듭니다. 동맥 문합을 수행 할 때 결찰 또는 방지 할 필요가있는 패치의 모든 혈관 루멘을 확인합니다.
- 하방 우량 신장 정맥 루멘 초 별도의 봉합 외부에서 내부로 열 / O 봉합사를 놓습니다. 봉합사는 부신 정맥을 나누는 데 사용 및 성선 정맥 혈관을 배향 할 수있다.
- 받는 사람 (그림 1.1)의 오른쪽 측면의 신장을 배치하고 봉합이 잘 혈관 문합은 면봉 또는 다른 악기에 묶여되는 것을 봉합없이 완료 될 수 있도록 배치됩니다 확인합니다.
(5) 신장 Transplan테이션 - 혈관 문합
첫번째 하방 후 우량 대정맥과 대동맥을 포괄하는 미세 혈관 클램프를 적용합니다.
- 대정맥의 앞쪽 벽을 천공하여 바늘 (31G)와 ventomy을 확인합니다. 0.9 %의 NaCl 약 50 μl를 주입하여 대정맥에서 세척 혈액.
- 길이가 도너 신장 정맥의 직경에 해당되도록 venotomy 내에 그들을 개방함으로써 미세한 팁 집게를 사용 venotomy 넓어.
- venotomy (그림 1.2)의 정점에 첫번째 (신장 혈관의 내강에 이미) 10 / O 우수한 봉합을 배치하고 하부 정점에 도달 할 때까지 (그림을 실행 봉합의 문합의 뒷면 벽 가입 1.3).
- 10 / O 열등 봉합을 배치 한 다음 다시 벽에서 실행 봉합사로 묶어 하나의 매듭 (그림 1.4)와 첫번째 넥타이.
- 전면 월마트를 만들 열등한 봉합사를 사용하여문 합부 리터 실행 봉합 (그림 1.5)와 우수한 정점 (그림 1.6)에서 우수한 봉합 끝에 넥타이.
- 집게로 대동맥 벽을 집어 들고 가위로 타원형 패치를 (약 aortotomy 대동맥의 둘레의 길이는 세 배 신장 동맥 내강의 5 분이어야 함) 절단에 의해 aortotomy을 만듭니다.
- 외부에서 내부로 대동맥 패치의 우수한 점 (그림 1.7)에서 10 / O 봉합을 놓고 aortotomy의 우수한 정점에 선박 외부 묶는 대동맥을 통해 전달합니다.
- 너무 꽉 봉합 (그림 1.9)를 묶는하여 문합을 수축하지 않도록주의, 실행 봉합 우량받는 사람 대동맥에 기증자 패치 anastomosing (그림 1.8)를 시작으로 동맥 문합을 만듭니다.
- (신장 재관류 먼저 우수한 클램프를 열등한 혈관 클램프를 제거그림 1.10 및 1.11). 요관에 충분한 혈액 공급이 달성되면 요관의 가시 연동 아마 본.
6 신장 이식 - Ureteric 문합
- 복벽에서 방광의 첨부 파일을 나눈다.
- 모두 벽을 통해 방광의 오른쪽에 왼쪽에서 바늘 (21G)를 전달합니다.
- 바늘 루멘 똑바로 forcep 팁을 놓고 통과를 모두 다시 집게 지금 방광의 왼쪽에서 오른쪽에서 왼쪽으로 전달되도록 방광을 통해.
- 요관이 오른쪽에서 다음 왼쪽 방광 결함에 전달하도록 방광을 통해 기증자 요관에 봉합을 그립니다.
- 둥근 바디 바늘 9 / O 나일론 봉합사로의 진입 점을 중심으로 세 번의 중단 봉합과 방광의 외막에 요관의 외막을 봉합.
- 합자로 요관 근위부를 잘라 따라서 열 번째전자 요관은 소변의 흐름과 요관의 끝이 방광의 몸으로 철회 할 수 있도록 허용합니다. 소변의 가시 생산 근교 ureteric 혈관에서 출혈과 함께 관찰 할 수있다.
- 하나의 중단 9 / O 실크 봉합사와 오른쪽 방광 결함을 닫습니다.
7 복구 및 수술 후 케어
원래 방향으로 복부에 위장 육부를 교체하고 6 / O 흡수성 봉합사 직근에 근접하여 복벽을 닫습니다.
- 금속 클립으로 피부를 피부에 근사.
- 부분적으로 atipamazole 하이드로 클로라이드 (10 μL / g)의 피하 주사로 마취를 반전.
- 피하 0.9 % NaCl을 1 ml의 피하 부 프레 노르 핀 염산염 (0.05 ㎎ / ㎏)에 의해 유체 지원 주입 진통을 관리 할 수 있습니다.
- 24-48 시간 동안 28 ° C로 예열 캐비닛에 마우스를 복구 할 수 있습니다. 에 질병까지에 마우스를 관찰실험의 완료.
- 십일에 작동 게시 - 금속 피부 클립 (7)를 제거합니다.
- 실험이 완료되면 경추 탈구하여 마우스를 안락사.
- 제거하고 조직 학적 분석을위한 반대측 신장 이식을 수집합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
신장 이식 거부 반응은 이식 된 신장 (그림 2)의 methacarn 고정 파라핀 조직 절편의 조직 학적 분석에 의해 평가 될 수있다. 신장 허혈 재관류 손상에서 동계 쥐의 결과와 신장의 Isograft 이식 그러나 사주에 의해 세뇨관 복구 및 기본 신장 조직 학적으로 비교할 수있다. 급성 거부 반응은 신장 실질 조직 전반에 걸쳐 확산 단핵 세포 침윤이 간질, 사구체와 세뇨관을 포함,이 일주 내 BALB / c를받는 사람에 C57BL / 6 신장 이식에 의해 모델링 될 수있다. 만성 동종 이식 손상이 C57BL / 6받는 사람에 이식 C57BL / 6 BM12 신장에서 모델링 할 수 있습니다, 이것은 간질 섬유화 점진적인 세관 손실로 구성된 인간의 병리에서 볼 수있는 일반적인 기능을 발생합니다. 고성능 필드 (X200 배율) 당 총 세관의 수는 (Fi 접속 기능 네프론 질량의 정량화 할 수 있습니다gure 3), 세관의 손실이 거부로 인해 관상 부상을 반영한다. 간질 섬유화는 팬 콜라겐 얼룩 picrosirius 빨강 (그림 4)를 사용하여 식별 할 수 있습니다. 정상적인 내생 콜라겐 그러나 프로그레시브 섬유증 결과 퇴적 만성 손상 새로운 콜라겐 중에 관찰된다. 만성 손상은 이식 후 분명 8 ~ 12 주 (그림 5)이된다.
상당한 학습 곡선 모델 (도 6)를 확립하기 위해 극복해야한다. 약 40 절차 재현 혈관 문합 시간이 합병증의 무료 허용 생존에 도달하기 전에 복구 된 생쥐에서 수행되었다. 마우스를 안락사에 대한 가장 일반적인 이유는 우리의 경험 전신 heparization이의 발생을 감소하지만, 그리고 혈전증 동맥 관련 척수 허혈 사지를 낮출 차 뒷다리 마비 때문이었다. 마우스 정기적 개월이었다실험을 종료하기위한 로컬 합의 기준에 따라 nitored. 학습 곡선의 고원 단계에서 수행 생존 실험은 28.9 ± 0.47 분의 평균 혈관 문합 시간 결과.
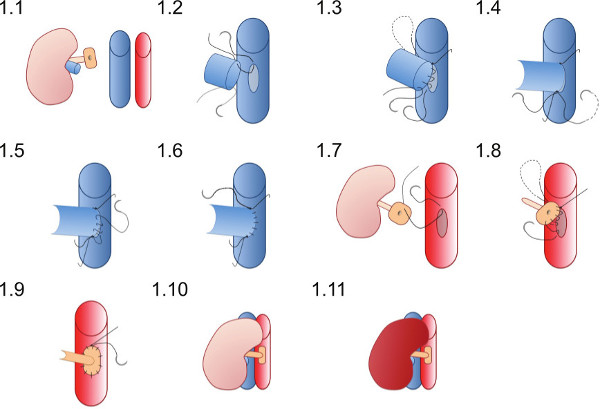
혈관 문합 기법의 그림 1 도식 표현. 기증자의 신장은받는 사람 마우스의 오른쪽 측면에 배치됩니다. 도너 신정맥은 엔드 - 투 - 사이드 방식으로 문합되고 대동맥 패치에 도너 신동맥는 수신자 대동맥에 문합된다.

이식 된 신장의 그림 2 대표 조직 학적 관 부상. 메틸 Carnoyl의 솔루션 조직에 고정 후 파라핀에 포함 된가 4μm 핀 및 조직 섹션은 Hemotoxylin 및 에오신으로 염색 하였다. 신장 세뇨관 손상을 전시 및 외관 기본 신장 비교할 수없는 isograft 이식 다음 사주에서. BALB / c를받는 사람에 이식 C57BL / 6 BM12 신장 확산 단핵 세포 침윤 (*) 및 괴사 세뇨관 (**)와 tubulitis 급성 이식 거부 반응을 겪는다. 혈관 주위 림프구 침윤 (블록 화살표 ⬆)을 특징으로 만성 동종 이식 손상 및 간질 섬유화와 세뇨관 위축 (중공 화살표 ⇧)에서 C57BL / 6 결과에 이식 C57BL / 6 BM12 신장. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

TR에서 관 손상의 그림 3 정량화 ansplanted 신장. 건강 세관 (그대로 기저막 그대로 세관 루멘, 건강 세포질 볼륨 및 유지 혀끝의 미세 융모 브러시 테두리의 존재에 의해 정의 된)가 작동 네프론의 질량을 반영 필드 당 세관의 평균 수를 계산하여 정량화 할 수있다 (X200 배율 ) (N = 6, 10 분야의 연속 평균, ** p <0.01).

그림 4 만성 동종 이식 손상이 이식 된 신장이 콜라겐의 picrosirius 빨간색 염색의 검출에 의해 명백하다 내에서 간질 섬유화 (대표 이미지). 콜라겐 증착에 의해 식별 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
gure 5 "SRC ="/ 파일 / ftp_upload / 52,163 / 52163fig5highres.jpg "/>
간질 섬유화의 그림 5 정량화. 빨간색 양성이 C57BL / 6BM12에서 발생 picrosirius에 의해 측정 간질 성 섬유증 (N = 이식 다음 C57BL / 6받는 사람 십이주을 ⇒ 6, 10 분야의 연속 평균, ** p <0.01, * p < 0.05).

도 6의 학습 곡선. 말단 마취 생쥐의 초기 비 회복 실험 수술 기술을 개발하기 위해 수행되었다. 이 합병증없이 생존 한 마우스로 성공적으로 다시 관류 이식 신장을 달성하기 위해 복구 실험으로 이어졌습니다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
동맥 문합을 수행하는 가장 잘 설명 된 방법은 수신자 대동맥으로 엔드 - 투 - 사이드 방식으로 이어져 신동맥와, 도너의 원위 대동맥을 사용하는 것이다. 우리는 더 편리한 것으로 우리가 믿는 인간 신장 이식으로 수행 'Carrell 패치'미러링 유사한 대동맥 패치의 사용을 설명한다. 기증자와받는 사람의 수술 시간의 문헌보고가 드문 드문 있지만 우리는받는 사람 대동맥에 엔드 - 투 - 사이드 기증자의 대동맥 대신받는 사람의 대동맥에 대동맥 패치를 사용하는 것이 바람직하다 생각합니다. 패치를 이용하면 모든 척추 도너 대동맥을 해부 분기 할 필요성을 부정하고, 또한 시간이 자연스럽게 제외 패치 anastomosing 같이, 개별적으로 결찰하는 데 걸리는.
이 모델을 달성하기 위해 중요한 단계는 동맥 패치 문합 내에서 신장 동맥 이외의 다른 동맥 내강이 없음을 확인하기 위해 돌보는 포함 그들은미세 혈관 클램프가 제거 될 때 누출됩니다. anastamoses를 구성 봉합은 타원형 aortotomy를 제공하는 우리가 관찰 한 실용성에서 문합 원인이 허혈을 축소 또는 혈액의 흐름을 억제 할 수있는 지갑 문자열 효과의 인식 밀접하지만, 연결 할 수있는 충분한 크기의 지갑 문자열입니다 효과는 발생하지 않습니다. venotomy이 다음 집게와 스트레칭으로 확대 바늘로 만든, 우리는이 집게와 스트레칭으로 절단하는 것이 바람직하다 안정된 문합을 만드는 정맥 쉽게 볼 수있는 조직과 원조 봉합의 반지를 만들어 믿습니다. 방광 ureteric 문합은 우리가 소변 누출 ureteric 협착 아마도 인한 국소 빈혈과 연관되어 방광 재 건설 방광 돔보다는 여기에 설명 된 기술을 옹호 고려해야 할 매우 중요한 요소입니다. 우리 기재된 기술은 직접적으로 bladd 문합 바와 같이 도너 ureteric 짧은 길이가 사용될 수 있도록어 오. 이러한 기술을 이용하여 개선 우리는 크게이 실험 모델을 완료하는 데 필요한 시간의 양을 줄일 수 있었다. 실제로 동시에 다섯 이식 작업이 사업자와 생쥐의 복구 및 모니터링을 할 수 있도록 충분한 시간과 하루에 수행 할 수 있습니다.
이 논문에 설명 된 모델과 기술의 주요 제한은 마우스가 마우스가 생존 신장에 의존하지 않도록 시츄 네이티브 신장 중 하나로 남아 있다는 것이다. 몇몇 저자는 따라서 이식 된 신장에 의존을 마우스를 떠남으로서, 즉시 이식의 시간이나 이식 후 5~10일에서 두번째 네이티브 신장의 제거를보고했다. 이것은 생존율은 혈청 크레아티닌 또는 혈중 요소로서 신장 기능의 지표를 측정하는 실험 결과뿐만 아니라 혈액 샘플링으로 사용할 수 있도록한다. 그러나 조직 학적 결과의 차이는 없다동종 이식에 따라 단일 기본 신장 9 쥐들를 비교할 때. 이 우리를 배제하지 않는다 기재된 프로토콜 실제로 제 네이티브 신장은 소정 시간 간격으로 제거 될 수있다. 추가적인 제한이 향상된 미세 수술이 비록 전문 훈련이 극복 될 수있는 명령에 대한 기술적 인 도면을 이용하여, 동맥과 정맥 봉합을 수행하기 위해 요구된다는 것이다. 혈관 합병증이있는 신장 동맥 또는 정맥 혈전증이 발생할 수 있습니다, 이것은 불변의 증세, 건강 악화 또는 특히 뒷다리 - 사지 마비를 표시하는 마우스가 발생합니다. 이 모델을 이용하면 따라서 엄격한 관리와 마우스의 모니터링은 필수적입니다.
신장 이식 급성 거부 반응은 크게 그러나 세포 매개 성 거부 반응의 에피소드는 여전히 신장 이식 전반에 걸쳐 발생할 수 있습니다, 면역 억제 유도 치료 고갈 순환 림프구에 의해 처리 된삶. 따라서이 기초가되는 메커니즘에 대한 연구는 여전히 적절하고 치료를위한 새로운 경로를 식별 할 수있다. 이러한 C57BL / BALB / C로 6 완전한 MHC 불일치에서, 신장 이식에 의존 생존율이 18.8 10 일만큼 낮은 것으로보고되고있다 의미한다. 조직 학적으로 급성 세포 및 혈관 제거는 사구체와 세뇨관 괴사와 림프구 침윤, 출혈 및 부종 간질에서, tubulitis, 혈관염에 의해 식별 될 수있다. 만성 동종 이식 손상에 기여 결합 과정은 공부를이 지역 어렵게 만들었습니다. 조직 학적 특징은 간질 섬유화, 세뇨관 위축, 사구체 경화증 및 혈관 내막의 증식을 포함한다. 프로그레시브 부상은 그러나 점점 많은 다른 요인들이 포함될 수 있음을 알 수있다, 영구 T 세포의 침윤과 관련된다. 영구 손상의 전위를 중개로 인해 도너 - 특이 항체, B 세포, 자연 살해 세포로 보완 증착을 포함이러한 내피 3으로서, 대 식세포, 및 그래프트 본질적인 세포. 따라서이 모델은 거절의 이러한 다양한 측면의 연구를 할 수 있습니다.
초기의 설명에도 불구하고 4이 모델을 이용하여 약 70 발표 된 연구가 있었다이 수백 기사가 있었다 신장 허혈 - 재관류 손상의 마우스 모델과 비교된다. 복강 신장 이식이 마우스 모델의 중요성은 또한 그 거부의 다양한 메커니즘을 모델링하는데 사용될 수있는 잘 정의 된 근친 마우스 균주의 사용에서 이점이 직접 인간 신장 이식의 프로세스를 재생성한다는 것이다. 따라서,이 모델을 이용한 연구는 매우 병진이다. 이 모델의 다른 미래의 애플리케이션은 특정 야생형 마우스로부터 모델 녹아웃 표현형 또는 유전자에서 반대로 야생형 신장과 신장 이식에 의해 극한 신장 이상을 포함 공부변경된받는 사람.
이 모델은 인간 신장 이식 성공의 프로세스를 복제 할 수있다. 근친 마우스 균주의 사용은 MHC 차이를 변화의 기증자받는 사람의 조합을 선택할 수 있습니다. 또한 마우스의 사용은 배제의 다양한 측면을 프로빙 녹아웃 및 유도 성 시스템을 포함한 다양한 기술을 사용할 수있다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자가 공개하는 게 없다.
Acknowledgments
신장 연구 UK에서 자금, 에딘버러 및 장기 이식의 유럽 사회의 외과 의사의 왕 대학은이 연구를 지원했다.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



