Introduction
Succesvolle niertransplantatie voor de behandeling van nierfalen werd voor het eerst beschreven in 1955 tussen eeneiige tweelingen 1, sindsdien is het uitgegroeid tot een revolutionaire behandeling voor patiënten met eindstadium nierfalen in de hele wereld en biedt zowel verbeteringen in de lengte en de kwaliteit van het leven 2. Maar op lange termijn overleving van het transplantaat is belemmerd door een veelheid van pathologische processen als gevolg chronische transplantaat schade 3.
Afstoting van de getransplanteerde nier bij de mens blijft een belangrijke oorzaak van morbiditeit, ondanks de aanzienlijke verbeteringen in immunosupporessive regimes. Het doel van het ontwikkelen van een muismodel van niertransplantatie is om nauw samen te repliceren het proces en pathologie aangetroffen in menselijk niertransplantatie 4. Skoskiewicz e.a.. Eerst beschreven muismodel van renale transplantatie in 1973 5. Hoewel advanced microchirurgische vaardigheden vereist, is een waardevol tool om verschillende redenen: de muis genoom is goed gekarakteriseerd en er is een grote verscheidenheid van experimentele methoden en technieken voor muizen studies.
Veel groepen met het muizenmodel van niertransplantatie hebben gemaakt van de getransplanteerde nier als levensbehoudend orgaan, maar in andere studies en in onze beschreven werkwijze een van natieve nieren van de ontvanger muis blijft in situ gedurende de duur van het experiment 4. Het voordeel is dat de muis ondergaat een anesthesie en operatie waardoor de morbiditeit voor de muis en het risico van overlijden door een tweede procedure verminderen. Bovendien de muis niet lijden onder de negatieve effecten van geleidelijke nierfalen.
Hoewel modellen van allogene afstoting bestaan in andere organen zoals het hart en de huid, deze zijn niet altijd direct relevant niertransplantatie. Er is bewijs dat deze modellen uitlokken verschillende modi en dydynamica van afwijzing, bijvoorbeeld het tijdsverloop van de afwijzing van de cardiale transplantaat en donornier sterk verschilt in bepaalde stam combinaties 6. We hebben acuut nierfalen allograftafstoting patronen beschreven in BALB / c donoren in niet-transgene FVB / nj muizen, dit model toonde cellulair gemedieerde letsel met accumulatie van T-cellen en macrofagen 7. Als alternatief hebben we ook beschreven een model van chronische allograft schade die interstitiële fibrose en tubulaire atrofie vertoont, dit uit overplanten een nier van C57BL / 6 BM12 donors in C57BL / 6 ontvangers, omdat deze muizen worden gekarakteriseerd door een MHC klasse II loci mis -match 8.
Meerdere aspecten van transplantatie zijn onderzocht met behulp van de muis-model van niertransplantatie waaronder acute afstoting, cellulaire en humorale afstoting, ischemie-reperfusie letsel en trialing nieuwe therapeutische middelen. We hebben wijzigde de chirurgische technique om bedrijfstijd te verminderen en het verbeteren van het gemak van een operatie. Vooral hebben we gelijktijdig donor en ontvanger opstelling en een vereenvoudigde vasculaire anastomose techniek met behulp van een continue patch aorta anastomose beschreven. Deze video en manuscript zal de belangrijkste punten om te helpen bij de oprichting van deze techniek.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Passende nationale en lokale institutionele ethiek zou moeten zijn in plaats voor het uitvoeren van dierproeven. Met name in het Verenigd Koninkrijk werden de volgende experimenten in het kader van de Dieren (Scientific Procedures) Act 1986 Waar twee microchirurgen beschikbaar zijn om tegelijkertijd werken de donor chirurg moet uitvoeren stappen 1,1-1,16 dan 3,1-3,5, terwijl de ontvanger chirurg voert 2,1-2,8 . Voor een enkele operator de stappen sequentieel kan worden gevolgd.
1 Donor Voorbereiding
Opmerking: De hier gepresenteerde procedure is voor een donor C57BL / 6 BM12 en ontvanger C57BL / 6 mannelijke muizen tussen de 8 tot 16 weken oude jaar met een lichaamsgewicht van meer dan 20 g. Maar deze procedure kan reproduceerbaar worden uitgevoerd op verschillende muizenstammen. De in de sectie representatieve resultaatgegevens verkregen uit C57BL / 6, C57BL / 6 BM12 en BALB / c muizen.
- Gedrag procedures using steriele chirurgische instrumenten en verbruiksgoederen (autoclaaf), met inspanningen om het werkgebied zo steriel mogelijk te houden. Voer de donor preparaat tegelijkertijd met de ontvanger preparaat als twee chirurgen beschikbaar.
- Verdoven van de muis met een intraperitoneale injectie (31G naald) van medetomidine (0,5 mg / kg) en ketamine hydrochloride (200 mg / kg). Dit resulteert in een verdovingsmiddel vlak dat wordt gedurende 4 uur verschaffen voldoende om de gehele procedure uit te voeren. Aanvullende verdoving niet noodzakelijk.
- Bevestigen dat de muis wordt verdoofd (geen reactie op teen knijpen).
- Scheer de buik van de muis en verwijder alle losse haren met plakband.
- Plaats de muis op zijn rug op een steriel gedrapeerd verwarmde mat en losjes immobiliseren de ledematen met steriele afplakband.
- Bewaken van de muis tijdens de gehele procedure voor brandwonden. Indien mogelijk gebruik maken van een niet-elektrische warmtebron.
- Breng een eye smeermiddel en sanitize de buikwand met een verdunde jodiumoplossing.
- Maak een middellijn incisie in de buik om de buikholte te gaan en plaats een 3 cm Calibri abdominale oprolmechanisme.
- Solliciteer opgewarmd zoutoplossing om de darmen en chirurgisch gebied vochtig te houden en te voorkomen dat onnodige drogen van de ingewanden.
- Bedek de muis met steriele doeken en zet de darmen aan links van de operator (rechter muis) aan de aorta, vena cava en de linker nier bloot.
- Breng een ratcheted pincet aan de maag en trek superieur aan de grote bloedvaten en de linker nier volledig bloot. Pack vochtig steriele swabs (2 mm x 2 mm) in de buik te trekken weefsels van het chirurgische gebied, zoals de lever lobben, zaadblaasjes en darm.
- Isoleer de linker nier van omliggende adventitia, vet en de linker bijnier in de peritoneale holte van het bot ontleden bindweefsel met fijne punt tang. Plaats de gesloten uiteinden van de tang tussen de gebieden die need worden gescheiden en langzaam laat de forcep tips te openen om de ruimte snijden.
- Isoleer de linker renale ader door ligatie en vervolgens te delen links bijnier ader en links gonadale ader met 9 / O nylon. Plaats de hechtdraad nabij de renale ader.
- Ligeer en verdeel de ureter met 7 / O zijden hechtdraad dichtbij de blaas waardoor de hechting eindigt lang. Deze lange hechtdraad einden worden gebruikt wanneer de nier geoogst en noodzakelijk zijn voor de ureteric anastomose.
- Te mobiliseren en volledig ontleden de aorta en vena cava superieur en inferieur aan de nierslagader en ader gebruiken fijne punt tang om lymfevaten en vet van de voorkant en de zijkanten van de schepen bot ontleden.
- Vind het weefsel vlak tussen de aorta en de vena cava en langzaam verspreidde de tang. Open langzaam de toppen van de fijne getipt tang om het weefsel met minimale trauma verspreiden.
- Das een losse 7 / O zijde rond de aorta superieur en inferieur aan de nierslagader door het passeren van een schuine fijnetip tang rond de achterkant van vaartuigen en trekken een hechting door. Deze hechtingen zullen voorafgaand aan de nieren retrieval worden verscherpt om retrograde perfusie van de University of Wisconsin-oplossing mogelijk te maken.
2 Ontvanger Voorbereiding
Zoals aangegeven in de donor voorbereiding Volg stappen 1,2 tot 1,8.
- Verplaats de darmen aan het recht van de exploitant (linkermuisknop's) aan de aorta, vena cava bloot. Bedek de darmen met een steriele zoutoplossing gedrenkte doekje.
- Voer een recht nefrectomie door ligatie van de rechter nierslagader en de ader samen met 7/0 zijden hechtdraad en vervolgens delen.
- Afbinden van de juiste ureter met 7 / O zijden hechtdraad en delen.
- Mobiliseren en volledig ontleden de aorta en vena cava inferior de renale slagader en ader zoals beschreven in stap 1.14 en 1.15. Zorgen voor volledige dissectie tussen de aorta en de vena cava. Zorg ervoor dat de interne spermatic slagader die anterior loopt naar de vena cava en aort behoudeneen samen met het lymfatische bundel.
- Lumbale vaartuigen die in het retroperitoneum van de vena cava en ader aan de wervelkolom identificeren, ligeren met 9 / O zijde in continuïteit, behoeft de vaartuigen verdelen.
- Identificeer voldoende ruimte om microvasculaire klemmen te plaatsen met ruimte tussen de voor vaatverbindingen.
- Dien intraveneus heparine (5 stuks) via dorsale penile ader.
3 donornier Retrieval
Draai de 7 / O zijden dassen die zijn geplaatst rond de lagere en hogere aorta naar de nier van de arteriële circulatie te isoleren.
- Bezielen retrograde koude 0,2-0,5 ml van de Universiteit van Wisconsin-oplossing met een naald (31G) in de aorta.
- Verdeel de aorta in de hechtingen en verdeel de renale ader bij de kruising met de vena cava naar de nieren en de renale slagader met een lengte van aorta verwijderen. Verdeel lumbale schepen die uit de aorta, indien zij aanwezig zijn, without ligatie.
- Plaats de nier in koude zoutoplossing op een steriel wattenstaafje in een cultuur schotel.
- Euthanaseren de donor muis door cervicale dislocatie.
4 Niertransplantatie - Nier Voorbereiding
- Maak een aorta patch door de aorta wand verdelen lengterichting direct tegenover de nierslagader. Het identificeren van elk vaartuig Lumen in de patch die moeten worden afgebonden of vermeden worden bij het uitvoeren van de arteriële anastomose.
- Plaats een 10 / O hechtdraad van buiten naar binnen de renale ader lumen craniaal en een tweede aparte hechtdraad caudaal. De hechtingen gebruikt om de adrenale ader delen en gonadale ader kan worden gebruikt om het vat oriënteren.
- Plaats de nier in de rechter flank van de ontvanger (figuur 1.1) en zorgen voor de hechtingen zijn goed geplaatst om ervoor te zorgen vaatverbindingen kan worden voltooid zonder de hechtingen raken verstrengeld in staafjes of andere instrumenten.
5 Nier Transplantatie - Vasculaire Anastomosis
Solliciteer microvasculaire klemmen eerst inferiorly dan superiorly omvat de vena cava en de aorta.
- Maak een ventomy met een naald (31G) door aanprikken van de voorste wand van de vena cava. Spoel bloed van de vena cava door injectie ongeveer 50 ui 0,9% NaCl.
- Widen de venotomie met fijne punt pincet door ze te openen in de venotomie zodat de lengte gelijk is aan de diameter van de donor renale ader.
- Plaats de 10 / O superieure hechting (die al in het lumen van de renale ader) eerst aan de top van de venotomie (figuur 1.2) en lid van de achterwand van de anastomose in een lopende hechtdraad tot de inferieure top is bereikt (Figuur 1.3).
- Plaats de 10 / O inferieur hechtdraad en bind eerst met een enkele knoop (figuur 1.4), dan koppelen aan de lopende hechting van de achterwand.
- De inferieure hechting maakt het voorste wall van de anastomose (figuur 1.5) met een lopende hechtdraad en binden aan de superieure hechting einde aan de superieure apex (figuur 1.6).
- Een aortotomy door het oppakken van de aortawand met een pincet en snijden een elliptische patch met een schaar (ongeveer aortotomy moet een vijfde van de omtrek van de aorta en driemaal de nierslagader lumen in lengte).
- Plaats een 10 / O hechting op de superieure punt van de aorta patch van buiten naar binnen (figuur 1.7) en pass aorta buiten de vaartuigen te binden op de superieure top van de aortotomy.
- Maak de arteriële anastomose met een lopende hechting begint superiorly (figuur 1.8) anastomose- de donor patch aan de ontvanger aorta, verzorgen de anastomose niet te vernauwen door koppelverkoop de hechtingen te strak (figuur 1.9).
- Verwijder de inferieure vasculaire klemmen dan eerst de superieure klem op de nier reperfusie (Figuur 1.10 en 1.11). Zichtbare peristaltiek van de ureter misschien gezien als voldoende bloedtoevoer naar de ureter bereikt.
6 Niertransplantatie - Ureteric Anastomosis
- Verdeel eventuele bijlagen van de blaas van de buikwand.
- Passeren een naald (21G) van links naar rechts van de blaas door beide muren.
- Plaats rechte pincet tips in de naald lumen en gaan beide terug door de blaas zodat de tang nu passeren van rechts naar links van de linker zijde van de blaas.
- Teken de hechting op de donor ureter door de blaas zodat de ureter passen in de linker blaas defect vervolgens uit de rechterkant.
- Hecht de adventitia van de urineleider naar de adventitia van de blaas met drie enkele onderbroken hechtingen rond de ingang met 9 / O nylon hechtdraad op een ronde-bodied naald.
- Snijd de ureter proximaal van de ligatuur, waardoor het openen van ee ureter om urine stromen en laat de ureter einde terug te trekken in het lichaam van de blaas. Zichtbare productie van urine kan worden waargenomen, samen met bloeden van peri-ureteric schepen.
- Sluit de rechterkant blaas defect met een enkele onderbroken 9 / O zijden hechtdraad.
7 Recovery en postoperatieve zorg
Vervang het maag-ingewanden in de buik in hun oorspronkelijke stand en sluit de buikwand door de onderlinge aanpassing van de rectus spieren met 6 / O-absorbeerbare hechtdraad.
- Benaderen de huid met metalen huid clips.
- Gedeeltelijk omkeren van de anesthesie met een subcutane injectie van atipamazole hydrochloride (10 ul / g).
- Dien pijnstiller door subcutane buprenorfine hydrochloride (0,05 mg / kg) en voor fluïdum support injectie 1 ml subcutane 0.9% NaCl.
- Herstel van de muis in een opwarming kast bij 28 ° C gedurende 24 tot 48 uur. Let op de muis voor de ziekte tot devoltooiing van het experiment.
- Verwijder de metalen huid clips 7-10 dagen na de operatie.
- Nadat het experiment voltooid euthanaseren de muis door cervicale dislocatie.
- En vang het contralaterale nier en allogreffe voor histologische analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Renale allograft afstoting kan worden beoordeeld door histologische analyse van methacarn vaste paraffine ingebedde weefselcoupes van de getransplanteerde nier (figuur 2). Isotransplantaat transplantatie van nieren tussen syngenetische muizen resulteert in renale ischemische reperfusie schade, echter met 4 weken de buisjes hebben zich hersteld en zijn histologisch vergelijkbaar met inheemse nieren. Acute afstoting kan worden gemodelleerd door C57BL / 6 niertransplantatie in BALB / c ontvangers, binnen 1 week is er diffuse infiltratie van mononucleaire cellen in de hele nierparenchym, waarbij het interstitium, glomeruli en tubuli. Chronische allograft schade kan worden gemodelleerd door C57BL / 6 BM12 nieren getransplanteerd in C57BL / 6 ontvangers resulteert in de typische functies van humane pathologie bestaat uit interstitiële fibrose en tubulus geleidelijk verlies. Bruto telling tubule per high-powered veld (x200 vergroting) kunt kwantificering van de functionele nefronen massa (Figuur 3), verlies van buisjes weerspiegelt buisvormige letsel door afwijzing. Interstitiële fibrose kunnen worden geïdentificeerd met de pan-collageen vlek picrosirius rood (figuur 4). Normaal endogene collageen wordt waargenomen, maar tijdens chronische aandoeningen nieuw collageen afgezet resulteert in progressieve fibrose. De chronische aandoeningen blijkt tussen 8 en 12 weken na transplantatie (Figuur 5).
Een belangrijke leercurve nodig heeft om het model (figuur 6) vast te overwinnen. Naar schatting 40 procedures werden uitgevoerd in muizen hersteld voordat een reproduceerbare vasculaire anastomose tijd werd bereikt met acceptabele overleving vrij van complicaties. De meest voorkomende reden voor euthanasie werd de muis door verlamming secundair aan en ruggemerg ischemie verband met arteriële trombose ledematen verlagen, maar in onze ervaring systemische heparization vermindert de incidentie van deze. Muizen werden routinematig monitored volgens lokaal overeengekomen criteria voor beëindiging van de experimenten. Survival experimenten uitgevoerd in de plateaufase van de leercurve tot een gemiddelde vasculaire anastomose tijd van 28,9 ± 0,47 min.
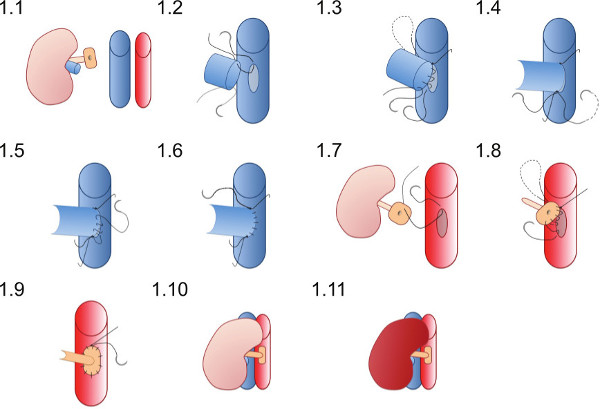
Figuur 1 Schematische weergave van de vasculaire anastomose techniek. Wordt de donornier geplaatst in de rechter flank van de ontvanger in de muis. De donor nier-ader wordt geanastomoseerd in een end-to-side mode en de donor nierslagader op een patch van de aorta wordt geanastomoseerd aan de ontvanger aorta.

Figuur 2 Vertegenwoordiger histologische buisvormige letsel in de getransplanteerde nier. Na fixatie in methyl Carnoyl's oplossing weefsels werden ingebed in parafvin en coupes van 4 urn werden gekleurd door Hemotoxyline en eosine. Op 4 weken na transplantatie isotransplantaat nieren niet vertonen tubulaire schade en vergelijkbaar met natuurlijk nieren uiterlijk. C57BL / 6 BM12 nieren getransplanteerd in BALB / c ontvangers ondergaan acute transplantaatafstoting met diffuse mononucleaire celinfiltraten (*) en necrotische buisjes (**) en tubulitis. C57BL / 6 BM12 nieren getransplanteerd in C57BL / 6 resultaten in chronische transplantaat schade gekenmerkt door perivasculaire lymfocytaire infiltraten (block pijl ⬆) en interstitiële fibrose en tubulaire atrofie (holle pijlen ⇧). Klik hier om een grotere versie van deze afbeelding te bekijken.

Figuur 3 Kwantificering van tubulaire schade in de tr ansplanted nier. Healthy tubuli (gedefinieerd door de aanwezigheid van een intact basaal membraan intact tubulus lumen, gezonde cytoplasmatische volume en onderhouden apicale microvilli brush border) reflecterende werking nefron massa kan worden gekwantificeerd door het tellen van het gemiddelde aantal buisjes per veld (vergroting x200 ) (n = 6, gemiddeld 10 opeenvolgende velden, ** p <0.01).

Figuur 4 Chronische allogreffe schade kan worden geïdentificeerd door interstitiële fibrose (vertegenwoordiger beelden). Collageen depositie binnen de getransplanteerde nier blijkt door detectie van picrosirius rode kleuring van collageen. Klik hier om een grotere versie van deze afbeelding te bekijken.
guur 5 "src =" / files / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figuur 5 Kwantificering van interstitiële fibrose. Interstitiële fibrose gemeten picrosirius rode positiviteit wordt opgeworpen in C57BL / 6BM12 ⇒ C57BL / 6 ontvangers twaalf weken na transplantatie (n = 6, gemiddeld 10 opeenvolgende velden, ** p <0,01, * p < 0,05).

Figuur 6 leercurve. Initiële experimenten niet-inning in terminaal verdoofde muizen werden uitgevoerd om de chirurgische techniek te ontwikkelen. Dit werd gevolgd door herstel experimenten om een succesvolle re-perfusie getransplanteerde nier met een overlevende muis zonder complicaties te bereiken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De meest beschreven wijze bij de arteriële anastomose voeren is de distale aorta van de donor gebruikt, de renale arterie bij voortzetting in een end-to-side wijze de ontvanger aorta. We beschrijven het gebruik van een aorta patch, vergelijkbaar met de "Carrell patch" mirroring die uitgevoerd humane niertransplantatie onze mening handiger zijn. Hoewel rapporten in de literatuur van donor en ontvanger operatietijd schaars zijn wij van mening dat het gebruik van een aorta patch aan ontvanger aorta in plaats van end-to-side donor aorta tot ontvanger aorta voorkeur. Met een patch ontkent de noodzaak alle lumbale donor aorta takken ontleden, en ook de tijd genomen om ze individueel te ligeren, als een pleister voor anastomose natuurlijk sluit dergelijke.
Kritische stappen om dit model te bereiken zijn onder meer de zorg om ervoor te zorgen dat er geen andere dan de nierslagader binnen de arteriële patch anastomose als arteriële lumen zezal lekken wanneer micro-vasculaire klemmen worden verwijderd. De hechtingen bouw van de anastamoses kan worden vastgebonden strak, maar zich bewust zijn van de portemonnee-string effect dat de anastomose en de oorzaak ischemie kan beperken of hinderen van de bloedstroom, in praktisch we hebben waargenomen dat de elliptische aortotomy voorzien is van voldoende omvang de portemonnee-string effect wordt niet aangetroffen. De venotomie is gemaakt met een naald vervolgens uitgebreid door rekken met een pincet, geloven we dat de voorkeur snijden zich uitrekken met een tang wordt een ring van veneuze weefsel dat gemakkelijk kan worden gezien en steun hechten een stabiele anastomose maken. De ureteric anastomose de blaas een belangrijke component te overwegen we pleiten de hier eerder beschreven dan blaas-dome blaas reconstructie die is geassocieerd met urine lekken en ureteric stenose waarschijnlijk door ischemie techniek. De beschreven techniek maakt een kortere donor ureteric lengte worden gebruikt als het direct anastomose aan de Bladder 5. Door het gebruik van deze technische verbeteringen wij de benodigde tijd om dit experimentele model voltooien aanzienlijk verminderen zijn. Inderdaad met twee operators werken gelijktijdig vijf ontvangers kunnen worden uitgevoerd per dag met voldoende tijd om het herstel en de monitoring van de muizen toe.
Een belangrijke beperking van het beschreven model en de techniek in dit document is dat de muis blijft met een van zijn natieve nieren in situ zodanig dat de muis niet afhankelijk van de nier te overleven. Sommige auteurs hebben het verwijderen van de tweede natieve nier onmiddellijk gemeld bij de transplantatie of vijf tot tien dagen na de transplantatie, zodat het aan muis afhankelijk van de getransplanteerde nier. Dit zou overleven, te gebruiken als een experimentele uitkomsten als bloedafname merkers van nierfunctie zoals serum creatinine of blood urea meten. Er is echter geen verschil in histologische resultatenbij het vergelijken muizen afhankelijk van de allograft en die met een enkel natieve nier 9. Ons protocol beschreven, sluit dit niet en inderdaad de tweede inheemse nier kon op een bepaald tijdsinterval worden verwijderd. Een extra beperking is dat geavanceerde micro-chirurgische deskundigheid vereist om een arteriële en veneuze anastomose uitvoert, maar met training en door gebruikmaking van de technische cijfer voor instructie kan worden overwonnen. Vasculaire complicaties kunnen optreden, dit zijn nierslagader of veneuze trombose, dit altijd als resultaat de muis het tonen tekenen van stress, slechte gezondheid of specifiek achterste ledematen verlamming. Daarom strikte beheer en monitoring van de muizen is noodzakelijk bij het gebruik van dit model.
Acute afstoting van niertransplantaat grotendeels behandeld met immunosuppressie en inductie therapie afbreken circulerende lymfocyten, maar episodes van cel-gemedieerde afstoting nog steeds optreden gedurende de renale graftsleven. Daarom is onderzoek naar de mechanismen die ten grondslag liggen aan deze zijn nog steeds relevant en kan nieuwe wegen te identificeren voor de behandeling. In volledige MHC mismatch, zoals C57BL / 6 in BALB / c, gemiddelde overleving afhankelijk niertransplantatie is gemeld zo laag als 7,4 dagen 10 zijn. Histologisch acute cellulaire en vasculaire afstoting kan worden geïdentificeerd door lymfocytische infiltratie, bloedingen en oedeem in het interstitium, tubulitis, vasculitis, met glomerulaire en tubulaire necrose. De gecombineerde werkwijzen tot chronische allograft schade hebben dit gebied moeilijk te bestuderen gemaakt. De histologische kenmerken zijn interstitiële fibrose, tubulaire atrofie, glomerulosclerose en intima proliferatie. De progressieve schade geassocieerd met aanhoudende T-cel infiltratie, maar het is steeds duidelijk zijn dat vele andere factoren betrokken kunnen zijn. Potentiële bemiddelt hardnekkige blessure omvatten complement depositie als gevolg van donor-specifieke antilichamen, B-cellen, natural killer cellen, Macrofagen en cellen inherent aan het transplantaat zoals het endotheel 3. Daarom is dit model maakt de studie van deze verschillende facetten van de afwijzing.
Er zijn ongeveer 70 gepubliceerde onderzoeken waarin dit model is ondanks zijn vroege beschrijving 4, dit in vergelijking met muismodellen nier ischemie-reperfusieschade waar honderden artikelen zijn. Het belang van dit muismodel van intra-abdominale niertransplantatie is dat het direct simuleert het proces van menselijke niertransplantatie voorts het profiteert van het gebruik van goed gedefinieerde inteelt muizenstammen die kunnen worden gemodelleerd verschillende mechanismen van afstoting. Vandaar dat de studies met behulp van dit model zijn zeer vertaalbaar. Andere toekomstige toepassingen van dit model omvatten bestuderen intrinsieke nierafwijkingen door transplanteren nieren specifieke fenotypes van knockout modellen in wild-type muizen of omgekeerd wildtype nieren in genetischveranderde ontvangers.
Dit model kan succesvol repliceren het proces van menselijke niertransplantatie. Het gebruik van inteelt muizenstammen maakt selectie van de donor-ontvanger combinaties van verschillende MHC verschillen. Verder het gebruik van muizen maakt het gebruik van verschillende technieken, waaronder knockout en induceerbare systemen om de verschillende aspecten van afstoting sonde.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Financiering van Kidney Research UK, The Royal College of Surgeons van Edinburgh en de European Society of Organ Transplantation ondersteund deze studie.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



