Introduction
El trasplante renal con éxito para el tratamiento de la insuficiencia renal fue descrita por primera vez en 1955 entre los gemelos monocigóticos 1, desde entonces se ha convertido en un revolucionario tratamiento para los pacientes con insuficiencia renal terminal en todo el mundo, ofreciendo mejoras en duración y calidad de vida 2. Sin embargo la supervivencia del injerto a largo plazo se ha visto obstaculizada por una multitud de procesos patológicos que resultan en daños crónica del injerto 3.
El rechazo del riñón trasplantado en el ser humano sigue siendo una causa importante de morbilidad, a pesar de las mejoras significativas en los regímenes immunosupporessive. El objetivo de desarrollar un modelo murino de trasplante renal es replicar de cerca el proceso y la patología que se encuentra en el trasplante renal humano 4. Skoskiewicz et al. Describe primero el modelo murino de trasplante renal en 1973 5. Aunque se requieren habilidades de microcirugía avanzados, es una valiosa tool por varias razones: el genoma del ratón ha sido bien caracterizada y hay una gran variedad de métodos y técnicas disponibles para los estudios del ratón experimentales.
Muchos grupos utilizando el modelo de ratón de trasplante renal han utilizado el riñón trasplantado como un órgano que sustenta la vida, sin embargo, en otros estudios y en nuestra metodología descrita uno de los riñones naturales del ratón receptor se deja in situ durante la duración del experimento 4. El beneficio es que el ratón se somete a una única operación de la anestesia y reduciendo así la morbilidad para el ratón y el riesgo de muerte a partir de un segundo procedimiento. Además, el ratón no sufren de los efectos adversos de la insuficiencia renal progresiva.
Aunque existen modelos de rechazo alogénico en otros órganos tales como el corazón y la piel, estos no siempre son directamente relevantes para el trasplante renal. Hay evidencia de que estos modelos provocan diferentes modos y dymica de rechazo, por ejemplo, el curso de tiempo de rechazo de aloinjerto cardíaco y en aloinjerto renal difiere significativamente en ciertas combinaciones de deformación 6. Hemos descrito patrones de rechazo de aloinjerto renal aguda en donantes BALB / c en ratones FVB / NJ no transgénicos, este modelo mostró la lesión mediada celular con acumulación de células T y macrófagos 7. Alternativamente también hemos descrito un modelo de daño crónico del aloinjerto que exhibe la fibrosis intersticial y atrofia tubular, esto resulta de trasplante de un riñón de ratones C57BL / 6 BM12 donantes C57BL / 6 en los destinatarios, ya que estos ratones se caracterizan por una sola MIS loci MHC de clase II -match 8.
Múltiples aspectos del trasplante han sido estudiados utilizando el modelo murino de trasplante renal, incluyendo rechazo agudo, rechazo celular y humoral, lesión de reperfusión de isquemia, y probando nuevos agentes terapéuticos. Hemos modificado el t quirúrgicaechnique para reducir el tiempo de operación y mejorar la facilidad de la cirugía. Particularmente hemos descrito donante simultánea y preparación de receptor y una técnica de anastomosis vascular simplificada mediante la utilización de una anastomosis aórtica parche continuo. Este video y manuscrito proporcionarán puntos clave para ayudar en el establecimiento de esta técnica.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Ética institucionales nacionales y locales apropiados deben estar en su lugar antes de realizar los experimentos con animales. Específicamente en el Reino Unido se llevaron a cabo los siguientes experimentos bajo los Animales (Procedimientos Científicos) de la Ley de 1986 Cuando dos microcirujanos están disponibles para funcionar a la vez que el cirujano donante debe realizar los pasos 1.1 a 1.16 luego 3.1 a 3.5, mientras que el cirujano realiza receptor 2.1 a 2.8 . Para un solo operador los pasos pueden ser seguidos secuencialmente.
1. Donantes Preparación
Nota: El procedimiento que aquí se presenta es un donante C57BL / 6 BM12 y el receptor C57BL / 6 ratones machos de edades comprendidas entre 8 y 16 semanas de edad con un peso corporal superior a 20 g. Sin embargo, este procedimiento se puede realizar de forma reproducible en una variedad de cepas de ratón. Los datos presentados en la sección de resultados representativos se obtuvieron de ratones C57BL / 6, C57BL / 6 y BM12, los cuales ratones BALB / c.
- Realizar procedimientos using instrumentos quirúrgicos estériles y consumibles (autoclave), con los esfuerzos para mantener la zona de trabajo lo más estéril posible. Realizar la preparación de donantes simultáneamente con la preparación destinatario si dos cirujanos están disponibles.
- Anestesiar al ratón con una inyección intraperitoneal (aguja 31G) de medetomidina (0,5 mg / kg) y clorhidrato de ketamina (200 mg / kg). Esto resulta en un plano anestésico que se mantiene durante 4 horas dando tiempo suficiente para que todo el procedimiento a realizar. Anestesia suplementaria no es necesario.
- Confirme que el ratón está anestesiado (sin respuesta a la pizca dedo del pie).
- Afeitarse el abdomen del ratón y eliminar los pelos sueltos con cinta adhesiva.
- Coloca el ratón sobre su espalda sobre una estera climatizada cubierta estéril y sin apretar inmovilizar las extremidades con cinta adhesiva estéril.
- Monitorear el ratón durante todo el procedimiento para las quemaduras térmicas. Si es posible utilizar una fuente de calor no eléctrico.
- Aplique un lubricante ocular y sanitize la pared abdominal con una solución de yodo diluido.
- Hacer una incisión en el abdomen para entrar en la cavidad peritoneal e inserte un 3 cm Calibri retractor abdominal.
- Aplicar solución salina calentada para mantener los intestinos y el área quirúrgica húmedo y evitar el secado innecesaria de las vísceras.
- Cubra el ratón con paños estériles y mover los intestinos a la izquierda del operador (el derecho del ratón) para exponer la aorta, la vena cava y el riñón izquierdo.
- Aplicar una pinza de trinquete hasta el estómago y tire superiormente para exponer los principales vasos y riñón izquierdo totalmente. Empaque amortiguar hisopos estériles (2 mm x 2 mm) en el abdomen para retraer los tejidos fuera de la zona de la cirugía, tales como los lóbulos hepáticos, vesículas seminales y de intestino.
- Aislar el riñón izquierdo de adventicia que rodea, la grasa y la glándula suprarrenal izquierda en la cavidad peritoneal por rodeos disección del tejido conectivo usando pinzas de punta fina. Coloque las puntas cerradas de la pinza entre las áreas que NEed a separar y lentamente permita que las puntas de fórceps para abrir disecar el espacio.
- Aislar la vena renal izquierda ligando y luego dividiendo la vena adrenal y la vena gonadal izquierda izquierda con 9 / O de nylon. Coloque la sutura cerca de la vena renal.
- Ligar y dividir el uréter con 7 / O sutura de seda cerca de la vejiga dejando la sutura termina de largo. Estos extremos largo de sutura se utilizarán cuando el riñón se cosecha y que sean necesarias para la anastomosis ureteral.
- Movilizar y diseccionar plenamente la aorta y la vena cava superior y inferior a la arteria y vena renal utilizar fórceps de punta fina para diseccionar sin rodeos vasos linfáticos y grasa de la parte frontal y los lados de los vasos.
- Encuentre el plano del tejido entre la aorta y la vena cava y propagarse lentamente las pinzas. Abra lentamente las puntas de la pinza de punta fina para extender el tejido con un mínimo trauma.
- Ate un flojo 7 / O de seda alrededor de la aorta superior e inferior de la arteria renal pasando un buen ángulopinzas de punta alrededor de la parte posterior de los vasos y dibujo una sutura a través. Estas suturas se harán más estrictas antes de la recuperación del riñón para permitir la perfusión retrógrada de la Universidad de Wisconsin solución.
2. destinatario Preparación
De acuerdo con el seguimiento de preparación de donantes pasos 1.2 a 1.8.
- Mover los intestinos a la derecha del operador (izquierda del ratón) para exponer la aorta, la vena cava. Cubra los intestinos con un bastoncillo empapado de solución salina estéril.
- Realizar una nefrectomía derecha por ligación de la arteria renal derecha y la vena junto con 7/0 sutura de seda y luego dividir.
- Ligar el uréter derecho con 7 / O sutura de seda y se dividen.
- Movilizar y diseccionar plenamente la aorta y la vena cava inferior a la arteria y la vena renal como se describe en el paso 1.14 y 1.15. Asegurar la disección completa entre la aorta y la vena cava. Tenga cuidado para preservar la arteria espermática interna que se extiende por delante de la vena cava y aortA junto con el paquete linfático.
- Identificar los vasos lumbares que se ejecutan en el retroperitoneo de la vena cava y la vena a la columna vertebral, se liga con 9 / O de seda en la continuidad, no hay necesidad de dividir los vasos.
- Identificar suficiente espacio para colocar pinzas microvasculares con espacio para entre anastomosis vasculares.
- Administrar heparina intravenosa (5 unidades) a través de la vena dorsal del pene.
Recuperación de riñón 3. Donantes
Apriete los lazos de seda 7 / S que se han colocado alrededor de la aorta inferior y superior para aislar el riñón de la circulación arterial.
- Infundir retrógradas frío desde 0,2 hasta 0,5 ml de solución de la Universidad de Wisconsin con una aguja (31G) en la aorta.
- Divida la aorta dentro de las suturas y dividir la vena renal en su unión con la vena cava para extraer el riñón y la arteria renal con una longitud de aorta. Divida vasos lumbares derivados de la aorta, si están presentes, wligadura ithout.
- Coloque el riñón en solución salina fría en un hisopo estéril en una placa de cultivo.
- La eutanasia el ratón donante por dislocación cervical.
4. Trasplante de Riñón - Kidney Preparación
- Crear un parche aórtico dividiendo la pared de la aorta longitudinalmente justo enfrente de la arteria renal. Identificar los lúmenes de los vasos en el parche que necesitan ser ligado o evitar cuando se realiza la anastomosis arterial.
- Colocar una sutura 10 de E / S del exterior al interior del lumen de la vena renal y superiormente una segunda sutura separada inferior. Las suturas utilizadas para dividir la vena adrenal y la vena gonadal se pueden utilizar para orientar la embarcación.
- Coloque el riñón en el flanco derecho del receptor (Figura 1.1) y asegurar las suturas están en condiciones de garantizar las anastomosis vasculares se pueden completar sin las suturas se entrelaza en hisopos u otros instrumentos.
5. riñón Transplantación - Vascular Anastomosis
Aplicar pinzas microvasculares primera inferiormente a continuación abarcan superiormente la vena cava y la aorta.
- Hacer un ventomy con una aguja (31G) por punción de la pared anterior de la vena cava. Flush sangre de la vena cava mediante la inyección de aproximadamente 50 l de 0,9% de NaCl.
- Ampliar el venotomía usando fórceps de punta fina mediante la apertura de ellos dentro de la venotomía manera que la longitud es equivalente al diámetro de la vena renal del donante.
- Coloque la sutura superiores 10 de E / S (que ya está en el lumen de la vena renal) primero en el vértice de la venotomía (Figura 1.2) y unirse a la pared posterior de la anastomosis en una sutura continua hasta que se alcanza el ápice inferior (figura 1.3).
- Coloque el 10 de E / S de sutura inferior y atar primero con un solo nudo (Figura 1.4) luego atar a la sutura que va desde la pared trasera.
- Uso de la sutura inferior crear el Wal frentel de la anastomosis (Figura 1.5) con una sutura continua y atar al extremo de sutura superior en el vértice superior, (Figura 1.6).
- Crear una aortotomía recogiendo la pared de la aorta con una pinza y corte un parche elíptico con tijeras (aproximadamente el aortotomía debe ser una quinta parte de la circunferencia de la aorta y tres veces la luz de la arteria renal de longitud).
- Coloque una sutura de 10 E / S en el punto superior del parche aórtico del exterior al interior (Figura 1.7) y pasar a través de la aorta para empatar fuera de los vasos en el vértice superior de la aortotomía.
- Cree la anastomosis arterial con una sutura continua de comenzar superiormente (Figura 1.8) anastomosando el parche de donantes a la aorta destinatario, tenga cuidado de no constreñir la anastomosis mediante la vinculación de la sutura demasiado apretado (Figura 1.9).
- Retire las abrazaderas vasculares inferiores primero y luego la pinza superior a reperfundir el riñón (Figura 1.10 y 1.11). Peristaltismo visible del uréter tal vez visto si se logra el suministro adecuado de sangre al uréter.
6. Trasplante de Riñón - Anastomosis ureteral
- Divida los archivos adjuntos de la vejiga de la pared abdominal.
- Pasar una aguja (21G) de izquierda a derecha de la vejiga a través de ambas paredes.
- Coloque puntas de fórceps rectos en el lumen de la aguja y pasar tanto a través de la vejiga de tal manera que las pinzas están pasando ahora de derecha a izquierda de la parte izquierda de la vejiga.
- Dibujar la sutura en el uréter donante a través de la vejiga de tal manera que el uréter pasa en el defecto de la vejiga izquierda y luego fuera del lado derecho.
- Suturar la adventicia del uréter a la adventicia de la vejiga con tres suturas interrumpidas simples alrededor del punto de entrada con 9 / O sutura de nylon en una aguja de cuerpo redondo.
- Cortar el uréter proximal a la ligadura, abriendo así ªe uréter para permitir que la orina fluya y permitir que el extremo uréter se retraiga en el cuerpo de la vejiga. Visible producción de orina se puede observar a lo largo de con hemorragia de los vasos peri-ureteral.
- Cierre el defecto de la vejiga lado derecho con un solo interrumpido 9 / O sutura de seda.
7. Recuperación y Cuidado Postoperatorio
Vuelva a colocar las vísceras gastrointestinal en el abdomen en su orientación original y cierre de la pared abdominal mediante la aproximación de los músculos rectos con 6 E / S de sutura absorbible.
- Aproximar la piel con clips de la piel metálica.
- Parcialmente invertir la anestesia con una inyección subcutánea de hidrocloruro de atipamazol (10 l / g).
- Administrar analgesia por vía subcutánea hidrocloruro de buprenorfina (0,05 mg / kg) y para la inyección de fluido de soporte 1 ml de NaCl al 0,9% por vía subcutánea.
- Recuperar el ratón en un armario de calentamiento a 28 ° C durante 24 a 48 horas. Observe el ratón para la enfermedad hasta elfinalización del experimento.
- Retire los clips de la piel metálica 7 - 10 días después de la operación.
- Una vez que el experimento se ha completado la eutanasia el ratón por dislocación cervical.
- Retire y recoger el riñón contralateral y aloinjerto para el análisis histológico.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Rechazo de aloinjerto renal puede ser evaluada por análisis histológico de parafina embebido en secciones de tejido fijadas con methacarn del riñón trasplantado (Figura 2). El trasplante de riñones entre isoinjerto resultados ratones singénicos en la lesión por reperfusión isquémica renal, sin embargo por 4 semanas, los túbulos se han recuperado y son histológicamente comparables a los riñones nativos. El rechazo agudo puede ser modelado por C57BL / 6 trasplante de riñón en receptores BALB / c, dentro de 1 semana hay difusa infiltración de células mononucleares en todo el parénquima renal, que implica el intersticio, glomérulos y los túbulos. Daño crónico del aloinjerto puede ser modelado por C57BL / 6 BM12 riñones trasplantados en ratones C57BL / 6 destinatarios, esto resulta en las características típicas encontradas en la patología humana que consiste en la fibrosis intersticial y la pérdida túbulo gradual. Recuento bruto túbulo por de alta potencia de campo (aumento x 200) permite la cuantificación de la masa de nefronas funcionales (Fifigura 3), la pérdida de túbulos refleja lesión tubular debido al rechazo. Fibrosis intersticial pueden identificarse utilizando la pan-colágeno rojo picrosirius mancha (Figura 4). Se observa colágeno endógena normal, sin embargo durante daño crónico nuevo colágeno se deposita dando lugar a fibrosis progresiva. El daño crónico se hace evidente entre 8 y 12 semanas después del trasplante (Figura 5).
Una curva de aprendizaje significativo debe superarse con el fin de establecer el modelo (Figura 6). Se estima que 40 procedimientos se realizaron en ratones recuperado antes de un tiempo anastomosis vascular reproducible se alcanzó con la supervivencia libre de complicaciones aceptable. La razón más común para la eutanasia el ratón era debido a la parálisis de la extremidad posterior secundaria a miembros inferiores y la isquemia de la médula espinal relacionado con trombosis arterial, sin embargo en nuestra experiencia heparization sistémica reduce la incidencia de esta. Los ratones fueron rutinariamente monitored según los criterios acordados a nivel local para la terminación de los experimentos. Experimentos de supervivencia realizados en la fase de meseta de la curva de aprendizaje resultó en un tiempo anastomosis vascular media de 28,9 ± 0,47 min.
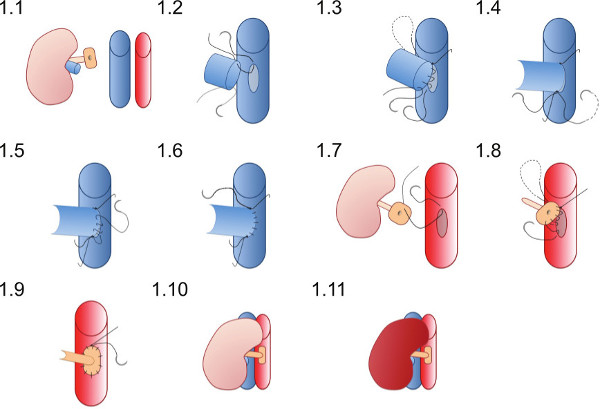
Figura 1. Representación esquemática de la técnica de anastomosis vascular. El riñón del donante se coloca en el flanco derecho del ratón receptor. La vena renal del donante se anastomosa en forma de extremo a extremo y de la arteria renal de donante en un parche de aorta se anastomosa a la aorta destinatario.

Figura 2. lesión tubular histológico Representante en el riñón trasplantado. Después de la fijación en los tejidos de la solución de metil Carnoyl fueron embebidos en parafinasecciones de tejido de aleta y de 4 micras fueron teñidas por hematoxilina y eosina. A las 4 semanas después del trasplante isoinjerto riñones no presentan lesión tubular y son comparables a los riñones naturales en apariencia. C57BL / 6 BM12 riñones trasplantados en receptores BALB / c se someten a rechazo de aloinjertos agudo con infiltrados difusos de células mononucleares (*) y los túbulos necróticas (**) y tubulitis. C57BL / 6 BM12 riñones trasplantados en ratones C57BL / 6 resultados en daño crónico del injerto que se caracteriza por infiltrados linfocitarios perivasculares (bloque de flecha ⬆) y la fibrosis intersticial y atrofia tubular (flechas huecas ⇧). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Cuantificación de lesión tubular en el tr riñón ansplanted. túbulos saludables (definida por la presencia de una membrana intacta sótano, luz del túbulo intactos, el volumen citoplásmico saludable y un microvellosidades apicales borde en cepillo mantenido) que refleja el funcionamiento masa de nefronas puede cuantificarse contando el número promedio de túbulos por campo (magnificación x200 ) (n = 6, media de 10 campos consecutivos, ** p <0,01).

Figura 4. daños crónica del injerto puede ser identificado por la fibrosis intersticial (imágenes representativas). Colágeno deposición dentro del riñón trasplantado es evidente por la detección de picrosirius tinción roja de colágeno. Por favor haga clic aquí para ver una versión más grande de esta figura.
gura 5 "src =" / files / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figura 5 La cuantificación de la fibrosis intersticial. Fibrosis intersticial medido por picrosirius positividad rojo se eleva en C57BL / 6BM12 ⇒ C57BL / 6 destinatarios doce semanas después del trasplante (n = 6, promedio de 10 campos consecutivos, ** p <0,01, * p < 0,05).

Figura 6. curva de aprendizaje. Experimentos de no recuperación iniciales en ratones anestesiados terminal se realizaron para desarrollar la técnica quirúrgica. Esto fue seguido por experimentos de recuperación para conseguir un riñón trasplantado con éxito re-perfundido con un ratón sobrevivir sin complicaciones.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La manera más bien descrito para realizar la anastomosis arterial es utilizar la aorta distal del donante, con la arteria renal en la continuación, de una manera de extremo a lado a la aorta destinatario. Se describe el uso de un parche de aorta, similar a la creación de reflejo 'Carrell parche' que lleva a cabo en el trasplante de riñón humano que creemos que es más conveniente. Aunque los informes en la literatura de donante y receptor operativo de tiempo son escasos creemos que la utilización de un parche aórtico hasta aorta destinatario en lugar de la aorta del donante de extremo a lateral a la aorta destinatario es preferible. El uso de un parche niega la necesidad de diseccionar todas las ramas aórticas de donantes lumbar, y también el tiempo necesario para ligarlos individualmente, como anastomosis de un parche excluye, naturalmente, estos.
Los pasos críticos para lograr este modelo incluyen tener cuidado para asegurarse de que no hay otros lúmenes arteriales distintos de la arteria renal dentro de la anastomosis arterial parche ya quese escapará cuando se quitan pinzas microvasculares. Las suturas que construyen las anastomosis se pueden atar firmemente pero ser conscientes del efecto en bolsa de tabaco que pueden reducir la anastomosis y causa isquemia o inhibir que el flujo de sangre, en la practicidad, hemos observado que proporcionó la aortotomía elíptica es de tamaño suficiente el cordón de bolsa no se encontró efecto. El venotomía se hace con una aguja a continuación, ampliado por el estiramiento con pinzas, creemos que esto es preferible a la de corte como el estiramiento con pinzas crea un anillo de tejido venoso que se puede ver fácilmente y sutura ayuda para crear una anastomosis estable. La anastomosis ureteral a la vejiga es un componente muy importante a considerar, abogamos por la técnica descrita aquí en vez de una vejiga de cúpula de la vejiga re-construcción que se ha asociado con la pérdida de orina y la estenosis ureteral presumiblemente debido isquemia. Nuestra técnica descrita permite una longitud ureteral donante más corto para ser utilizado como se anastomosa directamente a la Bladder 5. Mediante la utilización de estas mejoras técnicas que hemos sido capaces de reducir significativamente la cantidad de tiempo requerido para completar este modelo experimental. De hecho, con dos operarios trabajando simultáneamente cinco receptores de trasplante se puede realizar por día, con tiempo suficiente para permitir la recuperación y seguimiento de los ratones.
Una limitación importante del modelo descrito y la técnica en este trabajo es que el ratón se queda con uno de sus riñones nativos en situ de tal manera que el ratón no depende de riñón para sobrevivir. Algunos autores han informado de la eliminación de la segunda riñón nativo inmediatamente en el momento del trasplante o cinco a diez días después del trasplante, dejando así el ratón dependiente del riñón trasplantado. Esto permitiría la supervivencia para ser utilizado como un resultado experimental, así como tomar muestras de sangre para medir los marcadores de la función renal tales como la creatinina sérica o urea en sangre. Sin embargo no hay ninguna diferencia en los resultados histológicoscuando se comparan ratones dependientes del aloinjerto y aquellos con un solo riñón nativo 9. Nuestro protocolo descrito no se opone a esto y de hecho el segundo riñón nativo podrían ser eliminados en un intervalo de tiempo dado. Una limitación adicional es que se requiere conocimientos avanzados micro-quirúrgico para realizar una anastomosis arterial y venosa, aunque con la formación y mediante la utilización de la figura técnica para la instrucción de esto se puede superar. Pueden ocurrir complicaciones vasculares, siendo estos trombosis de la arteria o vena renal, esto se traduce invariablemente en el ratón que muestra signos de angustia, mala salud o específicamente la parálisis de las extremidades posteriores. Por lo tanto estricta gobernanza y la supervisión de los ratones es imprescindible cuando se utiliza este modelo.
El rechazo agudo del trasplante renal en gran medida ha sido tratada por la terapia de inmunosupresión y la inducción agotan los linfocitos circulantes, sin embargo episodios de rechazo mediado por células todavía pueden ocurrir a través de los injertos renalesla vida. Por lo tanto, los estudios sobre los mecanismos que subyacen a esta siguen siendo pertinentes y pueden identificar nuevas vías para el tratamiento. En completo desajuste MHC, tales como C57BL / 6 en ratones BALB / c, significa depende de la supervivencia de trasplante de riñón se ha informado a ser tan bajo como 7,4 días 10. Histológicamente rechazo celular y vascular agudo puede ser identificado por la infiltración linfocítica, hemorragia y edema en el intersticio, tubulitis, vasculitis, con necrosis glomerular y tubular. Los procesos combinados contribuyen al daño crónico del aloinjerto han hecho de esta zona difícil de estudiar. Las características histológicas incluyen fibrosis intersticial, atrofia tubular, glomeruloesclerosis y la proliferación de la íntima. La lesión progresiva se asocia con la persistencia de infiltración de células T, sin embargo, es cada vez más apreciado que muchos otros factores pueden estar involucrados. Medie potenciales de lesión persistente incluyen la deposición del complemento debido a los anticuerpos específicos del donante, las células B, células asesinas naturales, macrófagos, y células intrínsecas al injerto, tales como el endotelio 3. Por lo tanto, este modelo permite el estudio de estas diversas facetas de rechazo.
Ha habido cerca de 70 estudios publicados que utilizaron este modelo a pesar de su temprana descripción 4, esto es, en comparación con modelos de ratón de la lesión por isquemia-reperfusión del riñón donde se han producido varios cientos de artículos. La importancia de este modelo de ratón de trasplante renal intra-abdominal es que recrea directamente el proceso de trasplante de riñón humano, además, se beneficia de la utilización de cepas de ratón endogámicas bien definidos que se puede utilizar para modelar diferentes mecanismos de rechazo. De ahí que los estudios que utilizan este modelo son muy traducible. Otras aplicaciones futuras de este modelo incluyen el estudio de anomalías renales intrínsecas mediante el trasplante de riñones con fenotipos específicos de los modelos knockout en ratones de tipo salvaje o por el contrario los riñones de tipo salvaje en genéticamentereceptores alterados.
Este modelo se puede replicar con éxito el proceso de trasplante renal humano. El uso de cepas puras ratón permite la selección de combinaciones entre donantes y receptores de diversa diferencias MHC. Además, el uso de ratones permite el uso de diversas técnicas que incluyen knockout y sistemas inducibles para sondear los diferentes aspectos de rechazo.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
La financiación procedente del riñón Research UK, el Colegio Real de Cirujanos de Edimburgo y de la Sociedad Europea de Trasplante de Órganos apoyó este estudio.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



