Introduction
Transplantation rénale réussie pour le traitement de l'insuffisance rénale a été décrite pour la première en 1955 entre jumeaux monozygotes 1, depuis lors, il est devenu un traitement révolutionnaire destiné aux patients en phase terminale d'insuffisance rénale à travers le monde, offrant à la fois une amélioration de la longueur et de la qualité de la vie 2. Cependant la survie du greffon à long terme a été entravée par une multitude de processus pathologiques entraînant des dommages de l'allogreffe chronique 3.
Rejet du rein transplanté chez l'homme reste une cause majeure de morbidité, en dépit des améliorations significatives dans les régimes immunosupporessive. Le but de l'élaboration d'un modèle de souris de la transplantation rénale est de répliquer au plus près le processus et la pathologie trouvé dans la transplantation rénale humaine 4. Skoskiewicz et al. Décrit d'abord le modèle de souris de la transplantation rénale en 1973 5. Bien compétences de microchirurgie de pointe sont nécessaires, il est un objet de valeur tool pour plusieurs raisons: le génome de la souris a été bien caractérisé et il ya une grande variété de méthodes et de techniques disponibles pour les études de souris expérimentales.
De nombreux groupes en utilisant le modèle de souris de la transplantation rénale ont utilisé le rein transplanté comme un organe qui soutient la vie, mais dans d'autres études et dans notre méthodologie décrite une des reins natif de la souris receveuse est laissé en place pendant la durée de l'expérience 4. L'avantage est que la souris soumise à une anesthésie et opération unique en réduisant ainsi la morbidité de la souris et le risque de décès d'une deuxième procédure. En outre, la souris ne présente pas les effets négatifs de l'insuffisance rénale progressive.
Bien que les modèles de rejet allogénique existent dans d'autres organes tels que le cœur et la peau, ce ne sont pas toujours directement applicables à la transplantation rénale. Il existe des preuves que ces modèles suscitent différents modes et dynamique de rejet, par exemple au cours du temps de rejet dans l'allogreffe cardiaque et allogreffe rénale diffère de manière significative dans certaines combinaisons de contrainte 6. Nous avons décrit les modèles de rejet d'allogreffe rénale aiguë chez les BALB / c donateurs dans des souris FVB / nj non-transgéniques, ce modèle a montré une blessure à médiation cellulaire avec accumulation de macrophages et les cellules T 7. Sinon, nous avons décrit un modèle d'endommagement chronique de l'allogreffe qui présente une fibrose interstitielle et atrophie tubulaire, cela résulte de la transplantation d'un rein de souris C57BL / 6 BM12 donneurs dans des souris C57BL / 6 destinataires, que ces souris sont caractérisées par une seule CMH de classe II mis loci -match 8.
Plusieurs aspects de la transplantation ont été étudiés en utilisant un modèle de souris de la transplantation rénale, y compris le rejet aigu, le rejet humoral et cellulaire, une lésion de reperfusion de l'ischémie, et trialing nouveaux agents thérapeutiques. Nous avons modifié la t chirurgicaleechnique pour réduire le temps de fonctionnement et d'améliorer la facilité de la chirurgie. En particulier, nous avons décrit la préparation simultanée et donneur de destinataire et une anastomose vasculaire simplifié par l'utilisation d'un patch anastomose aortique continu. Cette vidéo et manuscrit fourniront des points clés pour aider à la mise en place de cette technique.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Éthique institutionnels appropriés nationales et locales devraient être en place avant de procéder à des expérimentations animales. En particulier au Royaume-Uni, les expériences suivantes ont été réalisées dans le cadre des Animaux (Scientific Procedures) Act 1986 Lorsque deux microchirurgiens sont disponibles pour faire fonctionner simultanément le chirurgien des bailleurs de fonds doit exécuter les étapes 1.1 à 1.16 puis 3.1 à 3.5, tandis que le chirurgien bénéficiaire effectue de 2,1 à 2,8 . Pour un seul opérateur les étapes peuvent être suivies successivement.
1. donateurs Préparation
Remarque: La procédure présentée ici est un donneur C57BL / 6 BM12 et le destinataire souris C57BL / 6 mâles âgés de 8 à 16 semaines avec un poids supérieur à 20 g. Toutefois, cette procédure peut être effectuée de manière reproductible sur une variété de souches de souris. Les données présentées dans la section des résultats représentatifs ont été obtenues à partir de souris C57BL / 6, souris C57BL / 6 / c BM12 et BALB.
- procédures de conduite using instruments chirurgicaux stériles et consommables (autoclave), avec s'efforce de maintenir la zone d'exploitation aussi stérile que possible. Effectuer la préparation des bailleurs de fonds en même temps que la préparation du destinataire si deux chirurgiens sont disponibles.
- Anesthésier les souris avec une injection intrapéritonéale (aiguille 31G) de médétomidine (0,5 mg / kg) et du chlorhydrate de kétamine (200 mg / kg). Il en résulte un plan anesthésique qui est maintenue pendant 4 h fournissant suffisamment de temps pour l'ensemble de la procédure à exécuter. Anesthésie supplémentaire n'est pas nécessaire.
- Assurez-vous que la souris est anesthésiée (pas de réponse à pincement de l'orteil).
- Raser l'abdomen de la souris et de supprimer toute cheveux dénoués avec du ruban adhésif.
- Placez la souris sur le dos sur un tapis chauffant stérile et drapé lâche immobiliser les membres avec du ruban de masquage stérile.
- Surveiller la souris tout au long de la procédure pour des brûlures thermiques. Si possible utiliser une source de chaleur non-électrique.
- Appliquer un lubrifiant oculaire et sanitize la paroi abdominale avec une solution diluée d'iode.
- Faire une incision médiane dans l'abdomen pour pénétrer dans la cavité péritonéale et insérer un 3 cm Calibri écarteur abdominal.
- Appliquer une solution saline chauffée à garder les intestins et zone chirurgicale humide et éviter le dessèchement inutile des viscères.
- Couvrir la souris avec des champs stériles et déplacer les intestins à la gauche de l'opérateur (droit de la souris) pour exposer l'aorte, la veine cave et rein gauche.
- Appliquer une pince à cliquet à l'estomac et tirez supérieurement à exposer les principaux vaisseaux et rein gauche complètement. Emballage humide écouvillons stériles (2 mm x 2 mm) dans l'abdomen pour rétracter les tissus de la zone chirurgicale, comme les lobes du foie, des vésicules séminales et des intestins.
- Isoler le rein gauche de adventia environnante, la graisse et la glande surrénale gauche dans la cavité péritonéale par crûment la dissection du tissu conjonctif à l'aide de fines pinces de pointe. Placez les pointes fermées de la pince entre les zones NEed à séparer et laisser lentement les conseils de pince pour ouvrir à disséquer l'espace.
- Isoler la veine rénale gauche par ligature, puis en divisant la veine surrénale gauche et gauche veine gonadique avec 9 / O nylon. Placez la suture près de la veine rénale.
- Ligaturer et diviser l'uretère avec 7 / O soie suture près de la vessie laissant la suture se termine longue. Ces longues extrémités de suture seront utilisés lorsque le rein est récoltée et qui sont nécessaires pour l'anastomose urétérale.
- À mobiliser et à disséquer complètement l'aorte et la veine cave inférieure en haut et à l'artère et la veine rénales utiliser pince fine pointe de disséquer carrément vaisseaux lymphatiques et de la graisse de l'avant et les côtés des navires.
- Trouver le plan du tissu entre l'aorte et la veine cave et répartis lentement la pince. Ouvrir lentement les conseils de la pince à pointe fine pour répandre le tissu avec un traumatisme minime.
- Faire un lâche 7 / O soie autour de l'aorte supérieur et inférieur de l'artère rénale en passant une amende anglepince pointe dans le dos des navires et de dessin une suture à travers. Ces sutures seront resserrées avant le prélèvement de rein pour permettre la perfusion rétrograde de l'Université du Wisconsin solution.
2. bénéficiaire Préparation
Comme par le suivi de la préparation des bailleurs de fonds les étapes 1.2 à 1.8.
- Déplacez les intestins à la droite de l'opérateur (la gauche de la souris) pour exposer l'aorte, la veine cave. Couvrir les intestins avec une solution saline stérile tige imbibé.
- Effectuer une néphrectomie droite par ligature de l'artère rénale droite et la veine avec 7/0 suture de soie, puis diviser.
- Ligaturer l'uretère droit avec 7 / O suture de soie et de partage.
- Mobiliser et disséquer complètement l'aorte et la veine cave inférieure à l'artère et la veine rénales comme décrit à l'étape 1.14 et 1.15. Veiller à dissection complète entre l'aorte et la veine cave. Prenez soin de préserver l'artère spermatique interne qui fonctionne antérieure à la veine cave et Aortavec un faisceau lymphatique.
- Identifier les vaisseaux lombaires s'étendant dans le rétropéritoine de la veine cave et la veine de la colonne vertébrale, ligaturer avec 9 / O soie dans la continuité, il n'est pas nécessaire de diviser les navires.
- Identifier suffisamment d'espace pour placer des pinces microvasculaires avec un espace entre des anastomoses vasculaires.
- Administrer par voie intraveineuse d'héparine (5 unités) par pénienne dorsale veine.
3. rein de donneur de récupération
Resserrer les liens 7 / S de soie qui ont été placées autour de l'aorte inférieur et supérieur pour isoler les reins de la circulation artérielle.
- Infuser rétrogrades froid 0,2 à 0,5 ml de solution de l'Université du Wisconsin avec une aiguille (31G) dans l'aorte.
- Diviser l'aorte dans les sutures et diviser la veine rénale à sa jonction avec la veine cave pour retirer le l'artère rénale avec une longueur de l'aorte et des reins. Diviser les vaisseaux lombaires résultant de l'aorte, s'ils sont présents, en poidsithout ligature.
- Placez le rein dans une solution saline froide sur un écouvillon stérile dans une boîte de culture.
- Euthanasier la souris donneuse par dislocation cervicale.
4. transplantation rénale - Kidney Préparation
- Créer une pièce aortique en divisant la paroi de l'aorte longitudinalement en face de l'artère rénale. Identifier toutes les lumières des navires dans le patch qui doivent être ligaturé ou évités lors de la réalisation de l'anastomose artérielle.
- Placer une suture 10 / S de l'extérieur vers l'intérieur de la lumière de la veine rénales en haut et un second fil de suture séparé le bas. Les sutures utilisées pour diviser la veine surrénale et la veine gonadique peuvent être utilisés pour orienter le récipient.
- Placez le rein dans le flanc droit du bénéficiaire (Figure 1.1) et s'assurer que les sutures sont bien placés pour assurer anastomoses vasculaires peuvent être menées à bien sans les sutures devenir enlacés dans les écouvillons ou d'autres instruments.
5. rein Transplanmise - vasculaire anastomose
Appliquer pinces microvasculaires abord le bas puis englobant supérieurement la veine cave et l'aorte.
- Ajouter un ventomy avec une aiguille (31G) en perforant la paroi antérieure de la veine cave. Rincer le sang de la veine cave par injection d'environ 50 pi de NaCl à 0,9%.
- Élargir la Phlebotomie en utilisant de fines pinces d'extrémité en les ouvrant à l'intérieur de la Phlebotomie de sorte que la longueur est équivalente au diamètre de la veine rénale du donneur.
- Placer la suture supérieure 10 d'E / S (qui est déjà dans la lumière de la veine rénale) d'abord au niveau du sommet de la Phlebotomie (figure 1.2) et de rejoindre la paroi arrière de l'anastomose en un fil de suture en cours d'exécution jusqu'à ce que le sommet inférieur est atteint (figure 1.3).
- Placez le 10 / O suture inférieure et attachez d'abord avec un seul nœud (Figure 1.4), puis attacher à la suture allant de la paroi arrière.
- Utilisation de la suture inférieure créer l'avant wall de l'anastomose (Figure 1.5) par un surjet et attacher à la fin de suture supérieure au sommet supérieur (Figure 1.6).
- Créer un aortotomie en décrochant le paroi de l'aorte avec une pince et couper une pièce elliptique avec des ciseaux (environ la aortotomie devrait être un cinquième de la circonférence de l'aorte et trois fois la lumière de l'artère rénale en longueur).
- Placez un fil de suture 10 / O au point supérieur du patch aortique de l'extérieur vers l'intérieur (Figure 1.7) et passer à travers l'aorte pour attacher à l'extérieur des bâtiments au sommet supérieur de la aortotomie.
- Créer l'anastomose artérielle par un surjet à partir supérieurement (Figure 1.8) anastomose le patch des bailleurs de fonds à l'aorte bénéficiaire, prendre soin de ne pas resserrer l'anastomose en liant la suture trop serré (Figure 1.9).
- Retirer les pinces vasculaires inférieures d'abord, puis la pince supérieure à la reperfusion du rein (Figure 1.10 et 1.11). Péristaltisme visible de l'uretère peut-être vu si l'approvisionnement en sang adéquat à l'uretère est atteint.
6. transplantation rénale - anastomose urétérale
- Diviser les pièces jointes de la vessie à partir de la paroi abdominale.
- Passer une aiguille (21G) de gauche à droite de la vessie par deux murs.
- Placez conseils de pince droite dans la lumière d'aiguilles et de passer à la fois à travers la vessie tels que les pinces passent maintenant de droite à gauche sur le côté gauche de la vessie.
- Dessiner la suture sur l'uretère des donateurs à travers la vessie tels que l'uretère passe dans le défaut de la vessie gauche, puis sur le côté droit.
- Suturer l'adventice de l'uretère à l'adventice de la vessie avec trois points séparés simples autour du point d'entrée avec 9 / O nylon suture sur une aiguille ronde valides.
- Couper l'extrémité proximale de l'uretère à la ligature, e ouvrant ainsie uretère pour permettre à l'urine de s'écouler et permettre à l'extrémité de l'uretère à se rétracter dans le corps de la vessie. Production visible de l'urine peut être observé avec des saignements de péri-uretère navires.
- Fermez le droit défaut de la vessie de côté avec une seule interruption de 9 / O soie suture.
7. Récupération et soins post-opératoires
Remplacer les viscères gastro-intestinal dans l'abdomen dans leur orientation d'origine et fermer la paroi abdominale en rapprochant les muscles droits avec 6 / O fil résorbable.
- Se rapprocher de la peau avec des clips de la peau de métal.
- Inverser partiellement l'anesthésie par une injection sous-cutanée de chlorhydrate atipamazole (10 ul / g).
- Administrer analgésie par le chlorhydrate de buprénorphine sous-cutanée (0,05 mg / kg) et de l'injection du fluide de support sous-cutanée de 1 ml de NaCl à 0,9%.
- Récupérer la souris dans une armoire chauffante à 28 ° C pendant 24 à 48 heures. Observez la souris pour maladie jusqu'à lafin de l'expérience.
- Retirer les clips de la peau de métal 7 - 10 jours après l'opération.
- Une fois l'expérience terminée euthanasier la souris par dislocation cervicale.
- Retirer et recueillir les controlatéral rein et allogreffe pour l'analyse histologique.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Le rejet d'allogreffe rénale peut être évaluée par une analyse histologique de coupes de tissus fixés Methacarn paraffine du rein transplanté (figure 2). Transplantation de reins isogreffe entre les résultats des souris syngéniques dans les lésions de reperfusion ischémique rénale, mais de 4 semaines, les tubules ont récupéré et sont histologiquement comparable à reins natifs. Le rejet aigu peut être modélisé par les souris C57BL / 6 dans des receveurs de transplantation rénale de souris BALB / c, pendant 1 semaine, il est diffus infiltration de cellules mononucléaires dans tout le parenchyme rénal, impliquant l'interstitium, les glomérules et les tubules. Dégâts d'allogreffe chronique peut être modélisé par C57BL / 6 BM12 reins transplantés dans des souris C57BL / 6 destinataires, il en résulte les caractéristiques typiques trouvés dans la pathologie humaine constitué de la fibrose interstitielle et une perte progressive de tubule. Nombre de tubule brut par haute puissance champ (x200 grossissement) permet de quantifier la masse de néphrons fonctionnels (Figure 3), la perte des tubules reflète lésion tubulaire due à un rejet. Fibrose interstitielle peut être identifié à l'aide du pan-collagène tache picrosirius rouge (Figure 4). Collagène endogène normale est observé, toutefois, au cours des dommages chroniques nouveau collagène est déposé entraînant de la fibrose progressive. Les dommages chronique apparaît entre 8 et 12 semaines après la transplantation (figure 5).
Une courbe d'apprentissage significatif doit être surmontée afin d'établir le modèle (figure 6). On estime à 40 procédures ont été réalisées chez la souris récupéré avant un temps d'anastomose vasculaire reproductible a été conclu avec la survie acceptable sans complications. La raison la plus commune pour euthanasier la souris devait paralysie des membres postérieurs secondaire à des membres inférieurs et l'ischémie de la moelle épinière liées à la thrombose artérielle, mais dans notre expérience heparization systémique réduit l'incidence de cette. Les souris étaient systématiquement monitored selon des critères convenus au niveau local pour mettre fin à l'expérimentation. expériences de survie réalisées dans la phase de plateau de la courbe d'apprentissage ont donné lieu à un temps d'anastomose vasculaire moyenne de 28,9 ± 0,47 min.
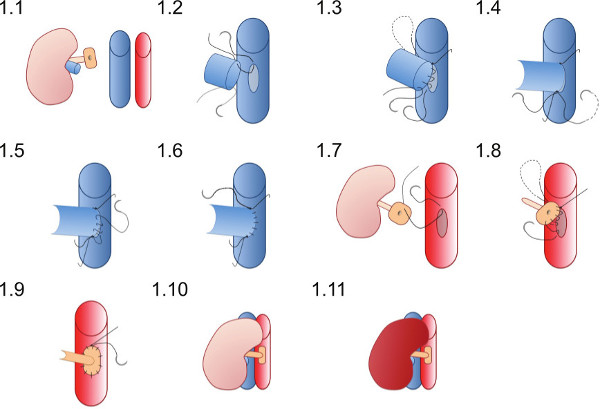
Figure 1: Représentation schématique de la technique d'anastomose vasculaire. L'rein de donneur est placé dans le flanc droit de la souris receveuse. La veine rénale du donneur est anastomosée dans un mode de bout à l'autre et l'artère rénale du donneur sur un patch de l'aorte est anastomosée à l'aorte destinataire.

Figure 2: Représentant lésion tubulaire histologique dans le rein transplanté. Après fixation dans les tissus de la solution de méthyle Carnoyl ont été intégrés dans paraffinesections d'ailettes et de tissus de 4 um ont été colorées par hématoxyline et éosine. À 4 semaines après la transplantation isogreffe reins ne présentent pas de lésion tubulaire et sont comparables aux reins natifs dans l'apparence. C57BL / 6 BM12 reins transplantés dans receveurs BALB / c subissent le rejet aigu d'allogreffe avec infiltrats diffus de cellules mononucléaires (*) et les tubules nécrotiques (**) et tubulite. C57BL / 6 BM12 reins transplantés dans des souris C57BL / 6 entraîne des dommages chroniques d'allogreffe caractérisé par des infiltrats lymphocytaires périvasculaires (bloc de direction ⬆) et la fibrose interstitielle et atrophie tubulaire (flèches creuses ⇧). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3 Quantification de lésion tubulaire dans le tr rénale ansplanted. tubules santé (définie par la présence d'une membrane intacte sous-sol, lumière du tubule intactes, le volume cytoplasmique sain et un microvillosités apicales bordure en brosse maintenu), reflétant le fonctionnement de masse des néphrons peut être quantifiée en comptant le nombre moyen de tubes par champ (x200 grossissement ) (n = 6, moyenne des 10 champs consécutifs, ** p <0,01).

Figure 4 de dommages de l'allogreffe chronique peut être identifié par une fibrose interstitielle (images représentatives). Dépôt de collagène dans le rein transplanté est évident par la détection de picrosirius coloration rouge de collagène. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
gure 5 "src =" / files / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figure 5 La quantification de la fibrose interstitielle. D'une fibrose interstitielle mesurée par picrosirius positivité rouge est soulevée dans des souris C57BL / 6BM12 ⇒ C57BL / 6 destinataires douze semaines après la transplantation (n = 6, moyenne des 10 champs consécutifs, ** p <0,01, * p < 0,05).

Figure 6 courbe d'apprentissage. D'expériences non-redressement initial des souris terminale anesthésiés ont été réalisées pour développer la technique chirurgicale. Cela a été suivi par des expériences de récupération pour atteindre un rein transplanté avec succès re-perfusion avec une souris survivre sans complications.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La manière la plus bien décrites pour effectuer l'anastomose artérielle est d'utiliser l'aorte distale du donneur, à l'artère rénale dans le prolongement, d'une manière bout à l'autre de l'aorte destinataire. Nous décrivons l'utilisation d'un correctif de l'aorte, similaire à la mise en miroir 'Carrell patch' qui a effectué la transplantation de rein humain que nous croyons être plus pratique. Bien que les rapports de la littérature du donneur et du receveur opératoire temps sont rares, nous croyons que l'utilisation d'une pièce à l'aorte aorte destinataire à la place de l'aorte du donneur fin à côté de l'aorte destinataire est préférable. Utilisant un patch nie la nécessité de disséquer toutes les branches de l'aorte lombaire donateurs, et aussi le temps nécessaire pour les ligaturer individuellement, comme l'anastomose un patch exclut naturellement ceux-ci.
Les étapes critiques pour atteindre ce modèle était de prendre soin de veiller à ce qu'il n'y ait pas d'autres lumières artérielles autres que l'artère rénale dans l'anastomose patch artérielle comme ilsfuira aux micro-vasculaire pinces sont supprimés. Les sutures construire les anastomoses peuvent être liés étroitement, mais être conscient de l'effet sac à main chaîne qui peut réduire l'anastomose et provoquer une ischémie ou empêcher tout écoulement de sang, en pratique nous avons constaté que prévu la aortotomie elliptique est de taille suffisante, le cordon de bourse effet n'est pas rencontré. Le veinotomie est faite avec une aiguille, puis élargi en étirant avec une pince, nous croyons que c'est préférable de couper avec une pince que l'étirement crée un anneau de tissu veineux qui peut être facilement vu et aide suture pour créer une anastomose stable. L'anastomose urétérale à la vessie est un élément très important à considérer, nous préconisons la technique décrite ici plutôt que d'une vessie dôme de la vessie re-construction qui a été associée à la fuite de l'urine et l'uretère sténose probablement en raison ischémie. Notre technique décrite permet une plus courte longueur donneur urétérale à être utilisée car elle est directement anastomosée au bladder 5. En utilisant ces améliorations techniques, nous avons été en mesure de réduire considérablement la quantité de temps nécessaire pour compléter ce modèle expérimental. En effet avec deux opérateurs travaillant simultanément cinq receveurs de greffe peut être effectuée par jour avec suffisamment de temps pour permettre la récupération et le suivi des souris.
Une limite importante de la technique et le modèle décrit dans ce document est que la souris se retrouve avec un de ses reins natifs in situ de telle sorte que la souris ne dépend pas de la rénale pour leur survie. Certains auteurs ont rapporté l'enlèvement du second rein natif immédiatement au moment de la greffe ou de cinq à dix jours après la transplantation, ce qui laisse la souris dépendant du rein transplanté. Cela permettrait de survie à utiliser en tant que résultat expérimental ainsi que le sang d'échantillonnage pour mesurer les marqueurs de la fonction rénale, tels que la creatinine sérique ou de l'urée dans le sang. Cependant, il n'y a pas de différence dans les résultats histologiqueslorsque l'on compare des souris dépendantes de l'allogreffe et ceux avec un seul rein natif 9. Notre protocole décrit ne fait pas obstacle à ce fait et la deuxième rein natif pourraient être éliminés à un intervalle de temps donné. Une autre limite est que les micro-chirurgicale expertise de pointe est nécessaire pour effectuer une anastomose artérielle et veineuse, bien que la formation et en utilisant la figure technique pour l'enseignement, cela peut être surmonté. Les complications vasculaires peuvent survenir, ces thrombose de l'artère ou de la veine rénale étant, il en résulte invariablement chez la souris présentant des signes de détresse, de la mauvaise santé ou spécifiquement postérieurs paralysie des membres. Par conséquent la gouvernance et la surveillance des souris strict est impératif lors de l'utilisation de ce modèle.
Le rejet aigu de la greffe rénale a été largement traité par immunosuppresseurs et induction thérapie appauvrissant les lymphocytes circulants, mais des épisodes de rejet à médiation cellulaire peuvent encore se produire au cours des greffes rénalesvie. Par conséquent études sur les mécanismes sous-jacents de cette restent pertinents et peuvent identifier de nouvelles voies pour le traitement. En décalage complet du CMH, comme des souris C57BL / 6 à des souris BALB / c, la survie moyenne dépend de la greffe de rein a été rapporté comme étant aussi faible que 7,4 jours 10. Histologiquement rejet cellulaire aigu vasculaire et peut être identifié par une infiltration lymphocytaire, une hémorragie et un œdème dans l'interstitium, tubulite, la vasculite, la nécrose glomérulaire et tubulaire. Les procédés combinés contribuent aux détériorations de l'allogreffe chronique ont fait de cette région difficile à étudier. Les caractéristiques histologiques comprennent la fibrose interstitielle, atrophie tubulaire, une glomérulosclérose et la prolifération intimale. La blessure progressive est associée à la persistance infiltration de cellules T, mais il est de plus en plus apprécié que de nombreux autres facteurs peuvent être impliqués. De médiateur potentiel d'une blessure persistante comprennent le dépôt complément due à des anticorps spécifiques du donneur, les cellules B, les cellules tueuses naturelles, les macrophages et les cellules de la greffe intrinsèques tels que l'endothélium 3. Par conséquent, ce modèle permet l'étude de ces différentes facettes de rejet.
Il ya eu environ 70 études publiées qui utilisent ce modèle malgré son début de la description 4, c'est par rapport aux modèles de souris de rein les lésions d'ischémie-reperfusion où il ya eu plusieurs centaines d'articles. L'importance de ce modèle de souris d'intra-abdominale transplantation rénale est qu'il restitue directement le processus de transplantation de rein humain, en outre, il bénéficie de l'utilisation de souches de souris consanguines bien définies qui peuvent être utilisés pour modéliser les différents mécanismes de rejet. Par conséquent, les études utilisant ce modèle sont très traduisible. D'autres applications futures de ce modèle comprennent l'étude des anomalies rénales intrinsèques par la transplantation de reins à des phénotypes spécifiques de modèles knock-out dans des souris de type sauvage ou inversement reins de type sauvage dans génétiquementbénéficiaires modifiés.
Ce modèle peut répliquer avec succès le processus de la transplantation rénale humaine. L'utilisation de souches de souris consanguines permet la sélection de combinaisons donneur-receveur de variable différences CMH. En outre, l'utilisation de souris permet l'utilisation de diverses techniques, y compris les systèmes inductibles et knock-out pour sonder les différents aspects de rejet.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n'ont rien à divulguer.
Acknowledgments
Financement de recherche sur le rein au Royaume-Uni, le Royal College of Surgeons d'Edimbourg et de la Société européenne de transplantation d'organes a soutenu cette étude.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



