Introduction
Vellykket nyretransplantation til behandling af nyresvigt blev første gang beskrevet i 1955 mellem enæggede tvillinger 1, siden da er det blevet en revolutionerende behandling til patienter med slutstadiet nyresvigt i hele verden, der tilbyder både forbedring i længden og livskvalitet 2. Men på lang sigt transplantat overlevelse er blevet hæmmet af en lang række patologiske processer resulterer i kronisk allograft skade 3.
Afvisning af den transplanterede nyre hos mennesker er fortsat en væsentlig årsag til sygelighed, til trods for væsentlige forbedringer i immunosupporessive regimer. Henblik på at udvikle en musemodel for nyretransplantation er at nøje replikere processen og patologi fundet i human nyretransplantation 4. Skoskiewicz et al. Først beskrev musemodel for nyretransplantation i 1973 5. Selv avancerede mikrokirurgiske færdigheder der kræves, er det en værdifuld tool af flere grunde: musegenomet er blevet godt karakteriseret, og der er et stort udvalg af eksperimentelle metoder og teknikker til rådighed til undersøgelser mus.
Mange grupper under anvendelse af musemodel for nyretransplantation har brugt den transplanterede nyre som en livsbevarende organ, men i andre undersøgelser og i vores beskrevne metode en af modtagerens mus native nyrer efterlades in situ for eksperimentets varighed 4. Fordelen er, at musen undergår en enkelt anæstesi og drift og derved reducere morbiditet til musen og risikoen for at dø af en anden procedure. Derudover musen ikke lider under de negative virkninger af en gradvis nyresvigt.
Selvom modeller af allogene afvisning findes i andre organer som hjerte og hud, er disse ikke altid er direkte relevante for nyretransplantation. Der er beviser for, at disse modeller fremkalde forskellige tilstande og dynamik for afvisning, for eksempel tidsforløbet for afvisning i hjertets allograft og nyre transplanteret adskiller sig væsentligt i visse stamme kombinationer 6. Vi har beskrevet akutte nyreallotransplantatafstødning mønstre i BALB / c donorer til ikke-transgene FVB / NJ mus, denne model viste cellemedieret skade med ophobning af T-celler og makrofager 7. Alternativt har vi også beskrevet en model af kronisk allograft skader, der udviser interstitiel fibrose og tubulær atrofi, dette skyldes at transplantere en nyre fra C57BL / 6 BM12 donorer i C57BL / 6 modtagere, da disse mus er kendetegnet ved en enkelt MHC klasse II-loci mis -match 8.
Flere aspekter af transplantation er blevet undersøgt ved anvendelse af musemodel for nyretransplantation herunder akut afstødning, cellulære og humorale afstødning, iskæmisk reperfusionsbeskadigelse og trialing hidtil ukendte terapeutiske midler. Vi har ændret den kirurgiske technique at reducere driftstiden og forbedre den lethed af operationen. Især har vi beskrevet samtidig donor og modtager forberedelse og en forenklet vaskulær anastomose teknik ved at anvende en kontinuerlig aorta patch anastomose. Denne video og manuskript vil give centrale punkter for at hjælpe i etableringen af denne teknik.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Relevante nationale og lokale institutionelle etik bør være på plads, før du udfører dyreforsøg. Specielt i Det Forenede Kongerige de følgende forsøg blev gennemført under de Dyr (videnskabelige procedurer) Act 1986 Når to microsurgeons er til rådighed til at operere samtidigt donor kirurg skal udføre trin 1,1-1,16 derefter 3.1 til 3.5, mens modtageren kirurg udfører 2.1 til 2.8 . For en enkelt operatør trin kan følges sekventielt.
1. Donor Forberedelse
Bemærk: Den procedure, der præsenteres her er for en donor C57BL / 6 BM12 og modtager C57BL / 6 hanmus i alderen mellem 8 til 16 uger gamle med en kropsvægt på mere end 20 g. Imidlertid kan denne procedure reproducerbart udføres på en række forskellige musestammer. De data, der præsenteres i repræsentative resultater afsnittet blev opnået fra C57BL / 6, C57BL / 6 BM12 og BALB / c-mus.
- Conduct procedurer using sterile kirurgiske instrumenter og forbrugsstoffer (autoklaveres), med bestræbelser på at holde operativsystemet område som sterilt som muligt. Udfør forberedelse donor samtidig med modtageren præparat, hvis to kirurger er tilgængelige.
- Bedøver mus med en intraperitoneal injektion (31G nål) af medetomidin (0,5 mg / kg) og ketamin-hydrochlorid (200 mg / kg). Dette resulterer i en bedøvelsesmiddel plan, der opretholdes i 4 timer der giver tid nok til hele proceduren skal udføres. Supplerende anæstesi er ikke nødvendig.
- Bekræft, at musen er bedøvet (intet svar til tå knivspids).
- Barbere musens mave og fjerne eventuelle løse hår med tape.
- Anbring musen på ryggen på et sterilt draperet opvarmet mat og løst immobilisere lemmer med steril malertape.
- Overvåg musen under hele proceduren for forbrændinger. Hvis det er muligt bruge et ikke-elektriske varmekilde.
- Påfør et øje smøremiddel og sanitize bugvæggen med en fortyndet jodopløsning.
- Lav en midterlinjen snit i maven for at komme ind i bughulen og indsæt en 3 cm Calibri abdominal retractoren.
- Anvend varmet saltvand for at holde tarmene og kirurgiske område fugtig og undgå unødvendig udtørring af indvoldene.
- Dæk musen med sterile forhæng og flytte tarmene til operatørens venstre (musens højre) for at blotlægge aorta, vena cava og venstre nyre.
- Påfør en ratcheted Forcep til maven og træk overlegent at afsløre de store skibe og venstre nyre helt. Pack fugtig sterile vatpinde (2 mm x 2 mm) i maven til at trække væv væk fra det kirurgiske område, såsom lever lapper, sædblærer og tarm.
- Isoler venstre nyre fra omgivende adventitiaen, fedt og venstre binyre i bughulen ved ligeud dissekere bindevævet ved hjælp af fin spids pincet. Placer lukkede spidsen af tangen mellem de områder, der need at blive adskilt, og langsomt lade pincetspidser at åbne for at dissekere rummet.
- Isoler venstre nyre vene ved ligering og derefter dividere venstre binyre vene og venstre gonadale vene med 9 / O nylon. Placer suturen tæt på den renale vene.
- Liger og dividere ureter med 7 / O silkesutur tæt til blæren forlader suturen ender lang. Disse lang sutur enderne vil blive anvendt, når nyrerne er høstet og er nødvendige for ureteric anastomosen.
- At mobilisere og fuldt dissekere aorta og vena cava overlegent og ringere nyrearterien og vene bruge fin spids pincet til ligeud dissekere lymfekar og fedt fra fronten og siderne af skibene.
- Find vævet flyet mellem aorta og vena cava og langsomt sprede pincet. Langsomt åbner spidserne af de fine tippet pincet til at sprede vævet med minimal traume.
- Bind en løs 7 / O silke omkring aorta overlegne og ringere nyrearterien ved at føre en vinklet bødetip pincet omkring bagsiden af skibene og tegning en sutur igennem. Disse suturer vil blive strammet før nyre hentning for at tillade retrograd perfusion af University of Wisconsin-opløsning.
2. Modtager Forberedelse
Som pr donor forberedelse Følg trin 1.2 til 1.8.
- Flyt tarmene til førerens højre (musens venstre) for at blotlægge aorta, vena cava. Dæk tarmene med et sterilt saltvand gennemblødt vatpind.
- Udfør en ret nefrektomi ved ligering højre nyre-arterie og vene sammen med 7/0 silkesutur og derefter opdele.
- Ligere højre ureter med 7 / O silkesutur og kløft.
- Mobilisere og fuldt dissekere aorta og vena cava ringere end den renale arterie og vene som beskrevet i trin 1.14 og 1.15. Sikre fuldstændig dissektion mellem aorta og vena cava. Vær omhyggelig med at bevare den interne spermatic arterie, der løber forreste til vena cava og aorten sammen med lymfe bundt.
- Identificer lumbale fartøjer kører i retroperitoneum fra vena cava og vene til rygsøjlen, liger med 9 / O-silke i kontinuitet, er det ikke nødvendigt at opdele skibene.
- Identificer tilstrækkelig plads til at placere mikrovaskulære klemmer med plads mellem for vaskulære anastomoser.
- Administrer intravenøs heparin (5 enheder) via dorsale penis vene.
3. donornyren Retrieval
Spænd de 7 / O silkeslips, som er blevet placeret rundt i ringere og overlegen aorta at isolere nyre fra den arterielle cirkulation.
- Indsprøjt retrograde kolde 0,2-0,5 ml University of Wisconsin opløsning med en kanyle (31G) i aorta.
- Opdel aorta inden suturerne og opdele nyrevenen ved krydset med vena cava at fjerne nyre og nyrearterien med en længde af aorta. Divider columna fartøjer som følge af aorta, hvis de er til stede, wed ligering.
- Placer nyre i koldt saltvand på en steril podepind i en dyrkningsskål.
- Aflive donormus ved cervikal dislokation.
4. Nyretransplantation - Nyre Forberedelse
- Opret en aorta plaster ved at dividere aortavæggen længderetningen direkte modsat den renale arterie. Identificere eventuelle karlumener i plasteret, der skal ligeret eller undgås, når du udfører den arterielle anastomose.
- Placer en 10 / O sutur udefra og ind nyrevenen lumen overlegent og en anden separat sutur inferiorly. De suturer bruges til at opdele den adrenale vene og den gonadale vene kan bruges til at orientere fartøjet.
- Placer nyren i højre flanke af modtager (Figur 1.1), og sikre suturerne er godt placeret til at sikre vaskulære anastomoser kan afsluttes uden suturerne bliver viklet ind i vatpinde eller andre instrumenter.
5. Nyre Transplantion - Vascular anastomosen
Påfør mikrovaskulære klemmer først inferiorly så overlegent omfatter vena cava og aorta.
- Lav en ventomy med en nål (31G) ved at punktere den forreste væg af vena cava. Skyl blod fra vena cava ved injektion ca. 50 ul 0,9% NaCl.
- Udvide venotomy hjælp fine spids pincet ved at åbne dem i venotomy således at længden svarer til diameteren af donor renal vene.
- Placer 10 / O overlegen sutur (som allerede er i hulrummet i den renale vene) først på toppen af venotomy (figur 1,2) og slutte sig til bagvæggen af anastomose i en løbende sutur indtil ringere toppunkt er opnået (Figur 1.3).
- Placer 10 / O ringere sutur og binde først med en enkelt knude (figur 1,4) og derefter binde til den løbende sutur fra bagvæggen.
- Brug af ringere sutur skabe front wall anastomosen (Figur 1.5) med en kørende sutur og binde til den overlegne sutur ende på den overlegne toppunkt (Figur 1.6).
- Opret en aortotomy ved optagning aortavæggen med en pincet og skære en elliptisk plaster med en saks (tilnærmelsesvis aortotomy bør være en femtedel af omkredsen af aorta og tre gange den renale arterie lumen i længde).
- Placer en 10 / O sutur på den overlegne punkt af aorta patch fra ydersiden til indersiden (Figur 1.7) og passerer gennem aorta at binde uden for fartøjer på den overlegne toppunkt aortotomy.
- Opret arteriel anastomose med en kørende sutur starter overlegent (Figur 1.8) anastomoserende donor patch til modtageren aorta, passe på ikke at snøre anastomosen ved at binde suturen for stram (Figur 1.9).
- Fjern ringere vaskulære klemmer først derefter den overlegne klemme til reperfundere nyren (Figur 1.10 og 1.11). Synlig peristaltik af ureter måske set, hvis tilstrækkelig blodforsyning til urinlederen er opnået.
6. Nyretransplantation - ureter anastomose
- Opdel vedhæftede filer i blæren fra bugvæggen.
- Pass en nål (21G) fra venstre til højre af blæren gennem begge vægge.
- Placer lige pincetspidser i nålehulrummet og passerer både tilbage gennem blæren, således at tangen nu passerer fra højre til venstre ud af den venstre side af blæren.
- Tegn suturen på donor urinlederen gennem blæren, således at ureter passerer i venstre blære defekt derefter ud af den højre side.
- Suturere adventitia af ureter til adventitia af blæren med tre enkelt afbrudte suturer omkring indgang med 9 / O nylonsutur på en runde rørige nål.
- Skær ureter proximalt til ligatur og dermed åbne the urinrøret for at tillade urin at flyde og tillade ureter ende trykkes ind i kroppen af blæren. Synlig produktion af urin kan observeres sammen med blødning fra peri-ureteric fartøjer.
- Luk højre blære defekt med et enkelt afbrudt 9 / O-silkesutur.
7. Inddrivelse og postoperativ pleje
Udskift mave indvolde i maven i deres oprindelige orientering og lukke bugvæggen ved at tilnærme de rectus muskler med 6 / O resorberbar sutur.
- Tilnærme huden med metal hudclips.
- Delvist vende anæstesi med en subkutan injektion af atipamazole hydrochlorid (10 ul / g).
- Indgives analgesi ved subkutan buprenorphin hydrochlorid (0,05 mg / kg) og for væske støtte injektion 1 ml subkutan 0,9% NaCl.
- Recover musen i et varmeskab ved 28 ° C i 24 til 48 timer. Overhold musen til sygdom op tilforsøgets afslutning.
- Fjern metal hudclips 7-10 dage efter operationen.
- Når eksperimentet er færdig aflive musen ved cervikal dislokation.
- Fjern og indsamle den kontralaterale nyre og allotransplantat til histologisk analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Nyreallotransplantatafstødning kan vurderes ved histologiske analyser af Methacarn-paraffinindlejrede vævssnit af den transplanterede nyre (figur 2). Isotransplantat transplantation af nyrer mellem syngene mus resulterer i nedsat iskæmisk reperfusionsskade, dog med 4 uger tubuli er genoprettet og er histologisk sammenlignes med indfødte nyrer. Akut afstødning kan modelleres ved C57BL / 6 nyretransplantation i BALB / c-modtagere, inden for 1 uge er der diffus mononukleær celleinfiltration hele nyreparenkym inddragelse interstitium, glomeruli og tubuli. Kronisk allotransplantat skader kan modelleres af C57BL / 6 BM12 nyrer transplanteret i C57BL / 6 modtagere, resulterer dette i de typiske funktioner, der findes i human patologi bestående af interstitiel fibrose og gradvis tubulus tab. Brutto tubulus tæller pr høj-drevne felt (x200 forstørrelse) giver mulighed for kvantificering af funktionelle nephron masse (Fifigur 3), tab af tubuli afspejler rørformet skade som følge af afvisning. Interstitiel fibrose kan identificeres ved hjælp af den pan-kollagen plet PicroSirius rød (Figur 4). Observeres normale endogent collagen imidlertid under kronisk skade ny collagen deponeret resulterer i progressiv fibrose. Den kroniske skade viser sig mellem 8 og 12 uger efter transplantation (figur 5).
En betydelig indlæringskurve skal overvindes for at fastslå modellen (figur 6). Skønsmæssigt 40 procedurer blev udført i genvundet mus før en reproducerbar vaskulær anastomose tid blev nået med acceptabel overlevelse fri for komplikationer. Den mest almindelige årsag til euthanizing musen skyldtes bagbensparalyse sekundært til at sænke-lem og rygmarvsiskæmi relateret til arteriel trombose, men i vores erfaring systemisk heparization reducerer forekomsten af dette. Mus blev rutinemæssigt monitored efter lokalt aftalte kriterier for afslutning af forsøgene. Overlevelse eksperimenter udført i plateau fase af indlæringskurven resulterede i en gennemsnitlig vaskulær anastomosis tid på 28,9 ± 0,47 min.
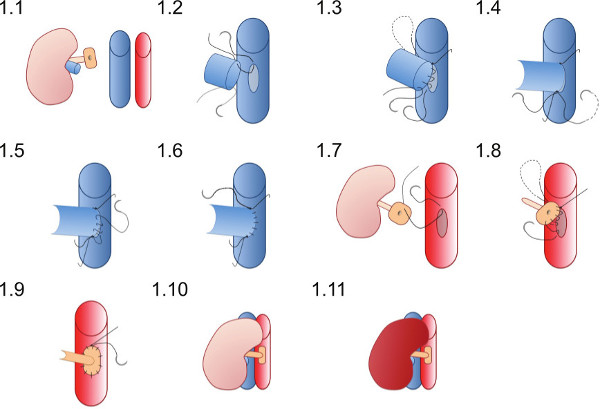
Figur 1. Skematisk fremstilling af vaskulær anastomose teknik. Er donornyren placeret i højre flanke modtagerens musen. Donoren renale vene anastomoseret i en ende-til-side-mode og donor nyrearterien på et plaster på aorta anastomoseret til modtageren aorta.

Figur 2. Repræsentant histologisk tubulær skade i den transplanterede nyre. Efter fiksering i methyl Carnoyl Solution væv blev indlejret i paraffin og vævssnit af 4 um blev farvet med hemotoxylin og eosin. 4 uger efter transplantation isotransplantat nyrer ikke udviser rørformet skade og kan sammenlignes med indfødte nyrer i udseende. C57BL / 6 BM12 nyrer transplanteret i BALB / c modtagere undergår akut afstødning med diffuse mononukleære celleinfiltrater (*) og nekrotiske tubuli (**) og tubulitis. C57BL / 6 BM12 nyrer transplanteret i C57BL / 6 resultater i kronisk allograft skader er kendetegnet ved perivaskulære lymfocytiske infiltrater (blok pil ⬆) og interstitiel fibrose og tubulær atrofi (hule pile ⇧). Klik her for at se en større version af dette tal.

Figur 3. Kvantificering af rørformede skade i st ansplanted nyre. Sunde tubuli (defineret ved tilstedeværelsen af et intakt basalmembran intakte tubulære lumen sund cytoplasmatisk volumen og en fastholdt apikale mikrovilli børste grænse) afspejler fungerende nephron masse kan kvantificeres ved at tælle det gennemsnitlige antal tubuli pr felt (x200 forstørrelse ) (n = 6, i gennemsnit 10 på hinanden følgende felter, ** p <0,01).

Figur 4. Kronisk allotransplantat skade kan identificeres ved interstitiel fibrose (repræsentative billeder). Collagenaflejring inden den transplanterede nyre fremgår ved påvisning af PicroSirius rød farvning af kollagen. Klik her for at se en større version af dette tal.
gur 5 "src =" / filer / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figur 5. Kvantificering af interstitiel fibrose. Interstitiel fibrose målt ved PicroSirius rød positivitet rejses i C57BL / 6BM12 ⇒ C57BL / 6 modtagere tolv uger efter transplantation (n = 6, i gennemsnit 10 på hinanden følgende felter, ** p <0,01, * p < 0,05).

Figur 6. indlæringskurve. Indledende manglende inddrivelse eksperimenter i terminalt bedøvede mus blev udført for at udvikle den kirurgiske teknik. Dette blev efterfulgt af udvinding eksperimenter for at opnå en vellykket re-perfunderet transplanteret nyre med en overlevende mus uden komplikationer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den mest beskrevne måde at udføre arteriel anastomose er at bruge den distale aorta donor, med den renale arterie i forlængelse i en ende-til-side-måde til modtageren aorta. Vi beskriver brugen af en aorta patch, svarende til 'Carrell patch' spejling, der udføres i den menneskelige nyretransplantation, som vi mener at være mere praktisk. Selvom rapporter i litteraturen af donor og modtager operationstid er sparsomme mener vi, at udnytte en aorta patch til modtager aorta i stedet for ende-til-side donor aorta til modtager aorta er at foretrække. Ved hjælp af en patch ophæver behovet for at dissekere alle lumbal donor aorta grene, og også den tid, det tager at ligere dem individuelt, som anastomoserende et plaster naturligt udelukker disse.
Kritiske skridt til at opnå denne model omfatter idet det sikres, at der ikke er andre, bortset nyrearterien inden for arteriel patch anastomosen som arterielle lumen devil lække når mikro-kar-klemmer fjernes. Suturerne konstruere anastomoser kan bindes stramt, men være klar over pung-strengen effekt, som kan indsnævre anastomosen og forårsage iskæmi eller forhindre blodgennemstrømning, i praktisk vi har observeret, at forudsat den elliptiske aortotomy er af tilstrækkelig størrelse pung-string effekt ikke er stødt på. Den venotomy er lavet med en nål og derefter udvidet ved strækning med en pincet, mener vi, det er at foretrække at skære som strækker sig med en pincet skaber en ring af venøs væv, som let kan ses og bistand suturering at skabe et stabilt anastomose. Den ureteric anastomose til blæren er en meget vigtig komponent til at overveje, vi går ind for den teknik, der er beskrevet her snarere end en blære-kuppel til blære re-konstruktion, der har været forbundet med urin lækage og ureteric stenose formentlig skyldes iskæmi. Vores beskrevne teknik tillader en kortere donor ureteric længde, der skal anvendes som den er direkte anastomoseret til bladdER 5. Ved at udnytte disse tekniske forbedringer har vi været i stand til at reducere mængden af tid, der kræves for at fuldføre denne forsøgsmodel. Faktisk med to operatører, der arbejder samtidigt fem transplanterede patienter kan udføres pr dag med tilstrækkelig tid til, at genopretning og overvågning af mus.
En væsentlig begrænsning af den beskrevne model og teknik i dette dokument er, at musen er tilbage med en af sine oprindelige nyrer in situ sådan, at musen ikke er afhængig af nyrerne for at overleve. Nogle forfattere har rapporteret fjernelse af den anden indfødte nyre straks på tidspunktet for transplantation eller fem til ti dage efter transplantationen, og dermed overlade musen afhængig af den transplanterede nyre. Dette ville muliggøre overlevelse, der skal anvendes som et eksperimentelt resultat samt blodprøvetagning at måle markører for nyrefunktion, såsom serum kreatinin eller blod urinstof. Men der er ingen forskel i histologiske resultaternår man sammenligner mus afhængige af allotransplantatet og dem med et enkelt indfødt nyre 9. Vores beskrevne protokol udelukker ikke dette, og faktisk den anden indfødte nyre kunne fjernes på et givet tidsinterval. En yderligere begrænsning er, at avancerede mikro-kirurgisk ekspertise kræves for at udføre en arteriel og venøs anastomose, men med træning og ved at udnytte det tekniske tal for instruktion dette kan overvindes. Vaskulære komplikationer kan forekomme, da disse er nyrearterie eller venetrombose, dette uvægerligt resulterer i mus viser tegn på lidelse, dårligt helbred, eller specifikt hind-lemmer lammelse. Derfor streng styring og overvågning af mus er afgørende, når man bruger denne model.
Akut afvisning af nyretransplantation er stort set blevet behandlet af immunosuppression og induktion terapi ozonlagsnedbrydende cirkulerende lymfocytter, men episoder af cellemedieret afstødning kan stadig forekomme i hele nyretransplantaterliv. Derfor studier af de mekanismer, der ligger til grund herfor er stadig relevante og kan identificere nye veje til behandling. I fuldstændig MHC mismatch, såsom C57BL / 6 i BALB / c, gennemsnitlige overlevelse afhænger af nyretransplantation er blevet rapporteret at være så lav som 7,4 dag 10. Histologisk akut cellulær og vaskulær afstødning kan identificeres ved lymfocytinfiltration, blødning og ødem i interstitium, tubulitis, vaskulitis, med glomerulær og tubulær nekrose. De kombinerede processer, der bidrager til kronisk allograft skader har gjort dette område vanskeligt at studere. De histologiske funktioner omfatter interstitiel fibrose, tubulær atrofi, glomerulosklerose og intimal proliferation. Den progressive skade forbundet med vedvarende T-celle-infiltration, men det er stadig mere klart, at mange andre faktorer kan være involveret. Potentielle medierer af vedvarende skade inkluderer komplement aflejring på grund af donor-specifikke antistoffer, B-celler, naturlige dræberceller, makrofager og celler iboende til transplantatet såsom endotel 3. Derfor er denne model gør det muligt at studere disse forskellige facetter af afvisning.
Der har været cirka 70 offentliggjorte forsøg med denne model på trods af sin tidlige beskrivelse 4, er det i sammenligning med musemodeller for nyre iskæmireperfusion skade, hvor der har været flere hundrede artikler. Betydningen af denne musemodel af intra-abdominalt nyretransplantation er, at det direkte genskaber processen med menneskelige nyretransplantation desuden det nyder godt af brug af veldefinerede indavlede musestammer, der kan bruges til at modellere forskellige ordninger for afvisning. Derfor undersøgelserne ved hjælp af denne model er meget oversætbare. Andre fremtidige anvendelser af denne model omfatter studere iboende renale abnormaliteter ved at transplantere nyrer med specifikke fænotyper fra knockout modeller til vild-type mus eller omvendt vildtype nyrer i genetiskændrede modtagere.
Denne model kan med held replikere processen af human nyretransplantation. Brugen af indavlede musestammer tillader valg af donor-modtager kombinationer af varierende MHC forskelle. Derudover kan brugen af mus muliggør anvendelse af forskellige teknikker, herunder knockout og inducerbare systemer til at undersøge de forskellige aspekter af afvisning.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at afsløre.
Acknowledgments
Finansiering fra Nyre Research UK, The Royal College of Surgeons i Edinburgh og European Society of organtransplantation støttede denne undersøgelse.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



