Introduction
Trapianto renale con successo per il trattamento di insufficienza renale è stata descritta per la prima nel 1955 tra gemelli monozigoti 1, da allora è diventato un rivoluzionario trattamento per i pazienti con insufficienza renale allo stadio terminale in tutto il mondo, che offre sia un miglioramento nella durata e la qualità della vita 2. Tuttavia la sopravvivenza del trapianto a lungo termine è stata ostacolata da una moltitudine di processi patologici con conseguente danno cronica del trapianto 3.
Rifiuto del rene trapiantato negli esseri umani rimane una delle principali cause di morbilità, nonostante i significativi miglioramenti nei regimi immunosupporessive. L'obiettivo di sviluppare un modello murino di trapianto renale è replicare da vicino il processo e la patologia trovato nel trapianto renale umano 4. Skoskiewicz et al. Prima descritto il modello murino di trapianto di rene nel 1973 5. Anche se sono richieste competenze avanzate microchirurgiche, è una preziosa tool per diversi motivi: il genoma del topo è stato ben caratterizzato e c'è una grande varietà di metodi e tecniche disponibili per studi sui topi sperimentali.
Molti gruppi che utilizzano il modello murino di trapianto renale hanno usato il rene trapiantato come un organo di supporto vitale, ma in altri studi e nella nostra metodologia descritta uno dei reni nativi del topo destinatario viene lasciato in situ per tutta la durata dell'esperimento 4. Il vantaggio è che il mouse subisce una sola anestesia e il funzionamento riducendo la morbilità per il mouse e il rischio di morte per una seconda procedura. Inoltre, il mouse non soffre gli effetti negativi di insufficienza renale progressiva.
Sebbene esistano modelli di rigetto allogenico in altri organi come il cuore e la pelle, queste non sono sempre direttamente rilevanti per il trapianto renale. Ci sono prove che questi modelli suscitano diverse modalità e dynamics di rifiuto, per esempio, l'andamento nel tempo del rigetto in allotrapianto cardiaco e trapianto renale differisce in modo significativo in determinate combinazioni di deformazione 6. Abbiamo descritto i modelli renale acuta rigetto allogenico in BALB donatori / c in non-transgenici topi FVB / NJ, questo modello ha mostrato lesioni mediato cellulare con accumulo di cellule T e macrofagi 7. In alternativa abbiamo anche descritto un modello di danno cronica del trapianto che presenta fibrosi interstiziale e atrofia tubulare, questo risulta dal trapianto di un rene da C57BL / 6 BM12 donatori in C57BL / 6 destinatari, in quanto questi mouse sono caratterizzati da un unico MHC di classe II mis loci -match 8.
Molteplici aspetti del trapianto sono stati studiati utilizzando il modello murino di trapianto renale tra cui rigetto acuto, rigetto cellulare e umorale, ischemia riperfusione, e sperimentando nuovi agenti terapeutici. Abbiamo modificato la t chirurgicaecnica per ridurre il tempo di funzionamento e migliorare la facilità di intervento chirurgico. In particolare abbiamo descritto donatore simultanea e la preparazione destinatario e un semplificato tecnica di anastomosi vascolare utilizzando un continuo aortica patch di anastomosi. Questo video e manoscritto forniranno punti chiave per aiutare nella creazione di questa tecnica.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Adeguati etica istituzionali nazionali e locali dovrebbero essere a posto prima di eseguire esperimenti su animali. In particolare nel Regno Unito i seguenti esperimenti sono stati intrapresi sotto gli Animali (Scientific Procedures) Act 1986, in cui sono disponibili ad operare contemporaneamente due microsurgeons il chirurgo donatore deve eseguire i passaggi 1,1-1,16 poi da 3.1 a 3.5, mentre il chirurgo destinatario esegue 2.1 a 2.8 . Per un singolo operatore le fasi possono essere seguite in modo sequenziale.
1 donatore Preparazione
Nota: La procedura qui presentata è un donatore C57BL / 6 BM12 e destinatario C57BL / 6 topi di sesso maschile di età compresa tra 8 a 16 settimane di vita con un peso corporeo superiore a 20 g. Tuttavia questa procedura può essere eseguita in modo riproducibile su una varietà di ceppi di topi. I dati presentati nella sezione risultati rappresentativi sono stati ottenuti da C57BL / 6, C57BL / 6 BM12 e topi BALB / c.
- Procedure di Condotta Using strumenti chirurgici sterili e di consumo (autoclave), con sforza di mantenere il campo operatorio sterile come possibile. Eseguire la preparazione del donatore in contemporanea con la preparazione destinatario, se due chirurghi sono disponibili.
- Anestetizzare il mouse con un'iniezione intraperitoneale (31G ago) di medetomidina (0,5 mg / kg) e ketamina cloridrato (200 mg / kg). Questo si traduce in un piano anestetico che viene mantenuta per 4 ore fornire tempo sufficiente per l'intera procedura da eseguire. Anestesia supplementare non è necessario.
- Verificare che il mouse è anestetizzato (nessuna risposta a pizzico tep).
- Shave addome del mouse e rimuovere tutti i capelli sciolti con nastro adesivo.
- Posizionare il mouse sulla sua schiena su una stuoia riscaldata sterilmente drappeggiato e vagamente immobilizzare gli arti con nastro adesivo sterile.
- Monitorare il mouse durante tutta la procedura per le ustioni termiche. Se possibile, utilizzare una fonte di calore non elettriche.
- Applicare un lubrificante occhio e sanitize la parete addominale con una soluzione diluita di iodio.
- Eseguire un'incisione mediana nell'addome per entrare nella cavità peritoneale e inserire un tre centimetri Calibri divaricatore addominale.
- Applicare salina riscaldata per mantenere l'intestino e l'area chirurgica umida ed evitare inutili essiccazione dei visceri.
- Coprire il mouse con teli sterili e spostare l'intestino alla sinistra dell'operatore (a destra del mouse) per esporre l'aorta, vena cava e il rene sinistro.
- Applicare una pinza sfogo allo stomaco e tirare superiormente per esporre i principali vasi e rene sinistro completamente. Confezione umidi tamponi sterili (da 2 mm x 2 mm) nell'addome di ritrattare tessuti lontano dalla zona chirurgica, come ad esempio i lobi del fegato, vescicole seminali, e intestino.
- Isolare il rene sinistro da nell'avventizia circostante, il grasso e la ghiandola surrenale sinistra nella cavità peritoneale senza mezzi termini dalla dissezione del tessuto connettivo con pinze punta fine. Posizionare le punte chiuse della pinza tra le aree che neEd da separare e lentamente lasciare le punte forcep per aprire a sezionare lo spazio.
- Isolare la vena renale sinistra legando e dividendo la vena surrenalica e gonadica sinistra vena sinistra con 9 / O nylon. Posizionare la sutura vicino alla vena renale.
- Legare e sezionare l'uretere con 7 / O sutura di seta vicino alla vescica lasciando la sutura termina lungo. Queste estremità lunga di sutura verranno utilizzati quando il rene è raccolto e sono necessari per l'anastomosi ureterale.
- Per mobilitare e sezionare completamente l'aorta e vena cava inferiore e superiormente l'arteria renale e la vena utilizzare pinze punta fine di sezionare senza mezzi termini vasi linfatici e il grasso dalla parte anteriore e sui lati dei vasi.
- Trovare il piano di tessuto tra l'aorta e vena cava e diffondere lentamente il forcipe. Aprire lentamente le punte delle belle pinze a punta a diffondere il tessuto con il minimo trauma.
- Legare un sciolto 7 / O seta intorno all'aorta superiore ed inferiore per l'arteria renale passando un bel angolatopinze punta intorno alla parte posteriore dei vasi e di disegno attraverso una sutura. Questi punti di sutura saranno serrati prima di recupero rene per consentire la perfusione retrograda della University of Wisconsin soluzione.
2 Destinatario Preparazione
Come per la preparazione donatore follow passi da 1.2 a 1.8.
- Spostare l'intestino alla destra dell'operatore (a sinistra del mouse) per esporre l'aorta, vena cava. Coprire l'intestino con una soluzione salina sterile tampone imbevuto.
- Eseguire una nefrectomia destra legando l'arteria renale destra e la vena con 7/0 sutura di seta e poi dividere.
- Legare l'uretere destro con 7 / O sutura di seta e dividere.
- Mobilitare e sezionare completamente l'aorta e vena cava inferiore per l'arteria renale e la vena come descritto al punto 1.14 e 1.15. Garantire la completa dissezione tra l'aorta e vena cava. Fare attenzione a preservare l'arteria spermatica interna che corre anteriormente alla vena cava e aortun insieme con il fascio linfatico.
- Identificare i vasi lombari esecuzione in retroperitoneo dalla vena cava e vena alla colonna vertebrale, legare con 9 / O seta in continuità, non c'è bisogno di dividere i vasi.
- Identificare lo spazio sufficiente per posizionare i morsetti microvascolari con spazio tra di anastomosi vascolari.
- Somministrare eparina per via endovenosa (5 unità) con pene dorsale vena.
3. donatori di rene Retrieval
Serrare i 7 / O cravatte di seta che sono stati posti in giro per l'aorta inferiore e superiore per isolare il rene dalla circolazione arteriosa.
- Infondere retrograde freddo 0,2-0,5 ml della University of Wisconsin soluzione con un ago (31G) nell'aorta.
- Dividere l'aorta entro le suture e dividere la vena renale alla sua giunzione con la vena cava per rimuovere il rene e l'arteria renale con una lunghezza dell'aorta. Dividere vasi lombari derivanti dall'aorta, se presenti, wenza legatura.
- Posizionare il rene in soluzione salina fredda su un tampone sterile in un piatto di cultura.
- Euthanize il topo donatore per dislocazione cervicale.
4. Trapianto di Rene - Rene Preparazione
- Creare una patch aortica dividendo la parete dell'aorta longitudinalmente di fronte l'arteria renale. Identificare i lumi dei vasi nella patch che devono essere ligato o evitati quando si esegue l'anastomosi arteriosa.
- Collocare una sutura 10 / O dall'esterno all'interno del lume della vena renale superiormente ed una seconda sutura separata inferiormente. Le suture utilizzati per dividere la vena surrenale e vena gonadica possono essere utilizzati per orientare la nave.
- Posizionare il rene nel fianco destro del destinatario (Figura 1.1) e verificare che i punti di sutura sono in grado di garantire la anastomosi vascolari possono essere completate senza suture diventare intrecciati in tamponi o altri strumenti.
5. Rene Transplanzione - anastomosi vascolare
Applicare fascette microvascolari prima inferiormente poi superiormente che comprende la vena cava e aorta.
- Fare un ventomy con un ago (31G) per pungere la parete anteriore della vena cava. Lavare il sangue dalla vena cava iniettando circa 50 microlitri di 0.9% NaCl.
- Ampliare la venotomy utilizzando una pinza punta fine con la loro apertura nel venotomy modo che la lunghezza è equivalente al diametro della vena renale donatore.
- Inserire la sutura superiore 10 / O (che è già nel lume della vena renale) prima all'apice del venotomy (Figura 1.2) ed entra nella parete posteriore della anastomosi in una sutura continua fino a raggiungere l'apice inferiore (Figura 1.3).
- Posizionare il 10 / O sutura inferiore e legare prima con un singolo nodo (Figura 1.4), poi legare la sutura che va dalla parete di fondo.
- Utilizzando la sutura inferiore creare il fronte wall della anastomosi (Figura 1.5) con una sutura continua e legare alla fine sutura superiore al vertice superiore (Figura 1.6).
- Crea un aortotomy sollevando la parete dell'aorta con una pinza e taglio di una patch ellittica con le forbici (circa il aortotomy dovrebbe essere un quinto della circonferenza dell'aorta e tre volte il lume dell'arteria renale di lunghezza).
- Inserire un 10 / O sutura nel punto superiore della patch aortico dall'esterno all'interno (Figura 1.7) e passare attraverso l'aorta per legare fuori dei vasi all'apice superiore della aortotomy.
- Creare l'anastomosi arteriosa con una sutura continua a partire superiormente (Figura 1.8) anastomosing la patch donatore al destinatario aorta, fare attenzione a non costringere l'anastomosi legando la sutura troppo stretto (Figura 1.9).
- Rimuovere le pinze vascolari inferiori prima poi il morsetto superiore al reperfuse rene (Figura 1.10 e 1.11). Visibile peristalsi dell'uretere forse vede se viene raggiunto un adeguato apporto di sangue al uretere.
6 Trapianto di Rene - Anastomosi Ureteric
- Dividere eventuali allegati della vescica dalla parete addominale.
- Far passare un ago (21G) da sinistra a destra della vescica attraverso entrambe le pareti.
- Inserire punte forcep diritte nel lume dell'ago e passare sia indietro attraverso la vescica tale che le pinze sono ora passando da destra a sinistra dal lato sinistro della vescica.
- Tracciare la sutura sul uretere donatore attraverso la vescica tale che l'uretere passa nel difetto vescica sinistra poi dal lato destro.
- Suturare la avventizia dell'uretere alla avventizia della vescica con tre singoli punti staccati in giro per il punto di ingresso con 9 / O nylon sutura su un ago rotondo e corposo.
- Tagliare il prossimale dell'uretere alla legatura, aprendo così the uretere per consentire l'urina di fluire e permettere al fine uretere per ritrarre nel corpo della vescica. Visibile produzione di urina può essere osservata con sanguinamento da peri-ureterali vasi.
- Chiudere il diritto difetto vescicale laterale con un solo interrotto 9 / O sutura di seta.
7 Recupero e assistenza post-operatoria
Sostituire i visceri gastro-intestinale in addome secondo l'orientamento originale e chiudere la parete addominale mediante il ravvicinamento delle muscoli retti con 6 / O sutura assorbibile.
- Approssimare la pelle con clip in metallo pelle.
- Parzialmente invertire l'anestesia con una iniezione sottocutanea di cloridrato atipamazole (10 ml / g).
- Somministrare analgesia sottocutanea buprenorfina cloridrato (0,05 mg / kg) e il supporto per l'iniezione di fluido 1 ml di sottocutanea 0,9% NaCl.
- Recuperare il mouse in un armadio riscaldamento a 28 ° C per 24-48 ore. Osservare il mouse per malattia fino allacompletamento dell'esperimento.
- Rimuovere le clip di pelle metallo 7 - 10 giorni dopo l'intervento.
- Una volta che l'esperimento è completo eutanasia il mouse per dislocazione cervicale.
- Togliere e raccogliere il rene controlaterale e allogenico per l'analisi istologica.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Renale rigetto del trapianto allogenico può essere valutata mediante analisi istologica di sezioni di tessuto incluse in paraffina methacarn-fisso del rene trapiantato (Figura 2). Trapianto di reni tra Isograft risultati topi singenici in renale danno da riperfusione ischemica, comunque da 4 settimane di tubuli hanno recuperato e sono istologicamente paragonabili a reni nativi. Rigetto acuto può essere modellato da C57BL / 6 trapianto renale in riceventi BALB / c, entro 1 settimana non vi è diffusa infiltrazione di cellule mononucleate in tutto il parenchima renale, che coinvolge l'interstizio, glomeruli e tubuli. Danni cronica del trapianto può essere modellato da C57BL / 6 BM12 reni trapiantati in C57BL / 6 destinatari, questo si traduce in caratteristiche tipiche presenti nella patologia umana composta da fibrosi interstiziale e la perdita graduale tubulo. Conteggio tubulo lordo per settore ad alta potenza (ingrandimento x200) permette la quantificazione della massa nefrone funzionale (Figura 3), perdita di tubuli riflette danno tubulare dovuto al rifiuto. Fibrosi interstiziale può essere identificato con la macchia picrosirius pan-collagene rosso (Figura 4). Collagene endogeno normale si osserva, tuttavia durante il danno cronico nuovo collagene si deposita con conseguente fibrosi progressiva. Il danno cronico diventa evidente tra le 8 e le 12 settimane dopo il trapianto (Figura 5).
Una curva di apprendimento significativo deve essere superata al fine di stabilire il modello (Figura 6). Si stima che circa 40 procedure sono state eseguite nei topi recuperato prima volta anastomosi vascolare riproducibile è stata raggiunta con la sopravvivenza accettabile libera di complicazioni. Il motivo più comune per eutanasia il mouse era dovuto a paralisi degli arti posteriori secondaria degli arti inferiori e l'ischemia del midollo spinale relativi alla trombosi arteriosa, ma nella nostra esperienza heparization sistemica riduce l'incidenza di questo. I topi sono stati regolarmente monitored secondo i criteri concordati a livello locale per terminare gli esperimenti. Esperimenti di sopravvivenza eseguite in fase di plateau della curva di apprendimento ha portato in un tempo anastomosi vascolare media di 28,9 ± 0,47 min.
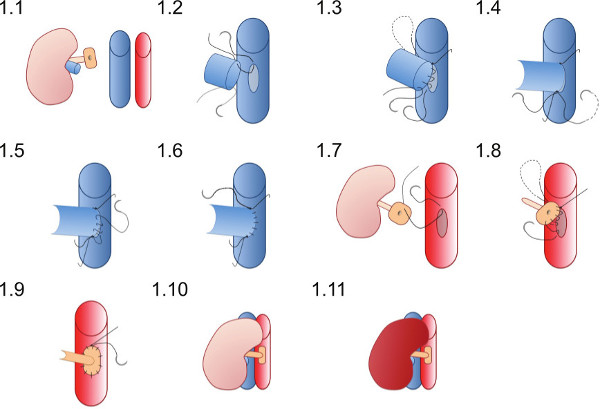
Figura 1 Rappresentazione schematica della tecnica di anastomosi vascolare. Il rene del donatore si trova nel fianco destro del mouse destinatario. La vena renale donatore viene anastomizzato in modo end-to-side e l'arteria renale donatore su una patch di aorta è anastomizzata all'aorta destinatario.

Figura 2 Rappresentante danno tubulare istologico nel rene trapiantato. Dopo la fissazione nei tessuti soluzione di metil Carnoyl sono stati incorporati in parafsezioni di pinna e di tessuto di 4μm sono state colorate da Hemotoxylin e eosina. A 4 settimane dopo il trapianto isograft reni non presentano danno tubulare e sono paragonabili ai reni nativi in apparenza. C57BL / 6 BM12 reni trapiantati in riceventi BALB / c sono sottoposti rigetto acuto con infiltrati diffusi di cellule mononucleate (*) e tubuli necrotiche (**) e tubulitis. C57BL / 6 BM12 reni trapiantati in C57BL / 6 risultati in danno cronico del trapianto allogenico caratterizzata da infiltrati linfocitari perivascolari (blocco freccia ⬆) e la fibrosi interstiziale e atrofia tubulare (frecce vuote ⇧). Cliccate qui per vedere una versione più grande di questa figura.

Figura 3 Quantificazione del danno tubulare nel TR rene ansplanted. tubuli sani (definita dalla presenza di una membrana intatta seminterrato, lume del tubulo intatti, volume del citoplasma sano e una spazzola microvilli apicali mantenuto) che riflette il funzionamento di massa nefrone può essere quantificata contando il numero medio di tubuli per campo (ingrandimento x200 ) (n = 6, media di 10 campi consecutivi, ** p <0.01).

Figura 4 danni cronica del trapianto può essere identificato da fibrosi interstiziale (immagini rappresentative). Deposizione di collagene all'interno del rene trapiantato è evidente dal rilevamento di picrosirius colorazione rossa del collagene. Cliccate qui per vedere una versione più grande di questa figura.
figura 5 "src =" / files / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figura 5 Quantificazione di fibrosi interstiziale. Fibrosi interstiziale misurata da picrosirius positività rosso è sollevata in C57BL / 6BM12 ⇒ C57BL / 6 destinatari dodici settimane dopo trapianto (n = 6, media di 10 campi consecutivi, ** p <0.01, * p < 0.05).

Figura 6 Curva di apprendimento. Esperimenti non-recupero iniziale in topi anestetizzati terminali sono stati effettuati per sviluppare la tecnica chirurgica. Questa è stata seguita da esperimenti di recupero per ottenere un rene trapiantato con successo nuovamente perfusi con un mouse sopravvivere senza complicazioni.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il modo più ben descritto effettuare l'anastomosi arteriosa è utilizzare l'aorta distale del donatore, con l'arteria renale in continuazione, in modo end-to-side all'aorta destinatario. Descriviamo l'uso di una patch aortica, simile al mirroring 'Carrell cerotto' che ha effettuato nel trapianto di rene umano che riteniamo essere più conveniente. Anche se segnalazioni in letteratura di tempo donatore e ricevente operativa sono scarsi crediamo che utilizzando una patch aortico al destinatario aorta invece di aorta donatore end-to-side al destinatario aorta è preferibile. Utilizzando una patch nega la necessità di sezionare tutti i rami dell'aorta donatori lombare, e anche il tempo impiegato per legare individualmente, come anastomosing una patch esclude naturalmente questi.
Passaggi critici per realizzare questo modello includono avendo cura di assicurare che non ci siano altre lumen arterioso diversi dell'arteria renale nel anastomosi arteriosa cerotto comecolerà quando morsetti micro-vascolari vengono rimossi. Le suture costruire le anastamoses possono essere legati strettamente, ma essere consapevoli dell'effetto borsa-stringa che può restringere l'anastomosi e causare ischemia o inibire qualsiasi flusso di sangue, in praticità abbiamo osservato che ha fornito il aortotomy ellittica è di dimensioni sufficienti borsa-stringa effetto non viene rilevato. Il venotomy è realizzato con un ago poi ampliato da stretching con le pinze, crediamo che questo sia preferibile al taglio come stiramento con una pinza crea un anello di tessuto venoso che può essere facilmente visto e aiuti sutura per creare un anastomosi stabile. L'anastomosi ureterale alla vescica è una componente molto importante da considerare, sosteniamo la tecnica descritta qui piuttosto che una vescica-cupola vescicale ricostruzione che è stata associata con perdita di urina e stenosi ureterali presumibilmente a causa ischemia. La nostra tecnica descritta consente una lunghezza ureterale donatore più breve da utilizzare in quanto è direttamente anastomizzata al bladder 5. Utilizzando questi miglioramenti tecnici siamo stati in grado di ridurre significativamente la quantità di tempo necessario per completare questo modello sperimentale. Infatti con due operatori che lavorano contemporaneamente cinque pazienti trapiantati possono essere eseguiti al giorno con tempo sufficiente per consentire il recupero e il monitoraggio dei topi.
Una limitazione importante del modello descritto e tecnica in questo documento è che il mouse è lasciato con uno dei suoi reni nativi in situ tale che il mouse non dipende dal rene per la sopravvivenza. Alcuni autori hanno riportato la rimozione del secondo rene nativo immediatamente al momento del trapianto o cinque a dieci giorni dopo il trapianto, lasciando così il mouse affidamento sul rene trapiantato. Ciò consentirebbe di sopravvivenza ad essere usato come un risultato sperimentale e campionamento del sangue per misurare i parametri della funzionalità renale come creatinina sierica o urea nel sangue. Tuttavia non vi è alcuna differenza nei risultati istologiciquando si confrontano i topi dipendenti dal allotrapianto e quelli con un solo rene nativo 9. Il nostro protocollo descritto non vi osti e anzi il secondo rene nativo potrebbero essere rimossi in un dato intervallo di tempo. Un'ulteriore limitazione è che le competenze micro-chirurgia avanzata è necessaria per eseguire una anastomosi arteriosa e venosa, anche se con formazione e utilizzando la figura tecnica per istruzione può essere superata. Possono verificarsi complicanze vascolari, essendo questi arteria o vena trombosi renale, questo risulti sempre che la topo che mostrano segni di disagio, cattiva salute o specificamente arti posteriori paralisi. Pertanto rigorosa governance e monitoraggio di topi è indispensabile quando si utilizza questo modello.
Rigetto acuto del trapianto renale è stato ampiamente trattato da immunosoppressione e la terapia di induzione che riducono linfociti circolanti, tuttavia episodi di rigetto cellulo-mediata possono ancora verificarsi durante gli innesti renalivita. Pertanto, gli studi dei meccanismi alla base di questo sono ancora pertinenti e possono identificare nuovi percorsi per il trattamento. In completo mancata corrispondenza MHC, come ad esempio C57BL / 6 in BALB / c, significa sopravvivenza dipende dal trapianto di rene è stato segnalato per essere a partire da 7,4 giorni a 10. Istologicamente rigetto cellulare acuto vascolare e può essere identificato da infiltrazione linfocitaria, emorragia ed edema nell'interstizio, tubulitis, vasculite, con necrosi glomerulare e tubulare. I processi combinati contribuiscono a danni cronica del trapianto hanno reso questa zona difficile da studiare. Le caratteristiche istologiche comprendono fibrosi interstiziale, atrofia tubulare, glomerulosclerosi e proliferazione intimale. La lesione progressiva è associata a persistente infiltrazione di cellule T, tuttavia è sempre più apprezzato che molti altri fattori possono essere coinvolti. Potenziali media di lesioni persistenti includono deposizione complemento a causa di anticorpi specifici donatore, le cellule B, le cellule natural killer, macrofagi e cellule intrinseche all'innesto quali l'endotelio 3. Pertanto, questo modello consente lo studio di queste diverse sfaccettature di rifiuto.
Ci sono stati circa 70 studi pubblicati che utilizzano questo modello, nonostante la sua precoce descrizione 4, questo è in confronto ai modelli murini di danno renale da ischemia-riperfusione, dove ci sono stati diverse centinaia di articoli. L'importanza di questo modello murino di trapianto di rene intra-addominale è che ricrea direttamente il processo di trapianto di rene umano, inoltre beneficia l'uso di ceppi di topi inbred ben definiti che può essere utilizzato per modellare diversi meccanismi di rigetto. Quindi gli studi che utilizzano questo modello sono molto traducibili. Altre applicazioni future di questo modello includono studiando le anomalie renali intrinseche da trapianto renale con fenotipi specifici da modelli knockout in topi wild-type o, al contrario wild-type reni in geneticamentedestinatari alterati.
Questo modello può replicare con successo il processo di trapianto renale umano. L'uso di ceppi inbred topo consente la selezione di combinazioni donatore-ricevente di varia differenze MHC. Inoltre l'uso di topi permette l'uso di varie tecniche tra cui knockout e sistemi inducibili per sondare i diversi aspetti di rigetto.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Finanziamento da Rene Research UK, The Royal College of Surgeons di Edimburgo e la Società Europea di Trapianto sostenuto questo studio.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



