Introduction
腎不全の治療のために成功した腎移植は、まずそれ以来、人生2の長さと品質の両方で改善を提供し、世界中の末期腎不全患者のための革新的な治療法となっており、1一卵性双生児の間で1955年に記載された。しかし長期的な移植片の生存は、慢性同種移植片損傷3をもたらし病理学的プロセスの多数によって妨げられてきた。
ヒトでの移植された腎臓の拒絶はimmunosupporessiveレジメンの大幅な改善にもかかわらず、罹患率の主要な原因である。腎移植のマウスモデルを開発の目的は密接にヒト腎移植4で見つかったプロセスおよび病理を複製することである。 Skoskiewicz らは、最初に1973年5において腎移植のマウスモデルを説明した。高度な顕微スキルが必要とされているが、それは価値のあるtといくつかの理由からOOL:マウスゲノムは、十分に特徴付けられており、実験方法とマウスの研究のために利用可能な技術の多種多様があります。
腎移植のマウスモデルを使用して多くのグループがしかし、実験4の期間中、 その場に放置されている他の研究でレシピエントマウスのネイティブ腎臓の私達の記載された方法論1で、生命維持器官などの移植された腎臓を使用している。利点は、マウスが、それによって、マウスへの罹患率と第二の手順による死亡のリスクを低減シングル麻酔して、操作を受けるということです。さらにマウスが緩やかな腎不全の悪影響を受けない。
同種異系拒絶のモデルは、心臓、皮膚などの他の臓器に存在するが、これらは常に腎移植とは直接関係ありません。これらのモデルは、異なるモードとdyを誘発するという証拠がある拒絶反応のナミックスは、例えば、心臓同種移植、腎同種移植における拒絶反応の時間的経過は、特定の菌株の組み合わせ6で大幅に異なっている。私たちは、非トランスジェニックFVB / NJマウスにBALB / c系ドナーにおいて急性腎同種移植片拒絶反応パターンを記載して、このモデルは、T細胞およびマクロファージ7の蓄積による細胞媒介性傷害を示した。代替的に、私たちはまた、間質性線維症および尿細管萎縮を示し、慢性の同種移植片損傷のモデルを記載したこれらのマウスは、単一のMHCクラスII遺伝子座のミスによって特徴付けられるように、これは、C57BL / 6レシピエントにC57BL / 6 BM12ドナーからの腎臓移植から生じる-match 8。
移植の複数の態様は、急性拒絶反応、細胞性および体液性拒絶反応、虚血再灌流障害、および新規治療薬を試用を含む腎移植のマウスモデルを用いて研究されている。 私たちは、外科トンを変更した運転時間を短縮し、手術の容易性を向上させるechnique。特に、私たちは、同時ドナーとレシピエントの準備および連続大動脈パッチ吻合を利用することによって単純化された血管吻合技術を記載している。このビデオと原稿が、この技術の確立を支援するために重要なポイントを提供します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
適切な国や地方の機関倫理、動物実験を行う前になされるべきである。受信者の外科医は2.1 2.8に出演しながら、具体的に、英国で以下の実験は、ドナー外科医が行うべき2 microsurgeonsが同時に動作するために利用可能である動物(科学的手続)法1986の下で実施された、1.1から1.16、その後3.1から3.5のステップ。一人のオペレータのためのステップを順次追跡することができる。
1ドナーの準備
注:ここで紹介する手順は、ドナーC57BL / 6 BM12と受信者の20グラムよりも大きい体重を8から16週齢歳のC57BL / 6雄マウス用です。しかし、この手順は、再現性のマウス系統の多様で行うことができる。代表的な結果のセクションに示したデータは、C57BL / 6、C57BL / 6 BM12及びBALB / cマウスから得た。
- 行動手順を使う可能な限り無菌の動作領域を維持するための努力とgの無菌手術器具や消耗品(オートクレーブ処理)、。 2外科医が利用可能な場合に、受信者の準備と同時に、ドナーの準備を行います。
- メデトミジン(0.5ミリグラム/ kg)および塩酸ケタミン(/ kgを200 mg)を腹腔内注射(31G針)でマウスを麻酔。全体の手順のために十分な時間を提供する4時間維持される麻酔薬平面におけるこの結果は、実行される。補足麻酔は必要ありません。
- マウスは(つま先のピンチへの応答)を麻酔していないことを確認してください。
- マウスの腹部を剃ると粘着テープを持つ任意の抜け毛を取り除く。
- 無菌ドレープ加熱されたマットの上に仰向けにマウスを置き、ゆるく無菌マスキングテープで手足を固定化する。
- 熱傷のための手順全体を通して、マウスを監視します。可能であれば、非電気の熱源を使用しています。
- 眼の潤滑剤とSAを適用します希薄ヨウ素溶液と腹壁をnitize。
- 腹膜腔に入り、3センチメートルゴシック腹部開創を挿入するために腹部正中切開を行います。
- しっとり腸や手術領域を維持し、内臓の不必要な乾燥を避けるために温め、生理食塩水を適用します。
- 無菌ドレープでマウスを覆い、大動脈、大静脈と左腎臓を露出させるために、オペレータの左(マウスの右)に腸を動かす。
- 胃にラチェット鉗子を適用し、完全に主要な血管や左腎臓を露出するように上方に引っ張る。そのような肝葉、精嚢、および腸のように、離れて手術領域からの組織を後退させる腹部に無菌の綿棒(2mm×2mmと)を減衰させる梱包してください。
- 周囲の外膜、脂肪とぶっきらぼうに先端の細いピンセットを用いて結合組織を切開することにより腹腔内左副腎から左腎臓を分離します。 NEエリア間鉗子の閉じた先端を置きますedは分離され、ゆっくりと鉗子先端がスペースを解剖するために開くことを可能する。
- 結紮した後、9 / Oナイロンで左副腎静脈と左性腺静脈を分割することにより左腎静脈を分離します。腎静脈に近い縫合糸を配置します。
- ライゲーションおよび縫合糸を残して膀胱に近い7 / O絹縫合糸で尿管を分割するには、長い終了します。腎臓を採取し、尿管吻合のために必要な時にこれらの長い縫合糸端部が使用される。
- 動員し、完全に腎動脈と静脈に大動脈と大静脈上方および下方を分析するには、ぶっきらぼうに血管の正面と側面からリンパ管や脂肪を切開する先端の細い鉗子を使用しています。
- 大動脈と大静脈の間の組織面を見つけて、ゆっくりと鉗子を広げた。ゆっくりと、最小限の外傷で組織を広げるために細かい傾いて鉗子の先端を開きます。
- 角度の付いた罰金を渡すことで、腎動脈に上位および下位大動脈周囲の緩い7 / Oシルクネクタイ血管の前後を通して縫合糸を引くの周り先端鉗子。これらの縫合糸はウィスコンシン大学液の逆行性灌流を可能にするために、腎臓の取得の前に強化される。
2受信者の準備
ドナーの準備のフォローあたりとしては1.2〜1.8を繰り返します。
- 大動脈、大静脈を露出させるために、オペレータの右(マウスの左)に腸を移動します。滅菌生理食塩水に浸した綿棒で腸をカバー。
- 右腎動脈を連結することにより、右腎摘出術を行い、7/0絹縫合糸と一緒に静脈、その後分割します。
- 7 / O絹縫合および除算と右尿管を連結。
- 動員し、ステップ1.14と1.15で説明したように、完全に腎動脈と静脈に劣る大動脈と大静脈を解剖。大動脈と大静脈間の完全な解剖を確認してください。大静脈とaortの前方に動作する内部精巣動脈を保つように注意してくださいリンパ管の束と一緒に。
- 、大静脈と静脈から脊椎に後腹膜で実行されている腰椎の血管を識別し、連続9 / O絹糸で結紮、血管を分割する必要はありません。
- 血管吻合のための間にスペースを微小血管クランプを配置するために十分なスペースを特定します。
- 背側陰茎静脈を介して静脈内ヘパリン(5単位)を管理します。
3ドナー腎臓検索
動脈循環から腎臓を分離するために劣ると優れた大動脈の周囲に配置された7 / Oシルクネクタイを締めます。
- 大動脈に針(31G)とウィスコンシン大学溶液0.5ml - 逆行冷たい0.2を注入。
- 縫合糸内の大動脈を分割し、腎臓と大動脈の長さの腎動脈を除去するために大静脈との接合部で腎静脈を分割。大動脈から生じる腰椎血管を分割し、それらが存在する場合、wのithoutライゲーション。
- 培養皿中の滅菌綿棒で冷生理食塩水で腎臓を置きます。
- 頸椎脱臼によってドナーマウスを安楽死させる。
4。腎臓移植 - 腎臓の準備
- 腎動脈の向かい縦方向に直接大動脈壁を分割することにより、大動脈パッチを作成します。動脈吻合を行う際にライゲートまたは回避する必要があるパッチ内の任意の血管の内腔を特定します。
- 下方上方腎静脈内腔の外側から内側に10 / O縫合糸を配置し、第2の別の縫合糸。副腎静脈および性腺静脈を分割するために使用される縫合糸は、容器を方向付けするために使用することができる。
- 受信者の右脇腹( 図1.1)に腎臓を置き、血管吻合は綿棒や他の楽器に絡めなるの縫合することなく完了することができることを確認するために、縫合糸が十分に配置されていることを確認してください。
5。腎臓Transplanテーション - 血管吻合
最初に下方その後上方大静脈と大動脈を取り囲む微小血管クランプを適用します。
- 大静脈の前壁を穿刺することによって針(31G)でventomyを行います。 0.9%NaClを約50μLを注入して大静脈から血液をフラッシュ。
- 長さはドナー腎静脈の直径に相当になるように静脈切開内でそれらを開くことによって、先端の細いピンセットを用いて静脈切開を広げる。
- 静脈切開( 図1.2)の頂点に最初の(腎静脈の内腔に既にある)10 / O優れた縫合糸を配置し、劣っ頂点に達するまで( 図を実行している縫合糸での吻合の後壁に参加1.3)。
- 10 / O劣る縫合糸を配置した後、後壁から実行している縫合糸に結びつの結び目( 図1.4)で最初に接続します。
- 劣った縫合糸を使用したフロントWALを作成吻合lの連続縫合で( 図1.5)と優れた頂点( 図1.6)で、優れた縫合糸端に接続します。
- 鉗子で大動脈壁を拾うとハサミで楕円形のパッチを(ほぼ大動脈切開は大動脈の周囲の長さで三回腎動脈内腔の第五でなければならない)切断することによって大動脈切開を作成します。
- 外部から内部への大動脈パッチの優れた点( 図1.7)で10 / O縫合糸を配置し、大動脈切開の優れた頂点に血管外に結ぶために大動脈を通過する。
- 受信者の大動脈にドナーパッチを実行している吻合縫合糸が上方に始まると動脈吻合( 図1.8)を作成します( 図1.9)きつすぎる縫合糸を結びつけることによって吻合を収縮しないように注意してください。
- (腎臓を再灌流まず、優れたクランプ劣る血管クランプを取り外し図1.10および1.11)。尿管に十分な血液供給が達成されている場合尿管の蠕動可視多分見。
6腎臓移植 - 尿管吻合
- 腹壁から膀胱の添付ファイルを分割します。
- 両方の壁を介して膀胱の左から右へ針(21G)を渡します。
- 針管腔内にストレート鉗子先端を置き、鉗子が今膀胱の左側から右から左に通過しているように、膀胱を通って両方がバックに渡す。
- 尿管が右サイドから次に左膀胱不良で通過するように、膀胱を経てドナー尿管上の縫合糸を描画します。
- ラウンドボディの針で9 / Oナイロン縫合糸のエントリポイントを中心に3つの結節縫合で膀胱の外膜への尿管の外膜を縫合。
- こうして目を開いて、合字に尿管の近位にカット電子の尿は、尿が流れると尿管の端部が膀胱の体内に引っ込めることができるように許可する。尿の可視生産はペリ尿管の血管からの出血と一緒に観察することができる。
- シングル中断された9 / O絹縫合糸で右側膀胱不良を閉じます。
7。回復と術後ケア
元の向きで腹部に胃腸内臓を交換して、6 / O吸収性縫合糸で直筋を近似することにより腹壁を閉じます。
- 金属の皮膚クリップで皮膚に近似している。
- 部分的atipamazole塩酸塩(10μL/ g)を皮下注射による麻酔を逆転。
- 皮下の0.9%NaCl 1mlを皮下ブプレノルフィン塩酸塩(0.05ミリグラム/ kg)を、流体支援注入に鎮痛を管理します。
- 24〜48時間、28℃で加温キャビネットにマウスを回復します。までの病気のためのマウスを観察します実験終了。
- 10日に作動ポスト - 金属の皮膚クリップ7を削除します。
- 実験が完了すると、頚椎脱臼によりマウスを安楽死させる。
- 取り外し、組織学的分析のための対側腎臓および同種移植片を収集します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
腎臓の同種移植片拒絶は、移植された腎臓( 図2)のmethacarn固定パラフィン包埋組織切片の組織学的分析によって評価することができる。腎臓の虚血再灌流障害における同系マウスの結果の間に腎臓の同系移植移植は、しかし、4週間までに細管を回収し、ネイティブの腎臓への組織学的に同等であるしている。急性拒絶反応は、BALB / cレシピエントにC57BL / 6腎臓移植によってモデル化することができる、1週間以内に拡散し、単核細胞浸潤は、間質、糸球体及び細管を含む、腎実質全体に存在する。慢性同種移植片の損傷が、C57BL / 6レシピエントに移植したC57BL / 6 BM12腎臓によってモデル化することができる、これは間質性線維症および段階的な尿細管の損失からなるヒト病態に見られる典型的な特徴になる。ハイパワーフィールド(×200倍率)あたりの総細管数は(Fiを提供して機能的ネフロン塊の定量化を可能にするグレ3)、尿細管の損失が拒絶に起因する細管障害を反映している。間質性線維症は、汎コラーゲン染色ピクロシリウスレッド( 図4)を用いて同定することができる。通常の内因性コラーゲンは、しかし、進行性の線維症を生じる堆積される慢性の損傷新しいコラーゲンの間に、観察される。慢性損傷は、移植後の見かけは8〜12週間( 図5)となる。
重要な学習曲線はモデル( 図6)を確立するために克服する必要がある。推定40の手順は、再現性のある血管吻合時間は合併症の自由許容される生存と達する前に回収されたマウスで行った。マウスを安楽死させるための最も一般的な理由は、しかし、私たちの経験では、全身heparizationこの発生率を減少させ、下肢および血栓症、動脈に関連する脊髄虚血に続発後肢麻痺によるものであった。マウスは日常カ月だった実験を終了するためのローカルで合意された基準に従ってnitored。学習曲線のプラトー相で行われるサバイバル実験は、28.9±0.47分、平均血管吻合時間をもたらした。
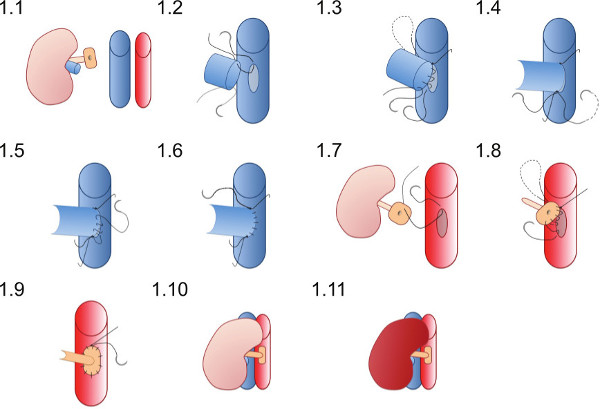
血管吻合技術の図1に概略図が。ドナーの腎臓をレシピエントマウスの右脇腹に配置されます。ドナー腎静脈は、エンド·ツー·サイド方式で吻合され、大動脈のパッチ上のドナー腎動脈は、受信者の大動脈に吻合される。

移植された腎臓における図2の代表的な組織学的細管障害。メチルCarnoylのソリューション組織における固定後パラフィンに包埋した4μmのフィンや組織切片は、ヘモトキシリン及びエオシンにより染色した。腎臓が細管障害を示し、外観のネイティブ腎臓に匹敵しない同系移植片移植後4週目に。 BALB / cレシピエントに移植したC57BL / 6 BM12腎臓はびまん性単核細胞浸潤(*)および壊死細管(**)および尿細管炎を伴う急性同種移植拒絶反応を受ける。血管周囲リンパ球浸潤(ブロック矢印⬆)を特徴とする慢性同種移植片の損傷や間質性線維症および尿細管萎縮(中空の矢印⇧)でのC57BL / 6の結果に移植したC57BL / 6 BM12腎臓。 この図の拡大版をご覧になるにはこちらをクリックしてください。

TRに細管障害の図3。定量機能するネフロンの質量を反映し(無傷の基底膜の存在によって定義された、無傷の尿細管内腔、健康な細胞質体積、維持頂端微絨毛刷子縁)ヘルシー細管は、フィールド当たりの細管の平均数を計数することによって定量することができる。腎臓ansplanted(×200倍率10の連続するフィールドの時)(n = 6、平均、**はp <0.01)。

図4慢性同種移植片の損傷が間質性線維症(代表画像)によって識別することができます。移植された腎臓内のコラーゲン沈着は、コラーゲンのピクロシリウスレッド染色を検出することによって明らかである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
グレ5 "SRC =" /ファイル/ ftp_upload / 52163 / 52163fig5highres.jpg "/>
間質性線維症の図5定量化。ピクロシリウス赤い陽性によって測定され間質性線維症は、** P <0.01、*はp <C57BL / 6BM12⇒C57BL / 6レシピエント移植(N = 6、10連続したフィールドの平均を以下の12週間で上昇し0.05)。

図6の学習曲線。致命的な麻酔をかけたマウスにおける初期の非回収実験は、手術技術の開発が行われた。これは、合併症なしに生存しているマウスで正常に再灌流移植された腎臓を達成するための回収実験を行った。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
動脈吻合を実行するために、最もよく説明した方法は、受信者の大動脈にエンド·ツー·サイド方式では、継続中の腎動脈に、ドナーの遠位大動脈を使用することです。私たちは、より便利であると私たちは信じている人間の腎臓移植で行われる「カレルパッチ」ミラーリングと同様、大動脈パッチの使用を記載している。ドナーとレシピエント手術時間の文献の報告が疎であるが、私たちは、受信者の大動脈に代わりに、エンドツーサイドドナー大動脈の受信者の大動脈に大動脈パッチを利用することが望ましいと考えています。パッチを使用すると、すべての腰椎のドナーの大動脈の枝を解剖する必要性を否定し、また時間が自然にこれらを除外するパッチを吻合するように、個別に連結するように注意。
このモデルを達成するための重要なステップは、動脈パッチ吻合内の腎動脈以外の他の動脈の内腔がないことを確認するために世話をして含まれ、それら微小血管クランプが削除されたときにリークします。吻合を構築する縫合糸は密接に関連しますが吻合を絞り込み、虚血を引き起こしたり、任意の血流を阻害することができる巾着効果を認識して、実用性に私たちは楕円形の大動脈切開を提供することを観察したことができ、十分な大きさの巾着です効果は発生しません。静脈切開、次いでピンセットで延伸することにより拡幅針で作られて、私たちは、これは、鉗子で延伸が容易に見ると安定した吻合を作成するために縫合を支援することができ、静脈組織のリングを作成するように切断することが好ましいと考えています。膀胱に尿管吻合は、私たちが、尿漏れや尿管狭窄おそらく虚血と関連している膀胱の再構築に膀胱ドームではなく、ここに記載されている技術を提唱し、考慮すべき非常に重要な要素である。当社の記載の技術は、それが直接bladdに吻合される短いドナー尿管の長さが使用されることを可能にするえー5。これらの技術改良を利用することによって、私たちはかなりこの実験モデルを完了するために必要な時間の量を減らすことができた。実際、同時に5移植レシピエントの作業の2つの演算子では、マウスの回復および監視を可能にするために十分な時間が一日あたりに行うことができます。
本論文で説明したモデルと技術の主な制限は、マウスがマウスが生存のために腎臓に依存しないように、その場でそのネイティブ腎臓の一つを残していることである。一部の著者は、このように移植された腎臓に依存マウスを残し、すぐに移植時または移植後5〜10日で第2のネイティブ腎臓の除去を報告している。これは、生存率は、血清クレアチニン、血液尿素などの腎機能のマーカーを測定するための実験結果と同様にサンプリング血液として使用することができるようになる。しかし、組織学的な結果に違いはありません同種移植に依存して、単一のネイティブ腎臓9にこれらのマウスを比較した場合。当社の記載されたプロトコルは、これを排除するものではない、実際に第二のネイティブ腎臓は、所定の時間間隔で除去することができた。追加の制限は、高度なマイクロ外科専門知識をも訓練で、これを克服することができる命令のための技術の図を利用して、動脈および静脈吻合を実行するために必要とされることである。血管合併症が発生する可能性があり、これらは腎動脈や静脈血栓症であることは、これは常に苦痛の徴候、不健康または特異的に後肢の麻痺を表示するマウスが得られる。このモデルを利用するときにそのためマウスの厳格なガバナンスとモニタリングが不可欠です。
腎移植の急性拒絶反応が大きく免疫抑制および循環リンパ球を枯渇導入療法によって治療したが、細胞媒介性拒絶反応のエピソードはまだ腎移植片全体に発生する可能性があります人生。したがって、この基礎をなす機構の研究は依然として適切であり、治療のための新規の経路を識別することができる。 BALB / cのようにC57BL / 6などの完全なMHCミスマッチでは、腎移植に依存する平均生存期間は7.4日間10と低いことが報告されている。組織学的に急性の細胞および血管拒絶は糸球体や尿細管壊死とリンパ球浸潤、間質における出血や浮腫、尿細管炎、血管炎によって同定することができる。慢性の同種移植片の損傷に貢献する複合プロセスは、研究に困難なこの領域を作った。組織学的特徴は、間質性線維症、尿細管萎縮、糸球体硬化症および内膜増殖を含む。進行性の傷害が持続的なT細胞の浸潤に関連している、しかし、それは、ますます多くの他の要因が関与し得ることが理解される。永続的な損傷の潜在的な媒介起因ドナー特異的抗体、B細胞、ナチュラルキラー細胞への補体沈着を含むこのような内皮3、マクロファージ、および移植片に固有の細胞。したがって、このモデルでは、拒絶反応のこれらのさまざまな側面の研究を可能にする。
これは、数百の記事があった腎臓虚血再灌流障害のマウスモデルと比較している場合、その初期の説明4にもかかわらず、このモデルを利用して約70公表された研究がなされてきた。腹腔腎臓移植のこのマウスモデルの重要性は、さらに、それは拒絶の異なるメカニズムをモデル化するために使用することができる明確に定義された近交系マウス株の使用から利益を得る、直接ヒト腎臓移植の過程を再現していることである。したがって、このモデルを用いた研究は、非常に翻訳可能である。このモデルの他の将来の応用は、遺伝子内の特定の野生型マウスへのノックアウトモデルの表現型または逆に、野生型腎臓で腎臓を移植することによって内因性腎異常を研究挙げ変更された受信者。
このモデルは、成功したヒト腎移植のプロセスを複製することができます。近交系マウス株の使用は、さまざまなMHC差のドナー - レシピエントの組み合わせの選択を可能にする。さらに、マウスの使用は、拒絶反応の異なる側面をプローブするためのノックアウトおよび誘導システムを含むさまざまな技法の使用を可能にする。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者らは、開示することは何もない。
Acknowledgments
腎臓研究英国、エジンバラの外科ロイヤルカレッジと臓器移植の欧州協会からの資金調達は、この研究を支持した。
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



