Introduction
Transplante renal bem sucedido para o tratamento da insuficiência renal foi descrita pela primeira vez em 1955 entre gêmeos monozigóticos 1, desde então, tornou-se um tratamento revolucionário para pacientes com insuficiência renal terminal em todo o mundo, oferecendo a melhoria da esperança e qualidade de vida 2. No entanto sobrevida do enxerto a longo prazo tem sido dificultado por uma multidão de processos patológicos, resultando em danos crônica do enxerto 3.
A rejeição do rim transplantado em humanos continua a ser uma das principais causas de morbidade, apesar das melhorias significativas nos regimes immunosupporessive. O objetivo de desenvolver um modelo do rato de transplante renal é replicar de perto o processo e patologia encontrada no transplante renal humano 4. Skoskiewicz et al. Descreveu pela primeira vez o modelo do rato de transplante renal em 1973 5. Embora sejam necessárias técnicas de microcirurgia avançados, é um valioso tool por várias razões: o genoma de ratinho foi bem caracterizada e não existe uma grande variedade de métodos e técnicas experimentais disponíveis para estudos com ratinhos.
Muitos grupos utilizam o modelo do rato de transplante renal têm usado o rim transplantado como um órgão de apoio à vida, no entanto, em outros estudos e na nossa metodologia descrita um dos rins nativa do rato destinatário é deixado no local durante todo o período do experimento 4. A vantagem é que o rato passa por uma única operação de anestesia e reduzindo desse modo a morbidade para o rato e o risco de morte de um segundo procedimento. Além disso, o mouse não sofrer com os efeitos adversos da insuficiência renal progressiva.
Apesar de existirem modelos de rejeição alogênico em outros órgãos, como o coração e pele, estes nem sempre são diretamente relevantes para o transplante renal. Há evidências de que esses modelos suscitar diferentes modos e dynamics de rejeição, por exemplo, o curso de tempo de rejeição do enxerto cardíaco em enxerto renal e difere significativamente em determinadas combinações de cepa 6. Nós descrevemos padrões de rejeição do enxerto renal aguda em BALB doadores / c em não-transgênicos camundongos FVB / NJ, este modelo mostrou lesão celular mediada com acúmulo de células T e macrófagos 7. Alternativamente, também descrito um modelo de dano do aloenxerto crónica que apresenta fibrose intersticial e atrofia tubular, isto resulta a partir do transplante de um rim de ratinhos C57BL / 6 doadores BM12 em ratinhos C57BL / 6 receptores, uma vez que estes ratos são caracterizadas por uma única classe de MHC II mis loci -match 8.
Vários aspectos do transplante, foram estudados utilizando o modelo do rato de transplante renal, incluindo a rejeição aguda, rejeição celular e humoral, isquemia lesão de reperfusão, e testando novos agentes terapêuticos. Nós modificamos o cirúrgico technique para reduzir o tempo de operação e melhorar a facilidade de operação. Particularmente descrevemos doador simultânea e preparação destinatário e uma técnica de anastomose vascular simplificado através da utilização de uma anastomose remendo aórtico contínuo. Este vídeo e manuscrito fornecerá pontos-chave para ajudar na criação desta técnica.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Ética institucionais nacionais e locais apropriados devem estar no local antes de realizar experimentos com animais. Especificamente no Reino Unido os seguintes experimentos foram realizados sob os Animais (Scientific Procedures) Act 1986 Onde dois microsurgeons disponíveis para operar simultaneamente o cirurgião doador deve executar os passos 1,1-1,16 então 3.1 a 3.5, enquanto o cirurgião realiza destinatário 2,1-2,8 . Para um único operador os passos podem ser seguidos sequencialmente.
1. Doador Preparação
Nota: O procedimento aqui apresentado é de um doador C57BL / 6 BM12 e destinatário C57BL / 6, machos, com idade entre 8 a 16 semanas de idade com um peso corporal superior a 20 g. No entanto, este procedimento pode ser realizado de forma reprodutível de uma variedade de estirpes de ratinho. Os dados apresentados na seção de resultados representativos foi obtido a partir de C57BL / 6, C57BL / 6 BM12 e BALB / c.
- Procedimentos de Conduta using instrumentos cirúrgicos estéreis e consumíveis (autoclave), com esforços para manter a área de operações tão estéril quanto possível. Realizar a preparação dos doadores em simultâneo com a preparação destinatário se dois cirurgiões estão disponíveis.
- Anestesiar o rato com uma injecção intraperitoneal (agulha de 31G) de medetomidina (0,5 mg / kg) e cloridrato de cetamina (200 mg / kg). Isso resulta em um plano anestésico que é mantida durante 4 horas dando tempo suficiente para a totalidade do procedimento a ser realizado. Anestesia suplementar não é necessário.
- Confirme se o mouse está anestesiado (sem resposta aos pés pitada).
- Raspar o abdômen do rato e remover qualquer cabelo solto com fita adesiva.
- Posicione o mouse sobre as suas costas em uma esteira aquecida esterilmente drapeado e vagamente imobilizar os membros com fita adesiva estéril.
- Monitorar o mouse durante todo o procedimento para queimaduras térmicas. Se possível usar uma fonte de calor não-elétrico.
- Aplique um lubrificante ocular e sanitize da parede abdominal com uma solução diluída de iodo.
- Faça uma incisão na linha média do abdome para entrar na cavidade peritoneal e inserir um 3 centímetros Calibri afastador abdominal.
- Aplicar soro fisiológico aquecido para manter os intestinos e área cirúrgica úmida e evitar a secagem desnecessária das vísceras.
- Cubra o mouse com campos estéreis e mover os intestinos à esquerda do operador (direita do mouse) para expor a aorta, veia cava e rim esquerdo.
- Aplique uma pinça reajustados para o estômago e puxar superiormente para expor os grandes vasos e rim esquerdo totalmente. Embalar amortecer zaragatoas esterilizadas (2 mm x 2 mm) no abdómen para retrair tecidos longe da área cirúrgica, tais como os lóbulos do fígado, vesículas seminais e do intestino.
- Isolar o rim esquerdo de adventícia circundante, gordura e glândula adrenal esquerda na cavidade peritoneal por bruscamente dissecando o tecido conjuntivo usando uma pinça de ponta fina. Coloque as pontas fechadas da pinça entre as áreas que need para ser separados e, lentamente, permitir que as dicas fórceps para abrir a dissecar o espaço.
- Isolar a veia renal esquerda por ligação e, em seguida, dividindo-se a veia supra-renal e veia gonadal esquerdo esquerda com 9 / ó de nylon. Coloque a sutura perto da veia renal.
- Ligadura e dividir o ureter com 7 / S de seda de sutura para fechar a bexiga deixando o fio de sutura termina longo. Estas extremidades longo de sutura irá ser utilizado quando o rim é colhida e são necessárias para a anastomose uretérica.
- Para mobilizar e dissecar totalmente a aorta ea veia cava inferior e superiormente à artéria e veia renal utilize uma pinça de ponta fina para dissecar sem rodeios vasos linfáticos e gordura da parte frontal e nas laterais dos vasos.
- Encontre o plano tecido entre a aorta ea veia cava e lentamente se espalhou a pinça. Abra lentamente as pontas dos pinça fina cotado para espalhar o tecido com um mínimo de trauma.
- Amarre uma solta 7 / O de seda em torno da aorta superior e inferior à artéria renal passando um bom ângulopinça de ponta em todo o volta dos vasos e desenho uma sutura através. Estas suturas serão mais rigorosas antes da recuperação renal para permitir perfusão retrógrada da Universidade de Wisconsin solução.
2. Destinatário Preparação
De acordo com o acompanhamento preparação doador passos 1.2 a 1.8.
- Mova os intestinos à direita do operador (à esquerda do mouse) para expor a aorta, veia cava. Cubra os intestinos com uma solução salina estéril cotonete embebido.
- Realize uma nefrectomia direita por ligadura de artéria renal direita e veia juntamente com 7/0 fio de seda e depois dividir.
- Ligadura do ureter direito com 7 / O fio de seda e dividir.
- Mobilizar e dissecar totalmente a aorta ea veia cava inferior à artéria e veia renal tal como descrito no passo 1.14 e 1.15. Certifique-se de dissecção completa entre a aorta ea veia cava. Tome o cuidado de preservar a artéria espermática interna que corre anterior à veia cava e aortum juntamente com o feixe linfático.
- Identificar vasos lombares em execução no retroperitônio da veia cava e da veia para a coluna, ligar com o 9 / O de seda em continuidade, não há necessidade de dividir os vasos.
- Identificar espaço suficiente para colocar grampos microvasculares com espaço entre para anastomoses vasculares.
- Administrar heparina intravenosa (5 unidades) através da veia dorsal do pênis.
3. doador de rim Retrieval
Apertar os 7 / S laços de seda que foram colocados em torno da aorta inferior e superior para isolar o rim a partir da circulação arterial.
- Infundir retrógradas frio 0,2-0,5 ml de solução da Universidade de Wisconsin, com uma agulha (31G) na aorta.
- Dividir a aorta dentro das suturas e dividir a veia renal na sua junção com a veia cava para remover o rim e a artéria renal com um comprimento da aorta. Divide vasos lombares decorrentes da aorta, se estiverem presentes, wligadura ithout.
- Inserir o rim em solução salina fria numa compressa estéril numa placa de cultura.
- Eutanásia do camundongo doador por deslocamento cervical.
4. Transplante renal - Kidney Preparação
- Criar um remendo aórtico dividindo a parede da aorta longitudinalmente em frente à artéria renal. Identificar os lúmenes embarcação no patch que precisam ser ligados ou evitado ao realizar a anastomose arterial.
- Coloque um fio de sutura 10 / O de fora para dentro do lúmen da veia renal superiormente e uma segunda sutura separada inferiormente. As suturas usadas para dividir a veia supra-renal e veia gonadal pode ser utilizado para orientar o recipiente.
- Coloque o rim no flanco direito do destinatário (Figura 1.1) e garantir as suturas estão bem colocados para garantir anastomoses vasculares pode ser concluída sem as suturas fiquem entrelaçados em cotonetes ou outros instrumentos.
5. Kidney Transplantação - Vascular Anastomose
Aplicar grampos microvasculares primeiro inferiormente então superiormente abrangendo a veia cava e aorta.
- Adicione uma ventomy com uma agulha (31G) por punção da parede anterior da veia cava. Lavar o sangue a partir da veia cava por injecção de cerca de 50 ul de 0,9% de NaCl.
- Alargar a venotomia usando fórceps de ponta fina abrindo-os dentro do venotomia modo que o comprimento é equivalente ao diâmetro da veia renal doador.
- Coloque a sutura superior, 10 / O (que já está na luz da veia renal) pela primeira vez no ápice da venotomia (Figura 1.2) e juntar-se a parede de trás da anastomose em sutura contínua até que o vértice inferior é alcançada (Figura 1.3).
- Coloque a 10 / O sutura inferior e gravata pela primeira vez com um único nó (Figura 1.4), em seguida, amarre a sutura contínua da parede do fundo.
- Usando fio de sutura inferior criar a parede frontall da anastomose (Figura 1.5), com uma sutura contínua e gravata para o final de sutura superior no ápice superiores (Figura 1.6).
- Criar um Aortotomia por pegar a parede da aorta com uma pinça e corte um remendo elíptica com uma tesoura (aproximadamente aortotomia deve ser um quinto da circunferência da aorta e três vezes o lúmen da artéria renal de comprimento).
- Coloque um 10 / S de sutura no ponto superior do remendo da aorta a partir do exterior para o interior (figura 1.7) e passar através da aorta para amarrar fora dos vasos no vértice superior do Aortotomia.
- Criar a anastomose arterial com sutura contínua começando superiormente (Figura 1.8) anastomose o patch doador para o receptor aorta, tomar cuidado para não contrair a anastomose por amarrar a sutura muito apertado (Figura 1.9).
- Retirar os grampos vasculares inferiores primeira então o grampo superior a reperfundir o rim (Figura 1.10 e 1.11). Peristaltismo visível do ureter talvez visto se o fornecimento de sangue adequado para o ureter é alcançado.
6. Transplante Renal - anastomose ureteral
- Divida os anexos da bexiga na parede abdominal.
- Passar uma agulha (21G) a partir da esquerda para a direita da bexiga por meio de ambas as paredes.
- Coloque dicas fórceps retas no lúmen da agulha e passar tanto de volta através da bexiga de tal forma que as pinças são agora passando da direita para a esquerda para fora do lado esquerdo da bexiga.
- Desenhar a sutura no ureter dador através da bexiga tal que a uretra passa no defeito do lado esquerdo, em seguida, para fora da bexiga do lado direito.
- Suturar a adventícia do ureter à adventícia da bexiga com três únicos pontos isolados ao redor do ponto de entrada com 9 / O nylon sutura em uma agulha round-bodied.
- Corte o ureter proximal à ligadura, th abrindo assime do ureter para permitir que a urina e permitir que a extremidade do ureter para retrair para dentro do corpo da bexiga. Visible produção de urina pode ser observado junto com o sangramento de vasos peri-ureterais.
- Feche a lesão da bexiga lado direito, com uma única interrupção 9 / O fio de seda.
7 Recuperação e cuidados pós-operatórios
Substitua as vísceras gastrointestinal no abdômen na orientação original e fechar a parede abdominal, aproximando os músculos retos com 6 / O fio absorvível.
- Aproximar a pele com agrafos para pele de metal.
- Pouco inverter a anestesia com uma injecção subcutânea de cloridrato de atipamazole (10 ul / g).
- Administrar analgesia por cloridrato de buprenorfina por via subcutânea (0,05 mg / kg) e para a injecção de fluido de apoio de 1 ml de NaCl a 0,9% por via subcutânea.
- Recuperar o mouse em um gabinete de aquecimento a 28 ° C por 24-48 horas. Observe o mouse para a doença até oconclusão da experiência.
- Remova os clipes de pele de metal 7-10 dias pós-operatório.
- Uma vez que a experiência é concluída a eutanásia por deslocamento cervical do rato.
- Retire e recolher o rim contralateral e enxerto para análise histológica.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A rejeição do aloenxerto renal pode ser avaliada através da análise histológica de secções de tecido embebidos em parafina fixados com Methacarn do rim transplantado (Figura 2). Transplante de rins entre isoenxerto resultados ratos sing�icas em renal lesão de reperfusão isquêmica, porém por 4 semanas, os túbulos se recuperaram e são histologicamente comparável à rins nativos. A rejeição aguda pode ser modelado por C57BL / 6 em receptores de transplante de rim de BALB / c, no prazo de 1 semana, há infiltração celular mononuclear difusa no parênquima renal, que envolve o interstício, glomérulos e dos túbulos. Danos do aloenxerto crónica pode ser modelado por C57BL / 6 BM12 rins transplantados em ratinhos C57BL / 6 receptores, isto resulta nas características típicas encontradas em patologia humana que consiste em fibrose intersticial e perda gradual do túbulo. Contagem bruta túbulo por alta potência de campo (ampliação x200) permite a quantificação da massa de néfrons funcionais (Figura 3), reflecte a perda dos túbulos lesão tubular devido à rejeição. A fibrose intersticial pode ser identificada usando o pan-colagénio vermelho de picrosirius mancha (figura 4). Colágeno endógeno normal é observada, no entanto, durante lesão crônica novo colágeno é depositado resultando em fibrose progressiva. O dano crónica se torna aparente entre 8 e 12 semanas após o transplante (Figura 5).
A curva de aprendizagem significativa precisa ser superado, a fim de estabelecer o modelo (Figura 6). Estima-se que 40 procedimentos foram realizados em camundongos recuperado antes de um tempo de anastomose vascular reprodutível foi alcançado com a sobrevivência aceitável livre de complicações. A razão mais comum para a eutanásia o mouse foi devido à paralisia dos membros posteriores secundário para membros inferiores e isquemia da medula espinhal relacionada à trombose arterial, no entanto, em nossa experiência heparinização sistêmica reduz a incidência deste. Ratos foram rotineiramente monitored conforme os critérios estabelecidos localmente para a rescisão dos experimentos. Sobrevivência experiências realizadas na fase de patamar da curva de aprendizagem resultou num tempo de anastomose vascular média de 28,9 ± 0,47 min.
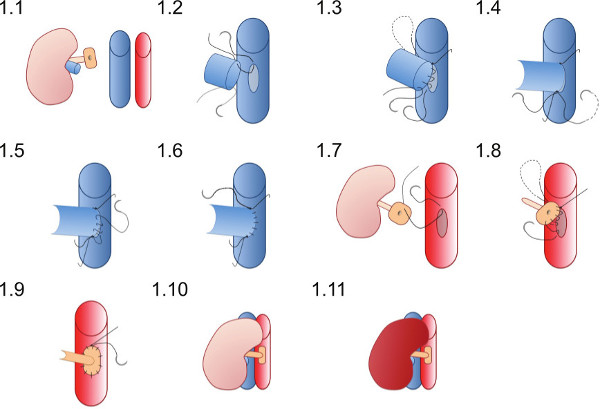
Figura 1 representação esquemática da técnica de anastomose vascular. O rim doado é colocado no flanco direito do rato destinatário. A veia renal doador é anastomosada de maneira término-lateral e da artéria renal de doadores em um remendo da aorta anastomosada à aorta destinatário.

Figura 2 lesão tubular histológica Representante no rim transplantado. Após a fixação em tecidos de solução de metil Carnoyl foram incluídos em PARAFseções fin e tecidos de 4μm foram corados pela hematoxilina e eosina. Em 4 semanas após o transplante isoenxerto rins não apresentam lesão tubular e são comparáveis aos rins nativos na aparência. C57BL / 6 BM12 rins transplantados em receptores BALB / c submetidos a rejeição aguda do enxerto com infiltrados difusos de células mononucleares (*) e túbulos necróticos (**) e tubulite. C57BL / 6 BM12 rins transplantados em C57BL / 6 resultados em lesão crônica do enxerto caracterizada por infiltrados linfocitários perivasculares (seta bloco ⬆) e fibrose intersticial e atrofia tubular (setas ocos ⇧). Clique aqui para ver uma versão maior desta figura.

Figura 3 A quantificação de lesões na tubular tr rim ansplanted. túbulos saudáveis (definida pela presença de uma membrana intacta porão, lúmen tubular intactas, o volume citoplasmático saudável e processos apicais borda escova mantida) reflectindo a funcionar massa nefrónio pode ser quantificado através da contagem do número médio de túbulos por campo (ampliação de x200 ) (n = 6, a média de 10 campos consecutivos, ** p <0,01).

Figura 4 crônica danos enxerto pode ser identificado por fibrose intersticial (imagens representativas). Deposição de colágeno dentro do rim transplantado é evidente pela detecção de picrossírius coloração vermelha de colágeno. Clique aqui para ver uma versão maior desta figura.
gura 5 "src =" / files / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figura 5 Quantificação de fibrose intersticial. Fibrose intersticial medido pela positividade picrosirius vermelho é gerado em ratinhos C57BL / 6BM12 ⇒ C57BL / 6 receptores 12 semanas após o transplante (n = 6, a média de 10 campos consecutivos, ** p <0,01, * p < 0,05).

Figura 6 curva de aprendizado. Experimentos não-recuperação inicial em ratos anestesiados terminal foram realizados para desenvolver a técnica cirúrgica. Isto foi seguido por ensaios de recuperação para conseguir um rim transplantado com sucesso re-perfundido com um rato sobrevivente sem complicações.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
A forma mais bem descrito a anastomose arterial é usar a aorta distai do doador, com a artéria renal em continuação, de uma maneira extremo-a-lado para o aorta do receptor. Descreve-se o uso de um tapa-aórtica, semelhante ao espelhamento 'Carrell remendo "que realizou no transplante de rim humano que acreditamos ser mais conveniente. Apesar de relatos na literatura de doador e receptor operatório tempo são escassos, acreditamos que a utilização de um remendo da aorta para aorta destinatário em vez de ponta-a-lado aorta doador de aorta destinatário é preferível. Usando um patch nega a necessidade de dissecar todos os ramos da aorta do doador lombar, e também o tempo necessário para ligá-los individualmente, como anastomose um patch naturalmente exclui estes.
As etapas críticas para alcançar este modelo incluem tomar cuidado para garantir que não há nenhum outro que não a artéria renal dentro da anastomose arterial remendo como lumens arteriais elesvai vazar quando grampos micro-vascular são removidos. As suturas construção do anastamoses pode ser bem amarrado, mas estar ciente do efeito em bolsa que pode restringir a anastomose e causa isquemia ou inibir qualquer fluxo sangüíneo, em praticidade observamos que desde o Aortotomia elíptica é de tamanho suficiente o cordão da bolsa efeito não é encontrado. O venotomia é feita com uma agulha em seguida ampliou esticando com uma pinça, acreditamos que este é preferível a corte como o alongamento com uma pinça cria um anel de tecido venoso que pode ser facilmente visto e sutura ajuda para criar uma anastomose estável. A anastomose ureteral na bexiga é um componente muito importante a considerar, defendemos a técnica descrita aqui, em vez de uma bexiga de cúpula de bexiga re-construção que tem sido associado com vazamento de urina e estenose ureteral presumivelmente devido a isquemia. Nossa técnica descrita permite um comprimento mais curto do doador ureteral para ser usado como ele é anastomosada diretamente à bladder 5. Ao utilizar essas melhorias técnicas, temos sido capazes de reduzir significativamente a quantidade de tempo necessário para concluir este modelo experimental. Com efeito, com dois operadores trabalhando simultaneamente cinco pacientes transplantados podem ser realizadas por dia, com tempo suficiente para permitir a recuperação e monitoramento dos ratos.
Uma das principais limitações do modelo e técnica descrita neste artigo é que o rato fica com um de seus rins nativos in situ de tal forma que o mouse não é dependente do rim para a sobrevivência. Alguns autores descreveram a remoção da segunda rim nativo imediatamente no momento do transplante ou cinco a dez dias após o transplante, deixando, assim, o rato dependentes do rim transplantado. Isto iria permitir a sobrevivência a ser usado como um resultado experimental, bem como sangue de amostragem para medir os marcadores da função renal, tais como creatinina sérica ou de ureia no sangue. Entretanto, não há diferença nos resultados histológicosquando se comparam os ratos dependentes do enxerto e aqueles com um único rim nativo 9. Nosso protocolo descrito não impede que isso e na verdade o segundo rim nativo pode ser removido em um determinado intervalo de tempo. Uma limitação adicional é que a micro-cirurgia perícia avançada é necessária, a fim de executar uma anastomose arterial e venosa, embora com formação e através da utilização da técnica de instrução figura isso pode ser superado. As complicações vasculares podem ocorrer, sendo estes trombose da artéria ou veia renal, este invariavelmente resulta no rato que indica sinais de desconforto, problemas de saúde ou especificamente paralisia traseiras-membro. Portanto governação rigorosa e monitoramento de ratos é imperativa a utilização deste modelo.
A rejeição aguda do transplante renal tem sido amplamente tratado por linfócitos e indução de imunossupressão terapêutica esgotando circulando, porém episódios de rejeição mediada por células ainda podem ocorrer ao longo dos enxertos renaisvida. Portanto estudos sobre os mecanismos subjacentes a esta ainda são pertinentes e podem identificar novos caminhos para o tratamento. Em incompatibilidade MHC completo, tais como C57BL / 6 para ratinhos BALB / c, significa que a sobrevivência depende do transplante renal tem sido relatada como sendo tão baixa como 7,4 dia 10. Histologicamente rejeição celular e vascular aguda pode ser identificado por infiltração linfocítica, hemorragia e edema no interstício, tubulite, vasculite, com necrose glomerular e tubular. Os processos combinados contribuem para danos crônica do enxerto têm feito nesta área difícil de estudar. As características histológicas incluem fibrose intersticial, atrofia tubular, glomeruloesclerose e proliferação da íntima. A lesão progressiva está associado com a infiltração de células T persistente, no entanto, é cada vez mais apreciado que muitos outros factores podem estar envolvidos. Medeia potenciais de lesão persistente incluem deposição de complemento devido a anticorpos específicos para o doador, células B, células assassinas naturais, macrófagos e células intrínsecas ao enxerto, tais como o endotélio 3. Portanto, este modelo permite que o estudo dessas várias facetas da rejeição.
Houve cerca de 70 estudos publicados utilizando este modelo, apesar de sua descrição inicial 4, isto é, em comparação com modelos do rato do rim lesão de isquemia-reperfusão em que houve várias centenas de artigos. A importância deste modelo de ratinho de transplante renal intra-abdominal é que recria directamente o processo de transplante de rim humano, para além disso, os benefícios da utilização de estirpes de rato consanguíneas bem definidas que podem ser utilizados para modelar de diferentes mecanismos de rejeição. Por isso, os estudos que utilizam este modelo são altamente traduzível. Outras aplicações futuras deste modelo incluem a estudar as anomalias renais intrínsecas através do transplante de rins com fenótipos específicos de modelos knockout em camundongos selvagens ou, inversamente rins do tipo selvagem em geneticamentereceptores alterados.
Este modelo pode replicar com sucesso o processo de transplante renal humano. O uso de linhagens puras permite a seleção de combinações entre doadores e receptores de diferentes diferenças de MHC. Além disso, a utilização de ratinhos permite o uso de várias técnicas, incluindo knockout e sistemas indutíveis para investigar os diferentes aspectos da rejeição.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada a revelar.
Acknowledgments
Financiamento de Kidney Research UK, The Royal College of Surgeons de Edimburgo e da Sociedade Europeia de Transplante de Órgãos apoiou esse estudo.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



