Introduction
Успешная трансплантация почки для лечения почечной недостаточности был впервые описан в 1955 году между монозиготных близнецов 1, с тех пор он стал революционером лечения для пациентов с терминальной стадией почечной недостаточности во всем мире, предлагая как улучшение длины и качества жизни 2. Однако долгосрочная выживаемость трансплантата была затруднена множеством патологических процессов, приводящих к хроническим повреждением трансплантата 3.
Отказ от пересаженной почки у человека остается одной из основных причин заболеваемости, несмотря на значительные улучшения в immunosupporessive схем. Цель разработки модели мыши почечной трансплантации является тесно повторить процесс и патологии, найденный в трансплантации почки человека 4. Skoskiewicz др. Впервые описал модель мыши трансплантации почки в 1973 году 5. Несмотря на передовые микрохирургические навыки необходимы, она является ценным тоол по нескольким причинам: геном мыши был хорошо охарактеризован и есть большое разнообразие экспериментальных методов и методик для исследований на мышах.
Многие группы с использованием мышиной модели трансплантации почки использовали трансплантированной почки в качестве жизни поддержки органа, однако в других исследованиях, и в нашей методики, описанной одного нативного почек, получающей мыши остается на месте в течение всего срока эксперимента 4. Выгода в том, что мышь подвергается одного анестезии и операции тем самым снижая заболеваемость к мыши и риск смерти от второй процедуры. Кроме мышь не страдают от неблагоприятных последствий постепенного почечной недостаточности.
Хотя модели аллогенной отказа существует и в других органах, таких как сердце и кожу, они не всегда непосредственное отношение к трансплантации почки. Существует доказательство того, что эти модели вызывают различные режимы и думика отказа, например, время, конечно, отторжения аллотрансплантата в сердечной и почечной аллотрансплантата существенно отличается в определенных комбинациях деформации 6. Мы описали острых модели почек отторжение аллотрансплантата в линии BALB / C доноров в не-трансгенных FVB / NJ мышей, эта модель показала сотовой опосредованное повреждение с накоплением Т-клеток и макрофагов 7. В качестве альтернативы мы также описали модель хронического повреждения трансплантата, который проявляет интерстициальный фиброз и трубчатую атрофию, это объясняется пересадки почки от C57BL / 6 BM12 доноров в C57BL / 6 получателей, как эти мыши характеризуются одного МНС класса II локусов MIS -match 8.
Несколько аспекты трансплантации были изучены с использованием мышиной модели трансплантации почки в том числе острого отторжения, клеточного и гуморального отторжения, ишемии, реперфузионного повреждения и испытания той новых терапевтических агентов. Мы модифицировали хирургическую тechnique сократить время работы и улучшить простоту операции. Особенно мы описали одновременное донора и подготовка получателя и упрощенную технику сосудистого анастомоза за счет использования непрерывный аорты патч анастомоза. Это видео и рукопись обеспечит ключевые моменты, чтобы помочь в создании этой техники.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Соответствующие национальные и местные институциональные этика должна быть на месте, прежде чем выполнять эксперименты на животных. В частности, в Великобритании следующие эксперименты были проведены в соответствии с животных (научные процедуры) Закон 1986 года Где два микрохирурги доступны одновременно работать донор хирург должен выполнить шаги 1,1 до 1,16, то 3,1 до 3,5, в то время как хирург получатель выполняет 2,1 до 2,8 . Для одного оператора, что шаги могут быть выполнены последовательно.
1 Донор Подготовка
Примечание: Эта процедура, представленные здесь, донора C57BL / 6 BM12 и получателя C57BL / 6 мышей-самцов в возрасте от 8 до 16 недель с массой тела, превышающей 20 г. Однако эта процедура может быть воспроизводимо выполняется на множестве линий мышей. Данные, представленные в разделе репрезентативные результаты были получены от мышей C57BL / 6, C57BL / 6 и BM12 линии BALB / C мышей.
- Процедуры Проведение Усинг стерильные хирургические инструменты и расходные материалы (автоклавного), с начинаниях сохранить рабочую зону максимальную стерильность. Выполните подготовку донорской одновременно с подготовкой получателя, если два хирурга доступны.
- Обезболить мыши путем внутрибрюшинной инъекции (31G иглы) медетомидина (0,5 мг / кг) и кетамина гидрохлорида (200 мг / кг). Это приводит к анестезии плоскости, которая ведется в течение 4 часов, обеспечивая достаточно времени для всей процедуры выполняться. Справочная анестезия не требуется.
- Убедитесь, что мышь не наркоз (ответа на носок щепотку).
- Бритье живот мыши и удалить любые свободные волосы с помощью клейкой ленты.
- Наведите на спине на стерильно завернуто подогревом коврик и свободно иммобилизации конечности стерильной липкой лентой.
- Монитор мыши на протяжении всей процедуры для термических ожогов. Если можно использовать не электрический источник тепла.
- Нанесите смазку глаз и саnitize брюшную стенку разбавленным раствором йода.
- Сделайте срединный разрез в брюшной полости, чтобы войти в брюшную полость и вставить 3 см Calibri животе втягивающим.
- Применить подогретое физиологический раствор, чтобы держать кишечник и хирургическую область влажной и избегать ненужного высыхание внутренних органов.
- Накройте мышь с стерильными пеленками и двигаться кишечник налево оператора (правой мыши), чтобы разоблачить аорты, полой вены и левую почку.
- Нанесите храповиком Forcep в желудок и тянуть кверху, чтобы выставить основные сосуды и левую почку полностью. Пакет влажные стерильные тампоны (2 мм х 2 мм) в брюшную полость для втягивания ткани от хирургической области, такие как долей печени, семенных пузырьков и кишечника.
- Изолировать левую почку от окружающей adventia, жиров и левого надпочечника в брюшную полость по прямо рассекает соединительной ткани с помощью тоненького кончика пинцета. Поместите закрытых кончики щипцов между областями, что Neред должны быть разделены и медленно позволяют кончики Forcep, чтобы открыть рассекать пространство.
- Изолировать левой почечной вены путем лигирования с последующим делением левой надпочечниковой вены и оставил половые железы вены с 9 / O нейлона. Поместите шва близко к почечной вене.
- Перевязывать и разделить мочеточник с 7 / O шелковой нити близко к мочевого пузыря, оставляя шов заканчивается долго. Эти концы длиной шовные будет использоваться при почка собирают и необходимы для мочеточника анастомоза.
- Мобилизовать и полностью рассекать аорты и полой вены главно и уступает почечной артерии и вены использовать тонким наконечником пинцет, чтобы тупо рассекать лимфатические сосуды и жир из передней и боковых сосудов.
- Найдите тканей самолет между аортой и полой вены и медленно распространяются пинцетом. Медленно откройте кончики точная наклоненная щипцов распространяться ткани с минимальной травмой.
- Свяжите свободную 7 / O шелк вокруг аорты верхней и нижней в почечной артерии, проходя под углом штрафнаконечник щипцы вокруг задней сосудов и чертежные шовного материала через. Эти швы будут ужесточены до извлечения почки, чтобы ретроградной перфузии университет Висконсина решения.
2 Получатель Подготовка
В соответствии с подготовки донора выполните шаги 1,2 до 1,8.
- Перемещение кишечник направо оператора (левой мыши), чтобы разоблачить аорты, полой вены. Обложка кишечник с помощью стерильного физиологического раствора пропитанной тампоном.
- Выполните правый нефрэктомию путем лигирования правой почечной артерии и вены вместе с 7/0 шелковой нити, а затем разделить.
- Лигировать правого мочеточника с 7 / O шелковой нити и разделить.
- Мобилизовать и полностью рассекать аорты и нижней полой вены в почечной артерии и вены, как описано в шаге 1,14 и 1,15. Убедитесь, полный рассечение между аортой и полой вены. Позаботьтесь, чтобы сохранить внутренней семенной артерии, которая проходит кпереди от полой вены и aortнаряду с лимфатической расслоения.
- Определить поясничные сосуды, работающие в забрюшинного пространства от полой вены и вены к позвоночнику, перевязывать с 9 / O шелка в непрерывности, нет необходимости делить сосуды.
- Определите достаточное пространство для размещения микрососудистых зажимы с пространством между сосудистых анастомозов.
- Администрирование внутривенно гепарин (5 единиц) через спинной полового члена вены.
3 донорской почки поисковая
Затянуть шелковые 7 / вывода связей, которые были поставлены вокруг низшие и высшие аорты изолировать почку от артериального кровообращения.
- Настаивать ретроградные холодные 0,2 - 0,5 мл университет Висконсина раствора с иглой (31G) в аорту.
- Разделите аорты в течение швов и разделить почечной вены на ее стыке с полой вены удалить почку и почечной артерии с длиной аорты. Разделите поясничные сосуды, вытекающие из аорты, если они присутствуют, жОтсутствует перевязки.
- Поместите почку в холодном физрастворе на стерильный тампон в культуральной чашке.
- Усыпить мыши-донора путем смещения шейных позвонков.
4 трансплантации почки - Подготовка почек
- Создание аорты путем деления участок стенки аорты в продольном направлении прямо напротив почечных артерий. Выявление любых люмен сосудов в патче, которые должны быть лигирована или избежать при выполнении артериальное анастомоза.
- Поместите 10 / вывода шов снаружи внутрь почечных вен просвет главно и второй отдельный шва книзу. Швы используются для разделения надпочечников вену и гонадной вены может быть использован, чтобы ориентироваться на судно.
- Поместите почку правом фланге получателя (Рисунок 1.1) и обеспечить швы имеют хорошие возможности для обеспечения сосудистые анастомозы может быть завершена без швов становится переплетенных в мазках или других инструментов.
5 почек Transplanставление - Сосудистая Anastomosis
Применить микрососудистых зажимы первый книзу то главно охватывающих полой вены и аорты.
- Сделать ventomy с иглой (31G) выкалыванием переднюю стенку полой вены. Флеш кровь из полой вены путем введения примерно 50 мкл 0,9% NaCl.
- Расширить venotomy помощью тоненького кончика щипцы, открывая их в venotomy так, чтобы длина эквивалентно диаметру доноров почечной вены.
- Поместите 10 / вывода превосходную шов (который уже в просвете почечной вены) сначала на вершине venotomy (Рисунок 1.2) и присоединиться заднюю стенку анастомоза в работающей шва до уступает вершина не будет достигнута (Рисунок 1.3).
- Поместите 10 / вывода уступает шва и связать сначала с одной узла (Рисунок 1.4) затем связать с управлением шва от задней стенки.
- Использование уступает шов создать переднюю Walл анастомоза (Рисунок 1.5) с управлением шва и галстук на верхнем конце шва на верхней вершине (рисунок 1.6).
- Создайте aortotomy, подняв стенки аорты с пинцетом и резки эллиптическую патч с ножницами (примерно aortotomy должна быть пятая часть окружности аорты и три раза просвета почечной артерии в длину).
- Поставьте шов 10 / вывода в верхней точке аорты патч снаружи внутрь (рисунок 1.7) и пройти через аорту, чтобы связать вне сосудов в верхней вершине aortotomy.
- Создать артериальное анастомоза с работы шов, начиная главно (Рисунок 1.8) анастомоза доноров патча в аорту получателя, заботиться, чтобы не стягивать анастомоза, связывая нити слишком туго (Рисунок 1.9).
- Удалить низшие сосудистые зажимы сначала тогда превосходную зажим для reperfuse почку (Рисунок 1.10 и 1.11). Видимый перистальтика мочеточника возможно увидеть, если адекватного кровоснабжения в мочеточнике достигается.
6 трансплантации почки - мочеточников Anastomosis
- Разделите все вложения мочевого пузыря из брюшной стенки.
- Pass иглу (21G) от слева направо мочевого пузыря через обе стены.
- Поместите прямые концы Forcep в просвете иглы и передать обратно и через мочевой пузырь, так что в настоящее время щипцы, проходящей в направлении справа налево из левой части мочевого пузыря.
- Draw шва на мочеточник доноров через мочевой пузырь, так что мочеточник проходит в левом дефекта мочевого пузыря, то из правой стороны.
- Шовный адвентиции мочеточника к адвентиции мочевого пузыря с тремя односпальными узловыми швами вокруг точки входа с 9 / O нейлона шва на круглом здоровых иглы.
- Разрежьте мочеточника проксимальнее лигатуры, тем самым открыв йэлектронной мочеточника, чтобы позволить моче протекать и позволяют конец мочеточника, чтобы убрать в тело мочевого пузыря. Видимый производство мочи может наблюдаться наряду с кровотечением из пригородных мочеточника сосудов.
- Закройте правую дефект сторона мочевого пузыря с одной прерванной 9 / O шелковой нити.
7 Восстановление и послеоперационный уход
Замените желудочно внутренности в брюшную полость в исходной ориентации и закрыть брюшную стенку путем аппроксимации прямых мышц с 6 / O рассасывающимся швом.
- Приблизительная кожу клипов металла кожи.
- Частично обратном анестезии с подкожной инъекции atipamazole гидрохлорид (10 мкл / г).
- Администрирование обезболивание путем подкожной бупренорфина гидрохлорида (0,05 мг / кг) и для инъекций поддержки жидкости 1 мл подкожно 0,9% NaCl.
- Восстановление мышь в потеплением шкафу при 28 ° С в течение 24 до 48 часов. Соблюдайте мышь для болезни дозавершение эксперимента.
- Удалить клипы металла кожи 7 - 10 дней после операции.
- После того, как эксперимент завершен усыпить мыши путем смещения шейных позвонков.
- Удалить и собирать контралатеральной почки и аллотранспланта гистологического анализа.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Почечная отторжение аллотрансплантата может быть оценена с помощью гистологического анализа methacarn фиксированной парафин тканевых секций трансплантированной почки (рисунок 2). Изотрансплантат трансплантация почки между сингенным мышей приводит к почечной реперфузии ишемического повреждения, однако на 4 недели трубочки выздоровели и гистологически сопоставимы с родных почек. Острое отторжение может моделироваться / 6 трансплантации почки C57BL в BALB / с получателей, в течение 1 недели есть диффузная инфильтрация мононуклеарных клеток по всему почечной паренхимы, с участием интерстиции, клубочки и канальцы. Хроническое повреждение аллотрансплантата могут быть смоделированы с помощью C57BL / 6 BM12 почек, трансплантированных в C57BL / 6 получателей, это приводит к характерных особенностей, обнаруженных в патологии человека, состоящей из интерстициального фиброза и постепенной потерей канальцев. Валовой Количество трубочка за мощного поля (x200 увеличения) позволяет количественно оценить массы функциональный нефрона (Fiфигура 3), потеря канальцев отражает трубчатый пораниться отторжения. Интерстициальный фиброз могут быть идентифицированы с помощью пан-коллагена пятно picrosirius красный (рисунок 4). Нормальный эндогенный коллаген наблюдается, однако в течение хроническое повреждение нового коллагена осаждается в результате прогрессивного фиброза. Хронические нарушения становится очевидным между 8 и 12 недель после трансплантации (Рисунок 5).
Необходимо преодолеть для того, чтобы установить модель (рисунок 6) Значительная обучение. По оценкам, 40 процедуры были выполнены в восстановленной мышей перед воспроизводимым сосудистой время анастомоза была достигнута с приемлемой выживания свободного осложнений. Наиболее распространенной причиной для эвтаназии мыши было обусловлено паралич задних конечностей, вторичной к нижних конечностей и спинного мозга к ишемии, связанной с артериальным тромбозом, однако в наш опыт системного heparization снижает заболеваемость это. Мыши были обычно моnitored соответствии с согласованными на местах критериев прекращения экспериментов. Эксперименты, проведенные на выживание в фазе плато кривой обучения привело к среднему времени сосудистого анастомоза 28,9 ± 0,47 мин.
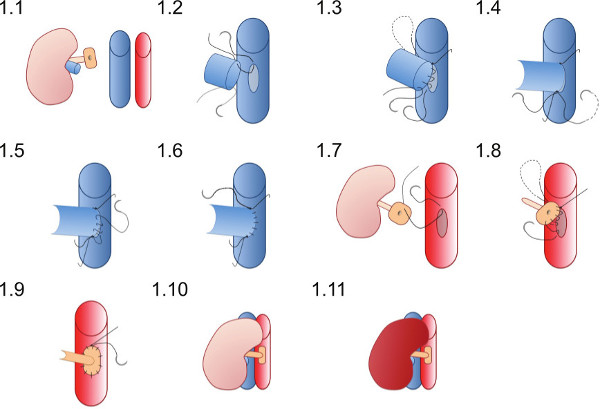
Рис.1 Схематическое изображение техники сосудистой анастомоза. Донорской почки находится в правом фланге мыши-реципиента. Донор почки вена анастомозировали в моде конца в сторону и донор почечной артерии на участке аорты анастомозировали к аорте получателя.

Рисунок 2 Представитель гистологическое трубчатый травмы в пересаженной почки. После фиксации в тканях решений метил Carnoyl были встроены в parafплавник и тканей разделы 4 мкм окрашивали Hemotoxylin и эозином. В 4-х недель после трансплантации изотрансплантат почки не проявляют трубчатый травмы и сопоставимы с родных почек по внешнему виду. C57BL / 6 BM12 почки пересаженные в BALB / с получателей пройти острого отторжения трансплантата с диффузных инфильтратов мононуклеарных клеток (*) и некротических трубочек (**) и tubulitis. C57BL / 6 BM12 почки пересаженные в C57BL / 6 приводит к развитию хронического повреждения трансплантата характеризуется периваскулярных лимфоцитарными инфильтратов (блок стрелок ⬆) и интерстициального фиброза и трубчатой атрофии (полые стрелки ⇧). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3 Количественное трубчатой травмы в тр ansplanted почек. Здоровые канальцы (определяется наличием неповрежденной базальной мембраны, целые канальцев просвет, здорового цитоплазматической объема и поддерживается верхушечный микроворсинок щеточной каймы) отражает функционирующей массы нефронов может быть определена количественно путем подсчета среднего количества канальцев в области (x200 увеличения ) (п = 6, средняя из 10 последовательных полей, ** р <0,01).

Рисунок 4 Хронический повреждения трансплантата можно определить по интерстициального фиброза (представительные изображения). Отложение коллагена в пересаженная почка очевидно обнаружением picrosirius красного окрашивания коллагена. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
фигура 5 "SRC =" / файлы / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Рисунок 5 Количественная оценка интерстициального фиброза. Интерстициальный фиброз измеряется picrosirius красный позитивность, поднятых в C57BL / 6BM12 ⇒ C57BL / 6 получателей двенадцать недель после трансплантации (п = 6, средняя из 10 последовательных полей, ** р <0,01, * р < 0,05).

Рисунок 6 Learning Curve. Первоначальные эксперименты без восстановления в смертельно наркозом мышей проводились развивать хирургическую технику. За этим последовало экспериментов восстановления для достижения успешного повторного перфузированной пересаженной почки с выжившей мыши без осложнений.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Наиболее хорошо описаны способ для выполнения артериального анастомоза является использование дистальный аорты донора, с почечной артерии в продолжение, в виде конца в сторону, чтобы аорты реципиента. Мы описали использование аорты патч, похожий на 'Карелл патч "зеркалирования, что выступал в трансплантации почки человека, который мы считаем более удобным. Хотя сообщения в литературе донора и реципиента оперативного времени редки мы считаем, что использование аорты патч к получателя аорты вместо конца в сторону донорской аорты к получателю аорты является предпочтительным. Использование патч отрицает необходимость проанализировать все поясничного доноров ветвей аорты, а также время, затраченное на перевязывать их по отдельности, как анастомоз патч естественно исключает эти.
Критические шаги по достижению этой модели включают заботясь, чтобы гарантировать, что нет никаких других артериальных кроме почечной артерии в артериальной патч анастомоза как люмен онибудет течь, когда микро-сосудистой зажимы удаляются. Швы, формирующие anastamoses можно туго, но быть в курсе кошелек-струнной эффект, который может сузить анастомоза и вызвать ишемию или препятствовать кровоток, в практичности мы наблюдали, что при условии эллиптическую aortotomy имеет достаточный размер кошелька-струнной Эффект не встречается. Venotomy производится с помощью иглы затем расширился, растягивая щипцами, мы считаем, что это предпочтительнее резки, как растяжения щипцами создает кольцо венозной ткани, которые легко было заметить и наложения швов помощи для создания стабильной анастомоза. Мочеточника анастомоза в мочевой пузырь является очень важным компонентом рассмотреть, мы выступаем за технику, описанную здесь, а не мочевого пузыря куполом для мочевого пузыря реконструкцию, что было связано с утечкой мочи и мочеточника стеноз предположительно вследствие ишемии. Наша методика позволяет описано более короткая длина донора мочеточника, которые будут использоваться как это непосредственно анастомозировали, чтобы bladdэ 5. Используя эти технические усовершенствования мы смогли значительно сократить время, необходимое для завершения этой экспериментальной модели. Действительно с двумя операторами, работающими одновременно пять реципиентов может быть выполнена за день достаточно времени, чтобы позволить восстановление и мониторинг мышей.
Главное ограничение описанной модели и методики в данной работе является то, что мышь остается с одним из своих родных почек в месте так, что мышь не зависит от почки за выживание. Некоторые авторы сообщали удаление второй родной почки сразу в момент пересадки или пяти до десяти дней после трансплантации, в результате чего мыши зависит от пересаженной почки. Это позволило бы выживаемости, которые будут использоваться в качестве экспериментального результата, а также крови дискретизации для измерения показателей почечной функции, такие как сывороточного креатинина или мочевины в крови. Однако нет никакой разницы в гистологических результатовпри сравнении мышей, зависящие от аллотрансплантата и те с одной родной почки 9. Наша описано протокол не допустить этого, и действительно вторым родным почек может быть удалена в течение заданного промежутка времени. Дополнительным ограничением является то, Advanced Micro-хирургический опыт необходим для выполнения артериальной и венозной анастомоза, хотя обучение и использование технической показатель обучения это могут быть преодолены. Сосудистые осложнения могут возникнуть, эти являющиеся артерии или вены тромбоз почечной, это неизменно приводит к мыши отображаются признаки бедствия, ухудшение состояния здоровья или конкретно задних конечностей паралич. Поэтому строгое управление и мониторинг мышей необходимо при использовании этой модели.
Острое отторжение почечного трансплантата в основном лечили иммуносупрессии и индукции терапия истощая циркулирующих лимфоцитов, однако эпизоды клеточного отторжения может еще произойти в течение почечных трансплантатовжизнь. Поэтому изучение механизмов, лежащих в основе этого по-прежнему актуальным и может идентифицировать новые пути для лечения. В полной МНС несоответствия, такие как C57BL / 6 в линии BALB / C, средняя продолжительность жизни зависит от трансплантации почки, как сообщается, быть как 7,4 дней 10. Гистологически острой сотовой и сосудистой отторжение может быть идентифицирован по лимфоцитарной инфильтрацией, кровоизлияния и отек в интерстиции, tubulitis, васкулит, с клубочковой и трубчатого некроза. Объединенные процессов, ведущих к хронической повреждения трансплантата сделали этот район трудно изучать. Гистологические особенности включают интерстициальный фиброз, трубчатый атрофия, гломерулосклероз и интимы пролиферацию. Прогрессивное травмы связана с постоянной инфильтрации Т-клеток, однако он все больше и больше понимать, что многие другие факторы могут быть вовлечены. Потенциальные опосредует упорного травмы включают комплемента отложение в связи с донорами-специфических антител, В-клетки естественных клеток-киллеров, макрофаги и клетки, присущие трансплантата, такие как эндотелий 3. Поэтому эта модель позволяет изучение этих различных аспектов отказа.
Там были примерно 70 опубликованных исследований, использующих эту модель, несмотря на ее ранней описание 4, это по сравнению с мышиных моделях почек ишемии-реперфузии, где были несколько сотен статей. Важность этой модели мыши трансплантации внутрибрюшного почек является то, что она непосредственно воссоздает процесс трансплантации почки человека, кроме того, это приносит пользу от использования четко определенных инбредных линий мышей, которые могут быть использованы для моделирования различных механизмов отказа. Поэтому исследования, использующие эту модель весьма переводимые. Другие будущие приложения этой модели являются изучение внутренние нарушения со стороны почечной путем пересадки почки с конкретными фенотипов из моделей нокаутом в мышей дикого типа или, наоборот почек дикого типа в генетическиизмененные получателей.
Эта модель может успешно повторить процесс трансплантации почки человека. Использование инбредных линий мышей позволяет выбрать комбинаций донор-реципиент различной МНС различия. Кроме того, использование мышей позволяет использование различных методов, включая нокаутом и индуцибельных систем, чтобы исследовать различные аспекты отказа.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего раскрывать.
Acknowledgments
Финансирование из почек исследования Великобритании, Королевский колледж хирургов Эдинбурга и Европейского общества трансплантации органов поддержали это исследование.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



