Introduction
Lyckad njurtransplantation för behandling av njursvikt beskrevs första gången 1955 mellan enäggstvillingar en, sedan dess har det blivit en revolutionerande behandling för patienter med terminal njursvikt i hela världen, som erbjuder både förbättring i längd och livskvalitet 2. Långsiktig graft överlevnad har dock hämmats av en mängd patologiska processer som leder till kronisk allograft skada 3.
Avvisning av transplanterad njure i människor förblir en betydande orsak till morbiditet, trots betydande förbättringar av immunosupporessive regimer. I syfte att utveckla en musmodell för njurtransplantation är att noggrant reproducera processen och patologi finns i human njurtransplantation 4. Skoskiewicz et al. Beskrev först den musmodell för njurtransplantation 1973 5. Även avancerade mikrokunskaper behövs, det är en värdefull tool av flera skäl: musgenomet har väl beskriven och det finns en stor mängd olika experimentella metoder och tekniker som kan mus studier.
Många grupper använder musmodell för njurtransplantation har använt den transplanterade njuren som en livsuppehållande organ, men i andra studier och i vår metod som beskrivs en av mottagarens musens infödda njurar är kvar på plats under hela experimentet 4. Fördelen är att musen genomgår en anestesi och operation därigenom minska sjuklighet till musen och risken att dö av en andra procedur. Dessutom musen inte lider av de negativa effekterna av en gradvis njursvikt.
Även modeller av allogen avstötning finns i andra organ som hjärta och hud, dessa är inte alltid direkt relevanta för njurtransplantation. Det finns belägg för att dessa modeller framkallar olika lägen och dynamics av avslag, till exempel tidsförloppet för avstötning vid hjärt allograft och allogent njurtransplantat skiljer sig avsevärt i vissa belastningskombinationer 6. Vi har beskrivit akut njuravstötningsmönster i BALB / c-givare till icke-transgena FVB / nj möss, visade denna modell cellulär medierad skada med ackumulering av T-celler och makrofager 7. Alternativt har vi också beskrivit en modell av kronisk allograft skador som uppvisar interstitiell fibros och tubulär atrofi, detta resulterar från transplantera en njure från C57BL / 6 BM12 donatorer i C57BL / 6 mottagare, eftersom dessa möss kännetecknas av en enda MHC klass Il-loci mis -match 8.
Flera aspekter av transplantation har studerats med hjälp av musmodell för njurtransplantation inklusive akut avstötning, cellulär och humoral avslag, ischemireperfusionsskada och trialing nya terapeutiska medlen. Vi har ändrat den kirurgiska technique att reducera driftstiden och förbättra den lätthet av kirurgi. Särskilt har vi beskrivit samtidig givare och mottagare förberedelser och en förenklad vaskulär anastomos teknik genom att använda en kontinuerlig aorta patch anastomos. Denna video och manuskript ger viktiga punkter till stöd i upprättandet av denna teknik.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Lämpliga nationella och lokala institutionella etik bör vara på plats innan du utför djurförsök. Speciellt i Storbritannien följande experiment bedrivs enligt de djur (Scientific Procedures) Act 1986 Om två microsurgeons finns att arbeta samtidigt donator kirurgen ska utföra steg 1,1-1,16 då 3,1-3,5, medan den mottagande kirurg utför 2,1-2,8 . För en enda operatör stegen kan följas i tur och ordning.
1. Donator Framställning
Obs: Det förfarande som presenteras här är en donator C57BL / 6 BM12 och mottagare C57BL / 6 hanmöss åldrarna 8 till 16 veckor gamla med en kroppsvikt över 20 g. Men detta förfarande kan reproducerbart utföras på en mängd olika musstammar. De data som presenteras i avsnittet representativa resultat erhölls från C57BL / 6, C57BL / 6 BM12 och BALB / c möss.
- Conduct förfaranden using sterila kirurgiska instrument och förbrukningsvaror (autoklaveras), med strävan att hålla operationsområdet så sterilt som möjligt. Utför givaren preparatet samtidigt med mottagaren beredningen om två kirurger är tillgängliga.
- Bedöva musen med en intraperitoneal injektion (31G nål) av medetomidin (0,5 mg / kg) och ketamin-hydroklorid (200 mg / kg). Detta resulterar i ett bedövningsmedel plan som upprätthålls under 4 timmar som ger tillräckligt med tid för hela proceduren som skall utföras. Kompletterande anestesi behövs inte.
- Kontrollera att musen är nedsövd (inget svar på tå nypa).
- Raka musens mage och ta bort lösa hår med tejp.
- Placera musen på rygg på ett sterilt draperad uppvärmd matta och löst immobilisera lemmar med sterilt maskeringstejp.
- Övervaka musen under hela förfarandet för brännskador. Om möjligt använda en icke-elektrisk värmekälla.
- Applicera ett öga smörjmedel och sanitize bukväggen med en utspädd jodlösning.
- Gör en mittlinje snitt i buken för att skriva in i peritonealhålan och infoga en 3 cm Calibri abdominal sårhaken.
- Applicera värmas saltlösning för att hålla tarmen och kirurgiska området fuktig och undvika onödig torkning av inälvorna.
- Täck musen med sterila dukar och flytta tarmarna till operatörens vänster (musens höger) för att exponera aorta, vena cava och vänster njure.
- Applicera ett ratcheted forcep till magen och dra mycket fint att exponera de stora fartygen och vänster njure helt. Packa damp sterila bomullstoppar (2 mm x 2 mm) in i buken för att dra tillbaka vävnader borta från operationsområdet, såsom levern lober, sädesblåsor och tarm.
- Isolera vänster njure från omgivande adventia, fett och den vänstra binjure i bukhålan genom rättframt dissekera bindväven med fina spets pincett. Placera slutna tips av pincetten mellan de områden som NEed som ska separeras och långsamt låta forcep tips för att öppna för att dissekera utrymme.
- Isolera den vänstra njurvenen genom ligering och sedan dividera den vänstra binjure ven och vänster gonadal ven med 9 / O-nylon. Placera sutur nära njurvenen.
- Ligera och dela urinledaren med 7 / O silkesutur nära blåsan lämnar sutur slutar lång. Dessa långa sutur ändar används när njurarna skördas och är nödvändiga för ureteric anastomos.
- Mobilisera och fullt dissekera aorta och vena cava mycket fint och underlägsen den njur artär och ven använda fin spets pincett för att rakt på sak dissekera lymfkärl och fett från framsidan och sidorna av fartygen.
- Hitta vävnaden planet mellan aorta och vena cava och sprids långsamt pincett. Öppna långsamt spetsarna på fin spets pincett för att sprida vävnad med minimalt trauma.
- Knyt en lös 7 / O siden runt aorta överlägsna och underlägsna njurartären genom att en vinklad böterspets pincett runt baksidan av fartygen och dra en sutur igenom. Dessa suturer kommer att skärpas före njur hämtning för att tillåta retrograd perfusion av University of Wisconsin-lösning.
2. Mottagarens Framställning
Enligt beredningen givar följ steg 1,2-1,8.
- Flytta tarmarna till operatörens högra (musens vänstra) för att exponera aorta, vena cava. Täck tarmarna med steril koksaltlösning indränkt bomullstopp.
- Utför en rätt nefrektomi genom ligering rätt renal artär och ven tillsammans med 7/0 silkessutur och sedan dela.
- Ligate rätt urinledaren med 7 / O silkesutur och dividera.
- Mobilisera och fullt dissekera aorta och vena cava inferior till njur artär och ven som beskrivs i steg 1.14 och 1.15. Säkerställa fullständig dissektion mellan aorta och vena cava. Var noga med att upprätthålla den inre spermatic artären som löper anterior till vena cava och aorta tillsammans med det lymfatiska bunten.
- Identifiera ländryggen fartyg körs i retroperitoneum från vena cava och ven till ryggraden, ligera med 9 / O silke i kontinuitet, finns det ingen anledning att dela in fartygen.
- Identifiera tillräckligt med utrymme för att placera mikrovaskulära klämmor med utrymme mellan för vaskulära anastomoser.
- Administrera intravenöst heparin (5 enheter) via rygg penis ven.
3 Donor Njure Retrieval
Dra åt de 7 / O sidenslipsar som har placerats runt underlägsna och överlägsna aorta att isolera njuren från den arteriella cirkulationen.
- Ingjuta retrograda kalla 0,2-0,5 ml University of Wisconsin-lösning med en nål (31G) i aorta.
- Dividera aorta inom suturerna och delar upp njurvenen vid dess föreningspunkt med hålvenen för att ta bort njuren och njurartären med en längd på aortan. Dela upp ländryggen fartyg till följd av aorta, om de finns, wtan att ligering.
- Placera njure i kall saltlösning på en steril bomullstopp i en odlingsskål.
- Euthanize donator musen genom cervikal dislokation.
4. Njurtransplantation - Njure Framställning
- Skapa en aorta lapp genom att dela aorta väggen längdled mittemot njurartären. Identifiera eventuella fartygs lumen i plåstret som behöver ligeras eller undvikas när du utför den arteriella anastomos.
- Placera en 10 / O sutur från utsidan till insidan njurvenen lumen mycket fint och en andra separat sutur inferiorly. De suturer används för att dela adrenal venen och gonadal ven kan användas för att orientera kärlet.
- Placera njuren i den högra flanken av mottagaren (figur 1.1) och se till att suturerna är väl lämpade för att säkerställa vaskulära anastomoser kan avslutas utan suturerna blir komplexare i toppar eller andra instrument.
5. Njure Transplanförandet - Vascular Anastomos
Applicera mikrovaskulära klämmor först inferiorly sedan superiorly omfattar vena cava och aorta.
- Gör en ventomy med en nål (31G) genom punktering av den främre väggen av vena cava. Spola blod från vena cava genom att injicera cirka 50 l av 0,9% NaCl.
- Vidga venotomi med fina spets pincett genom att öppna dem inom venotomi så att längden är ekvivalent med diametern hos donatorn njurvenen.
- Placera 10 / O överlägsen sutur (som redan finns i lumen njurvenen) först på toppen av venotomi (figur 1.2) och gå med den bakre väggen av anastomos i en löpande sutur tills sämre apex uppnås (Figur 1,3).
- Placera 10 / O sämre sutur och slips först med en enda knut (figur 1.4) sedan binda till rinnande sutur från den bakre väggen.
- Använda underlägsen suturen skapa front wall anastomosen (Figur 1.5) med en löpande sutur och slips till den överlägsna suturen slutet på den överlägsna apex (figur 1.6).
- Skapa ett aortotomy genom att plocka upp aorta väggen med pincett och skär en elliptisk lapp med sax (ungefär aortotomy bör vara en femtedel av omkretsen av aorta och tre gånger njurartären lumen i längd).
- Placera en 10 / O sutur vid överlägsna punkten av aorta patch från utsidan till insidan (figur 1.7) och passera genom aorta att knyta utanför kärlen vid överlägsen spetsen av aortotomy.
- Skapa den arteriella anastomos med en rinnande sutur börjar superiorly (figur 1.8) anastomosering givaren patch till mottagaren aorta, se till att inte tygla anastomosen genom att binda suturen för hårt (figur 1.9).
- Ta bort de sämre kärlklämmor först då den överlägsna klämman reperfundera njuren (Figur 1.10 och 1.11). Synlig peristaltik i urinledaren kanske ses om tillräcklig blodtillförsel till urinledaren uppnås.
6. Njurtransplantation - ureteric Anastomos
- Dela upp eventuella bilagor i blåsan från bukväggen.
- Passera en nål (21G) från vänster till höger i urinblåsan genom båda väggarna.
- Placera raka forcep tips nålen lumen och passera både tillbaka genom urinblåsan så att tången nu passerar från höger till vänster ut på vänster sida av urinblåsan.
- Rita suturen på givarens urinledaren genom blåsan, så att urinledaren passerar i den vänstra blåsan defekt sedan ut ur den högra sidan.
- Sutur adventitia i urinledaren till adventitia av urinblåsan med tre enkel avbrutna suturer runt ingång med 9 / O nylonsutur på en runda arbetsföra nål.
- Skär urinledaren proximalt om ligaturen, vilket öppnar the ureter för att tillåta urin att flöda och tillåta urinledaren ände att dras tillbaka in i kroppen av blåsan. Synlig produktionen av urin kan observeras tillsammans med blödning från peri-ureteric fartyg.
- Stäng den högra sidoblåsan defekt med en avbruten 9 / O silkessutur.
7 Återvinning och postoperativ vård
Byt mag inälvor i buken i sin ursprungliga orientering och stäng bukväggen genom en tillnärmning rectus muskler med 6 / O absorber sutur.
- Ungefärlig huden med metall hud klipp.
- Delvis vända anestesi med en subkutan injektion av atipamazole hydroklorid (10 | il / g).
- Administrera analgesi genom subkutan buprenorfinhydroklorid (0,05 mg / kg) och för fluid stöd injektion 1 ml subkutan 0,9% NaCl.
- Recover musen i en värmande skåp vid 28 ° C under 24 till 48 tim. Beakta musen för sjukdom fram tillfullbordandet av experimentet.
- Ta bort metall hud klipp 7 - 10 dagar postoperativt.
- När experimentet är klar avliva musen genom cervikal dislokation.
- Ta och samla den kontra njure och allograft för histologisk analys.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Nedsatt allograftavstötning kan bedömas genom histologisk analys av methacarn fixerade paraffininbäddade vävnadssnitt av den transplanterade njuren (Figur 2). Isograft transplantation av njurar mellan syngena möss resulterar i njur ischemisk reperfusionsskada, dock med 4 veckor tubuli har återhämtat sig och är histologiskt jämförbara med infödda njurar. Akut avstötning kan modelleras med C57BL / 6 njurtransplantation i BALB / c-mottagare, inom 1 vecka är det diffusa mononukleär cellinfiltration i hela njurparenkym, som omfattar interstitium, glomeruli och tubuli. Kronisk allograft skador kan modelleras med C57BL / 6 BM12 njurar transplanteras in C57BL / 6 mottagare, resulterar detta i de typiska funktioner som finns i människans patologi består av interstitiell fibros och gradvis tubuli förlust. Brutto tubuli talet per kraftfulla fält (x200 förstoring) medger kvantifiering av den funktionella nefronet massan (Figur 3), förlust av tubuli speglar tubulär skada på grund av avslag. Interstitiell fibros kan identifieras med hjälp av den pan-kollagen fläck picrosirius röd (Figur 4). Normal endogena kollagen observeras dock under kroniska skador nytt kollagen deponeras vilket resulterar i progressiv fibros. Den kroniska skador blir uppenbar mellan 8 och 12 veckor efter transplantation (Figur 5).
En betydande inlärningskurva måste övervinnas för att fastställa modellen (Figur 6). Uppskattningsvis 40 förfaranden utfördes i återvunna möss innan ett reproducerbart vaskulär anastomos tid nåddes med godtagbar överlevnad utan komplikationer. Den vanligaste orsaken till euthanizing musen berodde på bakbensförlamning sekundärt till lägre-lem och ryggmärg ischemi relaterade till arteriell trombos, men i vår erfarenhet systemisk heparization minskar förekomsten av detta. Möss var rutinmässigt monitored enligt lokalt överenskomna kriterier för att avsluta experimenten. Överlevnads experiment utförda i platåfasen av inlärningskurvan ledde till en vaskulär anastomos tid på 28,9 ± 0,47 min.
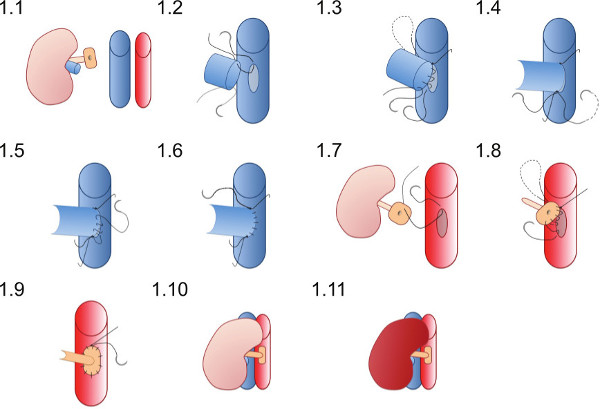
Figur 1 Schematisk återgivning av vaskulär anastomos teknik. Donatornjuren placeras i den högra flanken av den mottagande musen. Givaren njurvenen är anastomoseras i en end-to-side mode och givarnjurartären på en lapp av aorta är anastomoseras till mottagaren aorta.

Figur 2 Representant histologiska tubulär skada i den transplanterade njuren. Efter fixering i metyl Carnoyl lösning vävnader var inbäddade i paraffin och vävnadssnitt av 4μm färgades av hemotoxylin och eosin. Vid 4 veckor efter transplantation isograft njurar inte uppvisar tubulär skada och är jämförbara med infödda njurar i utseendet. C57BL / 6 BM12 njurar transplanterade till BALB / c-mottagare genomgår akut allograftavstötning med diffusa mononukleära cellinfiltrat (*) och nekrotiska tubuli (**) och tubulitis. C57BL / 6 BM12 njurar transplanteras in C57BL / 6 resultat i kronisk allograft skada karakteriseras av perivaskulära lymfocytiska infiltrat (blocket pil ⬆) och interstitiell fibros och tubulär atrofi (ihåliga pilar ⇧). Klicka här för att se en större version av denna siffra.

Figur 3 Kvantifiering av tubulär skada i st ansplanted njure. Friska tubuli (definieras av närvaron av en intakt basalmembran, intakta tubuli lumen, friska cytoplasmatisk volym och en underhålls apikal mikrovilli tarmluddet) återspeglar fungerande nephron massa kan kvantifieras genom att räkna det genomsnittliga antalet tubuli per fält (x200 förstoring ) (n = 6, medelvärde av 10 fält i följd, ** p <0,01).

Figur 4 Kronisk allograft skador kan identifieras genom interstitiell fibros (representativa bilder). Collagen deponerings inom den transplanterade njuren framgår genom detektion av picrosirius rödfärgning av kollagen. Klicka här för att se en större version av denna siffra.
gur 5 "src =" / filer / ftp_upload / 52163 / 52163fig5highres.jpg "/>
Figur 5 Kvantifiering av interstitiell fibros. Interstitiell fibros mättes genom picrosirius röd positivitet är upphöjda i C57BL / 6BM12 ⇒ C57BL / 6 mottagare tolv veckor efter transplantation (n = 6, medelvärde av 10 fält i följd, ** p <0,01, * p < 0,05).

Figur 6 inlärningskurva. Initiala icke återvinningsförsök i obotligt bedövade möss utfördes för att utveckla den kirurgiska tekniken. Detta följdes av återvinningsexperiment för att uppnå ett framgångsrikt åter perfusion transplanterad njure med en överlevande mus utan komplikationer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den mest väl beskrivna sättet att utföra den arteriella anastomosen är att använda den distala aortan av givaren, med njurartären i fortsättningen, i en ände-till-sida sätt till mottagaren aorta. Vi beskriver användningen av en aorta plåster, liknande den "Carrell patch" spegling som utförs i människans njurtransplantation som vi anser vara mer praktiskt. Även rapporter i litteraturen för givare och mottagare operativa tid är gles tror vi att utnyttja en aorta patch till mottagare aorta istället för end-to-side donator aorta till mottagare aorta är att föredra. Med hjälp av en patch eliminerar behovet att dissekera alla ländryggen givar aorta grenar, och även den tid det tar att ligera dem individuellt, som anastomosering ett plåster naturligt utesluter dessa.
Kritiska åtgärder för att uppnå denna modell ingår i syfte att säkerställa att inga andra än njurartären i arteriella patch anastomos som arteriella lumen dekommer att läcka när mikrokärlklämmor tas bort. De suturer Konstruera anastamoses kan knytas tätt men tänk över pengarna-strängen effekt som kan minska anastomosen och orsaka ischemi eller hindra blodflödet i praktiska vi har observerat att förutsatt den elliptiska aortotomy är av tillräcklig storlek för handväskan-strängen Effekten är inte stött på. Den venotomi görs med en nål därefter breddas genom sträckning med pincett, vi tror att det är bättre att skära som stretching med pincett skapar en ring av venös vävnad som lätt kan ses och stöd suturering för att skapa en stabil anastomos. Den ureteric anastomos till urinblåsan är en mycket viktig komponent för att tänka, vi förespråkar den teknik som beskrivs här snarare än en blåsa-dome till blås ombyggnad som har associerats med urinläckage och ureteric stenos förmodligen på ischemi. Vår beskrivna tekniken medger en kortare donator ureteric längd för att användas som den är direkt anastomoseras till bladdER 5. Genom att utnyttja dessa tekniska förbättringar har vi kunnat för att avsevärt minska den tid som krävs för att slutföra denna experimentella modell. Faktiskt med två operatörer som arbetar samtidigt fem transplanterade kan utföras per dag med tillräckligt med tid för att möjliggöra återvinning och övervakning av mössen.
En viktig begränsning av den beskrivna modellen och teknik i denna uppsats är att musen är kvar med en av sina infödda njurar på plats så att musen inte är beroende av njurarna för att överleva. Vissa författare har rapporterat borttagandet av den andra nativa njuren omedelbart vid tidpunkten för transplantation eller 5-10 dagar efter transplantation, vilket lämnar musen beroende av den transplanterade njuren. Detta skulle göra det möjligt att överleva för att användas som en experimentell utfall samt blodprovstagning för mätning av markörer för njurfunktion såsom serumkreatinin eller blodurea. Dock är det ingen skillnad i histologiska resultatnär man jämför möss beroende av allograft och de med en enda infödd njure 9. Vår beskrivna protokollet förhindrar inte detta och faktiskt den andra infödda njuren kunde avlägsnas vid en viss tidsintervall. En ytterligare begränsning är att avancerad mikrokirurgisk expertis som krävs för att utföra en arteriell och venös anastomos, men med träning och genom att utnyttja den tekniska siffran för undervisning detta kan övervinnas. Vaskulära komplikationer kan uppstå, dessa är njurartärstenos eller ventrombos, undantagslöst resulterar detta i mus visar tecken på stress, ohälsa eller specifikt hind-lem förlamning. Därför strikt styrning och övervakning av möss är absolut nödvändigt när använder denna modell.
Akut avstötning av njurtransplantat har i stor utsträckning behandlats av immunosuppression och induktionsbehandling nedbrytande cirkulerande lymfocyter, men episoder av cellmedierad avstötning kan fortfarande förekomma under hela njurtransplantatliv. Därför studier av mekanismerna bakom detta är fortfarande relevant och kan identifiera nya vägar för behandling. I komplett MHC obalans, såsom C57BL / 6 i BALB / c, medelöverlevnads beroende av njurtransplantation har rapporterats vara så låg som 7,4 dagar 10. Histologiskt akut cellulär och vaskulär avstötning kan identifieras med lymfocytär infiltration, blödning och ödem i interstitium, tubulitis, vaskulit, med glomerulär och tubulär nekros. De kombinerade processer som bidrar till kronisk allograft skador har gjort detta område svårt att studera. De histologiska funktioner inkluderar interstitiell fibros, tubulär atrofi, glomeruloskleros och intimaproliferation. Den progressiva skador förknippas med ihållande T-cell infiltration, men det är allt mer uppskattat att många andra faktorer kan vara inblandade. Potentiella förmedlar av ihållande skador inkluderar komplement avsättning på grund av donatorspecifika antikroppar, B-celler, naturliga mördarceller, makrofager och celler inneboende till transplantatet såsom endotelet 3. Därför denna modell gör det möjligt att studera dessa olika aspekter av avstötning.
Det har varit ca 70 publicerade studier som använder denna modell trots sin tidiga beskrivning 4, detta i jämförelse med musmodeller av njur ischemi-reperfusionsskada där det har funnits flera hundra artiklar. Betydelsen av denna musmodell av intraabdominell njurtransplantation är att det direkt återskapar processen för mänskliga njurtransplantation dessutom den drar nytta av användningen av väldefinierade inavlade musstammar som kan användas för att modellera olika mekanismer för avstötning. Därav de studier som använder denna modell är mycket översättnings. Andra framtida tillämpningar av denna modell inkluderar studera inneboende njuravvikelser genom att transplantera njurar med specifika fenotyper från knockout modeller i vildtyp möss eller omvänt vildtyp njurar i genetisktförändrade mottagare.
Denna modell framgångsrikt kan replikera processen för mänsklig njurtransplantation. Användningen av inavlade musstammar tillåter val av givare-mottagare kombinationer av olika MHC skillnader. Vidare användning av möss tillåter användning av olika tekniker inklusive knockout och inducerbara system för att sondera de olika aspekterna av avstötning.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har ingenting att lämna ut.
Acknowledgments
Finansiering från Kidney Research UK, The Royal College of Surgeons i Edinburgh och The European Society of Organ Transplantation stödde denna studie.
Materials
| Name | Company | Catalog Number | Comments |
| Surgical Instruments | |||
| Blunt Dissecting Scissors | Fine Science Tools | 14072-10 | For skin cutting |
| Curved Castoviejo scissors | Fine Science Tools | 15017-10 | For tissue cutting |
| Spring Scissors – straight | Fine Science Tools | 15000-08 | For suture cutting |
| Toothed forceps 1x2 teeth | Fine Science Tools | 11021-12 | |
| 2 x Fine Tip forceps (Dumont No.5) | Fine Science Tools | 11251-20 | |
| Angled Fine Tip forceps (Dumont No. 5/45) | Fine Science Tools | 11253-25 | For blunt dissecting |
| Curved Fine Tip forcep (Dumont No.7) | Fine Science Tools | 11273-22 | Useful to pass around vessels |
| Curved Crile Haemostat | Fine Science Tools | 1300-04 | |
| Micro clip applicator with lock | Fine Science Tools | 18056-14 | |
| 2 x Micro serrefines spring width 2mm, jaw length 4mm | Fine Science Tools | 18055-04 | Microvascular clamps |
| 2 x Colibri 3cm wire retractor | Fine Science Tools | 17000-03 | |
| Castroviejo needle holder with lock | Fine Science Tools | 120660-01 | |
| Wound clip applicator | Fine Science Tools | 12031-07 | |
| 7mm wound clips | Fine Science Tools | 12032-07 | Remove 7 to 10 days after surgery |
| Equipment | |||
| OPMI pico microscope | Carl Zeiss | S100 | |
| Thermal cautery unit with fine tip | Geiger | 150A | |
| Heat electronic pad | Cozee Cumfort | n/a | |
| Euroklav 23-S | Melag | n/a | Autoclave |
| Disposable equipment | |||
| 7/O Silk braided suture | Pearsall | 30514 | |
| 10/O Dafilon (polyamide) suture | B-Braun | G1118099 | |
| 6/O Vicryl (plygalectin) | Ethicon | W9537 | |
| Regular bevel needle, 1 inch, 21G | Bection, Dickinson and Company | 305175 | For ureteric anastamosis |
| Regular bevel needle, 5/8 inch, 25G | Bection, Dickinson and Company | 305122 | |
| Regular bevel needle, 1/2 inch, 30G | Bection, Dickinson and Company | 304000 | |
| Insulin needle 1ml, 29G | Bection, Dickinson and Company | 324827 | |
| Insulin needle 0.3ml, 30G | Bection, Dickinson and Company | 324826 | |
| 1 ml syringe slip tip | Bection, Dickinson and Company | 300184 | |
| 5 ml syringe slip tip | Bection, Dickinson and Company | 302187 | |
| Wypall paper swabs | Kimberley-Clark | L40 | sterilised by autoclave |
| Cotton wool buds | Johnson and Johnson | n/a | sterilised by autoclave |
| Plain drapes | Guardian | CB03 | sterilised by autoclave |
| Cell culture dish 60mm x 15mm | Corning Incorporated | 430166 | |
| Dispensing Pin | B-Braun | DP3500L / 413501 | Used with NaCl 0.9% |
| Re-agents and Drugs | |||
| (Lacri-Lube) White soft paraffin 57.3%, mineral oil 42.5% and lanolin alcohols 0.2% | Allergan Ltd | 21956GB10X | |
| (Videne) Povidone-iodine 10% | Ecolab Ltd | PL 04509/0041 | |
| (Vetalar V) Ketamine hydrochloride | Pfizer Animal Health | Vm 42058/4165 | 100mg/ml solution (dose 200mg/kg) |
| (Domitor) Medetomidine hydrochloride | Orion Pharma | Vm 06043/4003 | 1mg/ml (dose 0.5mg/kg) |
| (Vetergesic) Bupernorphine hydrochloride | Alsto Animal Health | Vm 00063/4002 | 0.3mg/ml (dose 0.05mg/kg) |
| (Antisedan) Atipamezole hydrochoride | Orion Pharma | Vm 06043/4004 | 5mg/ml (dose 2mg/kg) |
| University of Wisconsin Solution | Belzer Bridge to Life | n/a | dose approximately 500 microlitres/mouse |
| NaCl 0.9% | Baxter | FKE1323 | |
| Heparin Sulphate | non-proprietary | n/a | 5000units/ml (dose 5units/mouse) |
References
- Guild, W. R., Harrison, J. H., Merrill, J. P., Murray, J. Successful homotransplantation of the kidney in an identical twin. Trans. Am. Clin. Climatol Assoc. 67, 167-173 (1955).
- Wolfe, R. A., et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N. Engl. J. Med. 341, 1725-1730 (1999).
- Nankivell, B. J., Alexander, S. I. Rejection of the Kidney Allograft. N. Engl. J. Med. 363, 1451-1462 (2010).
- Tse, G. H., Hughes, J., Marson, L. P. Systematic review of mouse kidney transplantation. Transplant International. 26, 1149-1160 (2013).
- Skoskiewicz, M., Chase, C., Winn, H. J., Russell, P. S. Kidney transplants between mice of graded immunogenetic diversity. Transplant. Proc. 5, 721-725 (1973).
- Zhang, Z., et al. Pattern of liver, kidney, heart, and intestine allograft rejection in different mouse strain combinations. Transplantation. 62, 1267-1272 (1996).
- Qi, F., et al. Depletion of cells of monocyte lineage prevents loss of renal microvasculature in murine kidney transplantation. Transplantation. 86, 1267-1274 (2008).
- Dang, Z., Mackinnon, A., Marson, L. P., Sethi, T. Tubular atrophy and interstitial fibrosis after renal transplantation is dependent on galectin-3. Transplantation. 93, 477-484 (2012).
- Jabs, W. J., et al. Heterogeneity in the Evolution and Mechanisms of the Lesions of Kidney Allograft Rejection in Mice. Am. J. Transplant. 3, 1501-1509 (2003).
- Lin, T., et al. Deficiency of C4 from Donor or Recipient Mouse Fails to Prevent Renal Allograft Rejection. Am. J. Pathol. 168, 1241-1248 (2006).



