Abstract
Questo video dimostra in dettaglio una singola fibra protocollo registrazione elettrofisiologica in vitro utilizzando un preparato del mouse colon-retto-nervo. L'approccio permette l'identificazione imparziale e caratterizzazione funzionale delle singole afferenze del colon-retto. Registrazioni extracellulari di potenziali d'azione propagate (AP) che provengono da uno o pochi afferente (cioè, singolo-fibra) campi recettivi (RFS) del colon-retto sono costituiti da fasci di fibre nervose presi in giro. Il colon-retto viene rimosso sia con il bacino (PN) o splanchnic lombare (LSN) nervo collegato e aperta longitudinalmente. Il tessuto viene posto in una camera di registrazione, bloccato piatta e perfuso con soluzione di Krebs ossigenata. Stimolazione elettrica focale viene utilizzato per individuare le terminazioni afferenti colorettali, che vengono ulteriormente testati da tre stimoli meccanici distinti (smussare sondaggio, mucosa carezze e tratto circonferenziale) di categorizzare funzionalmente le afferenze in cinque mechanosensiclassi tive. Endings rispondono a nessuno di questi stimoli meccanici sono classificati come afferenze meccanico-insensitive (MIAS). Sia meccanosensibili e MIAS possono essere valutati per la sensibilizzazione (ad esempio, la risposta maggiore, soglia ridotta, e / o acquisizione di mechanosensitivity) per esposizioni localizzate del RFs ai prodotti chimici (per esempio, la zuppa infiammatoria (IS), la capsaicina, l'adenosina trifosfato (ATP)). Descriviamo l'apparecchio e la preparazione registrazione colorectum-nervo, raccolta di colon-retto con annesso PN o LSN, identificazione del RFs nel colon-retto, registrazione singola fibra da fasci nervosi, e l'applicazione localizzata di prodotti chimici per l'RF. Inoltre, le sfide della preparazione e l'applicazione di stimolazione meccanica standardizzati vengono anche discussi.
Introduction
Il dolore e ipersensibilità sono le lamentele predominanti dei pazienti affetti da disturbi gastrointestinali funzionali, tra cui la sindrome dell'intestino irritabile (IBS), che esistono in assenza di apparenti cause patobiologico o danni ai tessuti. Ad esempio, i pazienti IBS presentano ipersensibilità, comprese reazioni accresciute a rettale distensione palloncino e una maggiore sensibilità durante la normale funzione intestinale, così come ipersensibilità di rinvio somatiche (ossia, la tenerezza alla palpazione della zona addominale) 1. Perché il targeting afferenze colorettali ha dimostrato di essere efficace per alleviare il dolore e ipersensibilità in pazienti con IBS (ad esempio, l'instillazione intra-rettale di anestetici locali 2,3; ingestione orale della guanilato ciclasi C-agonisti linaclotide 4-6), una migliore comprensione della innervazione afferente del colon-retto è importante.
Afferenze viscerali, tra cui afferenze del colon-retto, Sono in grado di rispondere alle modalità chimici / di nutrienti e termiche (ad esempio, 7-9). Tuttavia, afferenze viscerali che rispondono a stimoli meccanici (cioè, afferenze meccanosensibili) sono stati i più studiato a fondo, perché gli stimoli meccanici (ad esempio, distensione luminale, tratto) sono quelle che generalmente danno luogo a sensazioni coscienti, tra cui il disagio e il dolore 10-16. Inoltre, i visceri sono innervate da afferenze meccanicamente insensibili (MIAS), comunemente definiti silenziosi o dormire nocicettori 17. In condizioni fisiologiche normali, MIAS non rispondere alla stimolazione meccanica o abbia una grande risposta soglie 18, ma possono diventare attivi e acquisire mechanosensitivity in condizioni fisiopatologiche e contribuire alla ipersensibilità.
Utilizzando la preparazione in vitro e il protocollo descritto qui, abbiamo sviluppato ed impiegato una strategia di stimolo elettrico al mare RCH per terminazioni ricettive, atti a identificare imparziale di entrambe le terminazioni meccanosensibili e MIA nel colon-retto 19. L'innervazione del colon-retto è derivato da splanchnic lombare (LSN) e del nervo pelvico (PN) percorsi, e include afferenze del colon che possono essere classificati in cinque classi meccanosensibili (sierose, mucose, muscoloso, muscoloso-mucosa, mesenterici) e una classe MIA 20. Utilizzando questa preparazione in vitro, abbiamo scoperto che MIAS colorettali mechanosensitivity acquisita (sensibilizzazione) a seguito di una breve esposizione dei loro campi recettivi ad una zuppa infiammatoria (IS), che ha sensibilizzato il 71% del MIAS nella via PN e il 23% del MIAS nella via LSN 19. Abbiamo anche documentato sensibilizzazione a lungo termine (fino a 28 giorni) del MIAS nel contesto di lunga durata ipersensibilità viscerale comportamentale (cioè, nei topi che ricevono trattamenti intracolonic con zymosan 21 o acido 2,4,6-trinitrobenzensulfonico (TNBS) 22) .
jove_content "> Tra afferenze meccanosensibili, afferenze muscolari e muscolo-mucose sono le uniche classi che tonicamente codificano tratto circonferenziale del colon-retto (cioè, sono stiro-sensitive) e Subserve la codifica dei nocivi distensione colorettale 23,24. Utilizzando un controllato dal computer Attuatore di forza, abbiamo applicato uno standard, omogenea, e riproducibile tratto rampa in direzione circonferenziale del tessuto colorettale appiattita e ulteriormente classificati afferenti tratto-sensibili, bassa soglia e ad alta soglia 23. Inoltre, l'andamento temporale della sensibilizzazione di stiramento afferenze -sensitive dopo zymosan intracolonic 21 o 22 TNBS trattamento corrisponde alla insorgenza, la persistenza, e / o il recupero dei comportamentale ipersensibilità viscerale, suggerendo un ruolo di afferenze colorettali tratto sensibile nel dolore viscerale e ipersensibilità.Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Questo protocollo è stato esaminato e approvato dalla University of Pittsburgh Istituzionale Animal Care and Use Committee.
1. Preparazione della soluzione di Krebs Modified e Drug Test Aliquote
- Rendere 6 L di soluzione di Krebs modificato contenente (in mM): NaCl 117,9, 4.7 KCl, 25 NaHCO 3, 1.3 NaH 2 PO 4, 1.2 MgSO4, CaCl 2 2,5, 11,1 D-glucosio, 2 butirrato di sodio, acetato di sodio 20 , 0.004 nifedipina (per bloccare le contrazioni muscolari spontanee), e 0,003 indometacina (per bloccare la sintesi di prostaglandine endogene). Utilizzare soluzioni Krebs ghiaccio freddi e caldi per la dissezione dei tessuti e la registrazione singola fibra, rispettivamente.
- Preparare eventuali soluzioni chimiche (ad esempio, IS, la capsaicina, ATP) in aliquote a concentrazioni desiderate.
2. Dissezione del Tissue colon-retto-nervo
- Anestetizzare e eutanasia topi maschi (6 - 8 settimane di vita, 20 - 30 g) inuna camera di CO 2 ad una velocità di flusso che sposta 10 - 30% del volume della camera per minuto fino topi smettere di respirare completamente come indicato dall'assenza di movimento del torace.
- Immediatamente dopo l'eutanasia, Exsanguinate tagliando aperta camera toracica, perforando l'atrio destro, e immergendo la carcassa del mouse in un ampio volume di (~ 500 ml) di ghiacciata soluzione Krebs (4 ° C) gorgogliare con CarboGen (95% O 2 , 5% di CO 2).
- Rimuovere accuratamente tutti i visceri, ma gli organi del colon e pelvica. Transetto il mouse nella metà attraverso il segmento vertebrale T12 leggermente sopra il diaframma toracico e trasferire il mezzo caudale di una camera di dissezione contenente ghiacciata, bolle soluzione Krebs.
- Sotto uno stereomicroscopio, rimuovere la vescica e gli organi riproduttivi per sezionare i loro incroci per l'uretra, e rimuovere la discesa / aorta addominale fino a quando non si biforca nelle arterie iliache comuni. Liberare il PN o il LSN dal loro surrounding tessuti per via smussa e seguire il nervo da fuori cresta iliaca fino al suo punto di ingresso ventrale nel L6 e S1 la colonna vertebrale (per PN) o T13 e L1 la colonna vertebrale (per LSN).
- Tagliare la sinfisi pubica e destra e giunti acetabolari sinistra, e togliere l'osso iliaco. Gratuito con attenzione sia la PN o LSN dal muscolo attaccato e del tessuto connettivo dal vicino al colon-retto fino dove il nervo entra la colonna vertebrale.
- Resecare attentamente l'osso iliaco per esporre il colon-retto distale. Sezionare il colon-retto distale con il PN collegato o LSN in continuum.
- Trasferire il colon retto con il nervo allegata al vano bagno di camera di tessuti. Rimuovere eccessivo tessuto connettivo da ulteriori dissezione, e aprire il colon-retto longitudinalmente lungo il confine anti-mesenterica.
- Con lato mucosa rivolto verso l'alto, pin bordo mesenterica del colon-retto adiacente al vano di registrazione nella base di silicone della chamber e fissare la lunghezza del colon-retto antimesenterico ad un rastrello di ganci collegati ad un attuatore forza (illustrata nella figura 1 e fotografato in Figura 2A).
- Estrarre il PN o LSN nel vano registrazione, che è collegato al vano vasca da un foro mouse e cancello. Adagiare il tronco nervoso su un piccolo specchio di vetro nel vano registrazione, che fornisce una superficie idrofila per il nervo di aderire. Superfuse vano bagno con calda (30 - 32 ° C), soluzione di Krebs ossigenata e riempire il vano di registrazione con olio minerale.
3. Single-fibra Registrazione e localizzazione del campo recettivo
- Rimuovere con cautela indietro il epinevrio (guaina del nervo) dal PN o LSN allo stereomicroscopio ad alto ingrandimento (50 - 60X). Utilizzando una pinza sottile, prendere in giro il tronco nervoso in 5-8 fasci nervosi di ~ 100 micron di spessore.
- Collocare il platino-iridioelettrodi a contatto con la soluzione Krebs nella camera tessuti. Posizionare in sequenza i singoli fasci nervosi sull'elettrodo registrazione fatta dello stesso materiale.
- Usare un pennello morbido per evocare gli AP delle afferenze colorettali delicatamente accarezzando su e giù per la superficie del colon-retto. Individuare il fascio nervoso (s) che innervano il colon attraverso rilevabile AP (potenziale d'azione) registrazioni.
NOTA: Il PN e LSN anche innervano la vescica urinaria e di altri organi pelvici. - Utilizzare un paio di 30 punte degli aghi G di dividere ulteriormente il fascio nervoso in sottili filamenti fascicolo di ~ 10 micron di spessore e posizionare un individuo filamento sul elettrodo di registrazione.
- Posizionare l'elettrodo concentrico con punta arrotondata perpendicolare alla superficie della mucosa per eccitare elettricamente terminazioni afferenti a intensità suprathreshold stimolo (10 mA magnitudo 0,5 durata msec @ 0,3 Hz), che produce un mm di raggio di diffusione attuale ~ 2. Spostare l'elettrodo sistematicamente (~ 1,5 mm passi) Lungo la lunghezza e la larghezza del colon-retto appiattita localizzare terminazioni ricettive.
- Quando un desinenza afferente è eccitato, regolare la posizione degli elettrodi di individuare il sito di attivazione (campo recettivo, RF) che richiede intensità dello stimolo minimo (soglia di stimolo). Scartare terminazioni con una soglia di stimolo> 3 mA 19.
- Calcolare la velocità di conduzione (CV) da 1) la distanza tra l'elettrodo di stimolazione al campo recettivo (RF) e il sito registrazione e 2) il ritardo di conduzione (ad esempio, la Figura 2B) tra il manufatto stimolo e l'inizio del potenziale d'azione .
CV (m / sec) = distanza (mm) / ritardo di conduzione (msec).
4. Classificazione funzionale di meccanosensibili colorettale afferenze
- Dopo aver individuato un RF da stimolazione elettrica, si applicano le seguenti tre stimoli meccanici alla RF:
- Effettuare lo stimolo tastatura premendo la punta di un calibramonofilamento ted von Frey-come il nylon (0,4 e 1 g di forza) perpendicolarmente verso la RF sul colon-retto appiattita.
- Effettuare lo stimolo accarezzando accarezzando delicatamente la mucosa del colon-retto con un bel filo di nylon filamento (10 mg forza) per generare un piccolo sforzo di taglio superficiale alla RF.
- Condurre il tratto circonferenziale con una forza attuatore controllato dal computer, che offre una forza tratto rampa (0-170 milioni di euro a 5 mN / sec) in direzione circonferenziale lungo il bordo anti-mesenterica del colon-retto attraverso la rake di ganci descritti al punto 2.8 .
- Classificare afferenze come sierose (solo rispondere a smussare sondare), della mucosa (rispondere alle mucose accarezzare e smussare sondare), muscolare (rispondere tratto circonferenziale e smussare sondare) muscolare / mucose (rispondere tratto circonferenziale, mucosa carezze e smussare sondare), o MIA (non reattivo a qualsiasi dei tre stimoli meccanici).
- Per afferenze mesenterici (solo inl'innervazione LSN), che sono difficili da attivare selettivamente dalla stimolazione elettrica, individuare le loro terminazioni ricettive da accarezzare meccanica / sondare del mesentere.
- Per afferenze tratto sensibili (muscolare e muscolo-mucose), determinare la soglia di risposta, che è definita come la forza che evoca il primo AP durante tratto rampa.
- Per afferenze sierose, registrare le loro risposte alla crescente livelli di puntata sondare il campo recettivo guidato dalla forza attuatore controllato dal computer.
5. Chemical Applicazione / Modulazione di Endings ricettive
- Registrare una risposta di base ad uno stimolo meccanico (cioè, la risposta al tratto rampa, puntata di sondaggio, o mucose carezze).
- Coat il bordo inferiore di un pezzo di tubo (ottone o acciaio inossidabile, altezza 10 mm e 4 x 4 mm 2 quadrata o 4 - diametro di 5 mm) con vaselina e posizionarlo sopra il campo recettivo sul colon-retto.
- Rimuoverela soluzione Krebs all'interno del tubo, ed esporre il finale ricettivo da 3 - 5 minuti a 170 microlitri della soluzione contenente la sostanza chimica (s) da testare.
- Monitorare la risposta del afferente durante l'applicazione chimica (alcune afferenze sono chemiosensibile).
- Rimuovere la soluzione chimica e il tubo di interrompere l'azione della sostanza chimica. Da 4 - 6 min, testare la risposta afferenti allo stesso stimolo meccanico nella risposta basale.
- Riapplicare di nuovo lo stimolo meccanico dopo periodo sufficiente di wash-out (> 15 min).
6. picchi Registrazione e discriminante AP
- Digitalizzare i segnali elettrici registrati da assoni a 20 kHz e salvare i dati su un computer. Monitorare il segnale in linea da un monitor audio.
- Analizzare le punte AP off-line e discriminare singole unità basate su analisi delle componenti principali delle singole forme d'onda picco 25.
NOTA: Un record deve contenere non più thun due unità attive facilmente discriminabili.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La configurazione è illustrata nella figura 1. Esso comprende una camera di tessuto su misura che ospita il colon retto in un vano vasca silicone rivestito e il nervo attaccato in un vano d'olio minerale contigui. La camera a due compartimenti stato lavorato da un blocco solido di plastica acrilica da una macchina CNC; il fondo di entrambi gli scomparti è stato successivamente rivestito con silicone ferma per consentire una facile pin giù del tessuto colorettale. AP extracellulari da fasci nervosi presi in giro sono registrati con un basso rumore, amplificatore differenziale a batteria con un elevato rapporto di reiezione di modo comune (CMRR ~ 60 dB). Il guadagno dell'amplificatore è impostato x10,000 e l'intervallo di banda del filtro a 0.3 a 10 kHz. La stimolazione elettrica del colon-retto viene consegnato da uno stimolatore otticamente accoppiato a corrente costante attraverso un elettrodo concentrica a contatto con la mucosa del colon-retto. Stimolazione meccanica (colon-retto e tratto punctate sondare) viene consegnato da acomputer controllato forza attuatore. Un convertitore AD e software appropriato sovrintendono entrambi i processi di stimolazione e registrazione inviando uscite di comando di tensione di avviare stimoli meccanici ed elettrici, nonché registrazione e digitalizzare i segnali extracellulari AP dall'amplificatore differenziale. Per isolare da sorgenti di rumore meccaniche ed elettriche, la camera di tessuti, microscopio e amplificatore differenziale sono collocati all'interno di una gabbia di Faraday montato su un tavolo pneumatico aria.
Come mostrato in Figura 2A, il colon retto con il nervo allegata è sezionato fuori da un mouse, sezionato lungo il bordo anti-mesenterico, e bloccato piatta nella camera tessuto rivestito di silicone; il nervo è posto su uno specchio di vetro nella camera di registrazione adiacenti. Mostrati nella Figura 2B è un record rappresentativo di un potenziale d'azione (AP) in risposta alla stimolazione elettrica del RF a soglia. L'AP in questo disco è in ritardo rispetto l'arte di stimoloifact (•) da 49 msec a causa del ritardo di conduzione dal RF all'elettrodo di registrazione, con un conseguente velocità di conduzione calcolato di 0,43 m / sec, e nell'intervallo di fibre C amieliniche. Visualizzati in Figura 2C sono risposte tipiche di un afferenti agli stimoli consegnate a mano (sondare della RF con von monofilamenti Frey-come, 1 g, e una raffinata mucosa carezze del RF, 10 mg). Questo record contiene due afferenze facilmente discriminabili; solo il grande afferenti ampiezza risponde carezze. Come mostrato nella Figura 2D, risposte afferenti tastatura sono stati valutati da una forza attuatore controllato da computer che fornisce allo stesso sito sul colorectum una serie di forze meccaniche precisamente temporizzati e riproducibili (5, 10, 20, 40 e 80 mN, 5 Durata sec). Allo stesso modo, tratto circonferenziale del colon-retto (0-170 milioni di euro a 5 mN / sec), viene consegnato dallo stesso attuatore con una risposta rappresentante visualizzato in figura 2E
Come mostrato in Figura 3, afferenti colorettali possono essere funzionalmente classificati in sei classi basate sui loro profili di risposta a stimoli meccanici tre distinti (vedi precedente punto 4.2). Tutte le terminazioni afferenti ad eccezione di afferenze mesenterici erano situati dalla stimolazione elettrica (e-stim, più a sinistra della colonna, le frecce indicano stimoli artefatto). Meccanicamente afferenze insensibili (MIAS) non rispondono a nessuna delle tre stimoli meccanici. Al contrario, tutti i finali meccanosensibili rispondono al sondaggio (0,4-1,4 g). Tra questi, terminazioni muscolari e muscolo-mucose sono anche attivate tratto circonferenziale (0-170 milioni), e, quindi, sono chiamati afferenze tratto sensibili; terminazioni muscolo-mucose sono anche attivati da accarezzare (10 mg). Terminazioni mucose sono anche attivati da accarezzare (10 mg), ma non si estendono e terminazioni sierose non sono attivati da una tratto o carezze. Terminazioni mesenteriche sono identificati da meccanico bcorrere il mesentere.
Mostrato in Figura 4A sono risposte rappresentativi di un tratto afferente sensibile evocata da tre tratti circonferenziali consecutivi separati da 5 min. I numeri spike sono equamente cestinate in tre scomparti e visualizzati come funzioni di stimolo-risposta in figura 4B, rivelando alta riproducibilità in entrambi magnitudo risposta (numero spike) e soglia di risposta.
Questa preparazione colon-retto-nervo in vitro permette anche l'applicazione locale di prodotti chimici per afferenti finali ricettive. L'esposizione a sostanze chimiche è limitata alle regioni del RF afferente posizionando ottone o tubo di acciaio inox cima mucosa colorettale isolare fisicamente il RF dal resto del colon-retto. I risultati tipici seguenti applicazioni chimico sono: attivazione diretta di afferenze su domanda di una soluzione ipertonica acida (AHS 26; Figura 5A), no attivazione, ma l'acquisizione di mechanosensitivity da MIA dopo l'applicazione di una zuppa infiammatoria (IS 19; Figura 5B), aumento della risposta (ad esempio, sensibilizzazione) a stiramento meccanico dopo l'applicazione di IS (Figura 5C), e la risposta ridotta a stiramento meccanico dopo l'applicazione di cGMP (Figura 5D).

Figura 1. Rappresentazione schematica del setup sperimentale. La colorectum-nervo viene posto in una camera di tessuto a due compartimenti e isolato con stadio dell'amplificatore differenziale con altri apparecchi elettronici da una gabbia di Faraday. Ogni RF afferente è identificato da stimolazione elettrica (e-stim), del colon-retto e testato da tre stimoli meccanici: nylon monofilamento di sondaggio, carezze della mucosa, e tratto circonferenziale. TTP: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
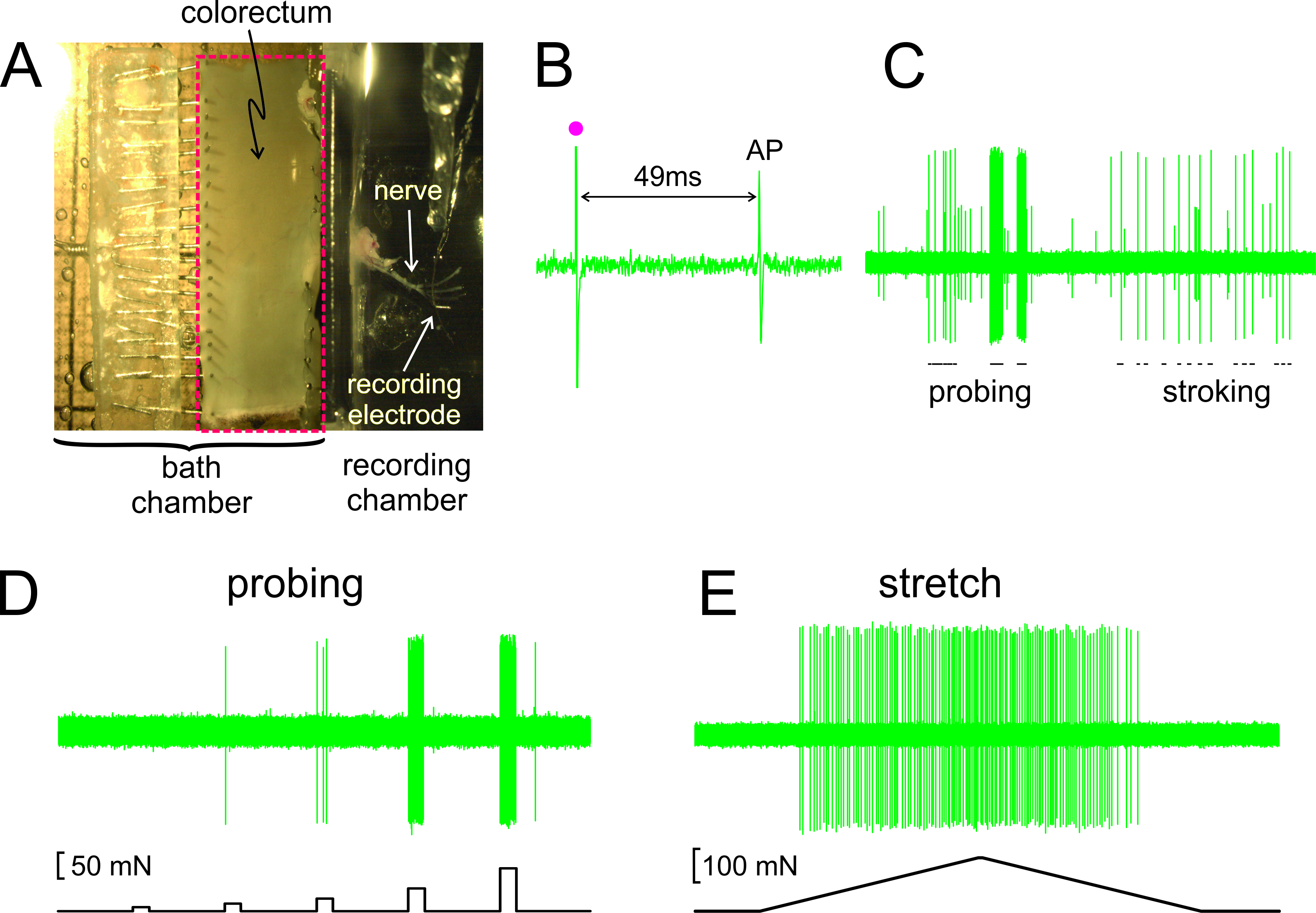
Figura 2. L'immagine attraverso lo stereomicroscopio del colon-retto sezionato con nervo pelvico allegato (A) B -. E mostrare record di rappresentanza. (B) un potenziale d'azione (AP) evocata dalla stimolazione elettrica (stimolo artefatto, •). (C) Le risposte tipiche di monofilo sondaggio e mucose carezze tenuto in mano. (D, E) Le risposte al sondaggio e per allungare circonferenziale consegnato dalla forza attuatore controllato dal computer, rispettivamente. Clicca qui per vedere una versione più grande di questa figura.

Figura 3. Caratterizzazione funzionale delle classi afferenti colorettali. Afferenze si trovano dalla stimolazione elettrica (e-stim, ↑), del colon-retto e suddivisi in cinque classi meccanosensibili ed uno afferente meccanico-insensitive di classe (MIA) in base ai loro rispettivi profili di risposta a tre stimoli meccanici:. sondare, accarezzare, e tratto Clicca qui per vedere una versione più grande di questa figura.

Figura 4. risposte afferenti riproducibili, stimolazione meccanica controllata da computer. (A) Le risposte di un muscolo-mucosa unfferent a tre consecutivi dilagato tratti (0-170 milioni di euro a 5 mN / sec; 5 min intervallo inter-stimolo). (B) Risposte (azione potenziali picchi) sono stati equamente cestinate in tre scomparti (0-57, 57-113, e 113-170 milioni) e visualizzati come funzioni di stimolo-risposta; soglia di intervento viene visualizzata nel riquadro. Clicca qui per vedere una versione più grande di questa figura.

Figura 5. risposte afferenti all'applicazione chimico localizzato ricettivi finali. (A) Un esempio di chemiosensibilità di un afferente sierosa di applicazione della soluzione ipertonica acida (AHS). (B) Un esempio di acquisizione di mechanosensitivity (sensibilizzazione) da un MIA termina. Questo MIA non ha risposto direttamentead una zuppa infiammatoria (IS), ma ha risposto a 1,4 g monofilamento di sondaggio dopo. (C) Sensibilizzazione (aumento di grandezza risposta e riduzione soglia di risposta) per allungare di un afferente muscolare dopo l'esposizione della sua fine per IS. (D) Attenuazione della risposta di allungare da un afferente muscolo-mucosa dopo l'esposizione della sua fine per guanosina monofosfato ciclico (cGMP). Clicca qui per vedere una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La vitro preparazione colon-retto-nervo qui descritta ha dimostrato di essere un approccio efficace per studiare le funzioni di codifica neurale delle singole afferenze del colon-retto, che integra ben altri approcci non funzionali (ad esempio, studi cellulari, molecolari e istologiche) sui neuroni sensoriali viscerali ( vedi recensione 27 per i dettagli). Meccanismi neuronali che contribuiscono alla nocicezione e ipersensibilità colorettale a lungo termine sono stati rivelati e manipolazioni farmacologiche sono stati effettuati che hanno obiettivi rivelato che potrebbe alleviare il dolore viscerale. I seguenti punti chiave associati con successo di questa preparazione sono discussi di seguito: 1) riduzione del rumore elettrico, 2) aumento di rilevamento del segnale, e 3) la selezione di uno stimolo standardizzato per valutare le variazioni di codifica afferente. Inoltre, alcune limitazioni di questa tecnica sono discussi.
Potenziali d'azione (AP) propagating intracellulare lungo nervo assoni hanno generalmente un potenziale transmembrana di 100-130 mV. Tuttavia, a causa della piccola capacità specifica della membrana dell'assone, questo relativamente grande di depolarizzazione traduce solo in un piccolo spostamento carica elettrica attraverso la membrana cellulare, che può facilmente dissipare nel tessuto extracellulare / liquido interstiziale circostante (che ha una impedenza elettrica notevolmente inferiore che la membrana lipidica). Per la registrazione extracellulare da filamenti nervosi / assoni, il segnale elettrico è solitamente nell'intervallo microvolt, vicino alla grandezza del rumore termico / bianco associato con una tipica configurazione di registrazione bioelettrica, rendendo la riduzione del rumore prima priorità per una scrittura. Per più efficace isolamento dal rumore elettrico ambiente, può essere utile per posizionare gli elettrodi camera tessuto, di registrazione e di messa a terra, l'amplificatore differenziale (DC a batteria) e lo stereomicroscopio in una gabbia di Faraday. Se il movimento artefattos verifica, posizionare la gabbia di Faraday su un tavolo aria pneumatica per smorzare vibrazioni meccaniche è utile. Idealmente, gli elettrodi di registrazione e di riferimento che entrano i "+" e "-" porte dell'amplificatore differenziale, rispettivamente, dovrebbero avere paragonabile impedenza rispetto alla loro base comune ed essere situato vicino a vicenda. Pertanto, qualsiasi rumore esterno verrà registrato circa ugualmente da entrambi gli elettrodi e sottoposto alla rigorosa reiezione di modo comune dell'amplificatore differenziale.
Nella nostra configurazione (Figura 2A), l'elettrodo di riferimento viene immerso nella soluzione di perfusione Krebs nella camera tessuto mentre l'elettrodo di registrazione è in contatto con un filamento nervo multa di notevole impedenza. Questa configurazione a singolo elettrodo con una mancata corrispondenza di impedenza non banale di solito non è l'ideale per la riduzione del rumore. Tuttavia, questa configurazione offre la comodità di collocare il sottile filo di nervi su un solo elettrode, che è particolarmente interessante quando si registra da topo filamenti nervosi colorettali di lunghezza limitata (10 - 15 mm). Basandosi sulla nostra esperienza, la configurazione a singolo elettrodo è accettabile quando il rumore di fondo da picco a picco è inferiore a 20 mV nel record. Altrimenti, la riduzione ulteriormente il rumore richiederebbe una configurazione di registrazione a due elettrodi in cui il sottile filo nervo deve essere in contatto con entrambi gli elettrodi di registrazione e di riferimento disposti parallelamente l'uno all'altro. Tutte le parti metalliche di grandi dimensioni all'interno della gabbia di Faraday devono essere a terra in maniera stella simile a un terreno comune, un blocco di rame nel nostro setup. Cura deve essere presa per evitare la formazione di anelli di massa.
Per garantire il rilevamento extracellulare di AP, il primo passo è successo dissezione del tessuto colon-retto-nervoso. Stringendo o tirando il nervo durante la dissezione deve essere evitata, che può danneggiare irreversibilmente il nervo e incidere AP conduzione. Lo stelo nervo sezionato bisogno anche to essere privi di qualsiasi tessuto muscolare connessa, che perde potassio se danneggiato e può bloccare conduzione nervosa dalla depolarizzazione. Questa abilità dissezione è generalmente acquisita attraverso la pratica diligente per settimane o mesi e richiede un alto livello di coordinazione occhio-mano e abilità nella gestione e l'utilizzo di strumenti chirurgici. Inoltre, per evitare danni al tessuto colorettale, la strategia di ricerca elettrica utilizza un elettrodo concentrica che ha una smussato, punta arrotondata e il diametro relativamente grande (esterna Φ0.55 mm, interno Φ0.125 mm) ed è collegato ad un micromanipolatore by un ponte compliant, determina una forza meccanica modesta applicata alla superficie della mucosa (~ 100 mg). Al fine di acquisire un segnale più grande nella traccia di registrazione, la corrente transmembrana AP-indotta deve essere incanalata e "intrappolato" sull'elettrodo creando un piccolo ponte impedenza tra l'assone del nervo (s) e la superficie dell'elettrodo. Così, il epineurio e perineurio che isolarebisogno del coraggio di essere sezionato gratuitamente durante il processo di scissione del nervo in sottili filamenti di ~ 10 micron di spessore. Poiché la corrente di transmembrana AP-indotta dissipa considerevolmente a breve distanza dalla membrana dell'assone, un filamento nervoso sottile solito si traduce in un miglior rapporto segnale-rumore dovuto alla maggiore vicinanza assoni 'alla superficie dell'elettrodo. Nella camera olio minerale, lo specchio che il nervo è posto spesso su attira un sottile strato di soluzione di Krebs (la superficie del vetro è idrofila). È quindi necessario che l'elettrodo di registrazione e del nervo filamento non sono in contatto con la superficie a specchio durante la registrazione. Eventuali goccioline residue di soluzione di Krebs, che forniscono un ponte a bassa impedenza tra l'elettrodo e la superficie a specchio (cioè, shunt) ridurrà significativamente l'ampiezza del segnale nel record.
Questa preparazione colon-retto-nervo permette lo studio delle alterazioni funzionali di afferenze dopo esposizioneLe RF ad una varietà di mediatori chimici e insulti in vitro come pure nel contesto di condizioni fisiopatologiche a lungo termine (ad esempio, colorectums prelevati da topi trattati in precedenza). Una misura oggettiva di cambiamenti funzionali afferenti dipende il seguente: 1) uno stimolo standardizzato con alta precisione e riproducibilità e 2) risposte afferenti che sono robusti e riproducibili. Dei tre stimoli meccanici applicati al colon-retto, di sondaggio e accarezzando stimoli del RF sono spesso consegnato da palmari von monofilamenti Frey-like. Per sondare il monofilamento di solito è calibrato per offrire una forza perpendicolare riproducibili quando si piega. Monofilamenti Tuttavia, von Frey-simili (0,4 e 1 g) hanno diametri in sezione trasversale piccole e diversi (0,2 e 0,3 mm, rispettivamente), con conseguente stress nominale elevata quando applicata perpendicolarmente alla superficie colorettale (124,8 kPa per 0,4 ge 138,7 kPa per 1 g), un intenso, puntata stimolo meccanico beyond il range fisiologico normale. Inoltre, il bordo tagliente del filamento probabile causa della distribuzione non uniforme delle sollecitazioni con focale picco dello stress notevolmente superiore alla tensione nominale (concentrazione stress). Dato che la dimensione tipica RF (1 mm 2) è significativamente maggiore della sezione trasversale di un monofilamento, e l'incapacità di stimolare riproducibile sito identico ad un monofilamento a mano, è comune osservare risposte a stimoli ripetuti che differiscono significativamente in frequenza AP e durata. Come esempio, le risposte al tastatura mostrato in Figura 2C dalla stessa monofilamento portatile (1 g) variava notevolmente che probabilmente sono contribuito ad dall'incapacità di sondare riproducibile sito identici e durata variabile e l'intervallo tra gli stimoli consecutivi. Mucosa Accarezzare consegnato da un filamento a mano è altrettanto impegnativo e tende a evocare risposte variabili dallo stesso afferente. Stimolo riproducibilità può esseremigliorata usando una forza attuatore controllato dal computer per fornire sondare precise (e allungamento) forze. Per tastatura, usiamo un monofilamento di diametro maggiore (ad esempio, # 6.45, 1 mm) che copre più pienamente un tipico RF afferente 24,28. Computer controllato tratto circonferenziale, a differenza di altri approcci tessuto estende diretti al RF, permette deformazione omogenea per tutta la lunghezza del colon-retto, rendendo possibile la correlazione con distensione colorettale nella sua configurazione cilindrica originale basata su comparabile sollecitazioni meccaniche circonferenziale (cioè 0 - 170 mN tratto è equivalente a 0 - 45 mm Hg di pressione endoluminale 23). Poiché la forza di allungamento viene applicata uniformemente sul bordo anti-mesenterico, non direttamente al RF, la sollecitazione meccanica locale evocata al RF afferente è riproducibile tra le applicazioni consecutivi di stiramento. Inoltre, la L-tipo Ca 2+ bloccante del canale nifedipina aggiunto al bagno per inhibit spontanea contrazione della muscolatura liscia, contribuisce al mantenimento della conformità del colon-retto tra i test tratto a rampa 23. Infine, le risposte afferenti al protocollo tratto rampa hanno dimostrato di essere riproducibile con piccolo variabilità sia la soglia funzione di stimolo-risposta e la risposta (ad esempio, figura 4). Così, le risposte afferenti alle tratto rampa sono stati ampiamente utilizzati come una valutazione oggettiva dei cambiamenti di funzione afferente nello studio dei meccanismi neuronali del dolore viscerale e ipersensibilità (ad esempio, 19-22,24,26,28-31).
La preparazione colon-retto, del nervo è un potente strumento per lo studio delle afferenze viscerali del colon-retto. Tuttavia, ha anche alcune limitazioni. In primo luogo, gli assoni dei corpi cellulari dei neuroni sensoriali nel ganglio della radice dorsale vengono recisi nella preparazione, precludendo lo studio delle identità molecolari di quei corpi cellulari (ad esempio, un'unica cellula RT-PCR o transcriptome analisi delle diverse classi di afferenze del colon-retto). In secondo luogo, il rapporto segnale-rumore della registrazione singola fibra richiede ottimali chirurgici dissezione / nervose competenze scissione e la registrazione a basso rumore, limitando significativamente più ampia applicazione di questo protocollo in altri laboratori. Terzo, questa preparazione in vitro può non essere applicabile alle indagini di fattori sistemici che modulano Sensazione viscerale, come il sistema nervoso autonomo, ormoni, citochine e microflora intestinale circolante, e scendendo la modulazione del sistema nervoso centrale.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



