Abstract
Este vídeo mostra em pormenor um protocolo de fibra única gravação electrofisiológico in vitro utilizando uma preparação colorectum rato-do nervo. A abordagem permite a identificação imparcial e caracterização funcional de aferentes colorretais individuais. Gravações extracelulares de potenciais de acção propagadas (APs) que se originam a partir de um ou alguns aferente (ou seja, de fibra única) campos receptivos (RFS) na colorectum fascículos são feitos de fibras nervosas provocavam. O colorectum é removido quer com o pélvica (PN) ou splanchnic lombar (LSN) do nervo ligado e abertos longitudinalmente. O tecido é colocado numa câmara de registo, fixado plana e perfundidas com solução de Krebs oxigenada. Estimulação elétrica Focal é usado para localizar as terminações aferentes colorretais, que são ainda mais testadas por três estímulos mecânicos distintos (sem corte sondagem, acariciando mucosa e stretch circunferencial) para categorizar funcionalmente os aferentes em cinco mechanosensiaulas operatório. Endings respondendo a nenhum desses estímulos mecânicos são classificados como aferentes mecanicamente insensíveis (MIAs). Ambos mechanosensitive e MIAs pode ser avaliado para a sensibilização (ou seja, a resposta melhorada, limiar reduzida e / ou aquisição de mecanosensibilidade) por exposição localizada entre os FR para produtos químicos (por exemplo, sopa inflamatória (IS), a capsaicina, trifosfato de adenosina (ATP)). Nós descrevemos o equipamento e preparação de gravação colorectum-nervo, colheita de colorectum com anexado PN ou LSN, identificação de FR no colorectum, gravação de fibra única de fascículos, e aplicação localizada de produtos químicos para a RF. Além disso, os desafios de preparação e aplicação de estimulação mecânica padronizada também são discutidos.
Introduction
Dor e hipersensibilidade são predominantes as queixas dos pacientes que sofrem de desordens gastrointestinais funcionais, incluindo o síndrome do intestino irritável (IBS), que existem na ausência de pathobiological causa aparente ou danos nos tecidos. Por exemplo, pacientes com SII exibem hipersensibilidade, incluindo respostas intensificadas para distensão rectal balão e aumento da sensibilidade na função normal do intestino, bem como a hipersensibilidade de referência somáticas (isto é, sensibilidade à palpação da zona abdominal) 1. Porque direccionamento aferentes colorectal tem provado ser eficaz no alívio da dor e hipersensibilidade em pacientes com IBS (por exemplo, a instilação intra-rectal de anestésicos locais 2,3; ingestão oral da guanilato ciclase C-agonista linaclotide 4-6), uma melhor compreensão do inervação aferente do colorectum é importante.
Aferentes viscerais, incluindo aferentes colorretais, São capazes de responder às modalidades químicos / em nutrientes e térmicos (por exemplo, 7-9). No entanto, aferentes viscerais que respondem a estímulos mecânicos (ou seja, aferentes mechanosensitive) ter sido o mais estudado porque estímulos mecânicos (por exemplo, distensão luminal, estiramento) são aqueles que normalmente dão origem a sensações conscientes, incluindo desconforto e dor 10-16. Além disso, as vísceras também são inervados por aferentes insensíveis mecanicamente (MIAs), vulgarmente designados por silenciosas ou dormir nociceptors 17. Em condições fisiológicas normais, MIAs não respondem ao estímulo mecânico ou ter resposta muito alta limiares 18, mas pode se tornar ativo e adquirir mecanosensibilidade em condições fisiopatológicas e contribuir para a hipersensibilidade.
Usando a preparação in vitro e protocolo descrito aqui, nós desenvolvemos e empregou uma estratégia de estímulo elétrico para o mar RCH para terminações receptivas, permitindo a identificação imparcial de ambas as terminações mechanosensitive e MIA no colorectum 19. A inervação colorectal é derivado splanchnic lombar (LSN) e do nervo pélvico (PN) vias, e inclui aferentes colorretal que podem ser classificados em cinco classes mechanosensitive (serosa, mucosa, muscular, músculo-mucosa, mesentérica) e uma classe MIA 20. Usando esta preparação in vitro, verificou-se que MIAs colorretais adquirido mecanosensibilidade (sensibilizar) após uma breve exposição de seus campos receptivos a uma sopa inflamatória (IS), que sensibilizados 71% dos MIAs na via PN e 23% das MIAs na via LSN 19. Nós também documentada sensibilização a longo prazo (até 28 dias) de MI As no contexto da hipersensibilidade visceral comportamentais de longa duração (isto é, nos ratos que receberam os tratamentos com zimosan intracolónica 21 ou ácido 2,4,6-trinitrobenzenossulfónico (TNBS) 22) .
jove_content "> Entre aferentes mechanosensitive, aferentes musculares e muscular-mucosas são as únicas classes que tonicamente codificam trecho circunferencial da colorectum (ou seja, são stretch-sensitive) e servir à codificação de nocivo distensão colorectal 23,24. Usando um computador controlado- força do actuador, foi aplicado um padrão, homogénea e reprodutível em rampa estiramento na direcção circunferencial do tecido colorectal achatada e mais categorizados aferentes sensíveis ao estiramento tão baixo limiar e de alto limiar 23. Além disso, o curso de tempo da sensibilização de estiramento aferentes sensíveis ao após zymosan intracolônica 21 ou 22 TNBS tratamento corresponde ao início, persistência e / ou recuperação de hipersensibilidade visceral comportamental, sugerindo um papel de aferentes colorretais sensíveis ao estiramento na dor visceral e hipersensibilidade.Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Este protocolo foi revisto e aprovado pela Universidade de Pittsburgh Institutional Animal Care e do Comitê Use.
1. Preparação da solução de Krebs modificado e teste de droga Alíquotas
- Adicione 6 L de solução de Krebs modificada, que contém (em mM): NaCl 117,9, KCl 4,7, NaHCO3 25, 1.3 NaH 2 PO 4, 1,2 MgSO4, 2,5 CaCl2, 11,1 de D-glucose, 2 butirato de sódio, acetato de sódio 20 , 0,004 nifedipina (para bloquear as contracções espontâneas do músculo), 0,003 e indometacina (para bloquear a síntese de prostaglandinas endógenas). Utilizar soluções ice-frias e quentes Krebs para dissecção dos tecidos e gravação de fibra única, respectivamente.
- Preparar todas as soluções químicas (por exemplo, IS, capsaicina, ATP) em alíquotas a concentrações desejadas.
2. dissecção do tecido colorectum nervo-
- Anestesiar e eutanásia ratos machos (6-8 semanas de idade, 20 - 30 g) emuma câmara de CO 2 a um caudal que desloca 10 - 30% do volume da câmara por minuto até que os ratinhos parar de respirar completamente, como indicado pela ausência do movimento do tórax.
- Imediatamente após a eutanásia, desangrar, cortando abrir a caixa torácica, perfurando o átrio direito, e imergindo a carcaça do mouse em um amplo volume de (~ 500 ml) de gelado Krebs solução (4 ° C) aeradas com carbogênio (95% O 2 , 5% de CO 2).
- Remova cuidadosamente todas as vísceras, mas os dois pontos e pélvicas órgãos. Transecto o mouse pela metade em todo o segmento da coluna vertebral T12 ligeiramente acima do diafragma torácico e transferir a metade caudal para uma câmara de dissecção contendo gelo frio, borbulhar solução Krebs.
- Sob um microscópio estereoscópico, remover a bexiga e os órgãos reprodutivos, ao seccionar os seus cruzamentos para a uretra, e remova o descendente / aorta abdominal até que se bifurca em artérias ilíacas comuns. Livre o PN ou o LSN de seu surrounding tecidos por dissecção romba e siga o nervo do lado de fora da crista ilíaca até o seu ponto de entrada ventral na L6 e S1 coluna vertebral (por PN) ou T13 e L1 coluna vertebral (por LSN).
- Corte a sínfise púbica e à direita e articulações do acetábulo esquerda, e remova o osso ilíaco. Cuidadosamente livre tanto o PN ou LSN do músculo ligado e do tecido conjuntivo de perto da colorectum até onde o nervo entra na coluna vertebral.
- Ressecar cuidadosamente o osso ilíaco para expor o colorectum distal. Dissecar o colorectum distal com o PN anexado ou LSN no continuum.
- Transferir a colorectum com o nervo ligado ao compartimento da câmara de banho de tecido. Remover excesso de tecido conjuntivo por mais dissecação, e abrir o colorectum longitudinalmente ao longo da fronteira anti-mesentérica.
- Com o lado da mucosa voltada para cima, o pino da borda mesentérica do colorectum adjacente ao compartimento de gravação para a base de silicone da chamber e anexar o comprimento antimesentérica do colorectum a um ancinho de ganchos ligados a um actuador de força (ilustrada na Figura 1 e fotografado na Figura 2A).
- Estender o LSN PN ou no compartimento de gravação, o qual está ligado ao compartimento de banho por um buraco de rato e portão. Cuidadosamente, coloque o tronco do nervo sobre um espelho de vidro pequeno no compartimento de gravação, o que proporciona uma superfície hidrófila para o nervo para aderir. Superfuse compartimento do banho com água morna (30-32 ° C), solução de Krebs oxigenada e encher o compartimento de gravação com óleo mineral.
Gravação 3. Single-fibra e localização do campo receptivo
- Retire cuidadosamente de volta o epineuro (bainha do nervo) do PN ou LSN, ao microscópio estereoscópico em alta ampliação (50 - 60X). Usando uma pinça fina, provocar o tronco do nervo em 5-8 feixes de nervos de ~ 100 m de espessura.
- Coloque a referência de platina-irídioeléctrodo em contacto com a solução de Krebs na câmara de tecido. Sequencialmente colocar os feixes de nervos individuais sobre o eléctrodo de gravação feitos do mesmo material.
- Use um pincel macio para evocar APs dos aferentes colorretais por acariciando acima e abaixo da superfície colorectal. Localize o pacote (s) de nervos que inervam o cólon através AP detectável (potencial de ação) gravações.
NOTA: A PN e LSN também inervam a bexiga e outros órgãos pélvicos. - Use um par de 30 g pontas de agulha para dividir ainda mais o feixe de nervos em filamentos finos fascículo de ~ 10 mm de espessura e coloque um filamento indivíduo para o eletrodo de registro.
- Coloque o eletrodo concêntrico rodada de ponta perpendicular à superfície da mucosa para excitar eletricamente terminações aferentes na intensidade suprathreshold estímulo (10 mA magnitude, 0,5 duração ms @ 0,3 Hz), que produz um raio de propagação mm atual ~ 2. Mova o eletrodo sistematicamente (~ 1,5 passos mm) Ao longo do comprimento e largura do colorectum achatadas para localizar terminações receptivas.
- Quando um final aferentes está animado, ajustar a posição do eletrodo para identificar o local da ativação (campo receptivo, RF) que requer intensidade mínima de estímulo (limiar de estímulo). Descarte terminações com um limiar de estímulo> 3 mA 19.
- Calcula-se a velocidade de condução (CV) a partir de 1) a distância entre o eléctrodo estimulante no campo receptivo (RF) e o local de gravação e 2) o atraso na condução (por exemplo, a Figura 2B) entre o artefacto de estímulo e o aparecimento do potencial de acção .
CV (m / s) = distância (mm) / atraso de condução (ms).
4. Classificação Funcional de Mechanosensitive colorretais Aferentes
- Depois de localizar um RF pela estimulação elétrica, aplicam-se as seguintes três estímulos mecânicos para a RF:
- Conduzir o estímulo sondagem pressionando a ponta de uma calibrated von Frey-like monofilamento de nylon (0,4 e 1 g vigor) perpendicularmente ao RF na colorectum achatada.
- Conduzir o estímulo acariciando acariciando gentilmente a mucosa retal com uma multa fio de nylon de filamento (10 mg vigor) para gerar uma pequena tensão de corte superficial na RF.
- Conduzir o trecho circular usando uma força atuador controlado por computador, o que proporciona uma força trecho em rampa (0-170 mN em 5 mn / seg) em direção circunferencial ao longo da borda anti-mesentérica do colorectum via o rake de ganchos descritos no passo 2.8 .
- Classifique aferentes como serosa (responder apenas a despontar sondagem), mucosa (responder a mucosa acariciando e neutralizar sondagem), muscular (responder ao estiramento circunferencial e neutralizar sondagem) muscular / mucosa (responder ao estiramento circunferencial, mucosa acariciando e neutralizar sondagem), ou MIA (não responsivos a qualquer um dos três estímulos mecânicos).
- Para aferentes mesentéricos (apenas eminervação LSN) que são difíceis de ativar seletivamente pela estimulação elétrica, localize suas terminações receptivas acariciando mecânica / sondagem do mesentério.
- Para aferentes sensíveis ao estiramento muscular e muscular (-mucosas), determinar o limiar de resposta, que é definida como a força que evoca o primeiro AP durante trecho em rampa.
- Para aferentes serosa, gravar as suas respostas a ascendente níveis de pontuada sondagem do campo receptivo impulsionado pela força do atuador controlado por computador.
5. Chemical Aplicação / Modulação da Endings Receptivo
- Grave uma resposta de linha de base a um estímulo mecânico (ou seja, a resposta ao trecho em rampa, pontuada de sondagem, ou mucosa carícias).
- Revestir a borda inferior de um pedaço de tubo (latão ou aço inoxidável, 10 mm de altura e 4 x 4 mm 2 quadrado ou 4 - 5 mm de diâmetro) com vaselina e colocá-lo sobre o campo receptivo no colorectum.
- Removera solução de Krebs no interior do tubo, e exponha o fim receptivo para o 3 - 5 min a 170 ul da solução que contém o produto químico (s) a ser testado.
- Monitorar a resposta das vias aferentes durante a aplicação de produtos químicos (aferentes são alguns quimiosensível).
- Remover a solução química e tubos para terminar a acção do produto químico. Dentro de 4-6 min, testar a resposta de aferentes ao mesmo estímulo mecânico como na resposta de linha de base.
- Reaplique o estímulo mecânico novamente após período suficiente de wash-out (> 15 min).
6. spikes Gravação e Discriminando AP
- Digitalizar os sinais elétricos gravados a partir de axônios em 20 kHz e salvar os dados para um computador. Monitorar o sinal on-line por um monitor de áudio.
- Analisar os pontos AP off-line e discriminar unidades individuais com base em análise de componentes principais das formas de onda de pico individuais 25.
NOTA: Um registro não deve conter mais thum duas unidades activas facilmente discrimináveis.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A configuração está ilustrada na Figura 1. Ela inclui uma câmara de tecido feito à medida que abriga o colorectum num compartimento de banho revestido de silicone e o nervo ligado num compartimento cheio com óleo mineral contígua. A câmara de dois compartimentos foi usinado a partir de um bloco sólido de plástico acrílico por uma máquina CNC; parte inferior de ambos os compartimentos foi posteriormente revestido com silicone firme para permitir a fácil pin para baixo do tecido colorretal. APs extracelulares de fascículos esmiuçadas são gravados usando, um amplificador diferencial alimentado por bateria de baixo ruído com uma alta taxa de rejeição de modo comum (CMRR ~ 60 dB). O ganho do amplificador é ajustado para a gama e x10,000 filtro de banda de 0,3 a 10 kHz. A estimulação eléctrica do colorectum é emitida por um estimulador opticamente acoplado em modo de corrente constante através de um eléctrodo concêntrico em contacto com a mucosa rectal. A estimulação mecânica (trecho colorectal e pontuada sondagem) é entregue por acomputer controlado força atuador. Um conversor AD e software apropriado supervisionar ambos os processos de estimulação e gravação através do envio de saídas de comando de tensão para iniciar estímulos mecânicos e eléctricos, bem como a gravação e digitalização dos sinais extracelulares AP a partir do amplificador diferencial. Para isolar a partir de fontes de ruído mecânicos e eléctricos, a câmara de tecido, do microscópio e do amplificador diferencial são colocados dentro de uma gaiola de Faraday montado sobre uma mesa de ar pneumático.
Como mostrado na Figura 2A, o colorectum com o nervo ligado é dissecado a partir de um rato, cortado ao longo da borda anti-mesentérica, e fixado plana na câmara de tecido revestido de silicone; o nervo é colocado sobre um espelho de vidro na câmara de gravação adjacentes. Exibido na figura 2B é um registro representante de um potencial de ação (AP), em resposta a estimulação elétrica da RF no limiar. A AP deste registro está atrás do art estímuloifact (•) por 49 ms, devido ao atraso na condução da RF para o eléctrodo de gravação, o que resulta numa velocidade de condução calculado de 0,43 m / seg, bem no intervalo de uma das fibras C não mielinizadas. Exibido na Figura 2C são respostas típicas de um aferentes a estímulos entregues em mão (sondagem do RF com monofilamentos von Frey, com 1 g, e acariciando mucosa fina da RF, 10 mg). Este registro contém dois aferentes facilmente discrimináveis; apenas o grande aferentes amplitude responde a acariciando. Como se mostra na Figura 2D, as respostas aferentes para sondagem também foram avaliados por uma força de accionamento controlado por computador, que proporciona ao mesmo local na colorectum uma série de forças mecânicas precisamente cronometrados e reprodutíveis (5, 10, 20, 40 e 80 mN, 5 duração sec). Da mesma forma, estiramento circunferencial do colorectum (0-170 mN em 5 mN / sec) é entregue pelo mesmo actuador com uma resposta representativa mostrada na Figura 2E
Como mostrado na Figura 3, os aferentes colorrectais podem ser funcionalmente classificadas em seis classes que se baseiam os seus perfis de resposta a estímulos mecânicos três distintos (ver passo 4.2 acima). Todas as terminações aferentes, exceto para aferentes mesentéricos foram localizados pela estimulação elétrica (e-stim; coluna mais à esquerda, setas indicam artefato estímulo). Mecanicamente aferentes insensíveis (MIAs) não respondem a qualquer um dos três estímulos mecânicos. Em contraste, todas as terminações mechanosensitive responder a sondagem (0,4-1,4 g). Entre eles, terminações muscular e muscular-mucosas também são activadas por estiramento circunferencial (0-170 nM), e, portanto, são designadas por aferentes sensíveis ao estiramento; terminações muscular-mucosa também são ativados pelo toque (10 mg). Terminações da mucosa também são ativados pelo toque (10 mg), mas não esticar e terminações serosa não são ativados por qualquer trecho ou acariciando. Terminações mesentérica são identificados por mecanicamente bapressando o mesentério.
Exibido na figura 4A são respostas representativas de um aferentes sensíveis ao estiramento evocada por três trechos circunferenciais consecutivos separados por 5 min. Os números de pico estão uniformemente finalmente resolvido em três caixas e exibido como funções de estímulo-resposta na figura 4B, revelando alta reprodutibilidade tanto em magnitude de resposta (número pico) e limiar de resposta.
Esta preparação colorectum-nervo in vitro também permite a aplicação local de produtos químicos para aferentes terminações receptivas. A exposição a produtos químicos é restrita a regiões em torno do RF aferente colocando bronze ou tubagem de aço inoxidável sobre a mucosa colorrectal para isolar fisicamente a RF do resto do colorectum. Os resultados típicos seguintes aplicação de produtos químicos incluem: ativação direta dos aferentes mediante aplicação de uma solução hipertônica ácido (AHS 26; Figura 5A), não ativação, mas aquisição de mecanosensibilidade por um MIA após a aplicação de uma sopa inflamatória (IS 19; Figura 5B), aumento da resposta (ou seja, a sensibilização) ao estiramento mecânico após a aplicação de IS (Figura 5C), e redução da resposta ao estiramento mecânico após a aplicação de cGMP (Figura 5D).

Figura 1. Representação esquemática da montagem experimental. O nervo colorectum é colocado numa câmara de tecido de dois compartimentos isolados e, juntamente com a fase de cabeça amplificador diferencial a partir de outro equipamento electrónico por uma gaiola de Faraday. Cada RF aferentes é identificado por estimulação elétrica (e-stim) do colorectum e testado por três estímulos mecânicos: nylon monofilamento sondagem, acariciando mucosa, e trecho circunferencial. ttps: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
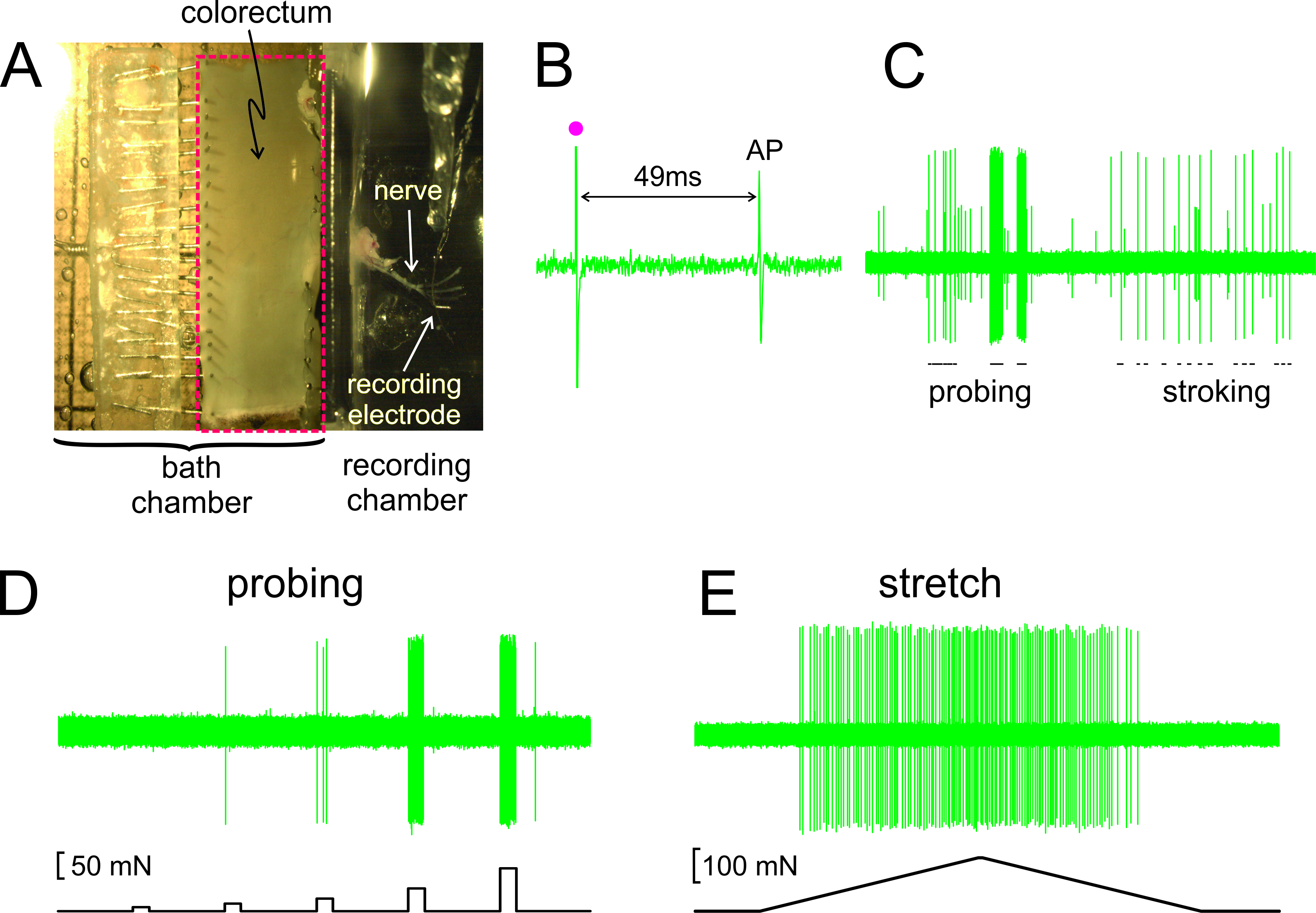
Figura 2. Uma imagem através do microscópio estereoscópico do colorectum dissecado com nervo pélvico em anexo (A) B -. E mostrar registros representativos. (B) Um potencial de ação (AP) evocados por estimulação elétrica (artefato de estímulo, •). (C) As respostas típicas de Hand-held monofilamento sondagem e mucosa acariciando. (D, E) As respostas a sondagem e para esticar circunferencial entregue pela força atuador controlado por computador, respectivamente. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. Caracterização funcional de classes de aferentes colorretais. Aferentes estão localizados pela estimulação elétrica (e-stim, ↑) do colorectum e classificados em cinco classes mechanosensitive e um aferentes mecanicamente-insensitive classe (MIA) com base em seus respectivos perfis de resposta a três estímulos mecânicos:. sondagem, acariciando, e trecho Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4. respostas eferentes para reprodutível, estimulação mecânica controlada por computador. (A) As respostas de um muscular-mucosa umafferent a três vezes consecutivas em rampa trechos (0-170 mN a 5 mN / sec; 5 min de intervalo inter-estímulo). (B) Respostas (ação potenciais pontos) foram uniformemente finalmente resolvido em três caixas (0-57, 57-113 e 113-170 MN) e exibido como funções de estímulo-resposta; limiar de resposta é exibida na inserção. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5. respostas eferentes para a aplicação localizada químico para terminações receptivos. (A) Um exemplo de chemosensitivity de um aferentes serosal a aplicação da solução hipertônica ácida (AHS). (B) Um exemplo de aquisição de mecanosensibilidade (sensibilização) por um MIA terminando. Este MIA não respondeu diretamentepara uma sopa inflamatória (IS), mas respondeu a 1,4 g de monofilamento de sondagem depois. (C) de sensibilização (um aumento na magnitude da resposta e redução no limiar de resposta) para esticar de um aferentes muscular após a exposição de seu término para IS. (D) Atenuação da resposta para esticar por um aferentes muscular-mucosa após a exposição de seu final de monofosfato de guanosina cíclico (cGMP). Por favor, clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
A preparação in vitro colorectum-nervo descrito aqui tem provado ser uma abordagem poderosa para estudar funções de codificação neural de aferentes colorretais individuais, que bem complementa outras abordagens não-funcionais (por exemplo, estudos celulares, moleculares e histológicos) sobre os neurônios sensoriais viscerais ( veja o comentário 27 para detalhes). Mecanismos neuronais que contribuem para a nocicepção e hipersensibilidade colorectal longo prazo foram revelados e manipulações farmacológicas foram realizados que têm metas revelou que poderia aliviar a dor visceral. Os seguintes pontos-chave associados à implementação bem sucedida desta preparação são discutidas a seguir: 1) redução de ruído eléctrico, 2) aumento na detecção de sinal, e 3) a seleção de um estímulo padronizado para avaliar as mudanças de codificação aferentes. Além disso, são discutidas várias limitações desta técnica.
Potenciais de ação (APs) propagating intracelularmente ao longo do nervo axônios geralmente têm um potencial de membrana de 100-130 mV. No entanto, devido à pequena capacitância específica da membrana axonal este relativamente grande despolarização somente resulta em um pequeno deslocamento de carga eléctrica através da membrana celular, o que pode facilmente ser absorvido pelo tecido extracelular / fluido intersticial circundante (o qual tem uma impedância eléctrica consideravelmente inferior do que a membrana lipídica). Para a gravação extracelular de filamentos nervosos / axônios, o sinal elétrico é geralmente na faixa de microvolts, perto da magnitude do ruído térmico / branco associado com uma configuração típica de gravação bioelétrica, tornando a redução de ruído a primeira prioridade para gravação de sucesso. Para isolar de forma mais eficaz de ruído elétrico ambiente, ele pode ser útil para colocar a câmara de tecido, de gravação e de aterramento eletrodos, o amplificador diferencial (DC alimentado por bateria) e ao microscópio estereoscópico em uma gaiola de Faraday. Se artefato movimentos ocorrer, colocando a gaiola de Faraday sobre uma mesa de ar pneumático para amortecer a vibração mecânica é útil. O ideal é que a gravação e os eléctrodos de referência que entram no "+" e "-" portos do amplificador diferencial, respectivamente, deve ter comparável impedância em relação ao seu terreno comum e estar localizado perto uns dos outros. Assim, qualquer ruído externo será gravado sobre partes iguais pelos dois eletrodos para ser submetido ao rigoroso modo comum de rejeição pelo amplificador diferencial.
Na nossa configuração (Figura 2A), o eléctrodo de referência é mergulhado na solução de perfusão de Krebs na câmara de tecido enquanto que o eléctrodo de gravação está em contacto com um nervo filamento fino de impedância considerável. Esta configuração single-eletrodo com uma diferença de impedância não trivial geralmente não é ideal para redução de ruído. No entanto, esta configuração oferece a conveniência de colocação do filamento nervo finas sobre apenas um electrode, o que é particularmente atraente quando a gravação a partir do mouse filamentos nervosos colorretais de comprimento reduzido (10-15 mm). Com base em nossa experiência, a configuração single-eletrodo é aceitável quando o ruído de fundo de pico-a-pico é abaixo de 20 mV no registro. Caso contrário, a redução ainda mais o ruído exigiria uma configuração de gravação de dois eléctrodos, em que o filamento fino nervo tem que estar em contacto com ambos os eléctrodos de referência e de gravação, dispostas paralelamente umas às outras. Todas as grandes peças de metal dentro da gaiola de Faraday precisa ser aterrado de forma semelhante a estrela de um terreno comum, um bloco de cobre em nossa configuração. Cuidado deve ser tomado para evitar a formação de loops de terra.
Para assegurar a detecção de APs extracelular, o primeiro passo é a dissecção do tecido bem sucedida colorectum-nervo. Beliscar ou puxando o nervo durante a dissecção deve ser evitada, o que pode causar danos irreversíveis ao nervo e afetar a condução AP. O caule nervo dissecado também precisa de to ser livre de qualquer tecido do músculo ligado, que vaza de potássio quando danificado e pode bloquear a condução nervosa por despolarização. Esta habilidade dissecção é geralmente adquirida através da prática diligente ao longo de semanas a meses e exige um elevado nível de coordenação olho-mão e destreza no manuseio e uso de instrumentos cirúrgicos. Além disso, para evitar danos ao tecido colorectal, a estratégia de pesquisa eléctrica utiliza um eléctrodo concêntrica que tem um rombo, ponta arredondada e de diâmetro relativamente grande (externo Φ0.55 mm, interno Φ0.125 mm) e está ligada a um micromanipulador pela uma ponte em conformidade, resultando numa força mecânica modesto aplicado à superfície mucosa (~ 100 mg). A fim de adquirir um sinal maior no rastreio de gravação, a corrente transmembranar induzido por AP precisa de ser canalizado e "preso" no eléctrodo através da criação de uma pequena ponte de impedância entre o axónio do nervo (s) e a superfície do eléctrodo. Assim, o epineuro e perineuro que isolaro nervo precisa ser dissecado livre durante o processo de dividir o nervo em filamentos finos de ~ 10 mm de espessura. Porque a corrente transmembranar induzido por AP dissipa consideravelmente dentro de uma curta distância da membrana axonal um filamento mais fina do nervo geralmente resulta em uma melhor relação sinal-para-ruído devido à proximidade dos axónios mais perto da superfície do eléctrodo. Na câmara de óleo mineral, o espelho que o nervo é muitas vezes colocada sobre atrai uma camada fina de solução de Krebs (a superfície do vidro é hidrófilo). Assim, é necessário que o eléctrodo de registo e de filamentos nervo não estão em contacto com a superfície do espelho durante a gravação. Quaisquer gotas residuais de solução de Krebs, que fornecem uma ponte de baixa impedância entre o eletrodo e a superfície do espelho (ou seja, o desvio) irá reduzir significativamente a amplitude do sinal no registro.
Esta preparação colorectum-nervo permite o estudo de alterações funcionais de aferentes depois de exporFR para uma variedade de mediadores químicos e insultos in vitro, assim como no contexto de condições fisiopatológicas a longo prazo (por exemplo, colorectums tomadas de ratinhos tratados previamente). Uma medida objetiva de alterações funcionais de aferentes depende do seguinte: 1) um estímulo padronizado com alta precisão e reprodutibilidade e 2) as respostas aferentes que são robustas e reprodutível. Dos três estímulos mecânicos aplicados ao colorectum, estímulos da RF de sondagem e acariciando são frequentemente entregues por portáteis von monofilamentos Frey-like. Para sondagem, o monofilamento é geralmente calibrado para fornecer uma força perpendicular reprodutível quando dobra. Monofilamentos No entanto, von Frey-like (0,4 g) e 1 têm pequenos e diferentes diâmetros transversais em corte (0,2 e 0,3 mm, respectivamente), o que resulta numa alta tensão nominal quando aplicado perpendicularmente à superfície colorretal (124,8 kPa durante 0,4 ge 138,7 kPa para 1 g), um intenso estímulo mecânico, pontuada beyond da faixa fisiológica normal. Além disso, a extremidade afiada do filamento causa provável distribuição desigual de tensões focal com pico de tensão consideravelmente mais elevada do que a tensão nominal (concentração de tensão). Dado que o tamanho típico de RF (1 mm 2) é significativamente maior do que a secção transversal de um monofilamento, e a incapacidade de estimular de forma reprodutível o local idêntico com um monofilamento de mão, é comum observar as respostas a estímulos repetitivos que diferem significativamente em frequência e duração AP. Como um exemplo, as respostas a sondagem mostrado na Figura 2C pelo mesmo monofilamento de mão (1 g), o que provavelmente variou consideravelmente são contribuídos por uma incapacidade para sondar o local reprodutivelmente idênticos e duração variável e intervalo entre estímulos consecutivos. Mucosa afaga entregue por um filamento de mão é semelhante desafiador e também tende a evocar respostas variáveis do mesmo aferentes. Estímulo reprodutibilidade pode sermelhorada pela utilização de um computador controlado por força do actuador para proporcionar forças precisas sondagem (e estiramento). Para sondagem, usamos um monofilamento com um diâmetro maior (por exemplo, # 6,45, 1 mm), que cobre mais plenamente a RF aferentes típico 24,28. Controlado por computador estiramento circunferencial, ao contrário de outras abordagens de alongamento do tecido voltadas para o RF, permite a deformação homogénea em todo o comprimento do colorectum, tornando possível a correlação com a distensão colorectal na sua configuração cilíndrica original, baseada sobre o stress mecânico circunferencial comparável (isto é, 0 - 170 mN estiramento é equivalente a 0 - 45 mm Hg de pressão intraluminal 23). Como a força de estiramento é aplicada de maneira uniforme na borda anti-mesentérica, não diretamente para a RF, a tensão mecânica local evocado na RF aferentes é reprodutível entre aplicações consecutivas de stretch. Além disso, a faixa tipo L de Ca2 + bloqueador do canal de nifedipina adicionado ao banho de inhibit contração do músculo liso espontânea, contribui para a manutenção da conformidade colorretal entre os testes de estiramento em rampa 23. Finalmente, as respostas aferentes para o protocolo de estiramento em rampa provaram ser reprodutível com uma pequena variabilidade tanto na função limiar do estímulo-resposta e resposta (por exemplo, Figura 4). Assim, as respostas aferentes para esticar rampa têm sido amplamente utilizados como uma avaliação objetiva das mudanças de função aferentes em estudar os mecanismos neuronais de dor e hipersensibilidade visceral (por exemplo, 19-22,24,26,28-31).
A preparação colorectum-nervo é uma ferramenta poderosa para o estudo dos aferentes viscerais colorretais. Contudo, também tem algumas limitações. Em primeiro lugar, os axônios dos corpos celulares dos neurônios sensitivos no gânglio da raiz dorsal são seccionadas na preparação, o que impossibilitou o estudo das identidades moleculares desses corpos celulares (por exemplo, uma única célula RT-PCR ou transcriptome análise das diferentes classes de aferentes colorretais). Em segundo lugar, a baixa relação sinal-ruído da gravação de fibra única exige Dissecção / nervosas habilidades divisão cirúrgicos ideais e gravação de baixo ruído, limitando significativamente maior aplicação deste protocolo em outros laboratórios. Em terceiro lugar, esta preparação in vitro pode não ser aplicável para as investigações de factores sistémicos que modulam a sensação visceral, tais como o sistema nervoso autónomo, hormonas e citocinas, que circula microbiota intestinal, e modulação descendente a partir do sistema nervoso central.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



