Abstract
Denna video visar i detalj en in vitro enda fiber elektrofysiologiska inspelning protokollet använder en mus colorectum-nerv beredning. Det tillvägagångssätt gör opartisk identifiering och funktionell karakterisering av enskilda kolorektala afferenter. Extracellulära registreringar från förökade aktionspotentialer (APS) som härstammar från en eller ett fåtal afferent (dvs enkelfiber) receptiva fält (RFS) i colorectum är gjorda av retad nervfiber fascicles. Den colorectum avlägsnas med antingen bäcken (PN) eller ländryggen splanchnicus (LSN) nerv bifogas och öppnade i längsled. Vävnaden placeras i en inspelning kammare, nålas platt och perfusion med syresatt Krebs lösning. Focal elektrisk stimulering används för att lokalisera kolorektal afferenta ändelser, vilket ytterligare har testats av tre distinkta mekaniska stimuli (trubbigt sondering, mucosal stryker och periferi stretch) för att funktionellt kategorisera afferenter i fem mechanosensitiva klasser. Ändelser svarar på någon av dessa mekaniska stimuli kategoriseras som mekaniskt okänsliga afferenter (mias). Både mechanosensitive och Mias kan bedömas för sensibilisering (dvs ökad respons, minskad tröskeln, och / eller förvärv av mechanosensitivity) genom lokal exponering av RFS för kemikalier (t.ex. inflammatorisk soppa (IS), capsaicin, adenosintrifosfat (ATP)). Vi beskriver den utrustning och colorectum-nerv inspelning förberedelse, skörd av colorectum med bifogade PN eller LSN, identifiering av RFS i colorectum, singel-fiber inspelning från nerv fascicles och lokaliserad applicering av kemikalier till RF. Dessutom är utmaningarna i utarbetande och tillämpning av standardiserade mekanisk stimulering också diskuteras.
Introduction
Smärta och överkänslighet är de dominerande klagomål från patienter som lider av funktionella gastrointestinala störningar, inklusive colon irritabile (IBS), som finns i avsaknad av uppenbar pathobiological orsak eller vävnadsskada. Till exempel, IBS-patienter uppvisar överkänslighet, inklusive förhöjda svar på rektal ballong distension och ökad känslighet vid normal tarmfunktion, samt överkänslighet av somatisk remiss (dvs., ömhet vid palpation av buken) 1. Eftersom inriktning kolorektala afferenter har visat sig vara effektiva för att lindra smärta och överkänslighet i IBS-patienter (t.ex. intra-rektal instillation av lokalbedövningsmedel 2,3, oralt intag av guanylatcyklas-C-agonist linaclotide 4-6), förbättrat förståelsen för afferenta innervation av colorectum är viktigt.
Visceral afferenter, inklusive kolorektala afferenter, Har förmåga att svara på kemiska / närings- och termiska modaliteter (t.ex. 7-9). Dock har viscerala afferenter svarar på mekaniska stimuli (dvs. mechanosensitive afferenter) varit den mest grundligt studerade eftersom mekaniska stimuli (t.ex. luminala buk, stretch) är de som generellt ger upphov till medvetna förnimmelser, inklusive obehag och smärta 10-16. Dessutom är de inälvor också innerveras av mekaniskt okänsliga afferenter (mias), vanligtvis kallas tysta eller sovande nociceptors 17. Under normala fysiologiska förhållanden, gör Mias inte svarar på mekanisk stimulering eller har mycket hög svarströsklar 18, men kan bli aktiva och förvärva mechanosensitivity i patofysiologiska förhållanden och bidra till överkänslighet.
Använda preparatet in vitro och protokoll som beskrivs här, vi utvecklat och anställda en elektrisk stimulans strategi till sjöss RCH för mottagliga ändelser, medger opartisk identifiera både mechanosensitive och MIA ändelser i colorectum 19. Den kolorektal innervation kommer från ländryggen splanchnicus (LSN) och bäckennerven (PN) vägar, och inkluderar kolorektal afferenter som kan kategoriseras i fem mechanosensitive klasser (serosala, mucosal, muskulös, muskulös-slemhinna, mesenteriska) och en MIA klass 20. Med hjälp av denna in vitro beredning, fann vi att kolorektal Mias förvärvat mechanosensitivity (sensitize) efter kortvarig exponering av sina receptiva fält till en inflammatorisk soppa (IS), vilket sensibiliserade 71% av Mias i PN vägen och 23% av Mias i LSN vägen 19. Vi dokumenterade även långtids sensibilisering (upp till 28 dagar) av Mias i samband med långvariga beteende visceral överkänslighet (dvs i möss som fick intrakolonisk behandlingar med zymosan 21 eller 2,4,6-trinitrobensensulfonsyra (TNBS) 22) .
jove_content "> Bland mechanosensitive afferenter, muskulösa och muskulös-mucosal afferenter är de enda klasserna som tonically kodar omkrets sträcka av colorectum (dvs, är stretch känsliga) och subserve kodning av skadlig kolorektal utspänning 23,24. Med hjälp av en datorstyrd force ställdon, vi tillämpat en standard, homogen och reproducerbar ramped stretch i omkretsriktning tillplattad kolorektal vävnad och ytterligare kategoris stretch känsliga afferenter så låg tröskel och högt tröskelvärde 23. Dessutom tidsförloppet för sensibilisering av stretch -känsliga afferenter efter intrakolonisk zymosan 21 eller TNBS 22 behandling motsvarar debuten, uthållighet, och / eller återvinning av beteende visceral överkänslighet, vilket tyder på en roll stretch känsliga kolorektala afferenter i visceral smärta och överkänslighet.Subscription Required. Please recommend JoVE to your librarian.
Protocol
OBS: Detta protokoll granskades och godkändes av University of Pittsburgh Institutional Animal Care och användning kommittén.
1. Beredning av Modified Krebs lösning och Test Drug Portioner
- Gör 6 L av modifierad Krebs-lösning som innehåller (i mM): 117,9 NaCl, 4,7 KCl, 25 NaHCOa 3, 1,3 NaH 2 PO 4, 1,2 MgSO 4, 2,5 CaCl2, 11,1 D-glukos, 2 natriumbutyrat, 20 natriumacetat , 0,004 nifedipin (för att blockera spontana muskelsammandragningar), och 0,003 indometacin (för att blockera syntesen av endogena prostaglandiner). Använd is-kalla och varma Krebs lösningar för vävnads dissekering och singel-fiber inspelning, respektive.
- Förbered några kemiska lösningar (t.ex. IS, capsaicin, ATP) i portioner vid önskade koncentrationer.
2. Dissekering av Colorectum-nervvävnad
- Söva och avliva hanmöss (6 - 8 veckor gammal, 20-30 g) ien CO 2 kammare vid en flödeshastighet som förskjuter 10-30% av kammarens volym per minut tills möss sluta andas helt såsom indikeras av frånvaron av bröströrelser.
- Omedelbart efter eutanasi, exsanguinate genom att skära öppna bröstkammaren, perforera det högra förmaket, och nedsänkning av mus stommen i en riklig volym (~ 500 ml) av iskall Krebs (4 ° C) lösning bubblades med karbogen (95% O 2 , 5% CO2).
- Ta försiktigt bort alla inälvor men kolon och bäckenorganen. Transekt musen i hälften över T12 spinal segmentet strax över bröst membranet och överföra den kaudala halv till en dissektion kammare som innehåller iskall, bubblade Krebs lösning.
- Enligt ett stereomikroskop, ta bort blåsan och könsorganen genom transecting vid sina korsningar till urinröret, och ta bort den nedåt / bukaorta tills den förgrenar till gemensamma höftartärerna. Frigör PN eller LSN från deras surrounding vävnader genom dissektion och följ nerven från utsidan höftbenskammen tills dess ventrala inkörsport till L6 och S1 kotpelaren (för PN) eller T13 och L1 kotpelaren (för LSN).
- Skär blygdbenssymfysen och höger och vänster acetabular lederna, och ta bort höftbenet. Försiktigt gratis antingen PN eller LSN från bifogade muskler och bindväv från nära colorectum tills där nerven kommer in i ryggraden.
- Försiktigt resekera höftbenet för att exponera den distala colorectum. Dissekera ut den distala colorectum med den bifogade PN eller LSN i kontinuum.
- Överför colorectum med nerven fäst till badet utrymmet i vävnadskammaren. Avlägsna överflödig bindväv genom ytterligare dissektion och öppna colorectum longitudinellt längs den anti mesenteriala gränsen.
- Med mucosal sidan uppåt, stift mesenterial kanten av colorectum intill inspelningsutrymmet i silikon bas chamber och bifoga antimesenteric längden av colorectum till en rake av krokar som är anslutna till en kraftmanövreringsorgan (visas i fig 1 och fotograferades i figur 2A).
- Förläng PN eller LSN in i inspelningsutrymmet, vilken är ansluten till badet facket genom en mus hålet och grind. Lägg försiktigt ned nervstammen på en liten glasspegel i inspelningsrummet, vilket ger en hydrofil yta för mage att hålla sig till. Superfuse badet utrymmet med varmt (30-32 ° C), syresatt Krebs lösning och fyll inspelningsutrymmet med mineralolja.
3. Single-fiber Inspelning och Lokalisering av den receptiva fält
- Dra försiktigt tillbaka epineurium (nerv slida) från PN eller LSN i stereomikroskop med hög förstoring (50 - 60X). Med fin pincett, retas nervstammen i 5-8 nervknippen ~ 100 ìm tjocklek.
- Placera platina-iridium referenselektrod i kontakt med Krebs lösning i vävnadskammaren. Sekventiellt placera de enskilda nervknippen på registreringselektrod tillverkad av samma material.
- Använd en mjuk pensel för att framkalla APs från kolorektala afferenter genom att försiktigt smeka upp och ner i kolorektal ytan. Leta reda på nervknippet (er) som innerverar kolon genom detekterbara AP (aktionspotential) inspelningar.
OBS: PN och LSN innerverar även urinblåsan och andra bäckenorganen. - Använd ett par 30 G nål tips för att ytterligare dela upp nervknippet i fina fascicle trådar av ~ 10 ìm tjocklek och placera en vågig tråd på inspelningen elektroden.
- Placera den runda spets koncentrisk elektrod vinkelrät mot slemhinneytan att elektriskt excitera afferenta ändelser på suprathreshold stimulusintensitet (10 mA magnitud, 0,5 ms varaktighet @ 0,3 Hz), vilket ger en ~ 2 mm radie av nuvarande spridning. Flytta elektroden systematiskt (~ 1.5 mm steg) Längs längden och bredden på den tillplattade colorectum att lokalisera recep ändelser.
- När en afferenta slut exciteras, justera elektrodläget att precisera platsen för aktivering (receptiva fält, RF) som kräver minimal stimulusintensitet (retningströskel). Kasta ändelser med retningströskel> 3 mA 19.
- Beräkna ledningshastigheten (CV) från 1) avståndet mellan den stimulerande elektroden vid den receptiva fält (RF) och inspelningsplatsen och 2) ledningsfördröjning (t.ex., Figur 2B) mellan stimulus artefakt och uppkomsten av aktionspotentialen .
CV (m / sek) = avstånd (mm) / konduktion fördröjning (millisekunder).
4. Funktionell Klassificering av Mechanosensitive Colorectal afferenter
- Efter att lokalisera en RF genom elektrisk stimulering, tillämpa följande tre mekaniska stimuli till RF:
- Genomför prob stimulus genom att trycka spetsen på en calibrated von Frey-liknande nylonmonofilament (0,4 och 1 g kraft) vinkelrätt mot RF på tillplattad colorectum.
- Genomför strök stimulans genom att försiktigt smeka den kolorektal slemhinnan med en fin nylonfilament strängen (10 mg kraft) för att generera en liten yta skjuvspänning vid RF.
- Genomför omkrets sträcka med hjälp av en dator-kontrollerad kraft ställdon, som levererar en sluttande sträcka kraft (0-170 mN vid 5 mN / sek) i omkretsriktningen längs den anti mesenteriska kanten av colorectum via rake krokar som beskrivs i steg 2,8 .
- Klassificera afferenter som serosala (svara endast slöa sondering), mucosal (svara på slemhinnor smeka och trubbigt sondering), muskulös (svara på omkrets stretch och trubbig sondering) muskulös / mucosal (svara på omkrets stretch, mucosal stryker och trubbigt sondering), eller MIA (inte reagerar för någon av de tre mekaniska stimuli).
- För mesenteriska afferenter (endast iLSN innervation) som är svåra att aktivera selektivt genom elektrisk stimulering, lokalisera sina recep ändelser genom mekanisk strök / sondering av tarmkäxet.
- För stretch känsliga afferenter (muskulös och muskulös-mucosal), bestämma tröskel, vilket definieras som den kraft som väcker den första AP under sluttande stretch.
- För serösa afferenter, spela in sina svar på stigande nivåer av punktat sondering av receptiva fält drivs av datorstyrda force ställdon.
5. Kemisk Ansökan / Modulering av Mottaglig Endings
- Spela en baslinje svar på en mekanisk stimulering (dvs svar på sluttande sträcka, punktuell sondering eller mucosal strök).
- Coat den nedre kanten av en bit slang (mässing eller rostfritt stål, 10 mm hög och 4 x 4 mm 2 offentlig 4-5 mm diameter) med vaselin och placera den över receptiva fält på colorectum.
- Ta bortKrebs lösning inuti röret, och exponera det recep sluttid 3 - 5 min till 170 ^ il av lösningen innehållande den kemiska (er) som skall testas.
- Övervaka svaret från afferenta under kemisk ansökan (vissa afferenter är kemosensitivt).
- Avlägsna den kemiska lösningen och slang för att avsluta åtgärden av kemikalien. Inom 4-6 minuter, testa afferenta svar på samma mekaniska stimulans som i baslinjen svar.
- Applicera den mekaniska stimulansen igen efter tillräckligt lång wash-out (> 15 min).
6. Inspelning och Diskriminerande AP spikar
- Digitalisera de elektriska signalerna som spelats in från axoner vid 20 kHz och spara data till en dator. Övervaka signalen på nätet från en ljud bildskärm.
- Analysera AP spikar off-line och diskriminera enskilda enheter baserade på principalkomponentanalys av enskilda spik vågformer 25.
OBS: En post ska innehålla mer then två lätt discriminable aktiva enheter.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Inställnings illustreras i figur 1. Den innehåller en skräddarsydd vävnad kammare som rymmer colorectum i ett silikonfodrad bad utrymmet och den bifogade nerven i en sammanhängande mineraloljefylld facket. Den två-avdelningskammaren bearbetad ur ett solitt block av akrylplast med en CNC-maskin; botten av båda avdelningarna har senare fodrad med fast silikon för att möjliggöra enkel stift ner av kolorektal vävnad. Cellulära APs från retad nerv fascicles registreras med hjälp av en låg brus, batteridriven differentialförstärkare med hög common-mode avslag förhållande (CMRR ~ 60 dB). Förstärkningen hos förstärkaren är satt till x10,000 och bandfiltret intervallet på 0.3 till 10 kHz. Elektrisk stimulering av colorectum levereras av en optiskt kopplad stimulator konstant ström läge via en koncentrisk elektrod i kontakt med kolorektal mukosa. Mekanisk stimulering (kolorektal stretch och punktat sondering) levereras av acomputer-kontrollerad kraft ställdon. En AD-omvandlare och lämplig programvara övervaka både stimulans och inspelningsprocesser genom att skicka spänningskommandoutgångar att initiera mekaniska och elektriska stimuli samt registrering och digitalisering av extracellulära AP signalerna från differentialförstärkaren. För att isolera från mekaniska och elektriska bruskällor, är vävnadskammaren, mikroskop och differentialförstärkare placerad inuti en Faradays bur monterad på en pneumatisk luft bord.
Såsom visas i fig 2A, är den colorectum med bifogade nerv dissekerades ut från en mus, uppskuren längs den anti mesenteriska kanten, och nålas plant i silikonfodrade vävnadskammare; nerven placeras på en glasspegel i den intilliggande inspelningen kammaren. Visas i figur 2B är en representativ registrering av en aktionspotential (AP) som svar på elektrisk stimulering av RF vid tröskeln. AP i denna post ligger efter stimulans konstifact (•) av 49 ms på grund av ledningsfördröjningen från RF till den registrerande elektroden, vilket resulterar i en beräknad ledningshastighet av 0,43 m / sek, väl inom området av en omyeliniserad C-fiber. Visas i figur 2C är typiska reaktioner på en afferenta till stimuli som levereras personligen (sondering av RF med von Frey-liknande monofilament, 1 g och fina mucosal stryker av RF, 10 mg). Denna post innehåller två lätt discriminable afferenter; bara den stora amplituden afferenta svarar på strök. Som visas i figur 2D, var afferenta svar på sondering också bedömas av en datorstyrd kraft ställdon som levererar till samma plats på colorectum en serie exakt tidsinställda och reproducerbara mekaniska krafter (5, 10, 20, 40 och 80 mN, 5 sek varaktighet). Likaså omgående sträcka av colorectum (0-170 mN på 5 mN / sek) levereras med samma ställdon med ett representativt svar visas i figur 2E
Såsom visas i fig 3, kan kolorektala afferenter funktionellt kategoriseras i sex klasser baserade på deras svarsprofiler till tre distinkta mekaniska stimuli (se steg 4.2 ovan). Samtliga afferenta ändelser utom mesenteriska afferenter lokaliserades genom elektrisk stimulering (e-stim; kolumnen längst till vänster, pilarna indikerar stimulans artefakt). Mekaniskt okänsliga afferenter (mias) inte svarar på någon av de tre mekaniska stimuli. Däremot alla mechanosensitive ändelser svara på sondering (0,4-1,4 g). Bland dem är muskulösa och muskulös-mucosal ändelser också aktiveras av periferi stretch (0-170 mN), och därmed kallas sträckkänsliga afferenter; muskulär-mukosala ändelser aktiveras också genom strök (10 mg). Mukosala ändelser aktiveras också genom strök (10 mg), men inte sträcka och serös ändelser är inte aktiverade av endera sträcka eller strök. Mesenteriska ändelser identifieras genom mekanisk brusar tarmkäxet.
Visas i figur 4A är representativa svar från en sträcka känslig afferenta framkallad av tre på varandra följande omkrets sträckor separerade med 5 min. Spetsen numren är jämnt binned in tre fack och visas som stimulus-responsfunktioner i figur 4B, avslöjar hög reproducerbarhet i både svars magnitud (spik nummer) och reaktionströskel.
Detta in vitro colorectum-nerv preparatet tillåter också lokal applicering av kemikalier för att afferenta recep ändelser. Den exponering för kemikalier begränsas till regioner runt afferenta RF genom att placera mässing eller rostfria stålrör ovanpå kolorektal slemhinnan att fysiskt isolera RF från resten av colorectum. Typiska resultat efter kemisk ansökan innehålla: direkt aktivering av afferenter vid tillämpning av en syra hyperton lösning (AHS 26; Figur 5A), ingen aktivering, men förvärv av mechanosensitivity av en MIA efter applicering av en inflammatorisk soppa (IS 19; Figur 5B), ökad respons (dvs sensibilisering) till mekanisk stretch efter applicering av IS (figur 5C), och minskad respons på mekanisk stretch efter applicering av cGMP (figur 5D).

Figur 1. Schematisk bild av experimentuppställning. Den colorectum-nerven placeras i en två-fack vävnadskammaren och isoleras tillsammans med differentialförstärkaren huvudet scenen från annan elektronisk utrustning av en Faradays bur. Varje afferenta RF identifieras genom elektrisk stimulering (e-stim) av colorectum och testats av tre mekaniska stimuli: nylon monofilament sondering, mucosal stryker, och periferi stretch. TTP: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Klicka här för att se en större version av denna siffra.
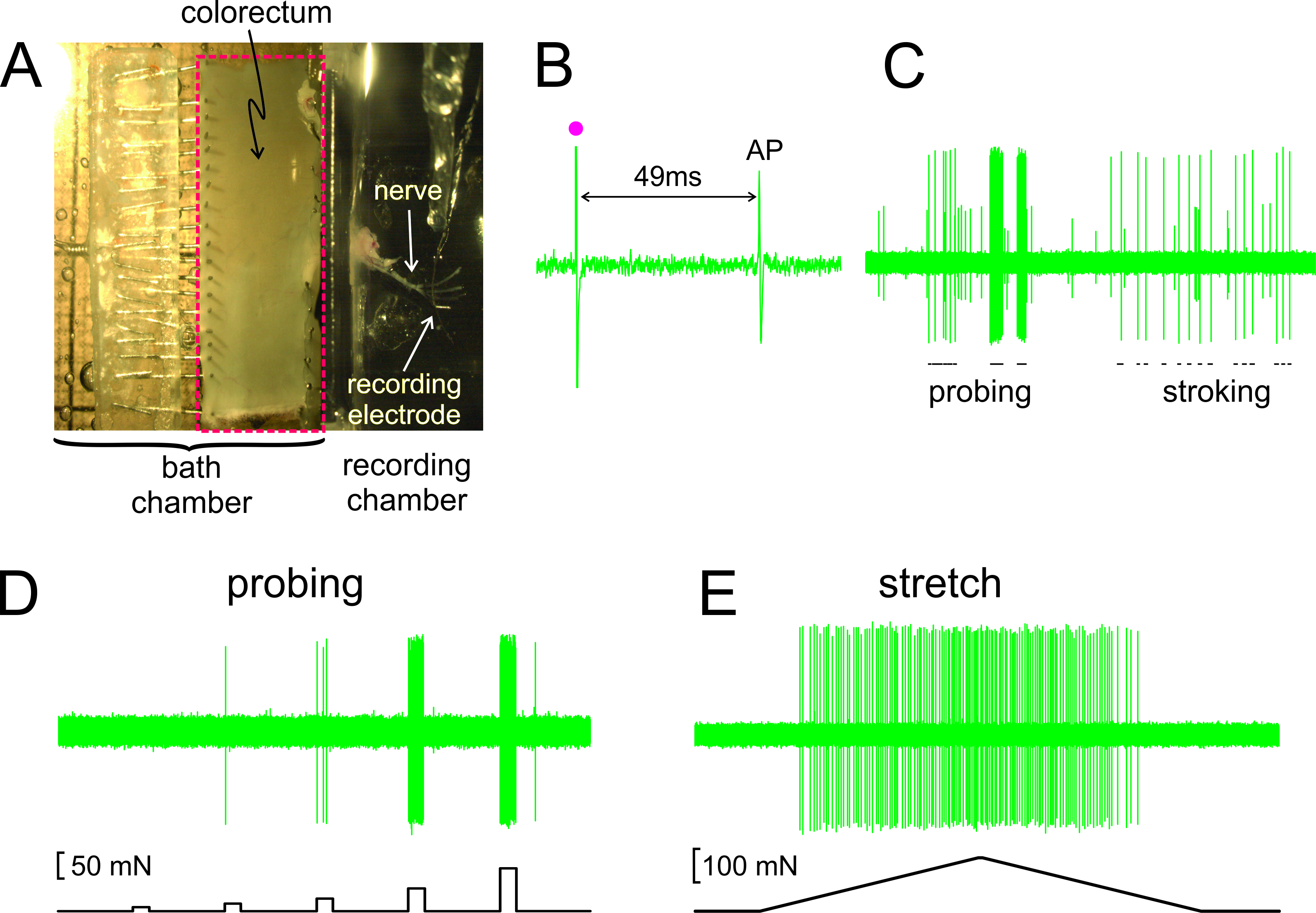
Figur 2. En bild genom stereo av dissekerade colorectum med bifogad bäckennerven (A) B -. E visar representativa poster. (B) En aktionspotential (AP) framkallade genom elektrisk stimulering (stimulans artefakt, •). (C) Typiska svar på handhållna monofilament sondering och mucosal strök. (D, E) Svar på sondering och till periferi stretch levereras av datorstyrda kraft ställdon, respektive. Klicka här för att se en större version av denna siffra.

Figur 3. Funktionell karakterisering av kolorektal afferenta klasser. Afferenter finns genom elektrisk stimulering (e-stim, ↑) för colorectum och kategoriseras i fem mechanosensitive klasser och en mekaniskt okänsliga afferenta (MIA) klass baserat på deras respektive responsprofiler till tre mekaniska stimuli:. sondering, strök och stretch Klicka här för att se en större version av denna siffra.

Figur 4. afferenta svar på reproducerbar, datorstyrd mekanisk stimulering. (A) Svar på en muskulös-mucosal afferent till tre på varandra följande rampas sträckor (0-170 mN vid 5 mN / sek, 5 min mellan stimulus intervall). (B) Svar (action potentiella spikar) var jämnt arkiveras i tre lådor (0-57, 57-113, och 113-170 mN) och visas som stimulus-responsfunktioner; tröskel visas i infällda. Klicka här för att se en större version av denna siffra.

Figur 5. afferenta svar på lokal kemisk ansökan till mottagliga ändelser. (A) Ett exempel på chemosensitivity på ett serosala afferenta tillämpningen av sura hyperton lösning (AHS). (B) Ett exempel på förvärv av mechanosensitivity (sensibilisering) av en MIA slutar. Denna MIA svarade inte direkttill en inflammatorisk soppa (IS), men svarade på 1,4 g monofilament sondering efteråt. (C) Sensibilisering (en ökning som svar magnitud och minskad tröskel svar) att sträcka av en muskulös afferenta efter exponering av dess slutar till IS. (D) Dämpning av svaret att sträcka med en muskulös-mucosal afferenta efter exponering av dess avslutning på cykliskt guanosinmonofosfat (cGMP). Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In vitro colorectum-nervpreparat som beskrivs här har visat sig vara en kraftfull metod för att studera neurala kodningsfunktioner individuella kolorektala afferenter, vilket fint kompletterar andra icke-funktionella metoder (t.ex. cellulära, molekylära och histologiska studier) på viscerala sensoriska neuroner ( se recension 27 för mer information). Neuronala mekanismer som bidrar till nociception och långsiktig kolorektal överkänslighet har uppenbarats och farmakologiska manipulationer har utförts som har avslöjat mål som skulle kunna lindra visceral smärta. Följande huvudpunkter i samband med ett framgångsrikt genomförande av detta preparat diskuteras nedan: 1) minskning av elektriskt brus, 2) ökad signaldetektering, och 3) val av en standardiserad stimulans för att utvärdera förändringar av afferenta kodning. Dessutom finns flera begränsningar med denna teknik diskuteras.
Aktionspotentialer (APS) propagating intracellulärt längs nerv axoner har i allmänhet en trans potential 100-130 mV. Emellertid, på grund av den lilla specifika kapacitansen hos axonet membran, denna relativt stora depolarisering resulterar endast i en liten elektrisk laddning förskjutning över cellmembranet, vilket lätt kan försvinna in i den omgivande extracellulära vävnad / interstitiell vätska (som har en elektrisk impedans väsentligt lägre än lipidmembranet). För extracellulärt inspelning från nervtrådar / axoner, är den elektriska signalen oftast i intervallet mikrovolt, nära till storleken av den termiska / vitt brus i samband med en typisk bioelektriska inspelningsinställningar, vilket gör brusreducering den första prioriteringen för bra inspelningar. Till mest effektivt isolera från omgivande elektriskt brus, kan det vara till hjälp att placera vävnadskammare, inspelnings- och jordningselektroder, differentialförstärkaren (DC batteridriven) och stereomikroskop i en Faraday-bur. Om rörelse artefakts inträffar, placera Faradays bur på en pneumatisk luft tabell för att dämpa mekaniska vibrationer är till hjälp. Helst inspelningen och referenselektroder som in i "+" och "-" hamnar i differentialförstärkare, respektive bör ha jämförbara impedans i förhållande till deras gemensamma jord och placeras nära varandra. Således kommer någon extern buller registreras ungefär lika av båda elektrod och utsättas för den stränga gemensamma läge förkastande av differentialförstärkaren.
I vår setup (Figur 2A) är referenselektrod doppas i Krebs perfusionslösningen i vävnaden kammaren medan inspelningen elektroden är i kontakt med en fin nerv filament av stor impedans. Denna konfiguration singel-elektrod med en icke-triviala mismatch impedans är vanligtvis inte idealisk för brusreducering. Dock erbjuder denna konfiguration bekvämligheten med att placera den fina nervglödtråden på endast en elektrode, vilket är särskilt tilltalande vid inspelning från mus kolorektal nervtrådar av begränsad längd (10 - 15 mm). Baserat på vår erfarenhet, är den enkel-elektrodkonfigurationen acceptabelt när topp-till-topp-bakgrundsbrus är under 20 μV i posten. Annars skulle minskning ytterligare brus kräva en inspelningskonfiguration två-elektrod, i vilken den fina nervfilament måste vara i kontakt med både inspelning och referenselektroder placerade parallellt med varandra. Alla de stora metalldelar inuti Faradays bur måste vara förankrat i ett stjärnliknande sätt till en gemensam grund, en kopparblock i vår setup. Försiktighet måste vidtas för att undvika bildandet av jordslingor.
För att säkerställa extracellulär detektering av accesspunkter, är det första steget framgångsrik dissektion av colorectum-nervvävnad. Klämmande eller dra nerven under dissektionen måste undvikas, vilket irreversibelt kan skada nerven och påverka AP ledning. Den dissekerade nervstammen behöver också to vara fri från alla anslutna muskelvävnad, som läcker kalium när skadade och kan blockera nervledningen genom depolarisation. Denna dissektion skicklighet allmänhet förvärvas genom flitigt övande under veckor till månader och kräver en hög nivå av öga-hand koordination och fingerfärdighet i hantering och användning av kirurgiska instrument. Dessutom, för att undvika skador på kolorektal vävnad, utnyttjar den elektriska sökstrategi en koncentrisk elektrod som har en trubbig, rundad spets och med relativt stor diameter (yttre Φ0.55 mm, inre Φ0.125 mm) och är ansluten till en mikromanipulator av en eftergivlig brygga, vilket resulterar i en blygsam mekanisk kraft som appliceras på slemhinneytan (~ 100 mg). För att få en större signal i inspelningen spår behöver AP-inducerad transström som ska kanaliseras och "instängd" på elektroden genom att skapa en liten impedans bro mellan nerv axonet (er) och elektrodytan. Sålunda epineurium och perineurium som isolerarnerven måste dissekeras fri under processen med att dela upp nerven i fina filament av ~ 10 | im tjock. Eftersom AP-inducerad transström avleder betydligt inom ett kort avstånd från axonet membran, en tunnare nervfilament resulterar vanligen i en bättre signal-brusförhållande på grund av de axoner "närmare närhet till elektrodytan. I mineraloljekammaren, spegeln att nerven är placerad på ofta lockar ett tunt lager av Krebs-lösning (glasytan är hydrofil). Det är således nödvändigt att inspelningen elektroden och nervfilament är inte i kontakt med spegelytan under inspelning. Eventuella kvarvarande droppar av Krebs lösning, som ger en låg impedans bro mellan elektroden och spegelytan (dvs växling) kommer att avsevärt minska signalamplituden i posten.
Denna colorectum-nerv möjliggör en undersökning av funktionella förändringar av afferenter efter exponeringRFS till en mängd olika kemiska mediatorer och förolämpningar in vitro samt i samband med långtids patofysiologiska förhållanden (t.ex. colorectums tagna från tidigare behandlade möss). Ett objektivt mått på funktionella förändringar av afferenter beror på följande: 1) ett standardiserat stimulans med hög precision och reproducerbarhet och 2) afferenta svar som är robusta och reproducerbara. Av de tre mekaniska stimuli appliceras på colorectum, prob och strök stimuli i RF ofta levereras av handhållna von Frey-liknande monofilament. För sondering är monofilament vanligtvis kalibrerad för att leverera en reproducerbar vinkelrät kraft när böjning. Men von Frey-liknande monofilament (0,4 och 1 g) har små och olika tvärsnittsdiameter (0,2 och 0,3 mm, respektive), vilket resulterar i en hög nominell spänning när de appliceras vinkelrätt mot kolorektal ytan (124,8 kPa för 0,4 g och 138,7 kPa för 1 g), en intensiv, punktuell mekanisk stimulans beyond det normala fysiologiska intervallet. Dessutom den vassa kanten på glödtråden orsakar sannolikt ojämn fördelning av spänningar med fokal topp stressen betydligt högre än den nominella spänning (spänningskoncentration). Med tanke på att den typiska RF storleken (1 mm2) är betydligt större än tvärsnittet av en monofilament, och oförmågan att reproducerbart stimulera samma ställe med en handhållen monofilament, är det vanligt att observera svar på upprepade stimuli som skiljer avsevärt i AP frekvens och varaktighet. Som ett exempel, svaren på sondering visas i figur 2C av samma handmonofilament (1 g) varierade avsevärt vilket sannolikt är bidragit till av en oförmåga att reproducerbart sondera samma ställe och varierande varaktighet och intervall mellan på varandra följande stimuli. Mukosal strök levereras av en handhållen filamentet är likaledes utmanande och tenderar också att framkalla variabla reaktioner från samma afferenta. Stimulus reproducerbarhet kan varaförbättras genom att använda en dator-kontrollerad kraft ställdon för att leverera exakta sondering (och stretch) krafter. För sondering, använder vi en monofilament med en större diameter (t.ex. # 6,45, 1 mm) som mer fullständigt täcker en typisk afferenta RF 24,28. Datorstyrd omkretssträcka, i motsats till andra vävnads stretching metoder riktade till RF, tillåter homogen deformation under hela längden av colorectum, vilket möjliggör korrelation med kolorektal utspänning i sin ursprungliga cylindriska konfiguration baserad på jämförbar omkrets mekaniska påfrestningar (dvs. 0 - 170 mN sträckan motsvarar 0-45 mm Hg intraluminal tryck 23). Eftersom sträckan kraften appliceras jämnt på anti mesenterica kanten, inte direkt till RF är den framkallade lokala mekaniska påfrestningar vid afferenta RF reproducerbar mellan konsekutiva tillämpningar av stretch. Dessutom, den av L-typ Ca 2+ antagonisten nifedipin till badet till Inhibit spontan glattmuskelkontraktion, bidrar till underhåll av kolorektal överensstämmelse mellan sluttande stretch tester 23. Slutligen har afferenta svar på sluttande stretch-protokollet visat sig vara reproducerbar med små variationer i både tröskel stimulus-responsfunktionen och svar (t.ex. figur 4). Således afferenta svar på sluttande sträcka har ofta använts som en objektiv bedömning av förändringar av afferenta funktion i att studera neuronala mekanismer för visceral smärta och överkänslighet (t.ex. 19-22,24,26,28-31).
Den colorectum-nerven preparat är ett kraftfullt verktyg för studier av kolorektala viscerala afferenter. Det har emellertid också vissa begränsningar. Först är de axoner av cellkroppar i de sensoriska nervceller i dorsalrotganglia transected i beredningen, utgör hinder studiet av molekylära identiteter av dessa cellkroppar (t.ex. enda cell RT-PCR eller transcriptome analys av de olika klasserna av kolorektala afferenter). För det andra, den låga signal-brusförhållandet för enkelfiber inspelning kräver optimala kirurgiska dissektion / nervsplitt färdigheter och lågbullrande inspelning, avsevärt begränsa bredare tillämpning av detta protokoll i andra laboratorier. För det tredje kan det in vitro-preparat inte tillämpas på undersökningar av systemfaktorer som modulerar visceral sensation, som det autonoma nervsystemet, cirkulerande hormoner och cytokiner, tarmfloran, och fallande modulering från det centrala nervsystemet.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



