Abstract
Dieses Video zeigt im Detail ein in vitro-Einzelfaser elektrophysiologische Ableitung Protokoll mit einer Maus Kolorektums-Nerven Vorbereitung. Der Ansatz ermöglicht unvoreingenommene Identifizierung und funktionelle Charakterisierung einzelner kolorektalen Afferenzen. Extrazelluläre Ableitungen von propagierten Aktionspotentiale (APs), die von einem oder wenigen afferenten stammen (dh Einzelfaser) rezeptiven Felder (RFS) in Kolorektum aus gehänselt Nervenfaser Faszikel gemacht. Die Kolorektums ist entweder mit dem Becken (PN) oder Lenden splanchnischen (LSN) Nerven befestigt und in Längsrichtung geöffnet entfernt. Das Gewebe wird in einer Aufnahmekammer gebracht, fixiert flach und mit Sauerstoff angereichertem Krebs-Lösung perfundiert. Brenn elektrischen Stimulation verwendet, um die kolorektale afferenten Endungen, die durch drei verschiedene mechanische Stimuli getestet lokalisieren (blunt Sondieren, Schleimhaut Streichen und Umfangsdehnung) funktionell zu kategorisieren Afferenzen in fünf mechanosensitive Klassen. Endings Reaktion auf keine dieser mechanische Reize werden als mechanisch unempfindlich Afferenzen (MIAs) kategorisiert. Sowohl mechanosensitive und MIAs kann Sensibilisierung (dh, verbesserte Reaktion, reduziert Schwelle und / oder Erwerb von Mechanosensitivität) bewertet werden, indem die lokale Exposition des RFs Chemikalien (zB entzündliche Suppe (IS), Capsaicin, Adenosintriphosphat (ATP)). Wir beschreiben die Geräte und Kolorektums-Nerven Aufnahme Vorbereitung, Ernte Kolorektums mit angeschlossenem PN oder LSN, die Identifizierung von RFs im Kolorektums, Einzelfaser-Aufnahme von Nervenfaszikel und lokalisierte Anwendung von Chemikalien auf die RF. Außerdem werden Probleme der Herstellung und Anwendung von standardisierten mechanischen Stimulation ebenfalls diskutiert.
Introduction
Schmerzüberempfindlichkeit sind die vorherrschenden Beschwerden von Patienten mit funktionellen gastrointestinalen Störungen einschließlich Reizdarmsyndrom (IBS), die in Abwesenheit des sichtbaren pathobiologischen Ursache oder Gewebeschäden vorliegen. Zum Beispiel weisen IBS-Patienten Überempfindlichkeit, einschließlich erhöhter Antworten auf rektale Ballon Spannungsgefühl und erhöhte Empfindlichkeit während des normalen Darmfunktion sowie Überempfindlichkeit der somatischen Weisung (dh Druckschmerz im Bauchbereich) 1. Da Targeting kolorektalen Afferenzen hat sich als wirksam bei der Linderung von Schmerzen und Überempfindlichkeit in IBS-Patienten (zB intrarektale Einträufeln von Lokalanästhetika 2,3; orale Aufnahme des Guanylatzyklase-C-Agonisten linaclotide 4-6) sein, ein besseres Verständnis der afferenten Innervation Kolorektum ist wichtig.
Visceral Afferenzen, darunter Dickdarm- AfferenzenIn der Lage sind zu reagieren, um chemische / Nähr- und thermischen Behandlungsformen (zum Beispiel 7-9). Allerdings viszerale Afferenzen Reaktion auf mechanische Reize (dh mechanosensitive Afferenzen) waren die am besten untersuchte, weil mechanische Reize (zB Lumen Blähungen, Dehnung) sind diejenigen, die in der Regel führen zu bewussten Empfindungen, einschließlich Beschwerden und Schmerzen 10-16. Darüber hinaus werden die Eingeweide auch mechanisch unempfindlich Afferenzen (MIAs) innerviert, allgemein als stille oder Schlaf Nozizeptoren 17. Unter normalen physiologischen Bedingungen, müssen MIAs nicht auf mechanische Reize reagieren und haben eine sehr hohe Ansprechschwellen 18, sondern kann aktiv werden und erwerben Mechanosensitivität in pathophysiologischen Bedingungen und dazu beitragen, Überempfindlichkeit.
Unter Verwendung der in vitro Herstellung und hier beschriebene Protokoll, entwickelt und verwendet ein elektrisches Stimulus-Strategie in See wir rch für aufnahmeEnden und ermöglicht unvoreingenommene Identifizierung der beiden mechanosensitive und MIA Enden in der Kolorektums 19. Das kolorektale Innervation aus Lenden splanchnischen (LSN) und Beckennerv (PN) Wege abgeleitet und enthält kolorektalen Afferenzen, die in fünf mechanosensitive Klassen (seröse, Schleimhäute, muskulös, Muskel-Schleimhaut, mesenterialen) und eine MIA-Klasse 20 eingestuft werden können. Mit dieser In-vitro-Vorbereitung, fanden wir, dass kolorektalen MIAs erworben Mechanosensitivität (Sensibilisierung) nach kurzzeitiger ihres rezeptiven Felder zu einer entzündlichen Suppe (IS), die 71% der MIAs in der PN-Bahn und 23% der MIAs im LSN Weg sensibilisiert 19. Wir haben auch dokumentiert Langzeitsensibilisierung (bis 28 Tage) von MIA in Zusammenhang mit langanhaltenden Verhaltens viszerale Hypersensitivität (dh in Mäusen intrakolische Behandlungen mit Zymosan 21 oder 2,4,6-Trinitrobenzolsulfonsäure (TNBS) 22) .
jove_content "> Unter mechanosensitive Afferenzen, muskulös und Muskel-Schleimhaut-Afferenzen sind die einzigen Klassen, die tonisch kodieren Umfangsdehnung des colorectal (dh sind Stretch-und Kleinschreibung) und dienstbar die Kodierung der schädlichen kolorektale Dehnung 23,24. Mit Hilfe eines computergesteuerten Kraftaktuator wir mit einem Standard, homogene und reproduzierbare gefahren Dehnung in der Umfangsrichtung des abgeflachten kolorektales Gewebe und weiter kategorisiert dehnungsempfindlichen Afferenzen als Niedrigschwellenwert und hohem Schwellenwert 23. Darüber hinaus den Zeitverlauf der Sensibilisierung von Dehnungs sensitive Afferenzen nach intrakolische Zymosan 21 oder TNBS 22 Behandlung entspricht der Beginn, Ausdauer, und / oder Wiederherstellung von Verhaltens viszerale Hypersensitivität, was auf eine Rolle von Dehnungsempfindlichen Dick Afferenzen in viszeralen Schmerzen und Überempfindlichkeit.Subscription Required. Please recommend JoVE to your librarian.
Protocol
HINWEIS: Dieses Protokoll wurde überprüft und von der University of Pittsburgh Institutional Animal Care und Verwenden Committee genehmigt.
1. Herstellung von modifiziertem Krebs-Lösung und Test-Arzneimittel Aliquots
- Make 6 L modifizierte Krebs-Lösung, die (in mM) enthält: 117,9 NaCl, 4,7 KCl, 25 NaHCO 3, 1,3 NaH 2 PO 4, 1,2 MgSO 4, 2,5 CaCl 2, 11.1 D-Glucose, 2 Natriumbutyrat 20 Natriumacetat , 0,004 Nifedipin (spontane Muskelkontraktionen blockieren) und 0,003 Indometacin (die Synthese von endogenem Prostaglandin blockieren). Verwenden eiskalt und warmen Krebs Lösungen für Gewebedissektion und Einzelfaser-Aufnahme auf.
- Bereiten keine chemischen Lösungen (zB, IS, Capsaicin, ATP) in Aliquots bei gewünschten Konzentrationen.
2. Dissektion der Kolorektums-Nervengewebe
- Betäuben und euthanize männliche Mäuse (6 - 8 Wochen alt, 20 - 30 g) inein CO 2 Kammer mit einer Strömungsgeschwindigkeit, die mit 10 verdrängt - 30% des Kammervolumens pro Minute bis Mäusen atmen aufhören vollständig wie durch das Fehlen von Brustbewegung angegeben.
- Unmittelbar nach Euthanasie, exsanguinate durch Aufschneiden der Thoraxkammer, Perforation des rechten Vorhofs und das Eintauchen der Maus Karkasse in einem großen Volumen (~ 500 ml) eiskaltem Krebs (4 ° C) Lösung geblasen mit Carbogen (95% O 2 und 5% CO 2).
- Alle inneren Organe, sondern auch die Dickdarm-und Beckenorgane vorsichtig entfernen. Transekt mit der Maus in die Hälfte über dem Wirbelsegment T12 leicht über dem Zwerchfell und übertragen Sie die Schwanz Hälfte zu einer Dissektion Kammer, eiskalt, sprudelte Krebs-Lösung.
- Unter einem Stereomikroskop, entfernen Sie die Blase und die Fortpflanzungsorgane durch Durchtrennung an ihren Verbindungsstellen an der Harnröhre, und entfernen Sie den absteigenden / Bauchaorta, bis sie in gemeinsamen Beckenarterien gabelt. Befreien Sie den PN oder die LSN von ihren surrounding Gewebe stumpf und folgen Sie den Nerv von außerhalb des Beckenkamm bis zu seiner ventralen Einstieg in die L6 und S1 Wirbelsäule (PN) oder T13 und L1 Wirbelsäule (für LSN).
- Schneiden Sie die Symphyse und rechts und links Pfannen Gelenke, und entfernen Sie das Darmbein. Sorgfältig kostenlos entweder die PN oder LSN aus dem beigefügten Muskels und des Bindegewebes aus der Nähe des colorectal, bis wo der Nerv in die Wirbelsäule.
- Sorgfältig Resektion des Darmbein, um den distalen Kolorektums aussetzen. Präparieren Sie die distale Kolorektums mit dem angebrachten PN oder LSN im Kontinuum.
- Übertragen Sie die Kolorektums mit dem Nerv in das Bad Fach der Gewebekammer angebracht. Überschüssiges Bindegewebe durch weitere Dissektion, und öffnen Sie die Kolorektums Längsrichtung entlang des Anti mesenterialen Grenze.
- Mit Schleimhautseite nach oben, stecken Sie die mesenterialen Rand des Kolorektums neben dem Aufnahmeraum in die Silikonbasis der chamber und befestigen Sie den antimesenteriale Länge des Kolorektums an einen Rake von Haken mit einem Kraftstellglied verbunden (in Abbildung 1 veranschaulicht und in 2A fotografiert).
- Erweitere PN oder LSN in die Aufnahmefach, das zu dem Bad Raum durch eine Mausloch und dem Gate verbunden ist. Legen Sie vorsichtig den Nervenstamm auf einen kleinen Glasspiegel im Aufnahmeraum, der eine hydrophile Oberfläche für den Mut, zu halten bietet. Superfuse das Baderaum mit warmem (30 bis 32 ° C), mit Sauerstoff angereicherte Krebs-Lösung und füllt die Aufnahmefach mit Mineralöl.
3. Einzelfaser-Aufnahme und Lokalisierung der rezeptiven Feld
- Schieben Sie vorsichtig die Epineurium (Nervenscheide) der PN oder LSN unter dem Stereomikroskop bei hoher Vergrößerung (50 - 60X). Mit einer feinen Pinzette, necken den Nervenstamm in 5-8 Nervenbündel von ~ 100 & mgr; m Dicke.
- Legen Sie die Platin-Iridium-ReferenzElektrode in Kontakt mit dem Krebs-Lösung in das Gewebe Kammer. Sequentielles Platzieren der einzelnen Nervenbündel auf die Aufzeichnungselektrode aus dem gleichen Material hergestellt.
- Mit einem weichen Pinsel, um APs von den Dick Afferenzen durch sanft streichelte oben und unten der kolorektalen Oberfläche hervorrufen. Suchen Sie den Nervenbündels (n), die den Doppelpunkt durch nachweisbare AP (Aktionspotential) Aufnahmen innervieren.
HINWEIS: Die PN und LSN auch die Harnblase und andere Beckenorgane innervieren. - Verwenden Sie ein Paar 30 G Nadelspitzen weiter zu spalten die Nervenbündels in feine Faszikel Filamente ~ 10 & mgr; m Dicke und legen Sie einen individuellen Filament auf die Aufzeichnungselektrode.
- Legen Sie die rund Spitze konzentrischen Elektrode senkrecht zur Schleimhautoberfläche zu afferenten Enden am Überschwellenreizstärke (10 mA Stärke, 0,5 ms Dauer @ 0,3 Hz), die eine mm Radius von aktuellen Ausbreitung ~ 2 produziert elektrisch erregt. Bewegen Sie den Elektroden systematisch (~ 1,5 mm Schritten) Entlang der Länge und Breite des abgeflachten colorectum empfänglich Digungen lokalisieren.
- Wenn ein afferenten Ende ist aufgeregt, stellen Sie die Elektrodenposition, um den Ort der Aktivierung (rezeptiven Feld, HF), die minimale Reizstärke (Reizschwelle) erfordert genau zu bestimmen. Entsorgen Enden mit einer Reizschwelle> 3 mA 19.
- Berechnen der Leitungsgeschwindigkeit (CV) von 1) der Abstand zwischen der Stimulationselektrode an dem Empfangsfeld (RF) und der Aufzeichnungsstelle, und 2) die Leitungsverzögerung (zB, 2B) zwischen dem Reizartefakt und dem Einsetzen des Aktionspotentials .
CV (m / sec) = Abstand (mm) / Leitungsverzögerung (msec).
4. Funktions Einstufung mechanosensitiven Colorectal Afferenzen
- Nach dem Auffinden eines RF durch elektrische Stimulation, gelten die folgenden drei mechanische Reize an den HF:
- Führen Sie die Sondierung Reiz, indem Sie die Spitze eines calibrated von Frey-like Nylonmonofilament (0,4 und 1 g Kraft), die senkrecht auf die RF auf der abgeflachten Kolorektums.
- Führen Sie den Reiz von streichelte sanft streichelte den kolorektalen Schleimhaut mit einer feinen Nylonfaden Strang (10 mg Kraft), eine kleine Oberflächenscherspannung an der RF zu erzeugen.
- Führen Sie die Umfangsdehnung mit Hilfe eines computergesteuerten Kraftantrieb, die eine rampenförmige Strecke Kraft liefert (0-170 mN bei 5 mN / sec) in Umfangsrichtung entlang der Anti mesenterialen Rand des Kolorektums über den Rechen des in Schritt 2.8 beschrieben Haken .
- Bewerte Afferenzen als Serosa (reagieren nur auf stumpf Sondieren), Schleimhaut (reagieren auf Schleimhaut streicheln und stumpf Sondieren), muskulös (zum Umfangsdehnung reagieren und stumpf Sondieren) Muskel / Schleimhaut (zum Umfangsdehnung, Schleimhaut Streicheln reagieren und stumpf Sondieren), oder MIA (nicht in Reaktion auf jede der drei mechanischen Reizen).
- Für mesenterialen Afferenzen (nur indie LSN Innervation), die schwierig sind, um selektiv durch elektrische Stimulation zu aktivieren, suchen ihre rezeptiven Enden durch mechanische Streicheln / Sondierung des Mesenteriums.
- Für Stretch-sensitive Afferenzen (Muskel-und Muskel-Schleimhaut), bestimmen die Ansprechschwelle, die als die Kraft, die die erste AP während der geneigte Strecke erinnert definiert ist.
- Für serösen Afferenzen, notieren ihre Antworten auf aufsteigend Ebenen der punktförmige Sondieren des rezeptiven Feldes durch die computergesteuerte Kraftstellglied angetrieben.
5. Chemische Anwendung / Modulation der Empfang Endings
- Zeichnen Sie eine Baseline-Reaktion auf einen mechanischen Reiz (dh Reaktion auf geneigten Strecke, punktförmige Sondieren oder Schleimhaut Streicheln).
- Bestreichen Sie die Unterkante eines Schlauchstück (Messing oder Edelstahl, 10 mm Höhe und 4 x 4 mm 2 quadratisch oder 4-5 mm Durchmesser) mit Vaseline und legen Sie es über dem rezeptiven Feld auf der Kolorektums.
- Entfernendie Krebs-Lösung im Inneren des Schlauchs, und setzen die aufnahme Endung für 3 - 5 min zu 170 ul der Lösung, die die Chemikalie (n) zu prüfen.
- Beobachten Sie die Reaktion des afferenten bei der chemischen Anwendung (einige Afferenzen sind chemosensitiven).
- Entfernen Sie die chemische Lösung und die Schläuche, die Wirkung der chemischen beenden. In 4 - 6 min, testen die afferenten Reaktion auf denselben mechanischen Stimulus, wie in der Grundreaktion.
- Wenden Sie die mechanischen Reiz wieder nach ausreichenden Zeitraum Auswaschen (> 15 min).
6. Aufnahme und Diskriminierende AP Spikes
- Digitalisieren der elektrischen Signale von Axonen bei 20 kHz aufgenommen und speichern Sie die Daten auf einen Computer. Überwachen Sie die Signal online durch eine Audio-Überwachung.
- Analysieren Sie die AP Spitzen off-line und diskriminieren einzelne Einheiten basierend auf der Hauptkomponentenanalyse einzelner Dorn 25 Wellenformen.
HINWEIS: Ein Datensatz sollte nicht mehr th enthaltenein zwei leicht unterscheidbar aktiven Einheiten.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Der Aufbau ist in Abbildung 1 dargestellt ist. Es umfasst eine maßgeschneiderte Gewebekammer, die die colorectum in einem Silikon-Bad ausgekleideten Kammer und der beigefügten Nerv in einem zusammenhängenden Mineralöl gefüllten Abteil untergebracht ist. Die Zwei-Kammer-Kammer wurde aus einem massiven Block aus Acrylkunststoff mit einer CNC-Maschine bearbeitet; der Boden der beiden Kompartimenten wurde anschließend mit festen Silikon ausgekleidet, um einfach Stift nach unten des kolorektalen Gewebe ermöglichen. Die extrazelluläre APs aus gehänselt Nervenfaszikel werden mit einem geräuscharmen, batteriebetriebenen Differenzverstärker mit hoher Gleichtaktunterdrückung (CMRR ~ 60 dB) aufgezeichnet. Die Verstärkung des Verstärkers auf 0,3 bis 10 kHz bis 10.000facher und der Bandfilterbereich eingestellt ist. Die elektrische Stimulation des colorectum durch eine optisch gekoppelte Stimulator im Konstantstrombetrieb über eine konzentrische Elektrode in Kontakt mit Dickdarmschleimhaut geliefert. Mechanische Stimulation (kolorektale Dehnung und punktförmige Sondieren) wird durch ac geliefertomputer gesteuerte Kraftstellglied. Einen AD-Wandler und eine geeignete Software zu überwachen beide Stimulation und Aufzeichnungsverfahren durch Senden Spannungsbefehlsausgänge mechanische und elektrische Reize sowie Aufzeichnungs initiieren und Digitalisieren der extrazellulären Signale AP des Differenzverstärkers. Von mechanischen und elektrischen Rauschquellen zu isolieren, werden die Gewebekammer, Mikroskop und Differenzverstärker in einem Faraday-Käfig an einer pneumatischen Lufttisch montiert angeordnet.
Wie in 2A gezeigt, wird die Kolorektums mit dem angehängten Nerven aus einer Maus seziert, geschnitten entlang der Anti mesenterialen Kante auf, und merken Wohnung im Silicon ausgekleideten Gewebe Kammer; der Nerv auf einer Glasspiegel in der benachbarten Aufzeichnungskammer gegeben. In 2B angezeigt ist eine repräsentative Aufzeichnung eines Aktionspotentials (AP) in Reaktion auf die elektrische Stimulation des RF beim Schwellenwert. Der AP in diesem Datensatz hinkt dem Konjunktur KunstiFact (•) von 49 msec wegen der Leitungsverzögerung von der RF an die Aufzeichnungselektrode, was zu einer berechneten Leitungsgeschwindigkeit von 0,43 m / sec, und im Bereich eines unmyelinated C-Faser. In 2C angezeigt sind typische Reaktionen eines afferenten Reize von Hand (Sondieren des HF mit von Frey-like Monofilamente, 1 g, und feine Schleimhaut Streicheln des HF, 10 mg) geliefert. Dieser Datensatz enthält zwei leicht unterscheidbar Afferenzen; nur die große Amplitude afferenten reagiert auf Streicheln. Wie in 2D gezeigt, wurden afferenten Antworten auf Sondierungs auch durch einen Computer-gesteuerten Kraftstellglied, die an der gleichen Stelle auf der colorectum liefert eine Reihe von zeitgenaue und reproduzierbare mechanische Kräfte (5, 10, 20, 40 und 80 mN beurteilt, 5 Sekunden Dauer). Ähnlich Umfangsdehnung des colorectum (0-170 mN bei 5 mN / sec) durch den gleichen Aktor mit einer repräsentativen Reaktion in 2E angezeigt gelieferten
Wie in 3 gezeigt, kolorektalen Afferenzen funktionell in sechs Klassen auf der Basis ihrer Reaktionsprofile auf drei verschiedene mechanische Reize (siehe Schritt 4.2) kategorisiert werden. Alle afferenten Enden außer mesenterialen Afferenzen wurden durch elektrische Stimulation liegt (e-stim, linke Spalte zeigen Pfeile Reizartefakt). Mechanisch unempfindlich Afferenzen (MIAs) nicht zu einem der drei mechanische Reize reagieren. Dagegen sind alle mechanosensitive Enden reagieren auf Sondierung (0,4-1,4 g). Unter ihnen sind muskulös und Muskel-Schleimhaut-Endungen auch durch Umfangsdehnung aktiviert (0-170 mN), und damit werden als Stretch-sensitive Afferenzen; Muskel-Schleimhaut-Endungen werden auch durch Streichen (10 mg) aktiviert. Mucosal Enden werden auch durch Streichen (10 mg) aktiviert, aber nicht strecken und serösen Endungen sind nicht von jeder Strecke oder Streicheln aktiviert. Mesenteriale Endungen werden von mechanisch b identifiziertrauschen die Gekröse.
In 4A angezeigt werden, sind repräsentative Antworten von einer Stretch-sensitiven afferenten von drei aufeinanderfolgenden Umfangs Strecken um 5 min getrennt hervorgerufen. Der Spike Nummern gleichmäßig in drei Bins binned und als Stimulus-Antwort-Funktionen in 4B und enthüllt hohe Reproduzierbarkeit sowohl Antwortgröße (Spike-Nummer) und Ansprechschwelle.
Diese in vitro-Nerven Kolorektums Vorbereitung erlaubt auch die lokale Anwendung von Chemikalien zu empfänglich Endungen afferenten. Die Exposition gegenüber Chemikalien auf Regionen der afferenten RF indem Messing oder Edelstahlrohr oberhalb Dickdarmschleimhaut physisch von dem Rest der colorectum isolieren RF begrenzt. Typische Ergebnisse folgende chemische Anwendung sind: direkte Aktivierung der Afferenzen auf Antrag einer Säure hypertonischen Lösung (AHS 26; 5A), keine Aktivierung, aber Nahme von Mechanosensitivität durch ein MIA nach Aufbringen einer entzündlichen Suppe (19; 5B), verstärkte Reaktion (dh, Sensibilisierung) auf mechanische Dehnung nach der Anwendung von IS (5C) und reduziertes Reaktion auf mechanische Dehnung nach Applikation des cGMP (5D).

Abbildung 1. Schematische Darstellung des Versuchsaufbaus. Die Kolorektums-Nerv in einem Zwei-Kammer-Gewebekammer gelegt und isoliert zusammen mit dem Differenzverstärker Kopfstufe in andere elektronische Geräte durch einen Faraday-Käfig. Jedes afferenten RF wird durch elektrische Stimulation (E-stim) des Kolorektums identifiziert und getestet von drei mechanische Reize: Nylonmonofilament Sondieren, Schleimhaut Streicheln und Umfangsdehnung. TGP: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
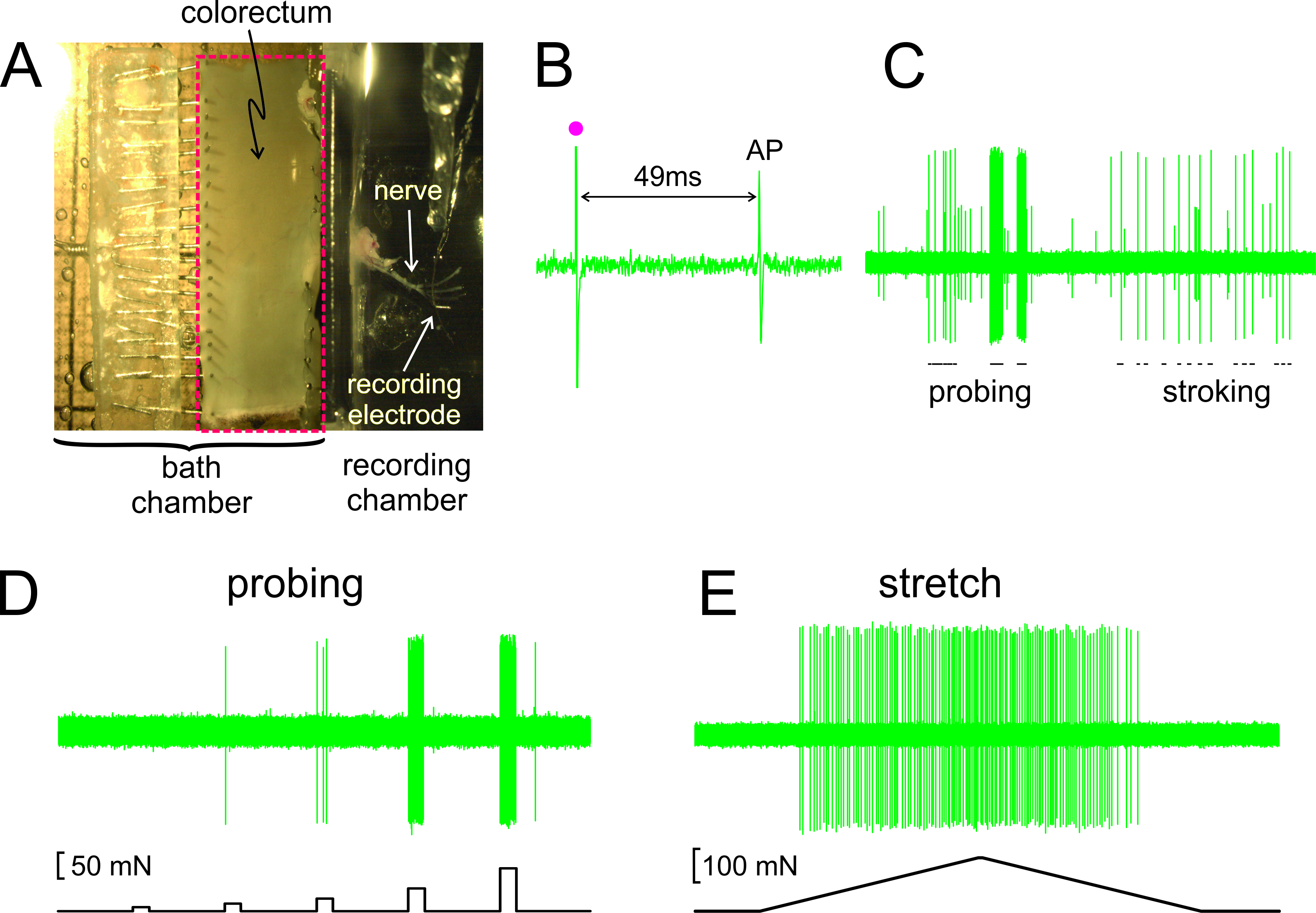
Abbildung 2. Ein Bild durch das Stereomikroskop der sezierten Kolorektums mit angeschlossenem Beckennerv (A). B - E zeigen repräsentative Aufzeichnungen. (B) Ein Aktionspotential (AP) durch elektrische Stimulation hervorgerufen (Reizartefakt, •). (C) Typische Antworten auf Hand Monofilament Sondieren und Schleimhaut Streicheln. (D, E) Antworten auf Sondieren und Umfangsdehnung durch die computergesteuerte Kraftstellglied geliefert sind. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3: Funktionelle Charakterisierung von kolorektalen afferenten Klassen. Afferenzen durch elektrische Stimulation befindet (E-stim, ↑) des colorectal und in fünf mechanosensitive Klassen eingeteilt und ein mechanisch unempfindlich afferenten (MIA) Klasse auf ihre jeweiligen Antwortprofile basieren auf drei mechanische Reize. Sondieren, Streicheln, und Stretch Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 4. Afferente Antworten auf reproduzierbare, computergesteuerte mechanische Stimulation. (A) Die Antworten eines muskulösen-Schleimhaut einfferent an drei aufeinander folgenden Rampenstrecken (0-170 mN bei 5 mN / s; 5 min Inter-Stimulus-Intervall). (B) Antworten (Aktionspotential Spikes) wurden gleichmäßig in drei Fächer (- 57, 57 bis 113 und 113 - 0 170 mN) klassierte und als Reiz-Reaktions-Funktionen angezeigt; Ansprechschwelle ist im Einschub angezeigt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 5. Afferent antwortet lokalisierten chemischen Anwendung Digungen empfänglich. (A) Ein Beispiel für die Chemosensitivität eines serösen afferenten die Anwendung von sauren hypertonische Lösung (AHS). (B) Ein Beispiel für den Erwerb von Mechanosensitivität (Sensibilisierung) von einem MIA endet. Das MIA nicht direkt antwortenzu einer entzündlichen Suppe (IS), jedoch reagiert, um 1,4 g Monofilament Sondieren danach. (C) Sensibilisierung (eine Erhöhung der Reaktions Größe und Verringerung der Ansprechschwelle) zu einer Muskel afferenten nach der Exposition der Endung IS dehnen. (D) Abschwächung der Reaktion auf die von einem Muskel-Schleimhaut-afferenten nach der Exposition der Endung für zyklischen Guanosinmonophosphat (cGMP) zu dehnen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Die hier beschriebene in vitro-Nerven Kolorektums Vorbereitung hat sich als leistungsfähiges Konzept für neuronale Kodierung Funktionen einzelner kolorektalen Afferenzen, die schön ergänzt andere nicht-funktionale Ansätze (zB Zell-, Molekular- und histologische Untersuchungen) auf viszeralen sensorischen Neuronen (studieren siehe Bewertung 27 für Details). Neuronalen Mechanismen Beitrag zur Nozizeption und langfristig colorectal Überempfindlichkeit festgestellt worden sind und pharmakologischen Manipulationen wurden durchgeführt, die ergab, Ziele, die Eingeweideschmerzen lindern könnte. Die folgenden wichtigen Punkte bei erfolgreicher Umsetzung dieser Zubereitung verbunden werden im Folgenden erörtert: 1) Reduzierung von elektrischen Störungen, 2) Erhöhung der Signalerkennung und 3) Auswahl eines standardisierten Impulse für Veränderungen der zuführenden Codierung zu bewerten. Darüber hinaus werden verschiedene Einschränkungen dieser Technik diskutiert.
Aktionspotentiale (APs) propagating intrazellulär entlang Nervenaxone haben in der Regel ein Transmembranpotential von 100 bis 130 mV. Jedoch aufgrund der kleinen spezifischen Kapazität des Axonmembran, diese relativ große Depolarisation bewirkt nur eine kleine elektrische Ladungsverschiebung über die Zellmembran, die leicht in die umgebende extrazelluläre Gewebe / Gewebeflüssigkeit dissipieren kann (was eine elektrische Impedanz wesentlich niedriger ist als Lipidmembran). Für extrazellulären Aufnahme von Nervenfasern / Axone, ist das elektrische Signal in der Regel im Bereich von Mikrovolt, in der Nähe der Höhe der thermischen / weißes Rauschen mit einem typischen bioelektrischen Aufnahme-Setup verbunden, wodurch Rauschunterdrückung die erste Priorität für die erfolgreiche Aufnahme. Um am effektivsten optimalen Störsicherheit zu isolieren, kann es hilfreich sein, um die Gewebekammer, Aufzeichnung und Erdungselektroden, die Differenzverstärker (DC Batteriebetrieb) und das Stereomikroskop in einem Faradayschen Käfig zu setzen. Wenn Bewegungsartefaktes auf, indem die Faraday-Käfig auf einem pneumatischen Lufttisch zu dämpfen mechanische Schwingungen hilfreich. Idealerweise sind die Aufnahme- und Referenzelektroden, die die "+" und "-" eingeben Anschlüsse des Differenzverstärkers bzw. sollte vergleichbar Impedanz im Verhältnis zu ihren Gemeinsamkeiten haben und nahe beieinander liegen. Somit kann jedes externe Rauschen zu gleichen Teilen von beiden Elektroden erfasst und an die strengen Gleichtaktunterdrückung durch den Differenzverstärker unterzogen werden.
In unserem Aufbau (2A), wird die Bezugselektrode in den Krebs Perfusionslösung in der Gewebekammer eingetaucht, während die Aufzeichnungselektrode in Kontakt mit einer feinen Nerven Filaments von beträchtlicher Impedanz. Diese Single-Elektroden-Konfiguration mit einem nicht-triviale Impedanzfehlanpassung in der Regel nicht ideal für die Rauschunterdrückung. Allerdings bietet diese Konfiguration die Bequemlichkeit der Platzierung der feinen Nervenfaden auf nur einer elektrOde, die besonders reizvoll ist, wenn Sie von der Maus kolorektalen Nervenfasern von begrenzter Länge (10 bis 15 mm). Basierend auf unserer Erfahrung ist die einzelne Elektrodenkonfiguration akzeptabel, wenn die Spitze-zu-Spitze-Hintergrundrauschen unterhalb von 20 & mgr; V in der Aufzeichnung. Andernfalls würde eine weitere Geräuschreduktion eines Zweielektrodenaufnahmekonfiguration, in welcher der feine Nerven Filament in Kontakt mit beiden Aufzeichnungs- und Referenzelektroden, die parallel zueinander angeordnet sein verlangen. Alle großen Metallteile im Faradayschen Käfig müssen sternförmig um eine gemeinsame Basis, einem Kupferblock in unserem Aufbau erden. Es muss darauf geachtet werden, die Bildung von Erdschleifen zu vermeiden.
Auf extrazelluläre Erkennung von APs zu gewährleisten, ist der erste Schritt erfolgreiche Präparation des colorectum-Nervengewebe. Quetschen oder Ziehen der Nerv bei der Präparation ist zu vermeiden, die irreversibel schädigen können die Nerven und AP Leitung beeinflussen. Die sezierten Nerv Schaft muss auch to frei von jedem angeschlossenen Muskelgewebe, die Kalium leckt, wenn sie beschädigt und kann Nervenleitung durch Depolarisation blockieren. Diese Präparation Fähigkeit wird in der Regel durch fleißiges Üben über Wochen bis Monate erworben und erfordert ein hohes Maß der Auge-Hand-Koordination und Geschicklichkeit in der Handhabung und mit chirurgischen Instrumenten. Darüber hinaus, um eine Beschädigung des kolorektalen Gewebe zu vermeiden, setzt die elektrische Suchstrategie eine konzentrische Elektrode, die eine stumpfe, abgerundete Spitze und relativ großem Durchmesser (Außen Φ0.55 mm, Innen Φ0.125 mm) aufweist und mit einem Mikromanipulator verbunden durch eine nachgiebige Brücke, was zu einer geringen mechanischen Kraft auf der Schleimhautoberfläche (~ 100 mg) aufgetragen. Um ein größeres Signal in der Aufzeichnungsspuren erwerben, muss die AP-induzierten Transmembranstrom kanalisiert wird und durch die Schaffung einer kleinen Impedanzbrücke zwischen Nervenaxon (n) und der Elektrodenoberfläche "gefangen" auf der Elektrode. Somit Epineurium und Perineurium die Isolierungder Nerv müssen während des Verfahrens der Spaltung der Nerv in feine Filamente von ~ 10 & mgr; m dicke, frei seziert. Da die AP-induzierten Transmembranstrom zerstreut deutlich innerhalb einer kurzen Entfernung von der Axon-Membran, führt ein dünner Nervenfaden in der Regel ein besseres Signal-Rausch-Verhältnis aufgrund der Axone 'näher an der Elektrodenoberfläche. In der Erdöl- Kammer, wobei der Spiegel, der Nerv auf häufig gestellt zieht eine dünne Schicht von Krebs-Lösung (die Glasoberfläche ist hydrophil). Es ist daher notwendig, daß die Aufzeichnungselektrode und Nerven Filament nicht während der Aufnahme in Kontakt mit der Spiegeloberfläche. Verbleibende Tröpfchen Krebs-Lösung, die eine niederohmige Verbindung zwischen der Elektrode und der Spiegelfläche (dh, Rangieren) deutlich die Signalamplitude in der Aufzeichnung zu reduzieren.
Diese Kolorektums-Nerven Vorbereitung ermöglicht die Untersuchung der funktionellen Veränderungen der Afferenzen nach der BelichtungRFs für eine Vielzahl von chemischen Mediatoren und Beleidigungen in vitro als auch in Zusammenhang mit der langfristigen pathophysiologischen Bedingungen (zB colorectums von zuvor behandelten Mäusen entnommen). Ein objektives Maß für funktionelle Veränderungen der Afferenzen hängt von der folgenden: 1) eine standardisierte Reiz mit hoher Präzision und Reproduzierbarkeit und 2) zuführenden Antworten, die robust und reproduzierbar sind. Von den drei mechanische Reize auf die Kolorektums angewendet, Erkundungs- und streichelte Reize des HF werden oft von Hand-von-Frey-Monofilamenten wie geliefert. Zum Sondieren wird das Monofilament in der Regel kalibriert, um eine reproduzierbare senkrechte Kraft beim Biegen zu liefern. Jedoch von Frey artigen Monofilamenten (0,4 und 1 g) haben kleine und unterschiedlichen Querschnittsdurchmessern (0,2 und 0,3 mm, jeweils), was zu einer hohen Nennspannung, wenn senkrecht zu der kolorektalen Fläche (124,8 kPa 0,4 g und angewendet 138,7 kPa für 1 g), eine intensive punktförmige mechanische Reiz beyond der normalen physiologischen Bereich. Darüber hinaus ist die scharfe Kante des Filaments wahrscheinlich eine ungleichmäßige Verteilung der Belastungen mit Schwerspitzenbelastung deutlich höher als die Nennspannung (Spannungskonzentration). Da die typischen RF-Größe (1 mm 2) ist deutlich größer als der Querschnitt eines Monofilaments, und die Unfähigkeit, reproduzierbar stimulieren die identischen Seite mit einem Hand Monofilament, ist es üblich, Antworten auf Reize, die wiederholt unterscheiden beachten deutlich in AP Häufigkeit und Dauer. Als ein Beispiel sind die Antworten auf Sondierung in 2C durch den gleichen Hand Monofilament (1 g) war sehr unterschiedlich dargestellt, die geeignet sind, um durch eine Unfähigkeit beigetragen reproduzierbar Sonde die gleiche Seite und variabler Dauer und das Intervall zwischen aufeinanderfolgenden Reizen. Mucosal streichelte durch einen Hand Filament geliefert ähnlich schwierig und neigt auch dazu, variable Reaktionen aus demselben afferenten hervorrufen. Stimulus Reproduzierbarkeit kannmit Hilfe eines computergesteuerten Kraftstellglied, um genaue Untersuchung (und Dehnung) Kräfte liefern verbessert. Zum Sondieren, verwenden wir ein Monofilament mit einem grßeren Durchmesser (beispielsweise # 6.45, 1 mm), die mehr deckt eine typische afferenten RF 24,28. Computergesteuerte Umfangsdehnung, im Gegensatz zu anderen Streckgewebe Ansätze zur RF gerichtet, ermöglicht homogenen Verformung der ganzen Länge des colorectum, was wiederum die Korrelation mit kolorektalen Dehnung in seine ursprüngliche zylindrische Konfiguration auf der Grundlage vergleichbarer Umfangs mechanische Belastung (dh 0 - 170 mN Strecke entspricht 0-45 mm Hg intraluminale Druck 23). Da die Dehnungskraft gleichmäßig über den anti mesenterialen Kante aufgetragen, die nicht direkt mit der RF, ist die hervorgerufene lokale mechanische Belastung an der afferenten RF reproduzierbare zwischen aufeinanderfolgenden Anwendungen der Dehnung. Darüber hinaus ist die L-Typ-Ca 2+ -Kanal-Blockers Nifedipin zu dem Bad zugegeben, um inhibit spontane Kontraktion der glatten Muskulatur, trägt zur Aufrechterhaltung der kolorektalen Übereinstimmung zwischen geneigten Strecke Tests 23. Schließlich werden die afferenten Antworten auf die geneigte Strecke Protokoll haben sich als reproduzierbar mit kleinen Schwankungen sowohl in der Stimulus-Antwort-Funktion und die Ansprechschwelle zu sein (zB Bild 4). Somit afferenten antwortet rampen Dehnung wurden weit verbreitet als eine objektive Beurteilung der Veränderung der afferenten Funktion bei der Untersuchung der neuronalen Mechanismen visceralem Schmerz und Überempfindlichkeit (zB 19-22,24,26,28-31) verwendet.
Die Kolorektums-Nerven Vorbereitung ist ein leistungsfähiges Werkzeug für die Untersuchung von kolorektalen viszerale Afferenzen. Allerdings hat es auch einige Einschränkungen. Zuerst werden die Axone der Zellkörper der sensorischen Neuronen des dorsalen Wurzelganglions bei der Herstellung durchtrennt, dass dadurch der Untersuchung molekularer Kennungen jener Zellkörper (zB Einzelzell-RT-PCR oder transcriptome Analyse der verschiedenen Klassen von kolorektalen Afferenzen). Zweitens ist die geringe Signal-zu-Rausch-Verhältnis der Einzelfaser-Aufzeichnung verlangt optimale chirurgische Präparation / Nerven Spaltung Fähigkeiten und rauscharme Aufnahme, breitere Anwendung dieses Protokolls in anderen Laboratorien deutlich begrenzen. Drittens kann dieses in vitro Herstellung nicht für Untersuchungen systemischer Faktoren, visceralen Empfindung zu modulieren, wie beispielsweise das vegetative Nervensystem, zirkulierende Hormone und Cytokine, Darmflora und absteigendem Modulation aus dem zentralen Nervensystem.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



