Abstract
详细此视频演示了使用鼠标结直肠神经制剂体外单纤维电生理记录协议。该方法允许公正的鉴定和个人结传入的功能特性。传播动作电位(APS),从一个或几个传入神经 起源的细胞外记录( 即,单纤维)感受域(RFS)在结直肠从逗神经纤维束状制成。结直肠与任何骨盆(PN)或连接并打开纵向腰内脏(LSN)神经去除。该组织被放置在记录室中,钉扎平并灌注充氧的Krebs溶液。焦电刺激被用于定位大肠癌的传入神经末梢,它们由三个不同的机械刺激进一步测试(钝探测,粘膜划线和周向拉伸)到传入功能分类成五个mechanosensi略去类。结局回应没有这些机械的刺激被归类为机械不敏感的传入(MIA中)。两个机械敏感和MIA中可评估致敏( 即,增强的响应,减小阈值,和/或获取mechanosensitivity的)通过射频对化学品的局部暴露( 例如,炎性汤(IS),辣椒素,三磷酸腺苷(ATP))。我们描述的设备和结直肠神经录音准备,收获结直肠附加PN或LSN,在结直肠,单纤维从神经束记录射频识别的,和化学品的本地化应用的RF。此外,制备和应用的标准化机械刺激的挑战进行了讨论。
Introduction
疼痛和过敏症是患者的主要抱怨从功能性胃肠疾病,包括肠易激综合征(IBS),在没有明显的病理生物学原因或组织损伤中存在的痛苦。例如,IBS患者表现出过敏症,包括在正常的肠功能提高反应直肠球囊扩张和增加的敏感性,以及体细胞介超敏反应( 即,压痛到腹部的触诊)1。因为靶向结肠传入已被证明是有效的,以减轻疼痛和过敏症中IBS患者( 例如,局部麻醉药2,3-直肠内滴注;鸟苷酸环化酶-C的利那洛肽激动剂4-6的口服摄取),改进的理解结直肠传入神经神经支配是很重要的。
内脏传入,包括结肠传入,能够应对化学/营养和热模式( 如 7-9)的。然而,内脏传入响应于机械性刺激( 即,机械敏感传入神经 )一直是最彻底的研究,因为机械性刺激( 例如,管腔腹胀,拉伸)是那些通常对感觉的,包括不适和疼痛10-16产生。此外,内脏也支配通过机械敏感传入神经 (MIA中),通常被称为无声或睡眠伤害感受器17。在正常生理条件下,MIA中不回应机械性刺激或有非常高的反应阈值18,但可以成为积极的,并获得mechanosensitivity在病理情况下,有助于过敏。
使用体外准备和这里描述的协议,我们开发并采用电刺激策略,海 RCH为接受的结局,允许公正的鉴定两种机械敏感性和MIA的结局在结直肠19。大肠支配从腰内脏(LSN)和骨盆神经(PN)的途径获得,并且包括可以被分类成五个机械敏感类(浆膜,粘膜,肌肉,肌肉粘膜,肠系膜)和一个MIA类20大肠传入。使用这种在体外制备,我们发现,大肠癌MIA中取得mechanosensitivity(致敏)以下的感受域的短暂暴露于炎性汤(IS),这在LSN通路敏化在PN通路MIA中的71%和MIA中的23%的19。我们也记录MIA中的长期敏(28天)的长期行为内脏过敏的情况下( 即在结肠内接受治疗与酵母多糖21或2,4,6-三硝基苯磺酸小鼠(TNBS)22) 。
jove_content“>其中机械敏感性传入,肌肉发达,肌肉,黏膜传入是唯一的类tonically编码结直肠周向拉伸( 即是拉伸敏感)和subserve性结直肠扩张23,24的编码,利用计算机控制力致动器,我们应用一个标准的,同质的,且可重复倾斜伸展的扁平大肠组织的圆周方向和进一步分类拉伸敏感传入神经 作为低阈值和高阈值23,此外,拉伸的致敏的时间过程经过酵母多糖结肠内21或22 TNBS治疗敏感的传入对应于起病,持续性,和/或行为内脏敏感性的恢复,提示舒展敏感结传入内脏疼痛和感觉过敏的作用。Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:该协议是审查和批准匹兹堡机构动物护理和使用委员会的大学。
1.准备修改克雷布斯解决方案和测试药物的等分
- 使6升的改良的Krebs溶液包含(以mM计):117.9氯化钠,氯化钾4.7,25的NaHCO 3,1.3的NaH 2 PO 4,1.2 MgSO 4干燥,2.5氯化钙2,11.1 D-葡萄糖,2-丁酸钠,乙酸钠20 ,0.004硝苯地平(阻止自发性肌肉收缩),以及0.003吲哚美辛(阻断内源性合成前列腺素)。用冰冷和温暖的克雷布斯解决方案的组织剥离和单纤维记录,分别为。
- 准备任何化学溶液( 如 IS,辣椒素,ATP)在分装时所需的浓度。
2.解剖结直肠神经组织
- 麻醉和安乐死雄性小鼠(6 - 8周龄,20 - 30克)的在CO 2室中的流速即位移10 -每分钟的腔室容积,直至小鼠的30%停止呼吸完全没有胸部运动所指示的。
- 紧接安乐死,抽血通过切割打开胸腔,射孔右心房,并浸渍鼠标胎体在充足体积的冰冷的Krebs(〜500毫升)(4℃)溶液鼓入卡波金(95%O 2的,5%的CO 2)。
- 小心地取出所有的内脏,但结肠和盆腔器官。断面跨T12脊髓节段鼠标的一半,略高于横膈膜和尾部半转移到含有冰冷的解剖腔,起泡克雷布斯解决方案。
- 在立体显微镜下,通过横断他们的路口尿道取出膀胱和生殖器官,并删除降/腹主动脉,直至其分叉成髂总动脉。释放PN或从他们surroundin的LSN克组织钝性分离,并按照从髂嵴,直至其腹入口点L6和S1椎列(PN)或T13和L1椎列(LSN)以外的神经。
- 切开耻骨联合和左,右髋关节,去除骨骼。仔细自由无论是PN或LSN从接近结直肠,直到那里的神经进入脊柱附着的肌肉和结缔组织。
- 仔细切除髂骨,露出远端结肠直肠。解剖出远端结肠直肠与连续所附PN或LSN。
- 转移带贴在组织腔的浴室中的神经结直肠。通过进一步解剖除去过量结缔组织,并纵向沿着反肠系膜边界打开结肠直肠。
- 与粘膜的一面朝上,PIN结直肠的靠近记录室中的肠系膜边缘进入室使用的聚硅氧烷基r和附加到连接到一个力致动器挂钩的耙结肠直肠的系膜长度(示于图1和拍摄在图2A)。
- 延长PN或LSN到记录室,它是由一鼠标孔和栅极连接到该浴室中。轻轻地将神经干到在录音室中,这为神经坚持亲水表面的小玻璃镜面。 Superfuse洗澡舱用温水(30 - 32°C),含氧克雷布斯解决方案,填补与矿物油的录音室中。
3.单纤维记录和感受野的本地化
- 小心剥离回从PN或LSN神经外膜(神经鞘)的体视显微镜,在高放大倍率(50 - 60X)下。用细镊子,挑逗神经干到5 - 〜100微米厚度的8神经束。
- 将铂 - 铱参考电极与在所述组织腔Krebs溶液接触。依次将各个神经束到由相同材料制成的记录电极。
- 使用软画笔轻轻抚摸上下结表面,以唤起从大肠传入的AP。找到神经束(S),通过检测AP(动作电位)录音支配结肠。
注:PN和LSN也支配膀胱等盆腔器官。 - 使用一对为30g针尖的神经束,以进一步分成10微米厚的556肌束长丝和放置一个单独的长丝到记录电极。
- 将圆尖同心电极垂直于粘膜表面,以电激发传入神经末梢在阈上刺激强度(10毫安幅度,0.5毫秒持续时间@ 0.3赫兹),其产生的电流扩散一〜半径2毫米。将电极系统(1〜1.5毫米间距)沿着所述扁平大肠的长度和宽度来本地化接受的结局。
- 当传入结局被激发,调整电极位置精确定位的激活(感受野,RF)的一个需要的最小刺激强度(刺激阈值)的位点。丢弃的结局与刺激的阈值>3毫安19。
- 计算刺激伪迹和动作电位的发生之间的传导速度(CV)从1)在感受野(RF)的刺激电极和记录位点和2)的导通延迟( 例如, 图2B之间的距离) 。
CV(米/秒)=距离(mm)/传导延迟(毫秒)。
机械敏感性结传入放电4.功能分类
- 定位一个射频电刺激后,取以下三个机械刺激到RF:
- 通过按压CALIBRA的前端进行探测刺激特德·冯·弗雷,如尼龙单丝(0.4和1克力)朝垂直的扁平结直肠的RF。
- 轻轻抚摸着大肠黏膜用细尼龙丝股(10毫克力)产生的RF小面剪应力进行抚摸刺激。
- 用计算机控制的力致动器,它提供了一个倾斜的拉伸力进行周向拉伸(0 - 170 MN在5分钟/秒)沿大肠经由在步骤2.8中所述钩的耙抗肠系膜边缘圆周方向。
- 分类传入为浆膜(只响应钝探测),粘膜(回应粘膜抚摸和钝探测),肌肉(回应周向拉伸和钝探测)肌肉/粘膜(回应周向拉伸,粘膜抚摸和钝探测),或MIA(未响应于任何三个机械刺激的)。
- 对于肠系膜传入(仅在该LSN支配),很难通过电刺激选择性激活,找到自己接受的结局由机械轻抚/探测肠系膜。
- 对于拉伸敏感传入(肌肉和肌肉粘膜),确定响应的阈值,其被定义为,唤起的第一个AP期间倾斜拉伸的力。
- 对于浆膜传入,记录他们的反应,上升点状探测的感受野由计算机控制的力致动器驱动的水平。
感受结尾5.化学应用/调制
- 记录基线响应机械刺激( 即响应斜坡舒展,点状探测,或粘膜行程)。
- 外套一块管(黄铜或不锈钢,高10毫米和4×4 平方毫米的方形或4 -直径5mm)的底部边缘与凡士林,并将其放置在对结直肠感受野。
- 拆除克雷布斯溶液的管内,并露出接受结束3 - 5分钟到170微升含有化学(S)以被测试的溶液中。
- 监测过程中的化学应用传入的响应(有些传入的化疗敏感)。
- 除去化学溶液和油管终止化学的作用。在4 - 6分钟,测试传入响应于相同的机械刺激如在基线响应。
- 后洗出足够的时间(> 15分钟)再重新应用机械刺激。
6.记录和判别AP尖峰
- 数字化记录在从轴突在20千赫的电信号并将数据保存到计算机。通过音频监视器监控上线的信号。
- 分析AP尖峰离线和歧视基于个人尖峰波形25的主成分分析单个单位。
注意:一个记录不应包含更多次一个2轻松地辨别现役部队。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
设置示于图1,它包括一个特制的组织腔,其容纳在硅氧烷衬里的浴室并在一个连续的矿物油填充室中的附神经结直肠。两室室从丙烯酸塑料由CNC机床的固体块加工;两个隔室的底部,随后衬有牢固的硅氧烷,以允许容易销的大肠癌组织中向下。从梳理神经束外的AP使用低噪声,电池供电的差分放大器具有高共模抑制比(CMRR〜60 dB为单位)被记录。放大器的增益被设定为x10,000和带过滤器范围在0.3至10千赫。结直肠电刺激是由恒流模式的光耦合刺激通过同心电极与结肠粘膜的接触传递。机械性刺激(结拉伸和点状探测)由AC交付动态数值控制的力致动器。 AD转换器和适当的软件通过发送电压指令输出给发起的机械和电刺激以及记录和从差分放大器的数字化的胞外信号的AP监督既刺激和记录的过程。从机械和电气噪声源隔离,所述组织腔,显微镜和微分放大器被放置在一个法拉第笼安装在气动气表内部。
如图2A所示 ,用附带的神经结直肠从小鼠摘出,切割沿反肠系膜边缘开放,并且钉扎平在硅氧烷衬里的组织腔;神经被放置在相邻的记录室中的玻璃镜。在图2B中显示的是一个动作电位(AP)响应于所述RF于阈电刺激的代表性记录。在此记录中AP滞后于经济刺激艺术背后ifact(•)由49毫秒由于从RF到记录电极的导通延迟,导致0.43米/秒的计算传导速度,以及在一个无髓C-纤维的范围内。在图2C显示的是一个传入的用手(探测用的von Frey状单丝,将1克,和RF的细粘膜划线,10毫克的射频的)递送刺激典型的反应。此记录包含了两个很容易地辨别传入;只有大振幅传入响应抚摸。 如图2D,传入响应探测也评估由一个计算机控制的力致动器,可提供在同一站点上的结直肠一系列精确定时和可重现的机械力(5,10,20,40和80的Mn, 5秒的持续时间)。同样地,结肠直肠的周向拉伸(0 - 170 MN在5分钟/秒)是由相同的致动器提供与在图2E显示的代表响应
如图3中 ,大肠癌的传入可以功能分为基于其响应曲线6类三个不同的机械刺激(见上面步骤4.2)。除了肠系膜传入所有传入神经末梢均位于由电刺激(E-STIM;最左边的列中,箭头表示刺激伪迹)。机械敏感传入(MIA中)不响应任何三个机械刺激。 ( - 1.4克0.4)与此相反,所有的机械敏感的结局来探测响应。其中,肌肉和肌肉粘膜结局也由周向拉伸激活(0 - 170 MN),并因此被称为拉伸敏感传入神经;肌肉,粘膜的结局被抚摸(10毫克)也被激活。粘膜末梢被抚摸(10毫克)也被激活,但不能伸展和浆膜结局不是由任何拉伸或抚摸激活。肠系膜结局由机械B中确定冲肠系膜。
在图4A显示的是从拉伸敏感传入神经 由5分钟分隔的三个连续的圆周延伸诱发代表的响应。秒杀号码均匀分级分为三个垃圾桶,并显示在图4B刺激反应的功能,揭示高重复性均响应幅度(穗数)和响应阈值。
这种体外结直肠神经制剂还允许化学品的本地应用程序的传入接受的结局。在暴露于化学品是通过将黄铜或不锈钢管上盖的大肠粘膜物理上从结肠直肠的其余部分隔离开的RF限定于传入射频周围的区域。以下化学应用的典型结果包括:直接激活应用程序时的酸高渗溶液传入(AHS 26; 图5A),无活化,但采集mechanosensitivity的通过的MIA应用的炎性汤后(IS 19; 图5B),增加的响应( 即致敏),以机械拉伸的应用是( 图5C)后,并以机械拉伸施用后减少响应的cGMP的( 图5D)。

实验装置的图1的示意图。该结直肠神经置于两室组织腔和沿着与所述差分放大器头阶段从其它电子设备由一个法拉第笼隔离。每个传入RF由结直肠电刺激(E-STIM)鉴定和测试由三个机械刺激:尼龙单丝探测,粘膜抚摸,和周向拉伸。 TTPS://www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg“目标=”_空白“>点击此处查看该图的放大版本。
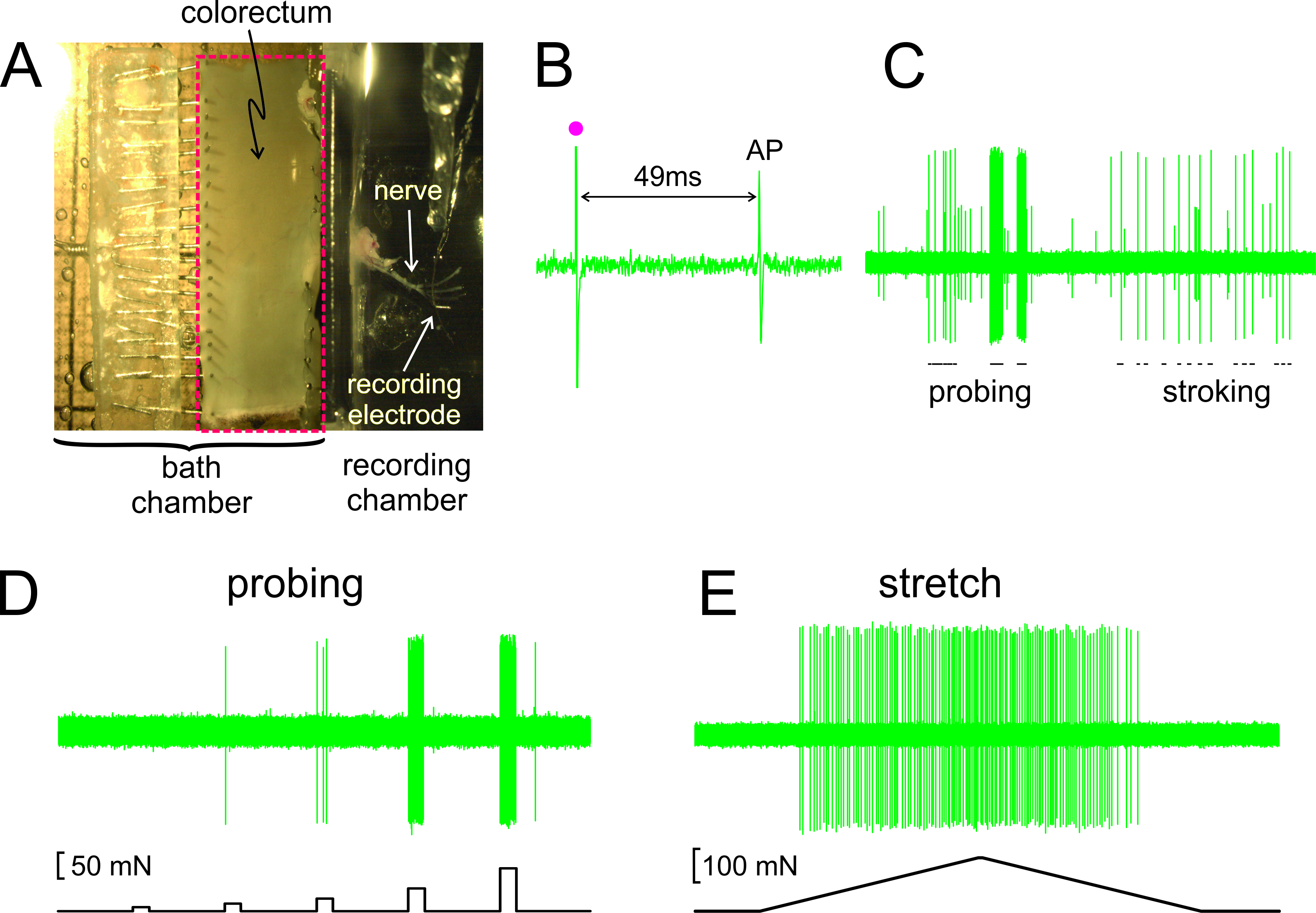
图2.通过解剖结直肠附有盆神经(A)的立体图像B - E显示代表性的记录。 (B)的动作电位(AP),通过电刺激诱 发(刺激伪迹,•)。 (C)的典型反应,手持单丝探测和粘膜抚摸。 (D,E)响应探测和周向拉伸由计算机控制的力致动器传递,分别请点击此处查看该图的放大版本。

结传入类图3.功能特性。传入放电位于电刺激(E-STIM,↑)结直肠和分为5类机械敏感性和一个机械不敏感的传入(MIA)级根据其各自的响应曲线三机械性刺激:探测,抚摸,舒展请点击此处查看该图的放大版本。

图4.传入的反应可再生的,电脑控制的机械刺激。(A)的肌肉,粘膜一个响应fferent三连冠斜坡延伸(0 - 170 MN在5万/秒; 5分钟刺激间间隔)。 (B)响应(动作电位尖峰)被均匀分档分 为三个垃圾桶(0 - 57 57 - 113和113 - 170 MN),并显示为刺激-反应功能;响应阈值显示在插图。 请点击此处查看该图的放大版本。

图5.传入应对本地化的化学应用程序接受的结局。(A)一浆膜传入到应用程序的酸性高渗溶液(AHS)的敏感性的一个例子。 (B)收购mechanosensitivity(过敏)的例子由MIA结束。该MIA没有直接回应到炎症汤(IS),但回应1.4克单丝之后的探测。 (C)过敏(增加幅度响应和减少响应阈值),其结局IS曝光后伸展肌肉传入的。响应的(D)衰减伸展其结局环磷酸鸟苷(cGMP)的曝光后,肌肉,黏膜传入。 请点击此处查看该图的放大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
这里所描述的在体外结直肠神经制剂已被证明是一个有效的方法来研究各个结传入,它很好的补充了对内脏感觉神经元等非功能性的方法( 例如,细胞,分子和组织学研究)的神经编码功能(见综述27的详细信息)。促进伤害感受和长期结肠超敏反应神经机制已经揭示和药理操作已经执行了具有可以减轻内脏痛显示目标。成功实施本制剂的相关联的以下要点讨论如下:1)减少电噪声的,2)在信号检测的增加,和3)选择的标准化刺激来评估传入的编码的改变。此外,这种技术的一些局限性进行了讨论。
动作电位(APS)propagati纳克细胞内沿着神经轴突一般具有100的跨膜电位 - 130毫伏。然而,由于轴突膜的小的比电容,这种相对较大的去极化仅导致跨细胞膜的小电荷位移,从而可以很容易地消散到周围的细胞外组织/间质液(其具有的电阻抗相当低比脂质膜)。对于外记录从神经纤丝/轴突,电信号通常在微伏,靠近与典型的生物电记录设定相关联的热/白噪声的幅度的范围内,使噪声降低所述第一优先级的成功记录。从环境的电噪声最有效地绝缘,也可以是有帮助的,以放置组织腔,记录和接地电极,所述差分放大器(直流电池供电),并在一个法拉第笼的立体显微镜。如果运动伪影s出现,把法拉第笼上气动表来抑制机械振动是有帮助的。理想的情况下,即输入“+”和记录和参考电极“ - ”差动放大器的端口,分别,应该具有相当的阻抗相对于它们的共同点和位于彼此接近。因此,任何外部噪声将被记录大约同样由两个电极,并进行了严格的共模抑制由差分放大器。
在我们的设置( 图2A),参比电极浸入在组织腔克雷布斯灌注溶液,而在记录电极与相当阻抗的精细的神经丝接触。这与一个非平凡的阻抗失配的单电极结构通常不是理想的降噪。但是,这种配置提供了将所述细神经纤维的方便性上只有一个ELECTR颂歌,从有限长度的鼠标结肠神经丝录制时,这是特别有吸引力(10 - 24毫米)。根据我们的经验,在单电极结构是可以接受的,当峰 - 峰的背景噪声低于20μV在记录中。否则,进一步降低噪音会要求在其中细神经纤维必须是在与平行放置彼此既记录和参考电极接触的两电极记录的配置。所有的法拉第笼内部的大金属部件需要在一个星形的方式被接地到一个共同点,在我们的设置一个铜块。小心,要注意避免形成接地回路。
以确保细胞外检测AP的,第一步是结肠直肠,神经组织的成功解剖。夹持或牵拉必须避免解剖过程中神经,它可以不可逆地损伤神经,影响的AP传导。解剖神经干也需要吨Ø无任何关连的肌肉组织,破坏,可以通过去极化阻断神经传导,当它泄漏钾。这种解剖技能是通过数周勤练一般后天个月,要求在处理和使用的手术器械高水平的手眼协调能力和灵巧。此外,为了避免损坏大肠组织中,电搜索策略利用了具有钝,圆形末端和相对大直径(外部Φ0.55毫米,内部Φ0.125毫米)和由连接到一个显微同心电极柔顺桥,从而产生适度的机械力施加到粘膜表面(〜100毫克)。为了获得在记录迹更大的信号时,AP诱导跨膜电流需要被引导,并在电极上“捕获”通过创建神经轴突(S)和电极表面之间的小的阻抗桥。因此,该隔离的神经外膜和神经束膜神经需要分裂神经成10微米厚的556长丝的过程中被解剖。因为AP诱导跨膜电流从轴突膜消散相当短的距离内,较薄的神经丝通常导致更好的信噪比因轴突'更接近所述电极表面上。在矿物油室,该神经常被放置在镜子吸引了一层薄薄的Krebs溶液(玻璃表面是亲水性的)。因此,这是必要的,在记录电极和神经灯丝不在记录期间与镜子表面接触。克雷布斯溶液的任何残余的液滴,其提供在电极和镜面之间的低阻抗电桥( 即,分路)将显著减少在记录中的信号幅度。
此结直肠神经准备允许传入的功能变化的研究后暴露射频到各种化学介质和体外损伤,以及在长期的病理生理条件下的上下文( 例如,从先前处理的小鼠采取colorectums)。对传入的功能变化的客观衡量取决于以下几点:1)标准化的刺激,精度高,重复性和2)传入的反应是稳健和可重复性。适用于结直肠三个机械刺激,探测和抚摸着RF的刺激往往是由手持冯弗雷样单丝交付。探测,单丝通常标定弯曲时提供一个可重复的垂直力。当垂直施加于结面(124.8千帕0.4 g且然而,冯弗雷状单丝(0.4和1μg)具有小的和不同的横截面直径(0.2和0.3毫米,分别),导致高名义应力138.7千帕1克),强烈的,点状机械刺激beyond是正常生理范围内。此外,灯丝的尖锐边缘可能会导致与焦点峰值应力比标称应力(应力集中)相当高的应力分布不均匀。鉴于典型的RF尺寸(1mm 2中)比横截面的单丝,以及无法可重复地刺激与手持单丝的相同部位显著较大,通常观察到的反应反复刺激而不同在AP频率和持续时间显著。作为一个例子,这可能是由一个无法被贡献的响应于由相同的手持式单丝(1克)相当大的变化探测技术如图2C所示,以重复地探测连续刺激之间的相同位点和可变持续时间和间隔时间。粘膜递送抚摸由手持长丝也同样具有挑战性并且也趋向于从同一传入唤起可变响应。重复性刺激可通过使用计算机控制的力致动器,以提供精确的探测(和拉伸)力提高。用于探测,我们使用的单丝具有较大直径( 例如,#6.45,1毫米)更充分覆盖一个典型的传入射频24,28。计算机控制的周向拉伸,而不是朝向所述RF其它组织的拉伸方法,可以均匀变形整个大肠的长度,使得能够基于比较的圆周的机械应力( 即,0与原文圆柱形结构结直肠扩张的相关性- 170 MN拉伸相当于0 - 45毫米汞柱腔内压力23)。由于拉伸力是在抗肠系膜边缘均匀地涂布,而不是直接到RF,诱发局部机械应力在传入RF是可重复的一段连续的应用程序之间。此外,L-型Ca 2+通道阻滞剂硝苯地平加到浴至inhibit自发的平滑肌收缩,有利于维护斜坡拉伸测试23之间的结合规性。最后,将传入响应的倾斜拉伸协议已被证明是可重复的,在两个所述刺激-反应功能和响应阈小变异性( 例如, 图4)。因此,传入的反应斜坡拉伸已广泛在研究内脏疼痛和感觉过敏( 如 19-22,24,26,28-31)神经机制作为传入功能变化的客观评估。
结直肠神经的准备是一个强大的工具,结内脏传入研究。然而,它也有一些限制。首先,在背根神经节的感觉神经元的细胞体的轴突横断在制备中,排除那些细胞体的分子身份( 例如,单细胞RT-PCR或TR的研究anscriptome分析不同类别结传入的)。第二,单纤维记录的低信噪比要求最佳手术剥离/神经分裂能力和低噪音记录,显著限制本协议中其他实验室的广泛应用。第三,该体外制剂未必适用于该调节内脏感觉全身性因素,调查诸如自主神经系统,循环激素和细胞因子,肠微生物群,以及从中枢神经系统降序调制。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



