Introduction
الحشرات تلعب دورا هاما في انتقال الأمراض ذات الصلة بالأغذية لأنها يمكن أن تنتشر الجراثيم في الغذاء أو الملامسة للأغذية الأسطح والأدوات 1. بين الحشرات والذباب والصراصير والنمل وتظهر السلوكيات التي تساعد على انتشار مسببات الأمراض المنقولة بالغذاء. وتشمل هذه السلوكيات وجود علاقة مع مسألة المتحللة، ورفض والبراز، endophily (دخول المباني)، وsynanthropy (يعاشر البشر) 2. . مسببات الأمراض المنقولة عن طريق الأغذية مثل السالمونيلا، الليستريا المستوحدة، العطيفة النيابة، الإشريكية القولونية O157: H7 تم الإبلاغ، وأعضاء من جنس Cronobacter (سابقا الأمعائية الساكازاكية) إلى أن تنتقل عن طريق الحشرات 3-5. القذارة Synanthropic الذباب ينتشر ميكانيكيا البكتيريا تنتقل عن طريق الأغذية عن طريق نقل مسببات الأمراض من الجسم السطوح الملوثة بها. ومع ذلك، فإن وجود مسببات الأمراض المنقولة عن طريق الأغذية في القناة الهضمية من الذباب يمكن أن تصل إلى ثلاثة أضعافأكبر من تلك التي لوحظت على أسطح الجسم (الجسم والرأس والساقين، وأجنحة) 5. يمكن أن تبقى مسببات الأمراض المنقولة بالأغذية أيضا في القناة الهضمية الذبابة لفترة أكبر من الوقت من على سطح الجسم 6،7 و في بعض الحالات، فهي قادرة على التكاثر، استعمار الهضمي المسالك 4،8،9 الذبابة. وهذا يزيد من احتمال متجه من الذباب لأنها يمكن أن تزيد من انتشار مسببات الأمراض المنقولة عن طريق الأغذية من خلال التغوط وقلس 10،11.
في الوقت الحاضر، وهناك تحسن أنظمة المراقبة التي هي قادرة على الكشف عن حالات تفشي الأمراض التي تنقلها الأغذية بسرعة أكبر. حين إجراء تحقيقات اندلاع المنقولة عن طريق الأغذية، مسؤولي الصحة العامة يبحثون عن الطعام الذي قد يكون المصدر (ق) أو مركبة (ق) من العدوى. المحققون قد تؤدي أيضا تقييما البيئي للمنشأة (أو المرافق) المعنية لمعرفة كيفية تلوث الغذاء، ويمكن جمع عينات كجزء من التحقيق 12. DespITE الكم الهائل من المؤلفات العلمية المتعلقة الحشرات وناقلات مسببات الأمراض المنقولة عن طريق الأغذية، وربط الحشرات وناقلات من مسببات المرض يسبب كان معين تفشي الأمراض المنقولة بالأغذية تحديا. ويرجع ذلك أساسا الحشرات لا يتم جمعها جو معقم و مطهر كجزء من برامج أخذ العينات البيئية أثناء التحقيقات اندلاع المنقولة عن طريق الأغذية. لتشمل الحشرات، وخاصة تلك التي تظهر السلوكيات التي تساعد على انتشار مسببات الأمراض المنقولة عن طريق الأغذية، وذلك كجزء من إجراء أخذ العينات البيئية، بروتوكول موحد، السريع، حساسة وموثوق بها للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من حشرة واحدة يجب أن يكون في المكان.
تقنيات الطلاء التقليدية للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من الحشرات هي شاقة وتعتمد على النمو التنافسي للبكتيريا المستهدفة في وسائل الإعلام ثقافة مختلفة للتغلب على النمو السريع لالجراثيم المتعايشة الفطرية من الحشرات. معظم الدراسات التي ترتبط مع الحشرات باوزادت مسببات الأمراض cterial حساسية طريقة عن طريق تجميع معا عدة الحشرات بدلا من تحديد وجود مسببات الأمراض على لكل أساس فردي. وهكذا، فإن تلك الدراسات لم تفرق الجزء جسم الحشرة التي عثر فيها على مسببات الأمراض 13-18. القدرة على تحديد ما إذا كانت مسببات الأمراض المنقولة عن طريق الأغذية وتقع على سطح الجسم أو في القناة الهضمية لحشرة الفردية أمر مهم لأن هذا قد تكون له آثار وبائية وربما يؤدي إلى استراتيجيات التخفيف مختلفة. كما ناقلات الميكانيكية، والذباب تلك الأرض على الطعام لفترة قصيرة قد نقل فقط مستويات منخفضة من البكتيريا من سطح الجسم، في حين أن الذباب الذي اجتر والتبرز على الطعام يزيد من احتمال نقل مسببات الأمراض عند مستويات يحتمل أن تكون أعلى من العدوى. ونتيجة لذلك، من المهم لتقدير مدى انتشار الممرض المنقولة عن طريق الأغذية في حشرة الفردية والتفريق بين جزء من الجسم لتلك الحشرة حيث ص البكتيرية يقع athogen.
على الرغم من أن استخدام وسائل ثقافة مستقلة للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية بشكل متزايد التي يجري تنفيذها، فإنها لم تستخدم تجاريا للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من حشرة واحدة. حاليا، يتم التحقق من صحة وجود بروتوكولات الجزيئية التي تتوفر للكشف السريع لمسببات الأمراض المنقولة عن طريق الأغذية من الأطعمة التي يتم استخدامها من قبل الصناعة والوكالات التنظيمية تجاريا. وتشمل هذه الأساليب النظم المعتمدة على الحمض النووي للكشف عن مسببات الأمراض في مجموعة متنوعة من العينات الغذائية. على الرغم من أن بروتوكولات الجزيئية هي أسرع من الطرق التقليدية الطلاء، ما زالت هناك حاجة لتخصيب العينة للحصول على مستوى حساسية 10 2 مستعمرة (كفو) من العوامل المسببة للأمراض البكتيرية اللازمة في تفاعل البلمرة المتسلسل (PCR) وسائل المستندة إلى 19. بالإضافة إلى ذلك، هناك حاجة إلى عزل المستعمرات البكتيرية نقية من عينات PCR إيجابية لتأكيد الممرض باستخدام الأساليب المناسبة.
المحتوى "> والهدف من هذا البروتوكول هو توحيد نظام يقوم PCR-متاحة تجاريا تستخدم لكشف مسببات الأمراض من عينات المواد الغذائية والبيئية للكشف عن البكتيريا تنتقل عن طريق الأغذية من سطح الجسم والقناة الهضمية لذبابة واحدة وإلى زيادة عزلة تلك تم معايرة مسببات الأمراض من حساسية samples.The البروتوكول الموصوفة هنا لأول مرة مع الذباب منزل الكبار تربى مختبر (الذبابة المنزلية) التي تم تغذيتها تجريبيا مع التخفيفات المسلسل من كل العوامل المسببة للأمراض البكتيرية. تم استخدام بروتوكول موحد لاحقا لمسح 100 البرية وصيدها الذباب عن وجود مسببات الأمراض المنقولة عن طريق الأغذية من السطوح أجسامهم و / أو القنوات الهضمية. وهذا بروتوكول موحد يسمح مختبرات الصحة العامة للكشف عن التهديدات الصحية التي يشكلها الحشرات، والسماح لإمكانية جمعها كجزء من برنامج أخذ العينات البيئية عند تنفيذ تنتقل عن طريق الأغذية التحقيقات تفشي المرض.Protocol
1. مجموعة من الذباب
- جمع الذباب الفردية باستخدام العقيمة شبكات الاجتياح الحشرات. وضع الشباك في برودة ونقلها إلى المختبر.
2. تشريح الذباب
- شل الذباب التي تم جمعها جو معقم و مطهر عن طريق وضعها في -20 درجة مئوية لمدة 5-7 دقيقة.
- باستخدام ملقط معقم ذبابة مكان واحد في أنبوب معقم 2 مل تحتوي على 1 مل من قبل تحسنت (37 ° C) البيبتون مخزنة (BPW). خلط أنبوب بلطف بواسطة انعكاس لمدة 2 دقيقة. ومن الضروري أن الجسم كله من الذبابة تكون على اتصال مع وسائل الإعلام بحيث سيتم نقل الجراثيم الموجودة على سطح الجسم (S) من الطاير للBPW (BPW-S). تسمية الأنبوب مع عدد والجسم جزء من ذبابة (أي 1S).
ملاحظة: يرجى الاطلاع على الجدول من الكواشف محددة / معدات وصفا مفصلا المواد والكواشف المذكورة في هذا البروتوكول. - باستخدام ملقط معقم إزالة ذبابة من وسائل الإعلام BPW-S ونقللأنبوب 2 مل فارغة ونظيفة على السطح تطهير الطاير. احتضان الأنبوب الذي يحتوي على وسائل الإعلام BPW-S في 37 ° C أثناء تنفيذ بروتوكول التطهير وتشريح.
- سطح تطهير الطاير عن طريق غمر في 1 مل من الايثانول 70٪ لمدة 1 دقيقة، تليها الشطف بالماء المقطر المعقم قبل تخبط في 1 مل من الطازجة بنسبة 0.05٪ (ت / ت) محلول التبييض. شطف 3 مرات مع الماء المقطر المعقم. نقل المياه من شطف الماضي إلى أنبوب مل تعقيمها 2.
ملاحظة: تجاهل السائل في كل مرة من قبل باستخدام micropipette 1،000 ميكرولتر أو عن طريق أنبوب للقلب، والتأكد من يبقى الطاير داخل الأنبوب. المزيج بلطف بواسطة انقلاب في كل خطوة من عملية سطح التطهير. - لتقييم فعالية عملية التطهير، ونقل 100 ميكرولتر من المياه من شطف الماضي إلى أجار تربتيكيز الصويا (TSA) لوحة وانتشر استخدام المعقم على شكل L رش المتاح. احتضان لوحة عند 37 درجة مئوية لمدة 24 ساعة. بعد فيcubation، سجل وجود أي المستعمرات البكتيرية.
ملاحظة: إن وجود المستعمرات البكتيرية على لوحات TSA يدل على وجود عملية تطهير أرض غير فعالة. إذا حدث هذا، وينبغي الإبلاغ عن وجود مسببات الأمراض المنقولة بالأغذية فقط على سطح جسم الذبابة بسبب التلوث المتبادل بين سطح الجسم والقناة الهضمية لا يمكن استبعاده.
- سطح تطهير الطاير عن طريق غمر في 1 مل من الايثانول 70٪ لمدة 1 دقيقة، تليها الشطف بالماء المقطر المعقم قبل تخبط في 1 مل من الطازجة بنسبة 0.05٪ (ت / ت) محلول التبييض. شطف 3 مرات مع الماء المقطر المعقم. نقل المياه من شطف الماضي إلى أنبوب مل تعقيمها 2.
- بعد سطح تعقيم الطاير، نقلها إلى قطعة من منشفة ورقية تعقيمها لإزالة الماء الزائد ثم إلى العقيمة 60 ملم المتاح طبق بتري.
- وضع طبق بتري تحت نطاق تشريح وتحديد الطاير إلى مستوى الأنواع باستخدام مفاتيح ثنائية التفرع للعائلات dipteran 20،21.
- باستخدام ملقط تعقيمها غيض غرامة برفق في فتحة الشرج والقناة الهضمية كاملة (A) من الطاير وجو معقم و مطهر تحويلها إلى آخر معقم أنبوب 2 مل تحتوي على 1 مل من قبل تحسنت (37 ° C) BPW مع 0.5 ملم زركونيا / السيليكا الخرز (BPW-A). عشر التسميةالبريد أنبوب مع نفس العدد المحدد للذبابة الفردية وجزء من الجسم من ذبابة (أي، 1A).
- مزيج الأنبوب الذي يحتوي على BPW-A بدقة لمن 5 - 10 دقيقة باستخدام اختلال الخلية. احتضان عند 36 ± 1 ° C أثناء تنفيذ بقية البروتوكول.
- لالقسائم و/ أو تخزين العينة على المدى الطويل، ووضع ما تبقى من ذبابة في أنبوب نظيف 2 مل وإضافة 1 - 2 مل من الايثانول 95٪.
3. إثراء الابتدائي والثانوي
- تسمية كل أنابيب تخصيب الابتدائي والثانوي التي تحتوي على وسائل الإعلام وفقا لعدد العينة وجزء من الجسم من الطاير.
- تحت غطاء العقيمة، ونقل 300 ميكرولتر من BPW-S (السطح) لعقيمة 2 مل أنابيب تحتوي على الوسائط التالية:
- لالسالمونيلا، استخدم 1 مل من قبل تحسنت (42 ° C) BPW. احتضان في حمام مائي إعادة تدوير في 42.5 درجة مئوية لمدة 22-24 ساعة. لتخصيب الثانوي، ونقل 100 ميكرولتر من BPW المخصب إلى 400 & #181؛ ل من قبل تحسنت (37 ° C) ضخ القلب الدماغ (BHI) مرق وضعت سابقا في أنابيب معقمة العنقودية. احتضان عند 37 درجة مئوية لمدة 3 ساعات.
- لCronobacter، استخدم 1 مل من قبل تحسنت (37 ° C) BPW مع نوفوبيوسين (10 ملغم / لتر، والاس، M.، اتصال شخصي). بدلا من ذلك، استخدم 1 مل من R & F الأمعائية مرق التخصيب الساكازاكية مع ملحق (فانكومايسين وcefsulodin) كما تخصيب الابتدائي. احتضان عند 37 درجة مئوية لمدة 22-26 ساعة. لتخصيب الثانوي، ونقل 100 ميكرولتر من BPW المخصب مع نوفوبيوسين إلى 400 ميكرولتر من قبل تحسنت (37 ° C) BHI مرق وضعت سابقا في أنابيب معقمة العنقودية. احتضان عند 37 درجة مئوية لمدة 3 ساعات.
- لL. اللستيريا، استخدم 1 مل من الطازجة RT 24 مرق تخصيب الليستيريا (24 LEB) مع ملحق انتقائي. احتضان عند 37 درجة مئوية لمدة 44 ± 5 ساعة. لا يلزم تخصيب الثانوي للكشف عن L. الليستريا. كرر الخطوات من 3.2.1 - 3.2.3 أعلاه باستخدام أنبوب وصفت بأنها BPW-A.
4. إعداد نظام PCR واستنادا لتضخيم والكشف عن مسببات الأمراض المنقولة بالأغذية الهدف
الخطوات 4-8 استخدام PCR النظام التجاري cycler على / كاشف، محطة عمل الكمبيوتر، والاستخدام مستعدة مجموعات للكشف عن السالمونيلا (السالمونيلا 2 طقم الفحص القياسية)، والأنواع Cronobacter (E. الساكازاكية عدة الفحص القياسية)، والليستريا المستوحدة (L. المستوحدة 24E فحص عدة). المقايسات استخدام معيار PCR الكشف عن نقطة النهاية. تحتوي كل مجموعة على أقراص PCR جاهزة مع صبغة الإقحام التي تنبعث إشارة مضان عندما ملزمة لالحمض النووي المزدوج تقطعت بهم السبل. يتم التقاط إشارة خلال مرحلة الكشف عن برنامج نظام PCR، وتوليد منحنى ذوبان التي يتم تفسيرها من قبل البرنامج بأنها إيجابية أو سلبية.
- إعداد الكواشف والمعدات كما هو محدد من قبل MANUFACTUبروتوكول الإندوبلازمية ولكل الممرض المنقولة بالأغذية الهدف.
ملاحظة: بروتوكولات للكشف عن السالمونيلا وCronobacter تتطلب إجراء تحلل من خطوة واحدة في حين أن بروتوكول للكشف عن L. يتطلب المستوحدة إجراء تحلل من خطوتين (انظر القسم 5 و 6 على التوالي). - بدوره على كتلة التدفئة الآلي اختيار برنامج محدد لمسببات الأمراض المستهدفة. بدلا من ذلك، إذا كانت كتل التدفئة واليدوية، تعيين درجات الحرارة إلى 37 درجة مئوية (لالسالمونيلا، Cronobacter النيابة، وL. الليستريا.) أو إلى 55 ± 2 ° C (لL. المستوحدة الجزء 2 من تحلل - راجع الخطوة 6.2) و 95 ± 3 ° C.
- تأكد من أن كتل تبريد تم المبردة O / N، هدئ خلاف ذلك لهم في 2-8 درجة مئوية لمدة لا تقل عن 2 ساعة.
- باستخدام برامج الكمبيوتر لنظام الكشف PCR القائم، إنشاء ملف رف التالية تعليمات الشركة الصانعة.
- تسمية وترتيب العنقوديةأنابيب تحتوي على كاشف تحلل في الرف، وفقا لملف الرف.
- تهيئة أداة نظام الكشف PCR القائم.
5. تنفيذ تحلل للكشف عن السالمونيلا وCronobacter
- إعداد كاشف تحلل بإضافة 150 ميكرولتر من البروتيني لواحد زجاجة 12 مل من تحلل العازلة.
- نقل 200 ميكرولتر من تحلل كاشف لكل من أنابيب مجموعة وصفت سابقا.
ملاحظة: أنابيب العنقودية التي تحتوي على كاشف تحلل يمكن تخزينها في 2-8 درجة مئوية لمدة تصل الى 2 أسابيع. - باستخدام نصائح ماصة طويلة، نقل 20 ميكرولتر من عينات المخصب الثانوية (راجع الخطوات 3.2.1 و3.2.2) إلى أنابيب العنقودية التي تحتوي على 200 ميكرولتر من تحلل كاشف المقابلة. استخدام نصائح ماصة جديدة لكل عينة.
ملاحظة: حافظ على الأنابيب من تخصيب الابتدائي والثانوي في الثلاجة (السالمونيلا) أو على RT (Cronobacter) لمزيد من التحليل تأكيد عينات PCR إيجابية / سلبية. إعداد الضوابط السلبية من خلال إضافة 20 ميكرولتر من وسائل الإعلام BHI معقم لأنابيب العنقودية التي تحتوي على 200 ميكرولتر من تحلل كاشف. - إعداد الضوابط الإيجابية من خلال إضافة 20 ميكرولتر من O / N الثقافات البكتيرية (تزرع في BHI) أي السالمونيلا المعروفة أو سلالة Cronobacter لأنابيب العنقودية التي تحتوي على 200 ميكرولتر من تحلل كاشف.
- أنابيب مجموعة كاب وتأمين بإحكام باستخدام أداة متوجا.
- وضع رف من الأنابيب العنقودية في كتلة التدفئة الآلي بعد اختيار برنامج محدد لمسببات الأمراض المستهدفة. بدلا من ذلك، احتضان أنابيب العنقودية في 37 ± 2 درجة مئوية لمدة 20 دقيقة، تليها الحضانة في 95 ± 3 درجة مئوية لمدة 10 دقيقة. وأخيرا، ونقل الأنابيب الكتلة لكتل التبريد (2-8 درجة مئوية) لمدة 5 دقائق.
ملاحظة: أنابيب العنقودية التي تحتوي على المحللة ويمكن تخزين في -20 درجة مئوية لمدة تصل الى 2 أسابيع.
6. تنفيذ تحلل للكشف عن L. اللستيريا
- أداء جزء واحد منتحلل على النحو التالي:
- إضافة 1.8 مل من الماء منزوع الأيونات معقمة لزجاجة من إذابة تماما كيل الناشر 1.
ملاحظة: مخزن الناشر وكيل 1 2 - 8 درجات مئوية لتصبح جاهزة للاستخدام. بعد الافتتاح وتمييع، متجر في RT (20 - 30 درجة مئوية) لمدة تصل إلى 6 أشهر. - الجمع بين الناشر وكلاء 1 و 2 في نسبة 4: 1 (40 ميكرولتر من المخفف الناشر وكيل 1 و 10 ميكرولتر من الناشر وكيل 2 في كل عينة). نقل 50 ميكرولتر من وكلاء الناشر مجتمعة إلى التجمع الأنابيب. استخدام الخليط داخل 4 ساعة.
- إضافة 500 ميكرولتر من عينة المخصب الأولية (راجع الخطوة 3.2.3) إلى أنبوب مجموعة تحتوي على 50 ميكرولتر من وكلاء الناشر مجتمعة.
- إعداد سيطرة سلبية من خلال إضافة 500 ميكرولتر من العقيمة 24 LEB إلى 50 ميكرولتر من وكلاء الناشر مجتمعة.
- إعداد مراقبة إيجابية من خلال إضافة 500 ميكرولتر من O / N L. ثقافة المستوحدة نمت في 24 LEB إلى 50 ميكرولتر من وكلاء الناشر مجتمعة.
- تتويج الأنابيب العنقودية، مزيج بلطف ومكانفي كتلة التدفئة في 37 ± 1 درجة مئوية لمدة 30 دقيقة.
ملاحظة: حافظ على الأنابيب من تخصيب الأساسي في الثلاجة لمزيد من التحليل تأكيد عينات PCR إيجابية / سلبية.
- إضافة 1.8 مل من الماء منزوع الأيونات معقمة لزجاجة من إذابة تماما كيل الناشر 1.
- أداء الجزء 2 من تحلل على النحو التالي:
- إعداد كاشف تحلل وفقا للتعليمات في الخطوات 5.1 و 5.2.
- باستخدام نصائح ماصة طويلة نقل 20 ميكرولتر من جزء واحد المحللة لأنابيب العنقودية التي تحتوي على 200 ميكرولتر من تحلل كاشف. استخدام نصائح ماصة جديدة لكل عينة.
- أنابيب مجموعة كاب وتأمين بإحكام باستخدام أداة متوجا.
- أنابيب مكان العنقودية في الآلي كتلة التدفئة اختيار برنامج محدد لL. الليستريا. بدلا من ذلك، احتضان أنابيب العنقودية في 55 ± 2 درجة مئوية لمدة 30 دقيقة، تليها الحضانة في 95 ± 3 درجة مئوية لمدة 10 دقيقة. وأخيرا، ونقل الأنابيب الكتلة لكتل التبريد (2-8 درجة مئوية) لمدة 5 دقائق.
ملاحظة: أنابيب العنقودية التي تحتوي على المحللة ويمكن تخزين في -20 درجة مئوية لمدة تصل الى 2 أسابيع.
أقراص 7. هيدرات PCR-جاهزة
- اختر المبردة (4 ° C) PCR كتلة التبريد ووضع أنبوب رف PCR على إدراج.
- وضع أنابيب PCR التي تحتوي على أقراص PCR جاهزة (المضمنة مع كل مجموعة) لمسببات المرض تنتقل عن طريق الأغذية المستهدفة في حامل المقابلة، وفقا لملف الرف.
- باستخدام أداة decapping، وإزالة بعناية قبعات من PCR-الأنابيب. تجاهل القبعات والتحقق من أن كل أنبوب يحتوي على قرص.
- نقل 50 ميكرولتر (لالسالمونيلا وCronobacter) أو 30 ميكرولتر (لالمستوحدة L.) من المحللة لأنابيب PCR محددة. استخدام القبعات البصرية الجديدة وتأمين بإحكام على أنابيب PCR باستخدام أداة متوجا.
ملاحظة: بعد إضافة المحللة لPCR جاهزة أقراص، والعينات يجب أن تبقى مبردة في 2-8 درجة مئوية حتى تحميلها في نظام الكشف PCR القائم. يمكن طرد الأنابيب PCR في 2،500 x ج لمدة بضع ثوان للتأكد من أن حجم الكامل هو في القاع رانه الأنبوب. - تحميل أنابيب PCR في PCR cycler على / كشف أداة النظام عن طريق فتح درج الصك.
- وضع رف من الأنابيب PCR في الآبار في درج وتحقق من أن أنابيب يجلس بشكل صحيح.
- إغلاق درج والشروع في برنامج كما وصفها بروتوكول الشركة المصنعة.
ملاحظة: تقوم أداة PCR-تمت مسبقا المعلمات الدراجات لكل الممرض المنقولة عن طريق الأغذية. - تحقق من أن يعرض شريط الحالة الدراجات PCR شريط أزرق يشير إلى أن الجزء التضخيم من تشغيل البرنامج.
ملاحظة: للحصول على المقايسات PCR القياسية، كان الوقت لتجهيز البرنامج الكامل (التضخيم والكشف) يستغرق حوالي 3-3،5 ساعة لإكمال.
8. مراجعة نتائج
- بعد اكتمال معالجة، اتبع الأوامر على الشاشة من الصك النظام القائم PCR لإزالة العينات ونتائج الاستعراض.
- إذا كان الممرض المنقولة بالأغذية الهدف موجود في العينة (إماالسطح أو القناة الهضمية لذبابة) البئر الأحمر مع علامة "زائد" (إيجابي). إذا كان الممرض غائب، وكذلك هو أخضر مع علامة "ناقص" (سلبي).
- إذا البئر الأصفر مع شريط أحمر عبر مركز، فإنه يشير إلى خطأ إشارة.
9. عزل مسببات الأمراض البكتيرية من نتائج إيجابية PCR-
- اختر أنابيب من المرحلة الابتدائية (لالمستوحدة L.) أو ثانويا (لالسالمونيلا وCronobacter) إثراء تلك العينات التي كانت PCR إيجابية. أيضا، باختيار عشوائي 3-5٪ من العينات التي كانت PCR سالب والمضي قدما على النحو التالي:
- لالسالمونيلا:
- إضافة 100 ميكرولتر من وسائل الإعلام تخصيب الثانوي إلى 10 مل من رابابورت-Vassiliadis (RV) المتوسطة و1 مل من التتراثيونات (TT) مرق. احتضان أنابيب في 42.5 درجة مئوية في حمام مائي لإعادة تدوير 22-24 ساعة.
- بعد الحضانة، خط 3 مم ملء غانة (10 ميكرولتر) من كل، RV لد وسائل الإعلام TT على كبريتيت البزموت (BS) أجار، الزيلوز يسين desoxycholate (XLD) أجار، وهكتون المعوي (HE) أجار. احتضان لوحات في 35 ± 1 درجة مئوية لمدة 22-24 ساعة.
- بعد مرور فترة الحضانة، ودراسة لوحات لوجود مستعمرات بكتيريا السالمونيلا نموذجية على كل وسائل الإعلام. إذا لم يكن هناك مستعمرات معزولة يمكن الحصول على بعد عدة خطوات زراعة الفرعية، والنظر في العينة بأنها سلبية والإبلاغ باعتباره إيجابية كاذبة لنظام يقوم PCR.
ملاحظة: للحصول على مستعمرات بكتيريا السالمونيلا نموذجية على وسائل الاعلام محددة انظر 22. حدد خمسة الظني مستعمرات بكتيريا السالمونيلا النموذجية وثقافة فرعية لهم على BS، XLD، أو HE حتى يتم الحصول على ثقافات نقية من معزولة / المستعمرات واحد. - اختيار مستعمرة واحدة نقية وتحديد السالمونيلا المفترض باستخدام الاختبارات البيوكيميائية التجارية مثل بطاقة الهوية VITEK 2 أو API نظام تحديد الكيمياء الحيوية، وباتباع إرشادات الشركة المصنعة.
- لCronobacter: <رأ>
- خط 3 مم ملء غانة (10 ميكرولتر) من وسائل الإعلام تخصيب الثانوي على لوحين من وسائل الإعلام الثقافة اللونية مثل الساكازاكية R & F الأمعائية (Cronobacter) الطلاء مولد اللون متوسطة، و / أو ChromID الساكازاكية آجار. احتضان لوحات في 35 درجة مئوية لمدة 22-24 ساعة.
- بعد مرور فترة الحضانة، ودراسة لوحات لوجود المستعمرات Cronobacter نموذجية (الأزرق والأسود إلى اللون الأزرق الرمادي). تحديد 5 مستعمرات Cronobacter الظني وثقافة فرعية لهم على الساكازاكية R & F الأمعائية (Cronobacter) الطلاء مولد اللون متوسطة، ChromID الساكازاكية آجار، أو TSA حتى يتم الحصول على ثقافات نقية من معزولة / المستعمرات واحد.
ملاحظة: إذا لم يكن هناك مستعمرات معزولة يمكن الحصول على بعد عدة خطوات زراعة الفرعية، والنظر في العينة بأنها سلبية والإبلاغ باعتباره إيجابية كاذبة لنظام الكشف PCR القائم. - اختيار مستعمرة واحدة نقية وتحديد Cronobacter افتراضية باستخدام commer الكيمياء الحيويةاختبارات املالية مثل بطاقة الهوية VITEK 2 أو API 20E نظام تحديد الكيمياء الحيوية، وباتباع إرشادات الشركة المصنعة.
- خط 3 مم ملء غانة (10 ميكرولتر) من وسائل الإعلام تخصيب أساسي على لوحين من بريليانس الليستيريا أجار (BLA). احتضان لوحات في 36 ± 1 درجة مئوية لمدة 22-26 ساعة.
- بعد مرور فترة الحضانة، ودراسة لوحات لوجود المفترض L. المستوحدة (الأخضر والأزرق) المستعمرات. تحديد 5 الظني L. اللستيريا المستعمرات وثقافة فرعية لهم على BLA حتى الحصول على ثقافات نقية من معزولة / المستعمرات واحد. إعادة احتضان لوحات السلبية في 36 ± 1 درجة مئوية لمدة إضافية 22-26 ساعة.
- اختيار مستعمرة واحدة نقية وتحديد المفترض L. اللستيريا باستخدام الاختبارات البيوكيميائية التجارية مثل بطاقة الهوية VITEK 2 أو API الليستيريا نظام تحديد الكيمياء الحيوية، وبعد ط الشركة المصنعةnstructions.
Representative Results
تم معايرة هذا البروتوكول الأول على مجموعة من الذباب منزل تربى المختبر التي تم تغذيتها بشكل تجريبي لمدة 24 ساعة مع الغذاء السائل ذبابة (2٪ مسحوق الحليب) التي تحتوي على التخفيفات التسلسلية (10 فبراير - 10 أغسطس كفو / مل) من C. الساكازاكية، S. الملهبة، L. اللستيريا، أو C. الصائمية (ن = 21 لكل ممرض بكتيري). تم تعديل وسائل الإعلام التخصيب وكذلك حضانة مرات ودرجات الحرارة لكل الممرض المنقولة بالأغذية حتى كان النظام القائم على PCR-قادرة على الكشف عن أدنى مستويات البكتيريا (10 2 كفو / مل) من سطح الجسم والقناة الهضمية لواحد تغذية تجريبيا يطير. استخدام وسائل الإعلام التخصيب والشروط الموضحة في قسم البروتوكول، الكشف عن نظام يقوم PCR-C. الساكازاكية، S. الملهبة، وL. اللستيريا من سطح الجسم بنسبة 100٪ من الذباب يتغذى مع البكتيرية قائح> 10 3 كفو / مل (الشكل 1A). عندما تم تغذية الذباب مع 102 كفو / مل، والنسبة المئوية للكشف عن C. الساكازاكية، S. الملهبة، وL. وكانت المستوحدة من سطح الجسم 100٪، 66٪، و 33٪ على التوالي (الشكل 1A). الكشف عن نظام يقوم PCR-أيضا هذه مسببات الأمراض المنقولة عن طريق الأغذية ثلاثة من القناة الهضمية لتغذية الذباب مع جميع التركيزات البكتيرية في النسب المئوية ≥33٪ (الشكل 1B). ومع ذلك، فإن الكشف عن C. وقد تحقق الصائمية فقط عندما تم تغذية الذباب تربى مختبر تجريبي مع المواد الغذائية السائلة التي تحتوي على أعلى اللقاح البكتيري (10 8 كفو / مل). وبالتالي، C. تم استبعاد الصائمية من مجموعة من مسببات الأمراض المنقولة عن طريق الأغذية التي يمكن اختبارها من القذارة synanthropic الفردية الذباب باستخدام هذا النظام القائم على الكشف PCR.
مع هذا بروتوكول موحد، كنا قادرين على تحديد مدى انتشار Cronobacter النيابة.، S. الملهبة، وL. اللستيريا من سطح الجسم و / أو عشرالبريد القناة الهضمية من 100 الذباب البرية التي كانت بشكل فردي وجو معقم و مطهر اشتعلت من منطقة القمامة من عشرة مطاعم حضرية تقع في منطقة العاصمة واشنطن، DC كانت 5 الذباب القذارة التي يتم جمعها ممثل لا يقل عن ستة أنواع بما في ذلك M. DOMESTICA (47٪)، الخشف النحاسي (33٪)، L. القزي (14٪)، المتحلزة macellaria (2٪)، المستلحمة الباسوري (2٪)، وOphyra leucostoma (1٪). وقد تم تحديد واحد فقط لذبابة مستوى الأسرة (ذباب الأزهار، 1٪). كان بروتوكول سطح تطهير فعال في تجنب التلوث المتبادل بين أجزاء الجسم من ذبابة لوحظ أي نمو البكتيريا على لوحات TSA للمياه من التطهير الماضي شطف كل ذبابة الفردية. وهكذا، يمكن التمييز بين البكتيريا تنتقل عن طريق الأغذية الحالية على أجزاء الجسم من كل الطاير.
تم الكشف عن أي ايجابيات كاذبة من عينات من سطح الجسم والقناة الهضمية لالذباب الفردية عند استخدام هذا النظام التجاري القائم PCR-للكشف عن S. الملهبة وL. الليستريا، وتأكيدا لمسببات الأمراض القابلة للحياة على لوحات أجار كانت في اتفاق مع النتائج PCR إيجابية. ومع ذلك، لم يكن من الممكن لعزل ثقافات نقية من Cronobacter النيابة. من جميع العينات PCR إيجابية. وبالتالي، فإن الكشف عن هذا الممرض من قبل PCR المستندة إلى أظهر نظام ايجابيات كاذبة من سطح الجسم (50٪، 9/18) والقناة الهضمية (48٪، 16/33) من الذباب البرية اشتعلت واحدة. وأكدت عينات-PCR سلبي اختيارها عشوائيا التي كانت مطلية على وسائل الإعلام الخاصة، وعدم وجود مسببات الأمراض المنقولة بالغذاء. ولذلك، تم الكشف عن أي السلبيات كاذبة من أي من العينات عند استخدام هذا النظام القائم على PCR التجاري للكشف عن Cronobacter النيابة.، S. الملهبة، أو L. الليستريا.
إلا اعتبرت تلك العينات PCR إيجابية حيث تم عزل العامل الممرض وأكد إيجابيوتضمن للتحليل الإحصائي. ان وجود العام لمسببات الأمراض المنقولة عن طريق الأغذية في القناة الهضمية من الذباب القذارة البرية اشتعلت أعلى بكثير من على سطح الجسم (χ 2 = 6.8772، DF = 1، ص = 0.0087). وكانت 22٪ من القنوات الهضمية و 8٪ من سطح الجسم من الذباب البرية التي تم جمعها إيجابية واحدة على الأقل من مسببات الأمراض المنقولة عن طريق الأغذية الثلاثة (الشكل 2). وعموما، فإن انتشار Cronobacter النيابة. إما على أسطح الجسم أو القنوات الهضمية لالذباب التي تم جمعها كانت أعلى إحصائيا (19٪، فيشر الدقيق اختبار ع = 0.0165) من انتشار S. الملهبة لل(7٪) والمستوحدة L. (4٪). ومع ذلك، لم يلاحظ أي فروق ذات دلالة إحصائية عند إجراء مقارنات البشرى بين أجزاء الجسم من الذباب لكل ممرض بكتيري (الشكل 3؛ فيشر الدقيق اختبار ص = 0،1464، ص = 0.1184، و p = 0.6212 لCronobacterالنيابة.، S. الملهبة، وL. اللستيريا، على التوالي). ولم يكن أي من الذباب إيجابية لجميع مسببات الأمراض الثلاثة تقييمها. ومع ذلك، وثلاثة من الذباب (اثنان L. النحاسي واحدة L. القزي) قامت السالمونيلا. وL. المستوحدة على السطح أو في القناة الهضمية.
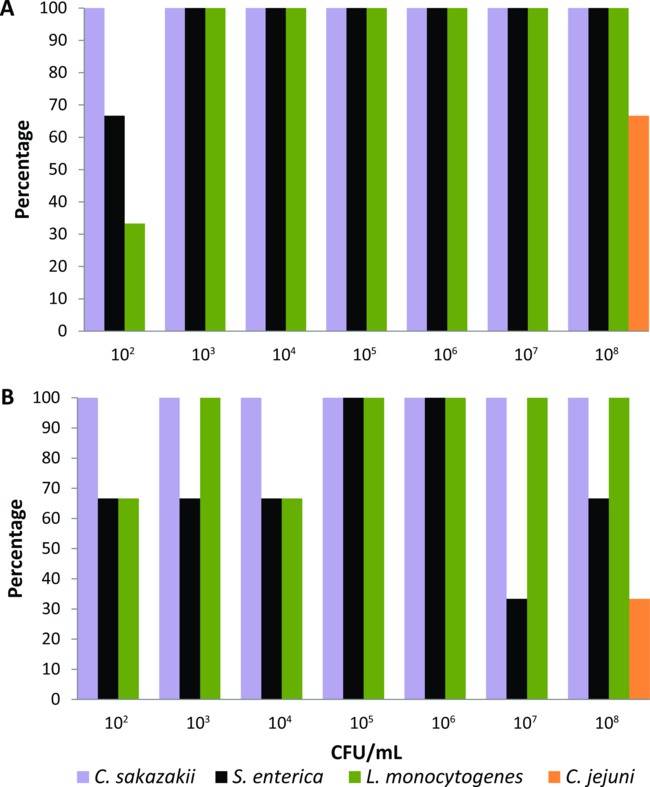
الشكل 1. مستويات الكشف عن الساكازاكية Cronobacter، السالمونيلا الملهبة، Listeria monocytogenes، كما العطيفة الصائمية من (A) على سطح الجسم و(B) القناة الهضمية لالفردية الذباب منزل تربى مختبر تتغذى على المواد الغذائية السائلة التي تحتوي على قائح البكتيرية المختلفة (ن = 21 لكل ممرض بكتيري، ن = 3 في كل تركيز البكتيريا).
الشكل 2. النسبة المئوية للسطوح الجسم والقنوات الهضمية لالذباب الفردية وجدت إيجابية لأي من مسببات الأمراض المنقولة بالأغذية الهدف.

الشكل 3. انتشار Cronobacter النيابة.، السالمونيلا الملهبة، والليستريا المستوحدة من سطح الجسم والقناة الهضمية من الذباب البرية اشتعلت synanthropic. القيم ص المبلغ عنها من مقارنات البشرى بين سطح الجسم والقناة الهضمية لكل ممرض بكتيري (اختبار فيشر الدقيق، قيمة P <0.05 يدل دلالة إحصائية). حقوق التأليف والنشر © جمعية الأمريكية لعلم الأحياء الدقيقة، مجلة علم الأحياء الدقيقة التطبيقية والبيئة 78 (22): 7891-902، 2012. دوى: 10.1128 / AEM.02195-12.
Discussion
الدراسات السابقة التي الكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من الحشرات البرية قد استخدمت مجموعة كبيرة ومتنوعة من البروتوكولات التي قد لا تتضمن المعلومات اللازمة لتقييم دقيق للمخاطر المرتبطة بالأغذية وجود ذبابة واحدة في الأطعمة أو البيئات ذات الصلة بالأغذية 13،15، 23،24. هنا، أثبتنا أن استخدام هذا بروتوكول موحد، فمن الممكن لكشف وعزل Cronobacter النيابة.، S. الملهبة، وL. المستوحدة من سطح الجسم والقناة الهضمية لذبابة واحدة اشتعلت في البرية. لأن الحشرات قد تحمل أرقام منخفضة من مسببات المرض تنتقل عن طريق الأغذية المستهدفة وأعداد كبيرة من الجراثيم الأخرى الأصلية 25،26، يتطلب هذا البروتوكول تخصيب الابتدائي (والثانوي في بعض الأحيان) من العينات في وسائل الإعلام ثقافة محددة لزيادة حساسية الكشف عن مسببات الأمراض المنقولة بالأغذية الهدف . وقد تم الحصول على النتائج من نظام الكشف القائم على PCR غضون ما يقرب من 30 ساعة (لDETEction من Cronobacter النيابة. وS. الملهبة) و 48 ساعة (للكشف عن المستوحدة L.) بعد تجهيز البداية العينات. وهكذا، وهذا البروتوكول هو موثوق بها وكذلك السريع وحساسة بما يكفي للكشف ذبابة واحدة لوجود مسببات الأمراض المنقولة بالغذاء.
تأكيد النتائج PCR-الإيجابية وعزل البكتيريا قابلة للحياة هو جزء من إجراءات التشغيل القياسية من العديد من المختبرات. وبالإضافة إلى ذلك، لأغراض علم الأوبئة، ومطلوبة الثقافات البكتيرية نقية من عينات PCR إيجابية لزيادة تأكيد والنمط المصلي الممرض المنقولة عن طريق الأغذية باستخدام الكيمياء الحيوية، والمناعية، أو أساليب الوراثية. وعلى الرغم من عدم ملاحظة أي ايجابيات كاذبة عندما كشف S. الملهبة وL. اللستيريا من أجزاء الجسم من الذباب البرية اشتعلت واحدة، وذلك باستخدام هذا البروتوكول، وجدنا ما يصل إلى معدل 50٪ من ايجابيات كاذبة لCronobacter النيابة. وهذا يوحي بأن نظام الكشف القائم على PCR لCronobact جنسإيه قد تعبر تتفاعل مع غيرها من البكتيريا المعوية موجودة بين الجراثيم معقدة للغاية التي يحملها الذباب. وهكذا، والعزلة وتنقية مستعمرات نقية من Cronobacter جنس من عينات PCR إيجابية تتطلب الطلاء أكثر انتقائية من مسببات الأمراض الأخرى تقييمها.
وقد تم في المقام الأول موحدة هذا البروتوكول لفحص الذباب اشتعلت البرية الفردية لوجود Cronobacter النيابة.، S. الملهبة، وL. اللستيريا باستخدام نظام كشف التجاري القائم PCR. ومع ذلك، تم أيضا تكييفها هذا البروتوكول بسهولة لفحص أجزاء الجسم من الذباب واحدة لوجود مسببات الأمراض المنقولة عن طريق الأغذية الأخرى مثل كولاي O157 enterohemorrhagic: H7 (باستخدام إما كولاي O157: H7 MP عدة معايير الفحص أو E. القولونية O157: H7 في الوقت الحقيقي طقم الفحص) وE.-شيجا مولد للذيفان القولونية (STEC) مجموعة (باستخدام الوقت الحقيقي STEC جناح)، والحصول على الحساسيات> 80٪ (إلغاء النشرالبيانات إد). أيضا، يمكن أن يحتمل هذا البروتوكول تكييفها للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من الحشرات الأخرى التي هي معروفة الناقلة للأمراض (الصراصير والنمل)، ولكن هناك حاجة إلى مزيد من الأبحاث في هذا المجال.
المنقولة عن طريق الأغذية التحقيقات اندلاع المرض هي ديناميكية للغاية وتشمل عملية متعددة الخطوات التي قد تختلف وفقا لحالة معينة والبيئة المحلية يجري التحقيق 12،27. هذه التحقيقات هي مهمة لأنها توفر حماية الصحة العامة الفورية عن طريق منع الأمراض المستقبلية. بالإضافة إلى ذلك، يمكن لهذه التحقيقات توضيح الآليات الجديدة التي تنتشر الكائنات الدقيقة التي تنقلها الأغذية، ويثير تساؤلات الهامة التي تؤدي إلى مجالات جديدة للبحث 28. أساليب التحري وكذلك بروتوكولات موحدة وسريعة، وحساسة ضرورية للكشف عن مسببات الأمراض المنقولة عن طريق الأغذية من الحشرات الفردية. يفتح هذا بروتوكول موحد الفرصة لجمع جو معقم و مطهر الحشرات مثل الذباب، ثhich يمكن أن ناقلات الممرض البكتيرية المنقولة عن طريق الأغذية، وذلك كجزء من برنامج أخذ العينات البيئية. إن المعلومات الوبائية التي يمكن الحصول عليها من هذا أن تكون ذات فائدة في بناء صورة دقيقة لآليات انتقال مسببات الأمراض المنقولة عن طريق الأغذية عن طريق الحشرات (أي طول وقت التعرض: ذبابة من قبل الهبوط مقابل الذباب الهبوط، التغوط، والتقيؤ).
وأخيرا، على الرغم من أن نظام الكشف التجاري القائم PCR-الموصوفة هنا هو عملي الاستخدام ويبسط PCR التضخيم والتصور من amplicon على مستوى جنس، فإنه ليست بأي حال النظام المناسب الوحيد. بدلا من ذلك يمكن أن تستخدم المحللة من عينات المخصب للكشف عن وجود مسببات الأمراض المنقولة عن طريق الأغذية باستخدام المتاحة علنا أزواج التمهيدي أنواع محددة. ومع ذلك، ينبغي أن يظهر حساسية الكشف قبل استخدامها.
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



