Introduction
Insecten spelen een belangrijke rol in de overdracht van voedselgerelateerde ziekten omdat ze ziektekiemen kunnen verspreiden naar voedsel of voedsel contactvlakken en gebruiksvoorwerpen 1. Onder insecten, vliegen, kakkerlakken, mieren en vertonen gedrag dat de verspreiding van pathogenen te bevorderen. Deze gedragingen omvatten een associatie met rottend materiaal, te weigeren en uitwerpselen, endophily (het invoeren van gebouwen), en synanthropy (samenwonend met mensen) 2. .. Door voedsel overgedragen pathogenen zoals Salmonella spp, Listeria monocytogenes, Campylobacter spp, Escherichia coli O157: H7 hebben, en de leden van het geslacht Cronobacter (voorheen Enterobacter sakazakii) gemeld door insecten 3-5 te verzenden. Synantrope vuiligheid vliegt mechanisch verspreid door voedsel overgedragen bacteriën door de overdracht van ziektekiemen uit hun besmette lichaam oppervlakken. Echter, de aanwezigheid van pathogenen in het spijsverteringskanaal van vliegen maximaal driemaalgroter dan waargenomen op de lichaamsoppervlakken (lichaam, hoofd, poten en vleugels) 5. Voedselpathogenen kan ook spijsverteringskanaal van de vlieg gedurende een grotere tijdsduur dan op het lichaamsoppervlak 6,7 en in sommige gevallen kunnen ze vermenigvuldigen, kolonisatie van de vlieg spijsverteringskanaal 4,8,9. Dit verhoogt de vector potentieel van vliegen omdat ze verder kunnen verspreiden pathogenen via de ontlasting en oprispingen 10,11.
Tegenwoordig zijn er betere surveillance systemen die in staat zijn om voedsel ziekte uitbraken sneller te detecteren zijn. Tijdens het uitvoeren van door voedsel overgedragen uitbraak onderzoeken, volksgezondheid ambtenaren op zoek naar het voedsel dat de bron (nen) of voertuig (en) van de infectie kunnen zijn. Onderzoekers kunnen ook een milieubeoordeling van de faciliteit (of faciliteiten) die betrokken zijn om uit te vinden hoe het eten was besmet te voeren en kunnen monsters te verzamelen als onderdeel van het onderzoek 12. Despite de enorme hoeveelheid wetenschappelijke literatuur over de insecten als dragers van pathogenen, het koppelen van insecten als vectoren van de ziekteverwekker die een bepaald voedsel ziekte-uitbraak is uitdagend. Dit komt vooral omdat de insecten worden niet aseptisch verzameld in het kader van milieu-sampling programma tijdens voedsel overgedragen uitbraak onderzoeken. Om insecten, met name degenen die gedragingen die de verspreiding van pathogenen gunst vertonen, als onderdeel van een milieu-sampling procedure, een gestandaardiseerde, snelle, gevoelige en betrouwbare protocol om pathogenen op te sporen van een enkele insect moet worden in de plaats te nemen.
Traditionele plating technieken voor de detectie van pathogenen van insecten omslachtig en afhankelijk van de concurrerende groei van de beoogde bacteriën in verschillende kweekmedia voor de snelle groei van de aangeboren commensale microbiota van het insect overwinnen. De meeste studies die insecten verbonden bacterial ziekteverwekkers hebben de gevoeligheid van de methode verhoogd door het bundelen van elkaar verschillende insecten in plaats van het identificeren van de aanwezigheid van ziekteverwekkers op een per individuele basis. Zo heeft deze studies geen onderscheid het lichaamsdeel van het insect waar de ziekteverwekkers werden gevonden 13-18. De mogelijkheid om te identificeren of pathogenen zich op het lichaamsoppervlak of het spijsverteringskanaal van een individuele insect is belangrijk omdat dit epidemiologische gevolgen kan hebben en kan leiden tot verschillende verweerstrategieën. Als mechanische vectoren, vliegen die grond voeding voor kort mag uitsluitend overdragen lage niveaus van bacteriën uit hun lichaamsoppervlak, terwijl die vliegen die braken en ontlasting van het levensmiddel verhogen de kans op overdracht van ziekteverwekkers potentieel hogere infectie. Daarom is het belangrijk om de prevalentie van een voedselpathogeen per individu insecten en het lichaamsdeel van deze insecten wanneer het bacteriële p differentiëren athogen ligt.
Ook al is het gebruik van de cultuur-onafhankelijke methoden om pathogenen op te sporen worden steeds vaker toegepast, ze zijn niet commercieel gebruikt om pathogenen op te sporen van een enkele insect. Momenteel zijn er gevalideerde moleculaire protocollen die in de handel verkrijgbaar voor de snelle detectie van pathogenen uit voedingsmiddelen die worden gebruikt door de industrie en de regelgevende agentschappen. Deze werkwijzen omvatten DNA gebaseerde systemen voor de detectie van pathogenen in een verscheidenheid van voedsel monsters. Hoewel moleculaire protocollen sneller dan traditionele plating werkwijzen wordt verrijking van het monster nog steeds vereist om de gevoeligheid van 2 10 kolonievormende eenheden (CFU) van de bacteriële pathogeen nodig polymerasekettingreactie (PCR) gebaseerde werkwijzen 19 bekomen. Bovendien wordt isolatie van zuivere bacteriële kolonies van PCR-positieve monsters nodig pathogeen adequate methoden bevestigen.
content "> Het doel van dit protocol is een commercieel beschikbare PCR-gebaseerde systeem om ziekteverwekkers uit voedsel en milieumonsters te detecteren voor het detecteren van voedsel- besmetting van het lichaamsoppervlak en het spijsverteringskanaal van een vlieg en verder isoleren die standaardiseren ziekteverwekkers uit de samples.The gevoeligheid van de hier beschreven protocol werd eerst gekalibreerd met-lab gekweekte volwassen huisvliegen (Musca domestica) die experimenteel werden gevoed met seriële verdunningen van elke bacteriële pathogenen. Het gestandaardiseerd protocol werd vervolgens gebruikt om de enquête 100 in het wild gevangen vliegt op de aanwezigheid van pathogenen uit hun lichaam oppervlakken en / of alimentary grachten. Dit gestandaardiseerd protocol zal toestaan laboratoria voor de volksgezondheid op gezondheidsbedreigingen als gevolg van insecten waar te nemen, waardoor de mogelijkheid om ze te verzamelen in het kader van de milieu-sampling programma bij het uitvoeren van voedselvergiftiging onderzoeken van uitbraken.Protocol
1. Het verzamelen van vliegen
- Verzamel individuele vliegen met behulp van steriele entomologische sweep netten. Doe de netten in een koeler en overbrengen naar het lab.
2. Dissectie van Flies
- Immobiliseer aseptisch verzameld vliegt door ze bij -20 ° C gedurende 5-7 min.
- Met steriele pincet plaats een vlieg in een steriele 2 ml buisje met 1 ml voorverwarmde (37 ° C) gebufferd peptonwater (BPW). Meng de buis voorzichtig door omkering gedurende 2 min. Het is essentieel dat het gehele lichaam van de vlieg in contact met het medium zodat de microbiota aanwezig op het lichaamsoppervlak (S) van de vlieg zal worden overgedragen aan de BPW (BPW-S). Label de buis met een nummer en lichaamsdeel van de vlieg (dwz, 1S).
OPMERKING: Zie Tabel van specifieke reagentia / Apparatuur voor een gedetailleerde beschrijving van de materialen en reagentia in dit protocol genoemd. - Met behulp van een steriel pincet verwijder de vlieg uit de BPW-S media en overdrachthet naar een lege en schone 2 ml buis aan de oppervlakte te desinfecteren de vlieg. Incubeer de buis met de BPW-S media bij 37 ° C tijdens het uitvoeren van de desinfectie en dissectie protocol.
- Oppervlakte-desinfecteren fly door onderdompeling in 1 ml 70% ethanol gedurende 1 minuut, gevolgd door een spoeling met steriel gedestilleerd water voordat dompelen in 1 ml vers bereid 0,05% (v / v) chloorbleekloog. Spoel 3 keer met steriel gedestilleerd water. Transfer water uit de laatste spoeling om een geautoclaveerd 2 ml buis.
LET OP: Gooi de vloeistof telkens met behulp van een 1.000 III micropipet of door het omkeren van de buis, zorg ervoor dat de vlieg blijft in de buis. Meng voorzichtig door inversie bij elke stap van de oppervlakte-desinfectie proces. - Om de effectiviteit van het desinfectieproces evalueren Breng 100 pi van het water van de laatste spoelgang van een trypticase soja agar (TSA) platen en verspreid met een steriele L-vormige disposable spreader. Incubeer de plaat bij 37 ° C gedurende 24 uur. Na incubation, registreert de aanwezigheid van een bacteriële kolonies.
OPMERKING: De aanwezigheid van bacteriële kolonies op de TSA platen geeft een inefficiënte oppervlakte-desinfectie proces. Als dit gebeurt, moet de aanwezigheid van pathogenen alleen worden gerapporteerd over het lichaamsoppervlak van de vlieg omdat kruisbesmetting tussen het lichaamsoppervlak en het spijsverteringskanaal niet kan worden uitgesloten.
- Oppervlakte-desinfecteren fly door onderdompeling in 1 ml 70% ethanol gedurende 1 minuut, gevolgd door een spoeling met steriel gedestilleerd water voordat dompelen in 1 ml vers bereid 0,05% (v / v) chloorbleekloog. Spoel 3 keer met steriel gedestilleerd water. Transfer water uit de laatste spoeling om een geautoclaveerd 2 ml buis.
- Na oppervlakte-desinfecteren van de vlieg, over te dragen aan een stuk geautoclaveerd papieren handdoek om het overtollige water en voer daarna naar een steriele 60 mm wegwerp petrischaal.
- Plaats de petrischaal onder een dissectie scope en identificeren van de vlieg aan de soort niveau met behulp van dichotome sleutels voor dipteran gezinnen 20,21.
- Met behulp van een autoclaaf fijne punt tang trek de anus en het hele spijsverteringskanaal (A) uit de vlieg en aseptisch overbrengen naar een andere steriele 2 ml buisje met 1 ml voorverwarmde (37 ° C) BPW met 0,5 mm zirconia / silica beads (BPW-A). Etiket the buis met hetzelfde nummer geselecteerd voor de individuele vlieg en het lichaamsdeel van de vlieg (dwz 1A).
- Meng de buis met de BPW-A grondig voor 5-10 min met behulp van een mobiele disruptor. Incubeer bij 36 ± 1 ° C tijdens het uitvoeren van de rest van het protocol.
- Om voucher en / of bewaar het model voor de lange termijn, leg de rest van de vlieg in een schone 2 ml buis en voeg 1-2 ml 95% ethanol.
3. Primaire en Secundaire Verrijking
- Labelen alle primaire en secundaire verrijking buisjes met media op basis van de steekproef aantal en het lichaamsdeel van de vlieg.
- Onder een steriele kap, overdragen 300 ul van BPW-S (oppervlak) tot 2 ml buisjes met de volgende media steriele:
- Voor Salmonella, gebruik 1 ml voorverwarmde (42 ° C) BPW. Incubeer in een recirculerende waterbad bij 42,5 ° C gedurende 22-24 uur. Voor het secundair verrijking, overdracht 100 ul van verrijkt BPW tot 400 & #181, l voorverwarmde (37 ° C) brain hart infusie (BHI) eerder steriele cluster buisjes geplaatst. Incubeer bij 37 ° C gedurende 3 uur.
- Voor Cronobacter gebruik 1 ml voorverwarmde (37 ° C) BPW met novobiocine (10 mg / l; Wallace, M., persoonlijke communicatie). U kunt ook gebruik maken van 1 ml van de R & F Enterobacter sakazakii aanrijkingsbouillon met supplement (vancomycine en cefsulodin) als primaire verrijking. Incubeer bij 37 ° C gedurende 22 - 26 uur. Voor secundaire verrijking is, 100 gl verrijkt BPW met novobiocine 400 ul voorverwarmde (37 ° C) BHI bouillon eerder steriele cluster buisjes geplaatst. Incubeer bij 37 ° C gedurende 3 uur.
- Voor L. monocytogenes, gebruik 1 ml vers bereide RT 24 Listeria aanrijkingsbouillon (24 LEB) met selectieve supplement. Incubeer bij 37 ° C gedurende 44 ± 5 uur. Nr secundaire verrijking nodig voor de detectie van L. monocytogenes. Herhaal stap 3.2.1 - 3.2.3 met de buis gelabeld als BPW-A.
4. Voorbereiding van de PCR-gebaseerd systeem voor amplificatie en detectie van de Target Foodborne Pathogen
Stappen 4-8 gebruiken commerciële PCR cycler / detector systeem, een computer werkstation, en kant-en-klare kits voor het screenen op Salmonella (Salmonella 2 standaard assay kit), Cronobacter species (E. sakazakii standaard testkit) en Listeria monocytogenes (L. monocytogenes 24E testkit). Standaard assays PCR eindpunt detectie. Elk pakket bevat PCR-ready tabletten met een intercalerende kleurstof die een fluorescentie signaal uitzendt wanneer binding aan dubbelstrengs DNA. Het wordt opgevangen tijdens de detectiefase van het PCR systeemprogramma, het genereren van een smeltcurve die wordt geïnterpreteerd door de software als positief of negatief.
- Bereid reagentia en apparatuur zoals gespecificeerd door de manufacturer's protocol per elke doelgroep door voedsel overgedragen pathogeen.
OPMERKING: De protocollen voor het opsporen van Salmonella en Cronobacter vereisen een one-step lysisprocedure terwijl het protocol voor het opsporen van L. monocytogenes vereist een twee-staps lysis procedure (zie rubrieken 5 en 6, respectievelijk). - Zet de automatische verwarming blok van het specifiek programma te selecteren voor de doelpathogeen. Als alternatief, als de verwarming blokken zijn handleiding, ingesteld temperaturen tot 37 ° C (voor Salmonella, Cronobacter spp, en L. monocytogenes.) Of tot 55 ± 2 ° C (voor L. monocytogenes deel 2 van lysis - zie stap 6.2) en 95 ± 3 ° C.
- Zorg ervoor dat de koelblokken zijn gekoeld O / N, anderszins chill bij 2 - 8 ° C gedurende ten minste 2 uur.
- De software van de PCR gebaseerde detectie systeem, maakt een rek bestand volgens de instructies van de fabrikant.
- Labelen en schik clusterbuisjes die de lysis reagens in het rek volgens het rek bestand.
- Initialiseer de PCR gebaseerde detectie systeem instrument.
5. Voer Lysis voor het aantonen van Salmonella en Cronobacter
- Bereid de lysis reagens door toevoeging van 150 pl van protease een 12 ml flesje lysis buffer.
- Breng 200 pi van lysis reagens aan elk van de eerder gemerkte cluster buizen.
OPMERKING: Cluster buisjes die de lysis reagens kan worden bewaard bij 2 - 8 ° C gedurende maximaal 2 weken. - Met behulp van lange pipet tips, overdracht 20 ul van secundaire verrijkte monsters (zie stappen 3.2.1 en 3.2.2) met overeenkomstige cluster buisjes met 200 ul van lysis reagens. Gebruik nieuwe pipet tips voor elk monster.
OPMERKING: Houd de buizen van primaire en secundaire verrijking in de koelkast (Salmonella) of bij RT (Cronobacter) voor verdere bevestiging analyse van PCR-positieve / negatieve monsters. Bereid negatieve controles door toevoeging van 20 pi steriel BHI media cluster buisjes die 200 ul lysis reagens. - Maak positieve controles door toevoeging van 20 ui O / N bacteriële kweken (gekweekt in BHI) volgens bekende Salmonella of Cronobacter stam cluster buisjes die 200 ul lysis reagens.
- Cap cluster buizen en zet stevig met behulp van de aftopping tool.
- Plaats het rooster van cluster buizen in de geautomatiseerde verwarming blok na het specifiek programma te selecteren voor de doelpathogeen. Alternatief incubeer cluster buizen bij 37 ± 2 ° C gedurende 20 minuten, gevolgd door incubatie bij 95 ± 3 ° C gedurende 10 min. Breng tenslotte de cluster buizen koelblokken (2 - 8 ° C) gedurende 5 min.
OPMERKING: Cluster buisjes die het lysaat kan worden opgeslagen bij -20 ° C gedurende maximaal 2 weken.
6. Voer Lysis voor de detectie van L. monocytogenes
- Voeren deel één vanlysis als volgt:
- Voeg 1,8 ml steriel gedeïoniseerd water aan de fles volledig ontdooid lyseermiddel 1.
OPMERKING: Bewaren lyseermiddel 1 bij 2 - 8 ° C tot gebruik. Na het openen en verdunnen bewaren bij kamertemperatuur (20 - 30 ° C) gedurende 6 maanden. - Combineer lyserende middelen 1 en 2 in een 4: 1 verhouding (40 pl verdund lyseermiddel 1 en 10 ui lyseermiddel 2 per elk monster). Breng 50 pl van de gecombineerde lyserende middelen buizen cluster. Gebruik het mengsel binnen 4 uur.
- Voeg 500 ul van primair verrijkte monster (stap 3.2.3) aan de cluster buis met 50 pl van de gecombineerde lyserende middelen.
- Bereid een negatieve controle door toevoeging van 500 pi steriel 24 LEB 50 gl van de gecombineerde lyserende middelen.
- Bereid een positieve controle toevoeging van 500 pl O / N L. monocytogenes-kweek 24 LEB 50 gl van de gecombineerde lyserende middelen.
- Cap het cluster buizen, meng voorzichtig en plaatsin verwarmingsblok bij 37 ± 1 ° C gedurende 30 min.
OPMERKING: Houd de buizen van de primaire verrijking in de koelkast voor een verdere bevestiging analyse van PCR-positieve / negatieve monsters.
- Voeg 1,8 ml steriel gedeïoniseerd water aan de fles volledig ontdooid lyseermiddel 1.
- Voeren deel 2 van lysis als volgt:
- Bereid de lysis reagens volgens de instructies in de stappen 5.1 en 5.2.
- Met behulp van lange pipetuiteinden overdracht 20 ul van deel één lysate om cluster buisjes met 200 ul van lysis reagens. Gebruik nieuwe pipet tips voor elk monster.
- Cap cluster buizen en zet stevig met behulp van de aftopping tool.
- Plaats cluster buizen in geautomatiseerde blokverwarming het specifiek programma voor L. selecteren monocytogenes. Alternatief incubeer cluster buizen bij 55 ± 2 ° C gedurende 30 minuten, gevolgd door incubatie bij 95 ± 3 ° C gedurende 10 min. Breng tenslotte de cluster buizen koelblokken (2 - 8 ° C) gedurende 5 min.
OPMERKING: Cluster buisjes die het lysaat kan worden opgeslagen bij -20 ° C gedurende maximaal 2 weken.
7. Hydrate PCR-Ready Tabletten
- Selecteer een gekoelde (4 ° C) PCR koelblok en plaats een PCR-buis rooster op het inzetstuk.
- Plaats overeenkomstige PCR buisjes die de PCR-klaar tabletten (bij elke kit) voor het doel voedselpathogeen in de houder volgens de rek bestand.
- Met behulp van de decapping gereedschap, zorgvuldig de doppen van PCR-buisjes te verwijderen. Gooi de doppen en controleer dat elke buis bevat een tablet.
- Pipetteer 50 ul (voor Salmonella en Cronobacter) of 30 ui (voor L. monocytogenes) lysaat specifieke PCR buizen. Gebruik nieuwe optische caps en zet stevig op de PCR-buizen met behulp van de aftopping tool.
OPMERKING: Na het toevoegen van het lysaat aan PCR-ready tabletten monsters moeten blijven gekoeld bij 2 - 8 ° C totdat in de PCR gebaseerde detectie systeem geladen. De PCR buizen kunnen bij 2500 xg gedurende enkele seconden gecentrifugeerd om te verzekeren dat het volledige volume in het onderste thij buis. - Laad de PCR-buisjes in de PCR cycler / detectiesysteem instrument door het openen van het instrument lade.
- Plaats het rooster van de PCR-buisjes in de putten in de lade en controleer of de buizen op hun plaats zitten.
- Sluit de lade en start het programma beschreven protocol van de fabrikant.
OPMERKING: De PCR-gebaseerde instrument fietsen parameters ingesteld voor elk voedsel overgedragen pathogenen. - Controleer of de PCR fietsen statusbalk verschijnt een blauwe balk die aangeeft dat de versterking deel van het programma wordt uitgevoerd.
OPMERKING: Voor standaard PCR-tests, de doorlooptijd van het volledige programma (amplificatie en detectie) duurt ongeveer 3-3,5 uur in beslag.
8. Beoordeling Resultaten
- Na verwerking is voltooid, volgt het scherm verschijnt de vraag van de PCR-gebaseerde systeem instrument om monsters en beoordeling resultaten te verwijderen.
- Als het doel voedselpathogeen aanwezig is in het monster (of deoppervlak of het spijsverteringskanaal van de vlieg) het goed is rood met een 'plus' teken (positief). Als de ziekteverwekker is afwezig, de put is groen met een 'min' teken (negatief).
- Als het goed is geel met een rode balk over het centrum, het geeft een signaal fout.
9. Isolatie van bacteriële pathogenen van PCR-positieve resultaten
- Selecteer buizen uit de primaire (voor L. monocytogenes) of secundaire (voor Salmonella en Cronobacter) verrijking van de monsters die PCR-positief waren. Ook selecteert willekeurig 3-5% van de monsters die PCR-negatief waren en ga als volgt:
- Voor Salmonella:
- Voeg 100 ul van de secundaire verrijking media om 10 ml van Rappaport-Vassiliadis (RV) medium en aan 1 ml tetrathionaat (TT) bouillon. Incubeer buizen bij 42,5 ° C in een recirculerende waterbad gedurende 22-24 uur.
- Na incubatie streak een 3 mm lusvol (10 pl) van elk, RV eend TT media op bismut sulfiet (BS) agar, xylose lysine desoxycholaat (XLD) agar, en Hektoen enterische (HE) agar. Incubeer de platen bij 35 ± 1 ° C gedurende 22-24 uur.
- Na incubatie onderzoeken platen voor de aanwezigheid van typische Salmonella kolonies op elk medium. Als er geen geïsoleerde kolonies kan worden verkregen na een aantal sub-kweken stappen, kunt u overwegen het monster als negatief en het verslag als een vals positief voor de PCR-gebaseerde systeem.
OPMERKING: Voor typische Salmonella kolonies op specifieke media zie 22. Selecteer vijf vermoedelijke typische Salmonella kolonies en subcultuur ze op BS, XLD, of HE tot zuivere kweken van geïsoleerde / single kolonies worden verkregen. - Selecteer een zuivere kolonie en identificeren vermoedelijke Salmonella met behulp van biochemische commerciële tests zoals de VITEK 2 identificatiekaart of API biochemische identificatie systeem, volgens de instructies van de fabrikant.
- Voor Cronobacter: <ol>
- Streak 3 mm lusvol (10 pl) van de secundaire verrijkingsmedia twee platen chromogene kweekmedia zoals R & F Enterobacter sakazakii (Cronobacter) chromogeen plating medium en / of ChromID sakazakii Agar. Incubeer de platen bij 35 ° C gedurende 22-24 uur.
- Na incubatie onderzoeken platen voor de aanwezigheid van typische kolonies Cronobacter (blauw-zwart naar blauw-grijs). Selecteer 5 vermoedelijke Cronobacter kolonies en subcultuur ze op R & F Enterobacter sakazakii (Cronobacter) chromogenic plating medium, ChromID sakazakii Agar, of TSA tot zuivere kweken van geïsoleerde / single kolonies worden verkregen.
OPMERKING: Als er geen geïsoleerde kolonies kan worden verkregen na een aantal sub-kweken stappen, kunt u overwegen het monster als negatief en het verslag als een vals positief voor de PCR-gebaseerde detectie systeem. - Selecteer een zuivere kolonie en identificeren vermoedelijke Cronobacter met behulp van biochemische Commerciële tests zoals de VITEK 2 identificatiekaart of API 20E biochemische identificatie systeem, volgens de instructies van de fabrikant.
- Streak 3 mm lusvol (10 pl) van de primaire verrijkingsmedia twee platen Schittering Listeria agar (BLA). Incubeer de platen bij 36 ± 1 ° C gedurende 22 - 26 uur.
- Na incubatie onderzoeken platen voor de aanwezigheid van vermoedelijke L. monocytogenes (blauw-groen) kolonies. Selecteer 5 vermoedelijke L. monocytogenes kolonies en subcultuur ze op BLA tot het verkrijgen van zuivere kweken van geïsoleerde / enkele kolonies. Opnieuw incubeer negatieve platen bij 36 ± 1 ° C gedurende nog 22 - 26 uur.
- Selecteer een zuivere kolonie en identificeren vermoedelijke L. monocytogenes met commerciële biochemische tests zoals de VITEK 2 identificatiekaart of API Listeria biochemisch identificatiesysteem, na i de fabrikantNSTRUCTIES.
Representative Results
Dit protocol werd eerst gekalibreerd op een set van-lab gekweekte huisvliegen die experimenteel werden gevoed gedurende 24 uur met vloeibare vlieg voedsel (2% melkpoeder) met seriële verdunningen (10 februari - 10 augustus CFU / ml) van C. sakazakii, S. enterica, L. monocytogenes of C. jejuni (n = 21 voor elke bacteriële pathogenen). Verrijking media en incubatietijden en temperaturen werden ingesteld voor elke voedselpathogeen totdat de PCR-systeem kon de laagste niveaus van bacteriën (10 2 CFU / ml) detecteren van het lichaamsoppervlak en het spijsverteringskanaal van een experimenteel toegevoerd vliegen. De verrijking media en omstandigheden in het protocol beschreven, de PCR-systeem gedetecteerde C. sakazakii, S. enterica en L. monocytogenes van het lichaamsoppervlak 100% van vliegen gevoed met bacteriële inocula> 10 3 CFU / ml (Figuur 1A). Wanneer vliegen werden gevoed met 102 CFU / ml, het percentage detectie van C. sakazakii, S. enterica en L. monocytogenes hun lichaamsoppervlak was 100%, 66% en 33%, respectievelijk (Figuur 1A). De PCR-gebaseerde systeem gedetecteerd ook deze drie pathogenen van het spijsverteringskanaal van vliegen gevoed met alle bacteriële concentraties op percentages ≥33% (Figuur 1B). De detectie van C. jejuni werd pas bereikt wanneer-lab gekweekte vliegen experimenteel werden gevoed met vloeibare levensmiddelen die de hoogste bacterieel inoculum (10 8 CFU / ml). Vandaar C. jejuni uitgesloten uit de groep van pathogenen die kunnen worden getest individuele synantrope vuil vliegt met deze PCR gebaseerde detectie systeem.
Met deze gestandaardiseerd protocol, waren we in staat om de prevalentie van Cronobacter spp bepalen., S. enterica, en L. monocytogenes van het lichaamsoppervlak en / of the spijsverteringskanaal van 100 wilde vliegen die individueel en aseptisch waren gevangen uit de vuilnisbak gebied van tien stedelijke restaurants gevestigd in het grootstedelijk gebied van Washington, DC 5 Verzamelde vuiligheid vliegen waren representatief voor ten minste zes soorten, waaronder M. domestica (47%), Lucilia cuprina (33%), L. sericata (14%), Cochliomyia macellaria (2%), Sarcophaga haemorrhoidalis (2%), en Ophyra leucostoma (1%). Een vlieg werd geïdentificeerd alleen aan familie-niveau (Anthomyiidae; 1%). De oppervlakte-desinfectie-protocol was effectief in het voorkomen van kruisbesmetting tussen de lichaamsdelen van de vlieg, omdat er geen bacteriële groei werd waargenomen op TSA-platen voor het water van de laatste ontsmetting spoeling van elke individuele fly. Aldus kan een onderscheid worden gemaakt tussen voedsel- besmetting aanwezig op de lichaamsdelen van elk fly.
Geen valse positieven gedetecteerd uit monsters van het lichaamsoppervlak en het spijsverteringskanaal vanafzonderlijke vliegen bij gebruik van deze commerciële PCR-gebaseerd systeem voor de detectie van S. enterica en L. monocytogenes, en de bevestiging van levensvatbare ziekteverwekkers op agarplaten was in overeenstemming met de PCR-positieve resultaten. Het was echter niet mogelijk om zuivere culturen van Cronobacter spp isoleren. van alle PCR-positieve monsters. Vandaar dat detectie van de pathogeen door het PCR-gebaseerde systeem toonde valse positieven van het lichaamsoppervlak (50%; 9/18) en het spijsverteringskanaal (48%; 16/33) van enkele in het wild gevangen vliegen. Willekeurig geselecteerde PCR-negatieve monsters die werden uitgeplaat op bepaalde media, bevestigde de afwezigheid van de voedselpathogenen. Daarom werden geen valse negatieven gedetecteerd elk van de monsters bij gebruik van deze commerciële PCR systeem Cronobacter spp detecteren., S. enterica of L. monocytogenes.
Alleen die PCR-positieve monsters waar de ziekteverwekker werd geïsoleerd en bevestigd werden als positief beschouwden inbegrepen voor statistische analyse. De totale aanwezigheid van pathogenen in het spijsverteringskanaal van in het wild gevangen vuiligheid vliegen was significant hoger dan op het lichaamsoppervlak (χ 2 = 6,8772, df = 1, p = 0,0087). 22% van het maag kanalen en 8% van de lichaamsoppervlakken van wild verzamelde vliegen waren positief voor tenminste één van de drie pathogenen (figuur 2). Kortom, de prevalentie van Cronobacter spp. op ofwel het lichaam oppervlakken of alimentary grachten van verzamelde vliegen was statistisch significant hoger (19%; Fisher's exact test p = 0,0165) dan de prevalentie van S. enterica (7%) en L. monocytogenes (4%). Er werden echter geen statistisch verschil waargenomen bij het uitvoeren van paarsgewijze vergelijkingen tussen de lichaamsdelen van de vliegen per bacteriële pathogenen (Figuur 3; Fisher's exact test p = 0,1464, p = 0,1184 en p = 0,6212 voor Cronobacterspp., S. enterica en L. monocytogenes, respectievelijk). Geen van de vliegen waren positief voor alle drie pathogenen geëvalueerd. Drie van de vliegen (twee L. cuprina en één L. sericata) uitgevoerd Salmonella spp. en L. monocytogenes op het oppervlak of in het spijsverteringskanaal.
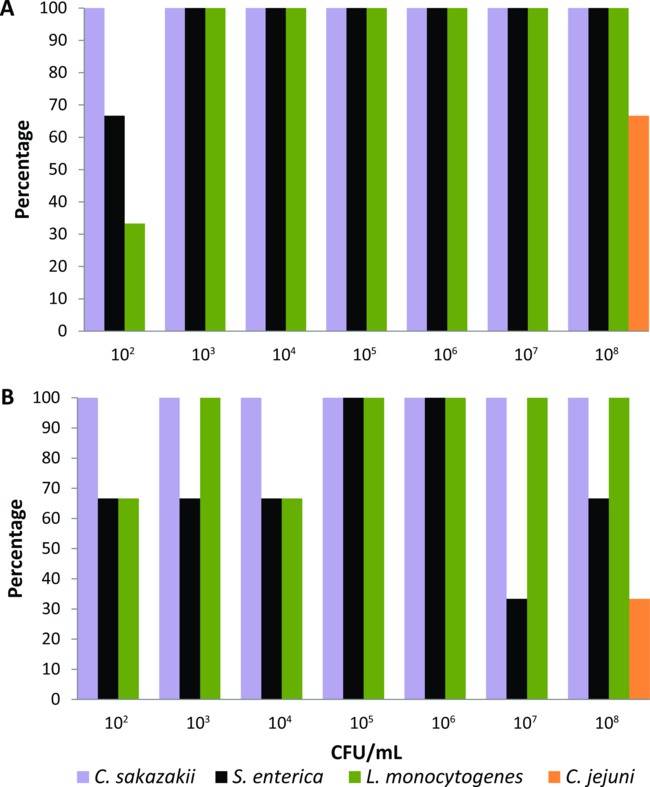
Figuur 1. Detectie niveaus van Cronobacter sakazakii, Salmonella enterica, Listeria monocytogenes en Campylobacter jejuni van (A) het lichaamsoppervlak en (B) het spijsverteringskanaal van de individuele-lab gekweekte huisvliegen gevoed met vloeibare levensmiddelen die verschillende bacteriële inocula (n = 21 voor elke bacteriële pathogenen, n = 3 per elke bacteriële concentratie).
Figuur 2. Percentage lichaamsoppervlakken en alimentary kanalen van afzonderlijke vliegen positief voor een van de beoogde voedselpathogenen.

Figuur 3. Prevalentie van Cronobacter spp., Salmonella enterica, en Listeria monocytogenes uit het lichaamsoppervlak en het spijsverteringskanaal van synantrope wild gevangen vliegen. De p-waarden gerapporteerd zijn van paarsgewijze vergelijkingen tussen het lichaamsoppervlak en het spijsverteringskanaal voor elke bacteriële pathogenen (Fisher's exact test, p-waarde <0,05 duidt statistische significantie). Copyright © American Society for Microbiology, Journal of Applied and Environmental Microbiology 78 (22): 7891-902 2012. doi: 10,1128 / AEM.02195-12.
Discussion
Eerdere studies die pathogenen van vrij insecten heeft mogelijk een grote verscheidenheid aan protocollen die de noodzakelijke informatie kan bevatten om de voedingsgerelateerde risico van de aanwezigheid van een vlieg in voedingsmiddelen of voedsel gerelateerde omgevingen 13,15 nauwkeurig te beoordelen gebruikt, 23,24. Hier toonden we aan dat het gebruik van deze gestandaardiseerde protocol, is het mogelijk te detecteren en isoleren Cronobacter spp., S. enterica en L. monocytogenes van het lichaamsoppervlak en het spijsverteringskanaal van enkele vliegen in het wild gevangen. Omdat insecten lage aantallen van de doelgroep door voedsel overgedragen pathogeen en hoge aantallen van andere inheemse microbiota 25,26 kan uitvoeren, dit protocol vereist primaire (en soms secundaire) verrijking van de monsters in een specifieke cultuur media om de gevoeligheid van de detectie van de doelgroep door voedsel overgedragen pathogeen verhogen . De resultaten van de PCR-gebaseerde detectie systeem werden verkregen binnen ongeveer 30 uur (voor de detectie van Cronobacter spp. en S. enterica) en 48 uur (voor de detectie van L. monocytogenes) na aanvankelijk behandelen van monsters. Dus dit protocol betrouwbaar en snel en gevoelig genoeg om een vlieg voor de aanwezigheid van voedselpathogenen screenen.
Bevestiging van PCR-positieve resultaten en isolatie van levensvatbare bacteriën behoort tot de standaard werkwijze van veel laboratoria. Bovendien, voor epidemiologie doeleinden zuivere bacterieculturen van PCR-positieve monsters is noodzakelijk om te bevestigen en het serotype voedselpathogeen met biochemische, immunologische of genetische methoden. Hoewel er geen false positives werden waargenomen bij het detecteren van S. enterica en L. monocytogenes uit de lichaamsdelen van enkele in het wild gevangen vliegen, met behulp van dit protocol, vonden we tot een aantal valse meldingen voor Cronobacter spp 50%. Dit suggereert dat de PCR-detectiesysteem voor het genus Cronobacter kunnen kruisreageren met andere Enterobacteriaceae aanwezig onder de zeer complexe microbiota door vliegen uitgevoerd. Aldus, isolatie en zuivering van zuivere kolonies van het genus Cronobacter van PCR-positieve monsters vereisen meer selectief plateren dan de andere pathogenen geëvalueerd.
Dit protocol is voornamelijk gestandaardiseerd op individuele wild gevangen vliegen screenen op de aanwezigheid van Cronobacter spp., S. enterica en L. monocytogenes met een commercieel PCR gebaseerde detectie systeem. Echter, dit protocol ook gemakkelijk aangepast lichaamsdelen single vliegen screenen op de aanwezigheid van andere pathogenen zoals enterohemorragische E. coli O157: H7 (via de E. coli O157: H7 MP standaard testkit of E. coli O157: H7 real-time testkit) en de shiga-toxigene E. coli (STEC) groep (met de real-time STEC suite), het verkrijgen van gevoeligheden> 80% (unpublished data). Ook kan dit protocol mogelijk worden aangepast aan pathogenen te detecteren van andere insecten die bekend zijn vectoren van ziekten (kakkerlakken en mieren), maar meer onderzoek op dit gebied is nodig.
Voedsel ziekte uitbraak onderzoeken zijn zeer dynamisch en bestaan uit een multi-step proces dat kan variëren naar gelang de specifieke situatie en de lokale omgeving wordt onderzocht 12,27. Deze onderzoeken zijn belangrijk omdat ze zorgen voor onmiddellijke bescherming van de volksgezondheid door het voorkomen van toekomstige ziekten. Bovendien kunnen deze onderzoeken nieuwe mechanismen waarmee voedsel overgedragen micro-organismen worden verspreid toe te lichten, en belangrijke vragen die leiden tot nieuwe gebieden voor onderzoek 28 te verhogen. Opsporingstechnieken evenals gestandaardiseerde, snelle en gevoelige protocollen zijn nodig voor de detectie van pathogenen uit individuele insecten. Dit gestandaardiseerd protocol opent de mogelijkheid om aseptisch insecten zoals vliegen verzamelen, which kan de voedselinfectie bacteriële pathogeen vector, als onderdeel van een milieu-sampling programma. De epidemiologische informatie die kan worden opgedaan met deze van toepassing zou zijn bij het construeren van een nauwkeurig beeld van de mechanismen van overdracht van pathogenen door insecten (dat wil zeggen, de duur van de blootstelling tijd: een vlieg door de aanvoer versus vliegen landing, poepen, en herkauwen).
Tenslotte, hoewel de commerciële PCR gebaseerde detectie systeem beschreven is praktisch in gebruik en vereenvoudigt PCR amplificatie en visualisatie van een genus-niveau amplicon is niet het enige geschikte systeem. Het lysaat van verrijkte monsters kunnen ook worden gebruikt om te screenen op de aanwezigheid van pathogenen door publiekelijk beschikbaar species-specifieke primerparen. Toch moet detectiegevoeligheid voorafgaand aan het gebruik worden aangetoond.
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



