Introduction
Insectes jouent un rôle important dans la transmission des maladies liées à l'alimentation, car ils peuvent répandre des agents pathogènes sur les surfaces et ustensiles alimentaires ou 1 contact avec les aliments. Chez les insectes, mouches, cafards, fourmis et présentent des comportements qui favorisent la propagation des agents pathogènes d'origine alimentaire. Ces comportements incluent une association avec la matière en décomposition, de refuser et les fèces, (bâtiments entrant) endophilie et synanthropy (cohabitation avec les humains) 2. .. pathogènes d'origine alimentaire tels que Salmonella spp, Listeria monocytogenes, Campylobacter spp, Escherichia de coli O157: H7, et les membres du genre Cronobacter (anciennement Enterobacter sakazakii) ont été signalés à être transmise par des insectes 3-5. Crasse synanthropique mouches propage mécaniquement bactéries pathogènes d'origine alimentaire par le transfert de leurs surfaces corporelles contaminées. Cependant, la présence d'agents pathogènes d'origine alimentaire dans le canal alimentaire des mouches peut être jusqu'à trois foissupérieure à celle observée sur les surfaces du corps (corps, tête, pattes, ailes et 5). les agents pathogènes d'origine alimentaire peuvent également rester dans le tube digestif de la mouche pendant une période de temps plus grande que sur la surface du corps 6,7 et, dans certains cas, ils sont capables de se multiplier, à coloniser des voies digestives 4,8,9 de la mouche. Cela augmente le potentiel vecteur de mouches parce qu'ils ne peuvent plus se propager pathogènes d'origine alimentaire grâce à la défécation et la régurgitation 10,11.
Aujourd'hui, il ya l'amélioration des systèmes de surveillance qui sont en mesure de détecter les éclosions de maladies d'origine alimentaire plus rapidement. Lors de l'exécution des enquêtes épidémiologiques origine alimentaire, les responsables de la santé publique cherchent la nourriture qui peut être la source (s) ou de véhicule (s) de l'infection. Les enquêteurs peuvent également effectuer une évaluation environnementale de l'installation (ou des installations) impliqués pour savoir comment la nourriture était contaminée et peut prélever des échantillons dans le cadre de l'enquête 12. Despite la grande quantité de la littérature scientifique concernant les insectes comme porteurs de pathogènes d'origine alimentaire, reliant les insectes vecteurs de l'agent pathogène à l'origine d'une éclosion de maladie d'origine alimentaire particulier a été difficile. Ce est principalement parce que les insectes ne sont pas prélevés de façon aseptique dans le cadre de programmes d'échantillonnage de l'environnement au cours des enquêtes sur les éclosions d'origine alimentaire. Pour inclure les insectes, en particulier ceux qui présentent des comportements qui favorisent la propagation des agents pathogènes d'origine alimentaire, dans le cadre d'une procédure d'échantillonnage de l'environnement, un protocole standardisé, rapide, sensible et fiable pour détecter les pathogènes d'origine alimentaire à partir d'un seul insecte doit être en place.
Techniques de placage traditionnelles pour la détection des pathogènes d'origine alimentaire des insectes sont laborieux et dépendent de la croissance compétitive des bactéries cibles dans différents milieux de culture pour surmonter la croissance rapide de la microflore commensale innée de l'insecte. La plupart des études qui ont associés insectes avec bacterial pathogènes ont augmenté la sensibilité de la méthode en regroupant plusieurs insectes plutôt que d'identifier la présence de pathogènes sur une base individuelle. Ainsi, ces études ne ont pas différencier la partie du corps de l'insecte où les agents pathogènes trouvés 13-18. La capacité de déterminer si des agents pathogènes d'origine alimentaire sont situés sur la surface du corps ou dans le tube digestif de l'insecte individuelle est important car cela peut avoir des implications épidémiologiques et peut conduire à différentes stratégies d'atténuation. Comme vecteurs mécaniques, mouches qui se posent sur la nourriture pour un court laps de temps ne peut transférer de faibles niveaux de bactéries de leur surface corporelle, que ces mouches qui régurgitent et déféquer sur la nourriture augmenter la probabilité de transfert de pathogènes à des niveaux potentiellement plus élevés d'infection. Par conséquent, il est important d'estimer la prévalence d'un agent pathogène d'origine alimentaire par un insecte particuliers et à différencier la partie du corps de cet insecte où le p bactérienne athogen est situé.
Même si l'utilisation de la culture indépendante des méthodes pour détecter des agents pathogènes d'origine alimentaire sont de plus en plus mis en œuvre, ils ne ont pas été utilisés dans le commerce pour détecter des agents pathogènes d'origine alimentaire à partir d'un seul insecte. Actuellement, il existe des protocoles validés moléculaires qui sont disponibles dans le commerce pour la détection rapide des agents pathogènes d'origine alimentaire dans les aliments qui sont utilisés par l'industrie et les organismes de réglementation. Ces méthodes comprennent les systèmes basés sur l'ADN pour la détection de pathogènes dans une variété d'échantillons d'aliments. Bien que les protocoles moléculaires sont plus rapides que les procédés de placage traditionnels, l'enrichissement de l'échantillon est toujours nécessaire pour obtenir le niveau de 10 2 unités formant des colonies (UFC) de l'agent pathogène bactérien nécessaires à la réaction en chaîne par polymérase (PCR) Méthodes-based 19 de sensibilité. En outre, l'isolement de colonies bactériennes pures à partir d'échantillons PCR-positives sont nécessaires pour confirmer l'agent pathogène en utilisant des méthodes appropriées.
contenu "> L'objectif de ce protocole est de normaliser un système basé sur la PCR disponible dans le commerce utilisé pour détecter des agents pathogènes à partir d'échantillons alimentaires et environnementaux pour la détection de bactéries d'origine alimentaire de la surface du corps et le tube digestif d'une seule mouche et d'isoler davantage ceux les agents pathogènes de la sensibilité samples.The du protocole décrit ici a d'abord été calibrés avec des mouches domestiques adultes en laboratoire élevés (Musca domestica) qui ont été expérimentalement nourris avec des dilutions successives de chaque bactérie pathogène. Le protocole standardisé a été ensuite utilisé pour sonder 100 capturés dans la nature mouches pour la présence d'agents pathogènes d'origine alimentaire de leurs surfaces de corps et / ou canaux alimentaires. Ce protocole standardisé permettra laboratoires de santé publique afin de détecter les menaces pour la santé posés par les insectes, permettant la possibilité de les collecter dans le cadre du programme d'échantillonnage environnemental lors de l'exécution d'origine alimentaire des enquêtes épidémiologiques.Protocol
1. Collection de mouches
- Recueillir mouches individuels en utilisant des filets de balayage entomologiques stériles. Mettre les filets dans une glacière et de les transférer au laboratoire.
2. Dissection of Flies
- Immobiliser mouches aseptique recueillies en les plaçant à -20 ° C pendant 5 à 7 min.
- En utilisant des pinces stériles lieu une mouche dans un tube de 2 ml stérile contenant 1 ml de pré-chauffé (37 ° C) de l'eau peptonée tamponnée (EPT). Mélanger doucement le tube par inversion pendant 2 min. Il est essentiel que l'ensemble du corps de la mouche être en contact avec le support de sorte que la microflore présente sur la surface du corps (S) de la mouche sera transférée à l'eau peptonée tamponnée (BPW-S). Etiqueter le tube avec un nombre et une partie du corps de la mouche (c.-à-1S).
NOTE: Se il vous plaît voir le tableau des réactifs spécifiques / équipement pour une description détaillée des matériaux et des réactifs mentionnés dans le présent protocole. - En utilisant des pinces stériles supprimer la volée par les médias et le transfert BPW-Sà un 2 ml tube vide et propre à la surface désinfecter la volée. Incuber le tube contenant le milieu BPW-S à 37 ° C tout en effectuant le protocole de désinfection et dissection.
- Surface-désinfecter la volée par immersion dans 1 ml d'éthanol à 70% pendant 1 min, suivie d'un rinçage avec de l'eau distillée stérile avant son immersion dans 1 ml fraîchement préparée de 0,05% (v / v) de solution de blanchiment. Rincez trois fois à l'eau distillée stérile. Transférer l'eau du dernier rinçage à un tube autoclave de 2 ml.
REMARQUE: Jeter le liquide à chaque fois à l'aide d'une micropipette 1000 pi ou en inversant le tube, en veillant à la volée reste à l'intérieur du tube. Mélanger doucement par inversion à chaque étape du processus de surface désinfection. - Pour évaluer l'efficacité du processus de désinfection, transférer 100 pi de l'eau du dernier rinçage à une plaque de gélose trypticase soja (TSA) et répandre avec une spatule jetable en forme de L-stérile. Incuber la plaque à 37 ° C pendant 24 heures. Après encubation, inscrivez-vous la présence de colonies bactériennes.
NOTE: La présence de colonies bactériennes sur les plaques de TSA indique un processus surface désinfection inefficace. Si cela se produit, la présence d'agents pathogènes d'origine alimentaire ne doit être rapporté à la surface du corps de la mouche parce contamination croisée entre la surface du corps et le tube digestif ne peut pas être exclue.
- Surface-désinfecter la volée par immersion dans 1 ml d'éthanol à 70% pendant 1 min, suivie d'un rinçage avec de l'eau distillée stérile avant son immersion dans 1 ml fraîchement préparée de 0,05% (v / v) de solution de blanchiment. Rincez trois fois à l'eau distillée stérile. Transférer l'eau du dernier rinçage à un tube autoclave de 2 ml.
- Après surface de désinfection à la volée, le transférer à un morceau de autoclave serviette en papier pour enlever l'excès d'eau et ensuite à un 60 mm boîte de Petri stérile à usage unique.
- Placez la boîte de Pétri sous un microscope à dissection et d'identifier la volée au niveau des espèces en utilisant clés dichotomiques pour les familles de diptères 20,21.
- En utilisant des pinces de pointe fine autoclave tirez doucement l'anus et l'ensemble tube digestif (A) sur la volée et de manière aseptique le transférer à un autre tube de 2 ml stérile contenant 1 ml de pré-chauffé (37 ° C) BPW avec 0,5 mm zircone / silice perles (BPW-A). e d'étiquetagee tube ayant le même nombre choisi pour la volée individu et la partie du corps de la volée (par exemple, 1A).
- Mélanger le tube contenant le BPW-A complètement pendant 5-10 min en utilisant un disrupteur de cellules. Incuber à 36 ± 1 ° C tout en effectuant le reste du protocole.
- Pour bon et / ou stocker l'échantillon pour le long terme, placer le reste de la mouche dans un tube de 2 ml propre et ajouter 1-2 ml d'éthanol à 95%.
3. Enrichissement primaire et secondaire
- Étiqueter tous les tubes d'enrichissement primaire et secondaire contenant un milieu en fonction du nombre d'échantillon et la partie du corps de la mouche.
- Sous une hotte stérile, transférer 300 pi de BPW-S (surface) pour stériles 2 ml tubes contenant les supports suivants:
- Pour Salmonella, utiliser 1 ml de pré-chauffé (42 ° C) BPW. Incuber dans un bain d'eau de recirculation à 42,5 ° C pendant 22-24 h. Pour l'enrichissement secondaire, transférer 100 pi de BPW enrichi à 400 & #181; l d'préchauffé (37 ° C) infusion de cerveau-coeur (BHI), précédemment mis dans des tubes stériles de cluster. Incuber à 37 ° C pendant 3 heures.
- Pour Cronobacter, utiliser 1 ml de pré-chauffé (37 ° C) BPW avec novobiocine (10 mg / L; Wallace, M., communication personnelle). Vous pouvez également utiliser 1 ml de la R & F bouillon d'enrichissement sakazakii Enterobacter avec supplément (vancomycine et cefsulodine) que l'enrichissement primaire. Incuber à 37 ° C pendant 22 à 26 h. Pour l'enrichissement secondaire, transférer 100 pi de BPW enrichi avec novobiocine à 400 pi de préchauffé (37 ° C) de bouillon BHI précédemment placés dans des tubes stériles de cluster. Incuber à 37 ° C pendant 3 heures.
- Pour L. monocytogenes, utilisent 1 ml de fraîchement préparé RT 24 Listeria bouillon d'enrichissement (24 LEB) avec supplément sélectif. Incuber à 37 ° C pendant 44 ± 5 heures. Aucun enrichissement secondaire est nécessaire pour la détection de L. monocytogenes. Répétez les étapes 3.2.1 - 3.2.3 ci-dessus en utilisant le tube étiqueté comme BPW-A.
4. Préparation du système de PCR-Based pour l'amplification et la détection de la cible pathogènes d'origine alimentaire
Les étapes 4-8 utilisent un système commercial PCR cycleur / détecteur, un poste de travail informatique, et des kits prêts à l'emploi pour le dépistage de Salmonella (salmonelle 2 kit de dosage standard), espèce Cronobacter (E. kit de dosage standard sakazakii), et Listeria monocytogenes (L. monocytogenes kit de dosage 24E). Dosages standard utilisent PCR détection du point final. Chaque kit contient comprimés PCR-prêts avec un colorant intercalant qui émet un signal de fluorescence lors de la liaison à l'ADN double brin. Le signal est capté pendant la phase de détection du système de programme PCR, la génération d'une courbe de fusion qui est interprété par le logiciel comme positif ou négatif.
- Préparer les réactifs et le matériel comme spécifié par le fabrile protocole de RER pour chaque agent pathogène cible d'origine alimentaire.
REMARQUE: Les protocoles de détection de Salmonella et Cronobacter nécessitent une procédure de lyse en une seule étape alors que le protocole pour la détection de L. monocytogenes nécessite une procédure de lyse en deux étapes (voir les sections 5 et 6, respectivement). - Tournez sur le bloc de chauffage automatisé sélectionnant le programme spécifique de l'agent pathogène cible. Alternativement, si les blocs de chauffage sont manuelles, régler les températures à 37 ° C (pour Salmonella, Cronobacter spp et Listeria monocytogenes.) Ou à 55 ± 2 ° C (par L. monocytogenes partie 2 de lyse - voir l'étape 6.2) et 95 ± 3 ° C.
- Assurez-vous que les blocs de refroidissement ont été réfrigérés O / N, sinon les refroidir à 2-8 ° C pendant au moins 2 h.
- En utilisant le logiciel de l'ordinateur du système de détection basé sur la PCR, créer un fichier de crémaillère suivant les instructions du fabricant.
- Étiqueter et organiser des grappestubes contenant le réactif de lyse dans le rack, en fonction du fichier de crémaillère.
- Initialiser l'instrument du système de détection basé sur la PCR.
5. Effectuez Lysis pour la détection de Salmonella et Cronobacter
- Préparer le réactif de lyse en ajoutant 150 pi de protease à une bouteille de tampon de lyse de 12 ml.
- Transférer 200 pl de réactif de lyse pour chacun des tubes à fragmentation précédemment marqués.
REMARQUE: Les tubes de munitions contenant du réactif de lyse peuvent être conservés à 2-8 ° C pendant jusqu'à deux semaines. - En utilisant des pointes de pipette longues, Transférer 20 ul d'échantillons enrichis secondaires (voir les étapes 3.2.1 et 3.2.2) à tubes de munitions contenant 200 pi de réactif de lyse correspondant. Utiliser des nouveaux embouts de pipette pour chaque échantillon.
NOTE: Garder les tubes de l'enrichissement primaire et secondaire dans le réfrigérateur (Salmonella) ou à température ambiante (Cronobacter) pour une analyse plus approfondie de confirmation des échantillons PCR-positives / négatives. Préparer contrôles négatifs en ajoutant 20 pi de milieu BHI stérile pour tubes de munitions contenant 200 pi de réactif de lyse. - Préparer des témoins positifs en ajoutant 20 pi d'O / N cultures bactériennes (cultivées en BHI) de tout ou de la souche Salmonella connu Cronobacter tubes de munitions contenant 200 pi de réactif de lyse.
- Tubes de cluster Cap et bien serrer à l'aide de l'outil de coiffage.
- Placer la grille de tubes de munitions dans le bloc de chauffage automatisé après avoir sélectionné le programme spécifique de l'agent pathogène cible. En variante, les tubes incuber à dispersion à 37 ± 2 ° C pendant 20 min, suivi par une incubation à 95 ± 3 ° C pendant 10 min. Enfin, les tubes de transfert de munitions à des blocs de refroidissement (2-8 ° C) pendant 5 min.
REMARQUE: Les tubes de munitions contenant le lysat peuvent être conservés à -20 ° C pendant jusqu'à deux semaines.
6. Effectuer Lysis pour la détection de L. monocytogenes
- Effectuer la première partie delyse comme suit:
- Ajouter 1,8 ml d'eau désionisée stérile au flacon de entièrement décongelé agent de lyse 1.
REMARQUE: Magasin 1 agent de lyse à 2-8 ° C jusqu'au moment de servir. Après ouverture et la dilution, stocker à température ambiante (20-30 ° C) pour un maximum de six mois. - Combinez agents de lyse 1 et 2 dans un rapport de 4: 1 (40 pi de dilution agent de lyse 1 et 10 ul d'agent 2 pour chaque échantillon de lyse). Transférer 50 pl des agents de lyse combinées à se regrouper tubes. Utiliser le mélange dans les quatre heures.
- Ajouter 500 pi d'échantillon enrichi primaire (voir l'étape 3.2.3) au tube de cluster contenant les 50 pi des agents de lyse combinés.
- Préparer un témoin négatif en ajoutant 500 ul de 24 LEB stérile à 50 pi des agents de lyse combinées.
- Préparer un contrôle positif en ajoutant 500 pi d'O / N L. culture monocytogenes cultivée dans 24 LEB à 50 pi des agents de lyse combinées.
- Boucher les tubes de munitions, mélanger délicatement et lieudans le bloc de chauffage à 37 ± 1 ° C pendant 30 min.
NOTE: Garder les tubes de enrichissement primaire dans le réfrigérateur pour une analyse approfondie de confirmation des échantillons PCR-positives / négatives.
- Ajouter 1,8 ml d'eau désionisée stérile au flacon de entièrement décongelé agent de lyse 1.
- Effectuer la partie 2 de lyse comme suit:
- Préparer le réactif de lyse comme indiqué dans les étapes 5.1 et 5.2.
- Utilisation des embouts de pipette longues transférer 20 ul de la première partie lysat à des tubes de munitions contenant 200 pi de réactif de lyse. Utiliser des nouveaux embouts de pipette pour chaque échantillon.
- Tubes de cluster Cap et bien serrer à l'aide de l'outil de coiffage.
- Lieu tubes de munitions au bloc de chauffage automatisé de sélection du programme spécifique de L. monocytogenes. En variante, les tubes incuber à dispersion à 55 ± 2 ° C pendant 30 min, suivi par une incubation à 95 ± 3 ° C pendant 10 min. Enfin, les tubes de transfert de munitions à des blocs de refroidissement (2-8 ° C) pendant 5 min.
REMARQUE: Les tubes de munitions contenant le lysat peuvent être conservés à -20 ° C pendant jusqu'à deux semaines.
Comprimés 7. hydrate PCR-Ready
- Sélectionner un réfrigéré (4 ° C) PCR bloc de refroidissement et posez une grille de tube PCR sur l'insert.
- Placez tubes PCR contenant les comprimés PCR-prêts (inclus avec chaque kit) pour l'agent pathogène cible d'origine alimentaire dans le support correspondant, selon le dossier de rack.
- Utilisation de l'Outil de décapsulage, retirez soigneusement les bouchons des tubes PCR. Jeter les bouchons et vérifiez que chaque tube contient une tablette.
- Transfert 50 pi (pour Salmonella et Cronobacter) ou 30 pi (pour L. monocytogenes) de lysat dans des tubes de PCR spécifiques. Utilisez de nouveaux bouchons optiques et bien serrer sur les tubes de PCR en utilisant l'outil de coiffage.
REMARQUE: Après addition du lysat de comprimés PCR en main, des échantillons doit rester refroidi à 2 - 8 ° C jusqu'à ce que chargé dans le système de détection basé sur la PCR. Les tubes de PCR peuvent être centrifugés à 2500 xg pendant quelques secondes pour se assurer que tout le volume se trouve dans le bas tqu'il tube. - Chargez les tubes PCR dans le cycleur / détection instrument du système PCR en ouvrant le tiroir de l'instrument.
- Placer la grille de tubes PCR dans les puits dans le tiroir et vérifier que les tubes sont correctement installés.
- Fermez le tiroir et lancer le programme tel que décrit par le protocole du fabricant.
NOTE: L'instrument basé sur la PCR a les paramètres prédéfinis de vélo pour chaque agent pathogène d'origine alimentaire. - Vérifiez que la barre d'état de cycle de PCR affiche une barre bleue indiquant que la partie d'amplification de l'exécution du programme.
NOTE: Pour les tests de PCR standard, le temps de traitement du programme complet (amplification et détection) prend environ 3 à 3,5 heures pour terminer.
8. Examen des résultats
- Après le traitement est terminé, suivez les invites de l'instrument du système basé sur la PCR de prélever des échantillons et les résultats de l'examen.
- Si l'agent pathogène d'origine alimentaire cible est présente dans l'échantillon (soit lesurface ou le tube digestif de la mouche) le bien est rouge avec un «plus» signe (positif). Si l'agent pathogène est absent, le bien est vert avec un signe 'moins' (négative).
- Si le bien est jaune avec une barre rouge à travers le centre, il indique une erreur de signal.
9. Isolement de bactéries pathogènes à partir des résultats positifs à la PCR
- Sélectionnez tubes du primaire (pour L. monocytogenes) ou secondaire (pour Salmonella et Cronobacter) l'enrichissement de ces échantillons qui étaient positifs à la PCR. Aussi, choisir au hasard 3-5% des échantillons qui étaient PCR négatif et procédez comme suit:
- Pour Salmonella:
- Ajouter 100 ul de la presse secondaire enrichissement à 10 ml de Rappaport-Vassiliadis (RV) moyen et à 1 ml de tétrathionate (TT) de bouillon. Incuber les tubes à 42,5 ° C dans un bain d'eau à recirculation de 22 à 24 heures.
- Après incubation, série une anse de 3 mm (10 pi) de chaque, un RVd TT médias sur sulfite de bismuth (BS) agar, le xylose-lysine-désoxycholate (XLD) et Hektoen entérique (HE) agar. Incuber les plaques à 35 ± 1 ° C pendant 22 à 24 h.
- Après incubation, examiner les plaques pour la présence de colonies typiques de Salmonella sur chaque support. Si aucune des colonies isolées peuvent être obtenus après plusieurs étapes de sous-culture, considérer l'échantillon comme négatif et de faire rapport comme un faux positif pour le système basé sur la PCR.
NOTE: Pour les colonies typiques de Salmonella sur les médias spécifiques, voir 22. Sélectionnez cinq colonies caractéristiques présumées de Salmonella et repiquer les sur BS, XLD, ou HE jusqu'au cultures pures de colonies isolées / simples sont obtenus. - Sélectionnez une colonie pure et identifier Salmonella présomption en utilisant des tests commerciaux biochimiques tels que la carte d'identification VITEK 2 ou API système d'identification biochimique, en suivant les instructions du fabricant.
- Pour Cronobacter: <ol>
- Streak une anse de 3 mm (10 pi) du support d'enrichissement secondaire sur deux plaques de milieux de culture chromogènes tels que R & F Enterobacter sakazakii (Cronobacter) moyen de placage chromogène et / ou ChromID sakazakii Agar. Incuber les plaques à 35 ° C pendant 22 à 24 h.
- Après incubation, examiner les plaques pour la présence de colonies de Cronobacter typiques (bleu-noir au gris-bleu). Sélectionnez cinq colonies de Cronobacter présomptifs et repiquer les sur R & F Enterobacter sakazakii (Cronobacter) milieu d'étalement chromogène, ChromID sakazakii Agar, ou TSA jusqu'au cultures pures de colonies isolées / simples sont obtenus.
REMARQUE: si aucun des colonies isolées peuvent être obtenus après plusieurs étapes de sous-culture, considérer l'échantillon comme négatif et signaler comme un faux positif pour le système de détection basé sur la PCR. - Sélectionnez une colonie pure et identifier Cronobacter présomption en utilisant commer biochimiqueessais ciaux tels que la carte d'identification VITEK 2 ou API 20E système d'identification biochimique, en suivant les instructions du fabricant.
- Déposer sur une anse de 3 mm (10 pi) du support d'enrichissement primaire sur deux plaques de gélose Brillance Listeria (BLA). Incuber les plaques à 36 ± 1 ° C pendant 22 à 26 h.
- Après incubation, examiner les plaques pour la présence de présomption L. monocytogenes (bleu-vert) colonies. Sélectionnez 5 présomption L. monocytogenes colonies et sous-culture-les sur BLA jusqu'à obtenir des cultures pures de colonies isolées / simples. Re-incuber les plaques négatives à 36 ± 1 ° C pendant encore 22 à 26 h.
- Sélectionnez une colonie pure et identifier présomption L. monocytogenes en utilisant des tests biochimiques commerciaux tels que la carte d'identification VITEK 2 ou API Listeria système d'identification biochimique, à la suite de i du fabricantnstructions.
Representative Results
Ce protocole a été étalonné sur un ensemble de mouches domestiques élevés en laboratoire qui ont été expérimentalement alimenté pendant 24 heures avec de la nourriture liquide à la mouche (2% de lait en poudre) contenant des dilutions en série (10 février-10 août CFU / ml) de C. sakazakii, S. enterica, L. monocytogenes, ou C. jejuni (n = 21 pour chaque bactérie pathogène). Milieux d'enrichissement ainsi que les temps d'incubation et les températures ont été ajustés pour chaque agent pathogène d'origine alimentaire jusqu'à ce que le système basé sur la PCR a permis de détecter les plus faibles niveaux de bactéries (10 2 UFC / ml) de la surface du corps et le tube digestif d'un seul expérimentalement nourris voler. En utilisant les médias et les conditions d'enrichissement décrits dans la section de protocole, le système basé sur la PCR détecté C. sakazakii, S. enterica, et L. monocytogenes dans la surface du corps de 100% des mouches alimentées avec inocula bactériens> 10 3 CFU / ml (figure 1A). Quand les mouches ont été nourris avec 102 UFC / ml, le pourcentage de détection de C. sakazakii, S. enterica, et L. monocytogenes de leur surface corporelle était de 100%, 66% et 33%, respectivement (figure 1A). Le système à base de PCR a également détecté ces trois agents pathogènes d'origine alimentaire dans le canal alimentaire des mouches alimentées avec toutes les concentrations bactériennes à des pourcentages ≥33% (figure 1B). Cependant, la détection de C. jejuni n'a été possible que lorsque les mouches de laboratoire ont été élevés en expérimentalement nourris avec de la nourriture liquide contenant l'inoculum bactérien le plus élevé (10 8 CFU / ml). De ce fait, C. jejuni a été exclu du groupe des pathogènes d'origine alimentaire qui pourrait être testé de souillures synanthropic individuelle mouches en utilisant ce système de détection basée sur la PCR.
Avec ce protocole standardisé, nous avons pu déterminer la prévalence de Cronobacter spp., S. enterica, et L. monocytogenes dans la surface du corps et / ou ee canal alimentaire de 100 mouches sauvages qui étaient individuellement et de façon aseptique pêché dans la zone de benne de dix restaurants urbains situés dans la région métropolitaine de Washington, DC 5 vol d'immondices accumulés étaient représentatives d'au moins six espèces, y compris M. domestica (47%), Lucilia cuprina (33%), L. sericata (14%), Cochliomyia macellaria (2%), (2%) de Sarcophaga et Ophyra leucostoma (1%). Une mouche a été identifié seulement au niveau de la famille (Anthomyiidae; 1%). Le protocole surface désinfection est efficace pour éviter la contamination croisée entre les parties du corps de la mouche car aucune croissance bactérienne n'a été observée sur des plaques de TSA à l'eau du dernier rinçage de désinfection chaque individu mouche. Par conséquent, une distinction peut être faite entre les bactéries alimentaires présents sur les parties du corps de chaque volée.
Pas de faux positifs ont été détectés dans des échantillons de la surface du corps et le tube digestif devol individuels pour l'utilisation de ce système commercial basé sur la PCR pour la détection de S. enterica et L. monocytogenes, et la confirmation des agents pathogènes viables sur des plaques d'agar était en accord avec les résultats positifs à la PCR. Cependant, il ne était pas possible d'isoler des cultures pures de Cronobacter spp. à partir de tous les échantillons positifs par PCR. PCR basée conséquent, la détection de cet agent pathogène par le système a montré faux positifs de la surface du corps (50%; 9/18) et le tube digestif (48%; 16/33) des mouches sauvages capturés simples. Échantillons de PCR négatif choisis au hasard qui ont été étalées sur des supports spécifiques, ont confirmé l'absence des agents pathogènes d'origine alimentaire. Par conséquent, aucun faux négatifs ont été détectés à partir de l'un des échantillons pour l'utilisation de ce système à base de PCR pour détecter commercial Cronobacter spp., S. enterica, ou L. monocytogenes.
Seuls les échantillons positifs à la PCR où le pathogène a été isolé et confirmé ont été considérés comme positifset inclus dans l'analyse statistique. La présence globale des agents pathogènes d'origine alimentaire dans le tube digestif des sauvages capturés vol d'immondices était significativement plus élevée que sur la surface du corps (χ 2 = 6,8772, df = 1, p = 0,0087). 22% des canaux alimentaires et 8% de la surface du corps de mouches sauvages recueillis étaient positifs pour au moins l'un des trois agents pathogènes d'origine alimentaire (Figure 2). Dans l'ensemble, la prévalence de Cronobacter spp. soit sur les surfaces du corps ou des canaux alimentaires de mouches recueillies était statistiquement plus élevée (19%; test exact de Fisher p = 0,0165) que la prévalence de S. enterica (7%) et de L. monocytogenes (4%). Cependant, aucune différence statistique n'a été observée pour les comparaisons par paires entre les parties du corps de vol pour chaque agent pathogène bactérien (Figure 3; test exact de Fisher p = 0,1464, p = 0,1184 et p = 0,6212 pour Cronobacterspp., S. enterica, et L. monocytogenes, respectivement). Aucun des mouches étaient positifs pour les trois agents pathogènes évalués. Cependant, trois des mouches (L. cuprina deux et une L. sericata) porté Salmonella spp. et L. monocytogenes sur la surface ou dans le tube digestif.
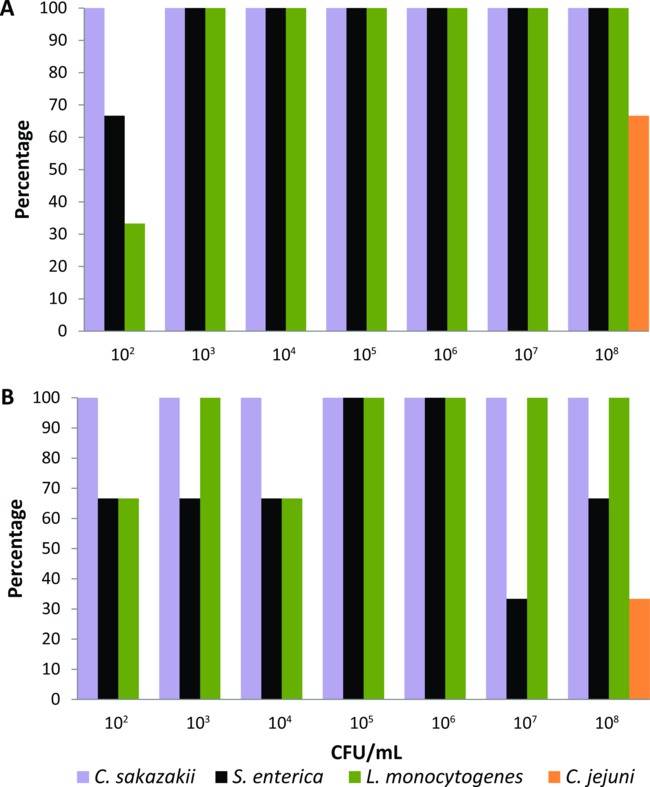
les niveaux de détection Figure 1. de Cronobacter sakazakii, Salmonella enterica, Listeria monocytogenes, et Campylobacter jejuni de (A) la surface du corps et (B) le tube digestif des maisons individuelles mouches élevés en laboratoire nourris avec de la nourriture liquide contenant inoculum bactérienne différente (n = 21 pour chaque agent pathogène bactérien, n = 3 pour chaque concentration bactérienne).
Figure 2. Pourcentage des surfaces du corps et les canaux alimentaires de mouches individuels trouvés positifs pour l'un des agents pathogènes d'origine alimentaire cible.

Figure 3. Prévalence de Cronobacter spp., Salmonella enterica, et Listeria monocytogenes de la surface du corps et le tube digestif de mouches sauvages capturés synanthropes. Les valeurs de p rapportées sont des comparaisons par paires entre la surface du corps et le tube digestif pour chaque bactérie pathogène (test exact de Fisher, valeur de p <0,05 indique la signification statistique). Copyright © American Society for Microbiology, Journal of Applied and Environmental Microbiology 78 (22): 7891-902, 2012. doi: 10.1128 / AEM.02195-12.
Discussion
Des études antérieures qui ont détectés pathogènes d'origine alimentaire des insectes sauvages ont utilisé une grande variété de protocoles qui pourraient ne pas inclure l'information nécessaire pour évaluer avec précision les risques liés à l'alimentation de la présence d'une mouche dans les aliments ou les environnements liés à l'alimentation 13,15, 23,24. Ici, nous avons démontré que l'utilisation de ce protocole standardisé, il est possible de détecter et d'isoler Cronobacter spp., S. enterica, et L. monocytogenes à partir de la surface du corps et le tube digestif de mouches simples capturés dans la nature. Parce que les insectes peuvent transporter de faibles effectifs de l'agent pathogène cible d'origine alimentaire et un grand nombre d'autres microbiote indigène 25,26, ce protocole nécessite enrichissement primaire (et parfois secondaire) des échantillons dans des milieux de culture spécifiques pour augmenter la sensibilité de la détection de l'agent pathogène cible d'origine alimentaire . Les résultats du système de détection basé sur la PCR ont été obtenus en environ 30 heures (pour le detection de Cronobacter spp. et S. enterica) et 48 h (pour la détection de L. monocytogenes) après le traitement de départ des échantillons. Ainsi, ce protocole est fiable ainsi que rapide et assez sensible pour cribler une seule mouche pour la présence d'agents pathogènes d'origine alimentaire.
Confirmation des résultats positifs à la PCR et l'isolement de bactéries viables fait partie de la procédure d'exploitation standard de nombreux laboratoires. En outre, à des fins épidémiologiques, des cultures bactériennes pures à partir d'échantillons PCR-positives sont nécessaires pour confirmer plus loin et sérotype pathogène d'origine alimentaire en utilisant biochimique, immunologique, ou des méthodes génétiques. Bien que pas de faux positifs ont été observés lors de la détection S. enterica et L. monocytogenes dans les parties du corps de mouches sauvages capturés simples, en utilisant ce protocole, nous avons trouvé jusqu'à un taux de faux positifs pour Cronobacter spp 50%. Ceci suggère que le système de détection à base de PCR pour le genre Cronobacter peuvent réagir de façon croisée avec d'autres entérobactéries présent parmi la flore très complexe réalisée par les mouches. Ainsi, l'isolement et la purification de colonies pures du genre Cronobacter à partir d'échantillons positifs par PCR placage nécessitent plus sélectif que les autres agents pathogènes évalués.
Ce protocole a été principalement normalisé pour dépister les mouches capturées dans la nature individuels pour la présence de Cronobacter spp., S. enterica, et L. monocytogenes en utilisant un système de détection basé sur la PCR commercial. Cependant, ce protocole a également été facilement adapté à l'écran les parties du corps de mouches simples pour la présence d'autres agents pathogènes d'origine alimentaire comme E. coli entérohémorragique O157: H7 (en utilisant soit le E. coli O157: H7 MP kit de dosage standard ou E. coli O157: H7 kit de dosage en temps réel) et la shiga-toxigène E. coli (STEC) groupe (en utilisant le temps réel Suite STEC), l'obtention de sensibilités> 80% (dépublierdonnées ed). En outre, ce protocole peut potentiellement être adapté pour détecter les agents pathogènes d'origine alimentaire des autres insectes qui sont des vecteurs de maladies (des cafards et les fourmis) connus, mais plus de recherche dans ce domaine est nécessaire.
Enquêtes sur les éclosions d'origine alimentaire de la maladie sont très dynamiques et comprennent un processus en plusieurs étapes qui peuvent varier en fonction de la situation spécifique et de l'environnement local étant enquête 12,27. Ces enquêtes sont importantes parce qu'elles fournissent une protection immédiate de la santé publique par la prévention des maladies futures. En outre, ces enquêtes peuvent élucider de nouveaux mécanismes par lesquels les micro-organismes d'origine alimentaire sont réparties, et soulever des questions importantes qui mènent à de nouveaux domaines de recherche 28. Techniques d'enquête ainsi que des protocoles normalisés, rapides et sensibles sont nécessaires pour la détection de pathogènes d'origine alimentaire des insectes individuels. Ce protocole standardisé ouvre la possibilité de recueillir de façon aseptique insectes comme des mouches, wHICH peut le vecteur bactérie pathogène d'origine alimentaire, dans le cadre d'un programme d'échantillonnage environnemental. L'information épidémiologique qui peut être acquise à partir de ce serait de l'utilisation dans la construction d'une image précise des mécanismes de transmission d'agents pathogènes d'origine alimentaire par des insectes (ce est à dire, la longueur du temps d'exposition: une mouche par l'atterrissage par rapport mouches atterrissage, déféquer, et régurgiter).
Enfin, bien que le système de détection basé sur la PCR commercial décrit ici est pratique à utiliser et simplifie l'amplification par PCR et la visualisation d'un amplicon au niveau du genre, il ne est nullement le seul système approprié. Le lysat à partir d'échantillons enrichis pourrait en variante être utilisé pour détecter la présence d'agents pathogènes d'origine alimentaire en utilisant publiquement disponibles paires d'amorces spécifiques à l'espèce. Cependant, la sensibilité de détection doit être démontrée avant leur utilisation.
Materials
| Name | Company | Catalog Number | Comments |
| Bismuth sulfite (BS) agar | Fisher Scientific | R452402 | *Multiple suppliers. |
| Brain heart infusion (BHI) broth | Becton, Dickson and Company | 299070 | *Pre-warmed to 37°C. Multiple suppliers. |
| Brilliance Listeria agar (BLA) | Fisher Scientific | CM1080B | *Multiple suppliers. |
| Buffered peptone water (BPW) | Becton, Dickson and Company | 212367 | *Pre-warmed to 37°C or 42°C. Multiple suppliers. |
| Brilliance Cronobacter agar (Druggan-Forsythe-Iversen formulation/DFI) | Fisher Scientific | CM1055B | *Multiple suppliers. |
| chromID Sakazakii Agar | bioMérieux | 43741 | *Call for information: 800.682.2666 |
| R & F Enterobacter sakazakii (Cronobacter) Chromogenic Plating Medium | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| R & F Enterobacter sakazakiii Enrichment Broth and supplement | R & F Laboratories | Various | *Call for information: +1.630.969.530 |
| Hektoen enteric (HE) agar | Fisher Scientific | OXCM0419B | *Multiple suppliers. |
| 24 Listeria enrichment broth (24LEB) | Oxoid | CM1107 | *Freshly prepared at room-temperature. Multiple suppliers. |
| Listeria selective enrichment supplement | Oxoid | SR0243 | *Multiple suppliers. |
| Novobiocin | Fisher Scientific | OXSR0181E | *Multiple suppliers. Store at 2-8 °C |
| Vancomycin hydrochloride hydrate | Sigma Aldrich | 861987 | Store at 2-8 °C |
| Cefsulodin sodium salt hydrate | Sigma Aldrich | C8145 | Store at 2-8 °C |
| Rappaport-Vassiliadis (RV) medium | Fisher Scientific | CM0669B | *Multiple suppliers. |
| Tetrathionate (TT) Broth | Becton, Dickson and Company | 249120 | *Multiple suppliers. |
| Trypticase soy agar (TSA) | Becton, Dickson and Company | 236930 | *Multiple suppliers. |
| Xylose lysine desoxycholate (XLD) agar | Becton, Dickson and Company | 221284 | *Multiple suppliers. |
| API Biochemical identification system | bioMérieux | Various | *Call for information: +1.800.682.2666 |
| VITEK 2: Product Safety | bioMérieux | Various | *Call for information: +1.800.682.2667 |
| BAX System Q7 | DuPont | ||
| BAX E. sakazakii Standard assay kit | DuPont | D11801836 | |
| BAX L. monocytogenes 24E assay kit | DuPont | D13608125 | |
| BAX Salmonella 2 Standard assay kit | DuPont | D14368501 | |
| Capping tool | DuPont | D11677028 | |
| Decapping tool | DuPont | D11134095 | |
| PCR tube rack/holder | DuPont | D12701663 | |
| Featherweight forceps, wide tip | BioQuip | 4750 | Sterilize before use. Multiple suppliers. |
| Fine point, straight tip forceps | BioQuip | 4731 | Sterilize before use. Multiple suppliers. |
| Zirconia/silica beads, 0.5 mm | Bio Spec Products, Inc. | 11079105z | Multiple suppliers. |
| Petri dishes - 60X15mm | Fisher Scientific | 08-772B | Multiple suppliers. |
| Disposable inoculating loops, 10µL | Fisher Scientific | 22-363-606 | Multiple suppliers. |
| L-shaped cell spreaders | Fisher Scientific | 14-665-230 | Multiple suppliers. |
| Microcentrifuge tubes, 2 ml | Fisher Scientific | Various | Sterilize before use when needed. Secure lid is preferred. Multiple suppliers. |
| Cluster tubes | Fisher Scientific | 05-500-13 | |
| Cluster tubes caps | Fisher Scientific | 05-500-23 | |
| Sodium hypochlorite (Liquid chlorine bleach) | *Dilute to 0.05% with water. Multiple suppliers. | ||
| Sterile deionized water | Multiple suppliers. | ||
| Sterile distilled water | Multiple suppliers. | ||
| Ethyl alcohol 190 proof | *Dilute to 70% with water when needed. Multiple suppliers. | ||
| Genie cell disruptor, 120V - for 1.5ml and 2.0ml microtubes | Scientific Industries, Inc. | SI-D238 | Multiple suppliers. |
| Heating block | Multiple suppliers. | ||
| Cooling block | Multiple suppliers. | ||
| Recirculating water bath | Multiple suppliers. | ||
| Stereo microscope | Multiple suppliers. | ||
| Centrifuge | Multiple suppliers. | ||
| Incubator | Multiple suppliers. |
References
- Voeller, J. G. Wiley Handbook of Science and Technology for Homeland Security. , Wiley Inc. 1-16 (2008).
- Olsen, A. R., Gecan, J. S., Ziobro, G. C., Bryce, J. R. Regulatory action criteria for filth and other extraneous materials V. Strategy for evaluating hazardous and nonhazardous filth. Regulatory Toxicology and Pharmacology. 33 (3), 363-392 (2001).
- Hald, B., Skovgård, H., Pedersen, K., Bunkenborg, H. Influxed insects as vectors for Campylobacter jejuni and Campylobacter coli in Danish broiler houses. Poultry Science. 87 (7), 1428-1434 (2008).
- Kobayashi, M., et al. Houseflies: Not simple mechanical vectors of enterohemorrhagic Escherichia coli O157:H7. American Journal of Tropical Medicine and Hygiene. 61 (4), 625-629 (1999).
- Pava-Ripoll, M., Pearson, R. E. G., Miller, A. K., Ziobro, G. C. Prevalence and relative risk of Cronobacter spp., Salmonella spp., and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies. Applied and Environmental Microbiology. 78 (22), 7891-7902 (2012).
- Hewitt, C. G. Houseflies and how they spread disease. , Cambridge University Press. (1912).
- Rochon, K., Lysyk, T. J., Selinger, L. B. Retention of Escherichia coli by house fly and stable fly (Diptera:Muscidae) during pupal metamorphosis and eclosion. Journal of Medical Entomology. 42 (3), 397-403 (2005).
- Greenberg, B., Kowalski, J. A., Klowden, M. J. Factors affecting the transmission of Salmonella by flies: natural resistance to colonization and bacterial interference. Infection and Immunity. 2 (6), 800-809 (1970).
- Mramba, F., Broce, A. B., Zurek, L. Vector competence of stable flies, Stomoxys calcitrans L. (Diptera:Muscidae), for Enterobacter sakazakii. Journal of Vector Ecology. 32 (1), 134-139 (2007).
- Ekdahl, K., Normann, B., Andersson, Y. Could flies explain the elusive epidemiology of campylobacteriosis. Bmc Infectious Diseases. 5 (11), 11 (2005).
- Nayduch, D., Noblet, G. P., Stutzenberger, F. J. Vector potential of houseflies for the bacterium Aeromonas caviae. Medical and Veterinary Entomology. 16 (2), 193-198 (2002).
- Multistate and Nationwide Foodborne Outbreak Investigations: A Step-by-Step Guide. , CDC. Atlanta, GA. Available from: http://www.cdc.gov/foodsafety/outbreaks/investigating-outbreaks/investigations/index.html (2013).
- Sievert, K., Messler, S., Klimpel, S., Feffer, K. Comprehensive study on the occurrence and distribution of pathogenic microorganisms carried by synanthropic flies caught at different rural locations in Germany. Journal of Medical Entomology. 46 (5), 1164-1166 (2009).
- Hernández-Escareño, J. J., et al. Presence of Enterobacteriaceae, Listeria spp., Vibrio spp. and Staphylococcus spp. in house fly (Musca domestica L.), collected and macerated from different sites in contact with a few animals species. Revista Cientifica-Facultad De Ciencias Veterinarias. 22 (2), 128-134 (2012).
- Mian, L. S., Maag, H., Tacal, J. V. Isolation of Salmonella from muscoid flies at commercial animal establishments in San Bernardino county, California. Journal of Vector Ecology. 27 (1), 82-85 (2002).
- Olsen, A. R., Hammack, T. S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera:Muscidae), at caged-layer houses. Journal of Food Protection. 63 (7), 958-960 (2000).
- Holt, P. S., Geden, C. J., Moore, R. W., Gast, R. K. Isolation of Salmonella enterica serovar Enteritidis from houseflies (Musca domestica) found in rooms containing Salmonella serovar Enteritidis-challenged hens. Applied and Environmental Microbiology. 73 (19), 6030-6035 (2007).
- Mramba, F., Broce, A., Zurek, L. Isolation of Enterobacter sakazakii from stable flies, Stomoxys calcitrans L. (Diptera:Muscidae). Journal of Food Protection. 69 (3), 671-673 (2006).
- Koyuncu, S., Andersson, M. G., Haggblom, P. Accuracy and Sensitivity of Commercial PCR-Based Methods for Detection of Salmonella enterica in Feed. Applied and Environmental Microbiology. 76 (9), 2815-2822 (2010).
- Gagné, R. Insect and mite pests in food, an illustrated. 1, U.S. Department of Agriculture and U.S. Department of Health and Human Service. 269-296 (1991).
- Greenberg, B. Flies and disease, Vol I. Ecology, classification and biotic associations. , Princeton University Press. (1971).
- Wallace, H. A., Jacobson, A., Hammack, T. S. Chapter 5 Salmonella. Bacteriological Analytical Manual. , Available from: http://www.fda.gov/downloads/Food/FoodScienceResearch/UCM244774.pdf (2007).
- Barro, N., Aly, S., Tidiane, O. C. A., Sababenedjo, T. A. Carriage of bacteria by proboscises, legs, and feces of two species of flies in street food vending sites in Ouagadougou, Burkina Faso. Journal of Food Protection. 69 (8), 2007-2010 (2006).
- Ugbogu, O. C., Nwachukwu, N. C., Ogbuagu, U. N. Isolation of Salmonella and Shigella species from house flies (Musca domestica L.) in Uturu, Nigeria. African Journal of Biotechnology. 5 (11), 1090-1091 (2006).
- Brownlie, J. C., Johnson, K. N. Symbiont-mediated protection in insect hosts. Trends in Microbiology. 17 (8), 348-354 (2009).
- Feldhaar, H. Bacterial symbionts as mediators of ecologically important traits of insect hosts. Ecological Entomology. 36 (5), 533-543 (2011).
- Foodborne disease outbreaks: Guidelines for investigation and control. , World Health Organization. Available from: http://www.who.int/foodsafety/publications/foodborne_disease/outbreak_guidelines.pdf (2008).
- Wright, A. P., Gould, L. H., Mahon, B., Sotir, M. J., Tauxe, R. V. Overview of the Impact of Epidemic-Assistance Investigations of Foodborne and Other Enteric Disease Outbreaks, 1946-2005. American Journal of Epidemiology. 174, S23-S35 (2011).



