Abstract
Elektroretinogrammet (ERG) er en noninvasiv elektrofysiologisk metode til bestemmelse af retinal funktion. Gennem anbringelse af en elektrode på overfladen af hornhinden, elektriske aktivitet genereret som reaktion på lys kan måles og anvendes til at vurdere aktiviteten af retinale celler in vivo. Dette håndskrift beskriver anvendelsen af ERG at måle visuel funktion i zebrafisk. Zebrafisk har længe været anvendt som en model for hvirveldyr udvikling på grund af den lette gensuppression med morpholino oligonukleotider og farmakologisk manipulation. 5-10 dpf kun kegler er funktionelle i larvernes retina. Derfor zebrafisk, i modsætning til andre dyr, er en kraftfuld modelsystem til undersøgelse af kegle visuel funktion in vivo. Denne protokol anvender standard anæstesi, mikromanipulering og stereomikroskopi protokoller, der er almindelige i laboratorier, som udfører zebrafisk forskning. De skitserede metoder gør brug af standard elektrofysiologi eqUDSTYR og en lav lys kamera til at styre placeringen af optagelsen mikroelektrode på larvernes hornhinden. Endelig demonstrere vi, hvordan en kommercielt tilgængelig ERG stimulator / recorder oprindeligt designet til brug med mus kan let tilpasses til anvendelse med zebrafisk. ERG af larver zebrafisk giver en fremragende metode til analyse kegle synsfunktionen hos dyr, der er blevet modificeret ved morpholino oligonukleotid injektion samt nyere genom teknikker såsom zink Finger nukleaser (ZFNs), Transskription Activator-Like Effector Nucleaser (Talens), og Clustered Regelmæssigt indbyrdes afstand Short palindromisk gentagelser (CRISPR) / Cas9, som alle i høj grad har øget effektiviteten og effekten af genmålretning i zebrafisk. Desuden, vi drage fordel af evnen af farmakologiske midler til at trænge zebrafisk larver at evaluere de molekylære bestanddele, der bidrager til photoresponse. Denne protokol beskriver en opsætning, der kan ændres og bruges af forskeremed forskellige eksperimentelle mål.
Introduction
Elektroretinogrammet (ERG) er en non-invasiv elektrofysiologisk metode, der har været anvendt i udstrakt grad i klinikken til at bestemme funktionen af nethinden hos mennesker. Den elektriske aktivitet som respons på en lys-stimulering måles ved at placere optagelse elektroder på den ydre overflade af hornhinden. Kendetegnene for stimulus paradigme og svaret bølgeform definerer de retinale neuroner, der bidrager til svaret. Denne fremgangsmåde er blevet tilpasset til anvendelse med en række dyremodeller, herunder mus og zebrafisk. Den typiske hvirveldyr ERG respons har fire hovedkomponenter: a-bølge, som er en hornhinde-negative potentiale afledt fra fotoreceptor celleaktivitet; b-bølge, en hornhinde-positivt potentiale afledt af ON bipolare celler; d-bølge, en hornhinde-positive potentiale tolkes som aktiviteten af OFF bipolære celler; og c-bølge, som forekommer flere sekunder efter b-bølge og afspejler aktivitet i Müller glia og RETginal pigment epitel 1-4. Yderligere referencer for at forstå historien og principperne for ERG analyse hos mennesker og dyremodeller er online lærebog, WebVision, fra University of Utah og tekster såsom principperne og praksis for Klinisk Elektrofysiologi af Vision 4, 5.
Danio rerio (zebrafisk) har længe været begunstiget som en model for hvirveldyr udvikling, på grund af sin hurtige modning og gennemsigtighed, som giver mulighed for noninvasiv morfologisk analyse af organsystemer, adfærdsmæssige analyser og fremadgående og tilbagegående genetiske skærme (til gennemgang, se Fadool og Dowling 6). Zebrafisk larver er meget modtagelige for genetisk og farmakologisk manipulation, som, når kombineret med deres høje frugtbarhed, gør dem en fremragende dyremodel for højt gennemløb biologiske analyser. Jo højere forholdet mellem kegler til stænger i larvernes zebrafisk - ca. 1: 1 i forhold til mus (~ 3% kegles) - gør dem særligt anvendelige til undersøgelse af kegle funktion 7-9.
I hvirveldyr nethinden, kegler udvikle før stængerne 10. Interessant, zebrafisk kegler er operative så tidligt som 4 dpf, der giver mulighed for selektiv elektrofysiologisk analyse af kegler på det tidspunkt 6, 11,12. I modsætning hertil ERG respons i stænger vises mellem 11 og 21 dpf 13. Derfor zebrafisk larver på 4-7 dpf tjene funktionelt som en all-kegle nethinden. Imidlertid er det native fotopiske ERG respons på 4-7 dpf larver domineret af b-bølgen. Anvendelse af farmakologiske midler, såsom L - (+) - 2-amino-4-phosphono-smørsyre (L-AP4) en agonist for metabotrope glutamatreceptorer (mGluR6) receptor ved den udtrykkes på bipolære celler, effektivt blokerer generation af b-bølge og afslører den isolerede kegle masse receptor potentiale ("a-bølge") 14-17.
Her beskriver vi en enkel og reliable fremgangsmåde til ERG analyse under anvendelse af kommercielt tilgængelige ERG udstyr beregnet til brug med mus, der er blevet tilpasset til brug med zebrafisk larver. Dette system kan anvendes på zebrafisk larver af varierende genetiske baggrunde, såvel som dem behandlet med farmakologiske midler, for at hjælpe forskerne i identifikationen af signalveje, der bidrager til visuel følsomhed og let tilpasning 16. De eksperimentelle procedurer i denne protokol vil guide efterforskere i brugen af ERG analyse til at besvare en række biologiske spørgsmål vedrørende visioner, og demonstrere opbygningen af en fleksibel ERG setup.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animal vedligeholdelse og forsøgsprotokoller blev godkendt af Institutional Animal Care og Brug udvalg University of North Carolina i Chapel Hill, og opfylder alle krav i NIH Office of Laboratory Animal Welfare og Foreningen for Vurdering og akkreditering af Laboratory Animal Care International.
Bemærk: For at få larver for ERG analyse offentliggjort protokoller for standard zebrafisk dyrehold og vedligeholdelse var ansat 18. Larverne opnås gennem naturlig avl og opstaldet under en 14 timers lys / 10 timer mørke cyklus. Denne protokol er optimeret til larver på 5-7 dage efter befrugtning (DPF), men kunne ideelt set udføres på ældre fisk med små ændringer af proceduren. Her bruger TL-stammen af vildtype zebrafisk larver ved 5 dpf.
1. Mikropipette Production
- Træk flere mikropipetter der bruger 1,5 x 0,86 mm (ydre diameter ved indvendig diameter) brand-poleret borosilikatglas kapillærer medfilament (smeltetemperatur 821 ° C) og en P-97 Flaming / Brown Mikropipette Puller forsynet med box varme filament. Bruge programmet til at udforme mikropipetter beskrevet i tabel 1.
- Kontroller hver mikropipette under et mikroskop med en passende stregglas lineal for at sikre, at tips er 10-15 um i diameter og har en glat spids åbning (dvs. ingen takkede kanter).
- Lagre forsigtigt mikropipetter at forhindre tip skader og eksponering for støv. Opbevaring muligheder omfatter petriskåle med lab tape, skum-foret kasser, eller kommercielt tilgængelige beholdere mikropipette opbevaring.
BEMÆRK: Andre mikropipette Aftrækkere og glaskapillarer kan anvendes, så længe den korrekte diameter af mikropipetten og en høj kvalitet spids opnås.
| Tryk | Hede | Træk | Velocity Tid | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabel 1: Program til fremstilling af mikropipetter bruger P-97 Flaming / brun Mikropipette Puller forsynet med en kasse varme filament Mikropipetter er fremstillet ved anvendelse af 1,5 x 1,0 mm 2 (ydre diameter indre diameter) brand-poleret borosilikatglas kapillærer med filament. (smeltetemperatur 821 ° C).
2. Buffer Forberedelse
- Brug filtreret iltet guldfisk Ringers buffer 19 i mikroelektrode kapillar og at mætte polyvinylalkohol (PVA) svamp på hvilken larver anbringes i eksperimenter. Alternativt kan du bruge E3 embryo medier eller Hanks Balanced Salt Solution.
- Forbered 10x guldfisk Ringers opløsning som beskrevet i tabel 2. Juster til pH 7,8, og der steriliseres under anvendelse af et 0,22 um filter og opbevar 10x lager ved 4 ° C.
- Opret en brugsopløsning på dagen for eksperimentet ved at fortynde 10x Ringers opløsning til 1x med deioniseret, destilleret vand. Filtreres gennem et 0,22 um filter system. Oxygenate ved gennembobling med 95% O 2/5% CO 2-gas i 10 minutter. Cap tæt bagefter for at sikre, at opløsningen forbliver iltet.
| NaCl | 1,25 M |
| KCI | 26 mm |
| CaCl2 | 25 mM |
| MgCI2 | 10 mM |
| glucose | 100 mM |
| HEPES | 100 mM |
3. elektroretinogrammet Platform
- Udfør ERG eksperimenter på en anti-vibration tabel inde et Faraday bur for at forbedre signal-støj-forholdet. Vedhæft en brugerdefineret stål platform til anti-vibration tabel ved hjælp sekskantmøtrikkerne. Placer en bevægelig plastik platform med en viskoelastisk urethanpolymer stødabsorberende bund på bordet under lyskilden.
- Anbring kameraet med en magnetiseret stativ, rettet ned på den bevægelige plastik platform. Placer mikromanipulator (som vil holde optagelsen mikroelektrode) med en anden magnetiseret stand til højre af den bevægelige plast platform. Sørg for, at kameraet og mikromanipulator ikke vil blive forstyrret af bevægelsen af andet udstyr, og at de ikke blokerer belysning fra lyskilden.
- Slut kameraet til en videoskærm og placer det til at se øjet aflarve til placering af elektroden i den korrekte position.
- Sørg for, at opsætningen er korrekt jordet med kobbertråd. For at kontrollere støj, skal du placere referenceelektrode og spidsen af optagelsen mikroelektrode i en 35 mm petriskål fyldt med Ringers opløsning. Kontrollér den elektriske støjniveau opsætningen med et oscilloskop eller en indbygget funktion i ERG apparatet. Støjniveauet bør ikke være mere end ± 10 μV fra baseline.
4. Svamp Fremstilling
- Skær et lille rektangel af tør PVA svamp, der vil passe perfekt i en 35 mm petriskål. Tykkelsen af svampen bør ikke være større end dybden af skålen. Brug en hobbykniv med en ren barberblad til skæring.
- Foretag en yderligere skåret i svampen til at rumme referenceelektrode (enten en overfladisk snit langs på bunden af svamp eller en sommerfugl skåret lodret gennem en af de mindre ender).
- Brug en kemisk resistent markørat markere en lille prik på svamp (hvor larve vil blive placeret), der kan anvendes til positionering af kameraet.
- Soak PVA svamp i Ringers opløsning indtil mættet. Fjern og skamplet hurtigt på et stykke køkkenrulle 2-3 gange. Placer svamp i et rent 35 mm petriskål.
- Placer petriskål indeholdende svamp på plastik platform, således at mærket kan visualiseres ved kameraet.
5. Elektrode Forberedelse
BEMÆRK: zebrafisk setup består af en referenceelektrode i kontakt med Ringers opløsning mættet PVA svamp og en elektrode i kontakt med hornhinden. Henvisningen elektrode består af en Ag / AgCl pellet. Optagelsen elektrode er en løftes glasmikropipette fyldt med Ringers opløsning, og som en mikroelektrode holder indeholder en Ag ledning.
- Chlorid elektroderne ved at opbløde dem i 6-9% natriumhypochlorit (blegemiddel) i 5 min (optagelsen MICRoelectrode tråd) eller 15 min (referenceelektroden). Air tørre på et Kimwipe i 5 min.
- Afhængigt af stil af snittet foretages i trin 4.2, skal du placere Ag / AgCl pellet af referenceelektroden ind (til den lodrette sommerfugl cut) eller under (for overfladisk snit på langs i bunden) svampen. Fastgør referenceelektroden føre til registreringssystem.
- Alternativt, hvis ERG setup har pladsproblemer eller der er særligt stærke fotovoltaiske artefakter fra Ag / AgCl-elektrode, forbinde referenceelektroden til svampen via en agar salt bro til at flytte elektroden ud af lysbanen.
- Vedhæft ~ 40 cm af passende størrelse slange til en 5 ml ikke-Luer lock sprøjte. Fyld sprøjten med Ringers opløsning. Mikroelektrode indehavere besidder trykporte sendes typisk med adaptere til at rumme rør med indvendige diameter på 1/16 ", 3/32", 1/8 "eller 5/32".
- Fyld en 1 ml ikke-Luer lock sprøjte medRingers opløsning og under anvendelse af en Micro-fil, omhyggeligt udfylde mikroelektrode holderen. Forebyg dannelsen af bobler.
- Sæt 5 ml sprøjte til trykket porten på mikroelektrode holder med slange og bruge den til at sikre, at mikroelektroden indehaveren er fuld af Ringers opløsning. Brug af Micro-fil og 1-ml sprøjte fyldt med Ringers opløsning, fylde mikropipette glas fra spidsen og sikre, at ingen luftbobler.
- Fastgør glasmikropipette til mikroelektrode indehaveren, være omhyggelig med at holde elektroden wire lige. Når sikrede bruge 5 ml sprøjte til omhyggeligt tvinge Ringers opløsning gennem mikroelektroden indtil en lille mængde opløsning er synlig på spidsen. Lejlighedsvis påføring af tryk på sprøjten (når de ikke anvendes på hornhinden) vil forhindre dannelse af luftbobler samt okklusioner grund af støv eller salt ophobning i mikropipettespidsen.
- Hvis opløsningen kommer ud som en strøm, erstatte glass mikropipette, som spidsen åbning er for stort eller er beskadiget.
- Placer forsigtigt optagelsen mikroelektrode i mikromanipulator og vedhæfte føringen til registreringssystemet.
6. elektroretinogrammet Analysis
BEMÆRK: På grund af kegle dominans larve nethinden, kan opnås, når forberedelserne til optagelse udføres under lave niveauer af indirekte hvidt lys af høj kvalitet ERG resultater (<1 lux) eller med korte perioder (<1 min), i højere intensitet ( ≤250 lux) arbejdslys. En kort periode med mørke tilpasning stadig påkrævet forud for optagelse (se trin 6.7). Dog kan eksperimenter udføres under svagt rødt eller infrarødt lys ved hjælp af en infrarød-følsom kamera. Alle eksperimenter blev udført i filtersteriliseret (0,22 um) systemet vand fra UNC zebrafisk akvakulturanlæggets men alternative embryo medier kan bruges.
- Skær papir håndklæde firkanter, der måler ca. 1cm2.
- Hvis måling isoleret kegle masse receptor potential, inkuberes 3-5 larver i systemet vand med 500 um (±) -2-amino-4-phosphonosmørsyre (APB) i 5 min.
BEMÆRK: Når APB er en racemisk blanding af den aktive (L) og inaktive (R) former af AP4, er det lige så effektivt som L-AP4 og er billigere. - Bedøver 3-5 larver i systemet vand med 0,02% (w / v) tricaine indtil reagerer, omkring 1-2 min.
- Brug en Pasteur-pipette og pipette pumpe til omhyggeligt at overføre individuelle larver på papir håndklæde firkanter under en dissekere stereoskop hjælp minimal belysning (≤250 lux for <1 min). Kontroller positionen af hver larve og vælge en kandidat, der er dorsale side op med en uokkluderet øje.
- For længere optagelser (> 30 min), holde larve fugtig ved ruder kroppen op til, men ikke inklusive hovedet med 3% methylcellulose med en fin kamel-hår børste.
- Ved hjælp af en pincet, overføre køkkenrulle square med larve til fugtig PVA svamp.
- For udvidede optagelser (> 30 min), anvende en kontinuerlig strøm af vandmættet 100% O 2 gas over larve ved at boble gassen gennem et airstone i en side-arm kolbe indeholdende destilleret vand. Placer slangen kommer ud af kolben side-arm, der formidler den befugtede ilt nær larve hoved.
BEMÆRK: Trin 6.4.1 og trin 6.5.1 vil forlænge levetiden af fisken 16.
- For udvidede optagelser (> 30 min), anvende en kontinuerlig strøm af vandmættet 100% O 2 gas over larve ved at boble gassen gennem et airstone i en side-arm kolbe indeholdende destilleret vand. Placer slangen kommer ud af kolben side-arm, der formidler den befugtede ilt nær larve hoved.
- Under minimal belysning, skal du bruge mikromanipulator og kamera for at placere mikroelektroden spids ved midtpunktet mellem nasal og caudale ender af øjet, og tryk forsigtigt på dorsale grænse på hornhinden.
BEMÆRK: fejlplacering af elektroden spids til langt distale områder af hornhinden kan resultere i ERG bølgeformer af omvendt polaritet. - Tillad larve til mørk-tilpasse i 5-10 min.
- Optag test flash reaktioner på lys leveres fra en LED lyskilde eller optisk stimulator vha available stimulation og optageudstyr. Juster protokolparametre såsom flash intensitet, flash længde, flash farve, baggrund intensitet og farve og filterindstillinger at passe eksperimentet.
- Når du er færdig med eksperimentet aflive larver ifølge AVMA / IACUC retningslinjer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Typisk ERG'er optaget fra zebrafisk larver ved 5 dpf, da en række undersøgelser har publiceret ERG optagelser på nuværende tidspunkt 9, 16,20. Larval responser blev målt under mørke-tilpassede betingelser uden baggrundsbelysning ved hjælp af en 20 ms stimulus af hvid LED lys. Vi udnyttede en kommercielt tilgængelig ERG system bestående af en Ganzfeld lys stimulator og computer controller / optager. Stimulatoren bruger en tæt kontrolleret proprietær pulsbreddemodulation (PWM) til at styre luminansen af både baggrund og flash stimulus. Reaktionerne blev registreret ved hjælp af en proprietær fuldt differential forstærker med en hardware anti-aliasing filter køre en 16-bit analog til digital konverter (ADC). Stimulus og respons optagelser blev kontrolleret af leverandørejet software, der følger med udstyret i henhold til producentens protokol. Vores udstyr var programmeret til at udnytte en prøveudtagning på 1 kHz, digital Bessel CASCADE filtre sat til en båndpas på mellem 0,312 Hz og 300 Hz, og et 60 Hz notch filter for at fjerne overskydende støj. I den mørke tilpasset larve B-bølge stigninger i amplitude med stigende lysintensiteter (Figur 1). A-bølge er typisk dækket af b-bølge og ikke kan detekteres pålideligt. B-bølge kan blokeres ved at inkubere larverne med metabotrope glutamat-receptor (mGluR6) agonist, 4-phosphono-smørsyre (APB). Dette giver mulighed for kegle masse receptor potentiale (eller "A-wave"), der skal detekteres. Denne "a-bølge" respons stigninger i amplitude med stigende intensitet af lys (figur 2).
Yderligere paradigmer kan anvendes til at teste visuelle parametre ud over basale synsfunktion og følsomhed. Gennem brug af en dobbelt flash paradigme, kan man måle evnen af keglen photoresponse at komme fra den oprindelige stimulus (figur 3A). Som interstimulus interval(ISI) øger amplituden af den anden respons stiger, indikerer genvinding fra den oprindelige stimulus (figur 3B). APB-isolerede "a-bølge" spor præsenteres er gennemsnittet af tre sweeps og i overensstemmelse med offentliggjorte rapporter fra de zebrafisk larver ERG'er udnytte lignende stimulering paradigmer 2, 9,16.
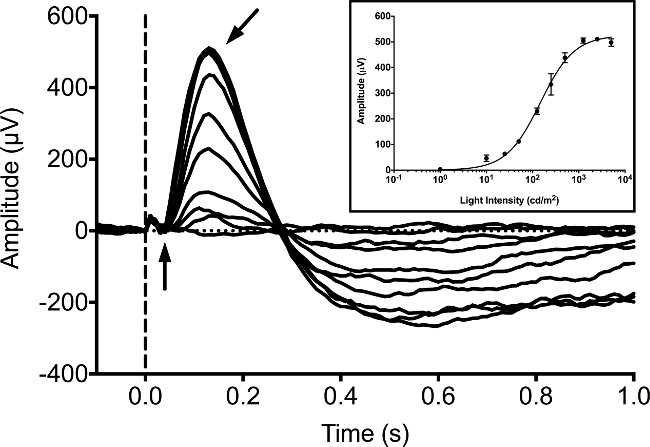
Figur 1: Typisk ERG optagelse i 5 dpf larver zebrafisk. Intensiteten serien blev opnået under mørke-tilpassede forhold. Fiskene udsættes for LED hvidt lys i en periode på 20 ms med intensiteter svarende 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 og 5.000 cd / m2. Starten af lys stimulus er angivet ved den stiplede lodrette linje. Den negative potentiale a-bølge (lodret pil) er vanskeligt at skelne, mens den positivepotentiel b-bølge (vinklet pil) er den dominerende top af bølgeform. En lille solcelle artefakt kan observeres som en mindre positiv afbøjning før indtræden af a-bølge. Indsat gennemsnit b-bølge respons amplituder med stigende intensitet af lys, der er blevet passe hjælp af Naka-Rushton ligning 21, 22. Fejlsøjler repræsenterer SEM.

Figur 2: APB-isoleret kegle masse receptor potentiale optaget fra larve zebrafisk Intensitet serie opnået under mørke-tilpassede betingelser ved 5 dpf.. Stimulus er en 20 ms LED hvidt lys med intensiteter svarende 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 og 5.000 cd / m2. Starten af lys stimulation er angivet ved den stiplede lodrette linje. Den isolerede kegle masse receptor potentiale ("a-bølge") er den dominerende bestanddel i det bølgeform (pil). En lillesolcelle artefakt kan observeres som en mindre positiv afbøjning før indtræden af keglen respons. Indsat, gennemsnit af responsen amplituder med stigende intensitet af lys, der er blevet passe hjælp af Naka-Rushton ligning. Fejlsøjler repræsenterer SEM.

Figur 3:.. Cone masse receptor potentiel optagelse udnytte en dobbelt flash paradigme En 5 dpf APB-behandlede larve blev udsat for to 20 msek glimt af hvidt lys (LED kilde), hver med en intensitet på 1.000 cd / m2 (A) Reaktionen på 2 på hinanden følgende blink med en interstimulus interval (ISI) svarende til 2 sek. Lette eksponeringer er markeret med stiplede lodrette linjer. Amplituden af den anden reaktion er lavere end den første reaktion, hvilket indikerer ufuldstændig reaktion opsving. (B) Forholdet mellem den maksimale isoleret kegle masse receptor potenoplys- reaktion af den anden stimulus med den oprindelige stimulus for hver ISI. En best-fit ikke-lineær regressionsanalyse er blevet anvendt. Som ISI stiger, til den anden stimulus stigninger i amplitude i forhold til svaret på den oprindelige stimulus angiver progressiv genopretning af fotoreceptor følsomhed. Klik her for at se en større udgave af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I denne protokol en enkel procedure for ERG optagelser af larver zebrafisk er detaljeret. Denne procedure giver mulighed for en hurtig og omfattende analyse af visuel function.There er flere kritiske trin hele proceduren, der bør holdes for øje. Zebrafisken larver skal være sundt før forsøget for at forhindre dødsfald i løbet af potentielle lægemiddelbehandlinger og sikre langvarig udkomme i løbet af ERG optagelser. Desuden er det vigtigt, at den anvendes i eksperimenter larver er tæt aldersmatchning. Dette skyldes den hurtige udvikling af nethinden (dvs. forskellen udvikling af kegle undertyper) og også den samlede morfologi og fysiologi larver. For eksempel, efter 7 dpf effektiviteten af epitelial transpiration aftager gør det mere vanskeligt at holde fiskene i live. En anden vigtig faktor er kvaliteten af optagelsen og referenceelektroderne. Der skal udvises forsigtighed, når du trækker glaskapillarer at forhindre ru kanter tips. En mikropipette microforge kunne anvendes til brand-polsk trak elektroder og bidrage til at forbedre signal erhvervelse. Derudover er det meget vigtigt at opretholde kvaliteten af Ag / AgCl elektroder. Efter brug, skal de skylles med destilleret vand og lufttørret straks. Mens mørkfarvning af den ydre overflade af elektroder kan forekomme med tiden og ikke påvirke ydeevne, plettet (gul til mørkerød) eller revnede elektroder bør undgås. Undgå håndtering elektroder med bare hænder, da protein forurening negativt kan påvirke elektrode adfærd. Endelig skal det bemærkes, at Ag / AgCI-elektroder er lysfølsomme og kan føre til flash artefakter hvis ikke beskyttet. Vi har imidlertid fundet disse artefakter til at være minimal (se legender til figur 1 og 2) og ikke interfererer med vores målinger af larvestadium zebrafisk reaktioner at blinke stimuli. Alternativt kan et salt bridge bruges til at forbinde den Ag / AgCl elektroden til svamp via en agar salt bro til at flytte elektroden ud af lysbanen. Selvom en saltbro anvendes jævnstrøm (DC) optagelser at stabilisere elektrodepotentialet 23 udnytter ERG optagelse vekselstrøm (AC). Derfor det eneste formål med et salt bro i dette system ville være, hvis den særlige setup har pladsproblemer eller særligt stærke fotovoltaiske artefakter.
ERG har flere fordele i forhold til andre teknikker til at måle synsfunktion. Den primære fordel er, at det er en in vivo optagelse. Ulempen er, at aktiviteten af specifikke celler skal udledes bølgeform snarere end måles direkte, som det ville være tilfældet for sugning elektrode eller patch clamp optagelser af fotoreceptorer og andre celler i nethinden. Normalt sugning elektrode optagelser, patch clamp optagelser og hele nethinden ERG'er har den fordel, at farmakologiske midler let kan indføres i celler til at definere de molekylære bestanddeleaf svaret, mens det er mere vanskeligt i vivo ved hjælp pattedyr modeller. Permeabiliteten af zebrafisk larver til sådanne midler overvinder denne ulempe.
Analyse af dark-tilpassede larver i mangel af farmakologiske midler frembringer en ERG bølgeform domineret af b-bølge, et resultat, der er blevet observeret af en række andre grupper 2, 9,24 -26. Vi viser evnen til at isolere kegle masse receptor potentiale ved at udnytte muligheden for farmakologiske midler til at trænge larvernes zebrafisk. Larver behandlet med APB vise en ophævelse af b-bølge, således at "a-bølge" skal visualiseres 14-17. Kurver med fremragende signal-støj-forhold blev opnået ved at tage gennemsnittet 3 sweeps. Variation i svaret bølgeformer er undertiden bemærket, men Makhankov et al. 2 har rapporteret, at variansen i gentagne målinger fra samme dyr er mindreend den, der ses mellem individer. Derfor variansen er sandsynligvis resultatet af biologisk variation snarere end variabilitet i teknikken.
Vi udnyttede også ERG analyse til at undersøge kegle genvinding in vivo ved anvendelse af en dobbelt flash paradigme, svarende til offentliggjorte resultater i nærvær og fravær af baggrundsbelysning 9, 16. Dette blev udført ved at måle evnen af larvestadiet nethinden til at reagere på successive glimt af varierende ISI. Ved anvendelse i kombination med farmakologiske midler eller genom engineering strategier såsom Talens at slå pathway mål, at zebrafisk er kraftfuld system til in vivo-undersøgelse af de molekylære mekanik kegle tilpasning og visuel opsving.
Vores procedure og udstyr kunne let tilpasses til at undersøge isolerede larval øjne, ældre zebrafisk eller andre hvirveldyr 27, 28. Faktisk ERG stimulering og registreringssystemat vi anvender er hovedsagelig konstrueret til brug i et klinisk miljø, og derefter ændret til forsøg på mus. Tilpasning af platform for zebrafisk larver var ligetil og let kunne gentages i andre laboratorier til lav pris. Lignende opsætninger, der består af klassisk elektrofysiologisk udstyr kan være konstrueret til minimale omkostninger, og har vist sig at give pålidelige resultater 16. Samlet set denne teknik er til stor gavn for forskere studerer mekanismerne i visuel funktion.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen interessekonflikter erklæret.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



