Abstract
L'elettroretinogramma (ERG) è un metodo non invasivo per determinare elettrofisiologico funzione retinica. Attraverso il posizionamento di un elettrodo sulla superficie della cornea, attività elettrica generata in risposta alla luce può essere misurato e utilizzato per valutare l'attività di cellule retiniche in vivo. Questo manoscritto descrive l'uso della ERG per misurare la funzione visiva in zebrafish. Zebrafish sono stati a lungo utilizzato come modello per lo sviluppo vertebrato a causa della facilità di soppressione genica mediante oligonucleotidi morfolino e manipolazione farmacologica. A 5-10 dpf, solo coni sono funzionali nella retina larvale. Pertanto, il zebrafish, a differenza di altri animali, è un potente sistema modello per lo studio della funzione visiva cono in vivo. Questo protocollo utilizza l'anestesia standard micromanipolazione e protocolli stereomicroscopia che sono comuni nei laboratori che eseguono la ricerca zebrafish. I metodi di cui fanno uso di eq elettrofisiologia normaAZIONE e una telecamera a bassa luce per guidare il posizionamento della microelettrodo di registrazione sulla cornea larvale. Infine, si dimostra come un disponibile in commercio ERG stimolatore / registratore originariamente progettato per l'uso con i topi possono essere facilmente adattato per l'uso con zebrafish. ERG di zebrafish larvale fornisce un metodo eccellente per saggiare cono funzione visiva in animali che sono stati modificati da morpholino iniezione oligonucleotide nonché nuove tecniche di ingegneria del genoma come zinco Finger nucleasi (ZFNs), Trascrizione Activator-Like Effector nucleasi (Talens), e cluster regolarmente intervallate brevi palindromo Ripete (CRISPR) / Cas9, i quali hanno notevolmente aumentato l'efficienza e l'efficacia del gene targeting in zebrafish. Inoltre, abbiamo approfittato della capacità di agenti farmacologici di penetrare larve zebrafish per valutare le componenti molecolari che contribuiscono alla fotorisposta. Questo protocollo delinea una configurazione che può essere modificato e utilizzato dai ricercatoricon diversi obiettivi sperimentali.
Introduction
L'elettroretinogramma (ERG) è un metodo elettrofisiologico invasivo che è stato ampiamente utilizzato in clinica per determinare la funzione della retina nell'uomo. L'attività elettrica in risposta ad uno stimolo luce viene misurata ponendo elettrodi di registrazione sulla superficie esterna della cornea. Le caratteristiche del paradigma stimolo e la forma d'onda di risposta definiscono i neuroni retinici contribuiscono alla risposta. Questo metodo è stato adattato per l'uso con un certo numero di modelli animali tra cui topi e zebrafish. La tipica risposta vertebrati ERG ha quattro componenti principali: l'a-onda, che è un potenziale cornea-negative derivanti dall'attività cellule fotorecettori; la b-wave, un potenziale positivo cornea derivato dal ON cellule bipolari; d-onda, un potenziale positivo cornea interpretato come l'attività delle cellule bipolari OFF; e il c-onda, che si verifica alcuni secondi dopo la b-wave e riflette l'attività in Müller glia e il retinale pigmento epitelio 1-4. Ulteriori riferimenti per la comprensione della storia e dei principi di analisi ERG negli esseri umani e modelli animali sono il libro di testo on line, WebVision, presso la University of Utah e testi, come i Principi e Pratica di Elettrofisiologia clinica di Vision 4, 5.
Danio rerio (zebrafish) è stato a lungo favorita come un modello di sviluppo dei vertebrati, a causa della sua rapida maturazione e trasparenza, che permette l'analisi morfologica non invasiva dei sistemi d'organo, test comportamentali e sia in avanti e retromarcia schermi genetici (per la revisione, vedi Fadool e Dowling 6). Larve Zebrafish sono altamente suscettibili di manipolazione genetica e farmacologica, che, accoppiato con la loro alta fecondità, loro un ottimo modello animale per le analisi biologiche high-throughput fare. Il più alto rapporto di coni di canne in zebrafish larvale - circa 1: 1 rispetto ai topi (~ 3% a conos) - renderli particolarmente utile per lo studio della funzione cono 7-9.
Nella retina dei vertebrati, coni sviluppano prima di aste 10. È interessante notare che, coni zebrafish sono operativi già dal 4 dpf, consentendo selettiva analisi elettrofisiologiche di coni in quella fase 6, 11,12. Al contrario, le risposte ERG a barre compaiono tra 11 e 21 dpf 13. Pertanto, larve di zebrafish 4-7 dpf servire funzionalmente come retina all-cono. Tuttavia, il nativo fotopico risposta ERG di 4-7 dpf larve è dominato dalla b-wave. Applicazione di agenti farmacologici, quali L - (+) - 2-ammino-4-fosfono-butirrico (L-AP4), un agonista per il glutammato metabotropici (mGluR6) recettore espresso dalla ON cellule bipolari, blocca efficacemente la generazione del B-wave e rivela il potenziale isolato massa cono recettore, (la "a-wave") 14-17.
Qui si descrive un semplice e reliablMetodo e per l'analisi ERG utilizzando disponibili in commercio apparecchiature ERG progettato per l'utilizzo con i topi che sono stati concepiti per essere utilizzati con le larve di zebrafish. Questo sistema può essere utilizzato su larve zebrafish di varia background genetici, così come quelli trattati con agenti farmacologici, per aiutare i ricercatori nella identificazione di vie di segnalazione che contribuiscono alla sensibilità visiva e adattamento alla luce 16. Le procedure sperimentali descritte in questo protocollo guideranno gli investigatori in uso dell'analisi ERG per rispondere a una serie di domande biologiche relative alla visione, e dimostrare la costruzione di una configurazione flessibile, ERG.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Mantenimento degli animali e protocolli sperimentali sono stati approvati dalla cura e utilizzo dei Comitati animali istituzionale della University of North Carolina a Chapel Hill, e soddisfano tutte le esigenze dell'Ufficio NIH di laboratorio Animal Welfare e l'Associazione per la valutazione e l'accreditamento del laboratorio Animal Care International.
NOTA: Per ottenere le larve di analisi ERG, pubblicato protocolli per la zootecnia zebrafish norma e manutenzione sono stati impiegati 18. Le larve sono ottenuti attraverso l'allevamento naturale e ospitato sotto una luce 14 ore / 10 ore ciclo scuro. Questo protocollo è stato ottimizzato per le larve in 5-7 giorni dopo la fecondazione (DPF), ma potrebbe essere idealmente eseguite sul pesce più vecchio con piccole modifiche alla procedura. Qui, utilizzare il ceppo TL di wild-type larve di zebrafish a 5 dpf.
1. Micropipetta Produzione
- Tirare diversi micropipette con 1,5 x 0,86 millimetri (diametro esterno da diametro interno) capillari in vetro borosilicato fuoco lucido confilamento (temperatura di fusione, 821 ° C) e un P-97 Flaming / Brown Micropipetta Estrattore dotato di filamento calore scatola. Utilizzare il programma per modellare micropipette descritti nella tabella 1.
- Controllare ogni micropipetta al microscopio con un appropriato righello reticolo per garantire che suggerimenti sono di 10-15 micron di diametro ed ha un'apertura punta liscia (cioè, senza bordi frastagliati).
- Conservare con cura micropipette per evitare danni punta e l'esposizione alla polvere. Le opzioni di memorizzazione includono piastre di Petri con del nastro di laboratorio, scatole di schiuma rivestita, o contenitori micropipetta disponibili in commercio.
NOTA: Altri estrattori micropipetta di vetro e capillari possono essere usati fino a quando il corretto diametro della micropipetta e una punta di alta qualità è ottenuta.
| Pressione | Calore | Tirare | Velocità Tempo | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabella 1: Programma per la produzione di micropipette con un P-97 Flaming / marrone Micropipetta Estrattore dotato di un filamento di calore casella micropipette sono realizzati con 1,5 x 1,0 mm 2 (diametro esterno dal diametro interno) capillari di vetro borosilicato ribruciate con filamento. (temperatura di fusione, 821 ° C).
2. Buffer Preparazione
- Utilizzare filtrato, tampone ossigenato pesci rossi di Ringer 19 nella microelettrodo capillare e saturare la spugna alcool polivinilico (PVA) su cui le larve sono collocati per esperimenti. In alternativa, utilizzare E3 supporti embrione o soluzione salina bilanciata di Hank.
- Preparare la soluzione 10x pesci rossi di Ringer, come descritto nella Tabella 2. Regolare a pH 7,8, e sterilizzare utilizzando un filtro 0,22 micron e conservare lo stock 10x a 4 ° C.
- Creare una soluzione di lavoro il giorno dell'esperimento diluendo la soluzione di Ringer 10x a 1x con deionizzata, acqua distillata. Filtrare su un filtro di 0,22 micron. Ossigenare insufflando 95% O 2/5% CO 2 gas per 10 minuti. Cap strettamente seguito per garantire che la soluzione rimane ossigenato.
| NaCl | 1.25 M |
| KCl | 26 mm |
| CaCl 2 | 25 MM |
| MgCl 2 | 10 mM |
| glucosio | 100 MM |
| HEPES | 100 MM |
3. Elettroretinogramma Platform
- Eseguire esperimenti ERG su un tavolo antivibrante all'interno di una gabbia di Faraday per migliorare il rapporto segnale-rumore. Allegare una piattaforma in acciaio personalizzato al tavolo anti-vibrazioni con dadi esagonali. Inserire una piattaforma mobile di plastica con un polimero uretanico ammortizzante inferiore viscoelastico sul tavolo sotto la sorgente luminosa.
- Posizionare la fotocamera con uno stand magnetizzato, volto giù alla piattaforma mobile di plastica. Posizionare il micromanipolatore (che eserciterà la microelettrodo registrazione) con un secondo supporto magnetizzato alla destra della piattaforma mobile di plastica. Assicurarsi che la fotocamera e micromanipolatore non saranno disturbati dal movimento di altre apparecchiature e che non blocchino illuminazione dalla sorgente luminosa.
- Collegare la fotocamera a un monitor video e posizionarla per visualizzare l'occhio dellarva per collocare l'elettrodo nella posizione corretta.
- Assicurarsi che l'impostazione sia collegato a terra con filo di rame. Per controllare il rumore, collocare l'elettrodo di riferimento e punta del microelettrodo registrazione in una piastra di Petri 35 millimetri riempito con soluzione di Ringer. Controllare i livelli di rumore elettrici della configurazione con un oscilloscopio o una funzione incorporata dell'apparato ERG. I livelli di rumore dovrebbero essere non più di ± 10 mV dal basale.
4. Sponge Preparazione
- Tagliare un piccolo rettangolo di spugna PVA secca che si inserisce perfettamente in una capsula di Petri da 35 mm. Lo spessore della spugna non deve essere maggiore della profondità del piatto. Usare un taglierino con una lama di rasoio pulito per il taglio.
- Effettuare un taglio aggiuntivo nella spugna per accogliere l'elettrodo di riferimento (un taglio superficiale longitudinale sul fondo della spugna o una farfalla tagliato verticalmente attraverso una delle estremità inferiori).
- Utilizzare un marcatore resistente agli agenti chimiciper contrassegnare un puntino sulla spugna (dove verrà posizionata la larva) che può essere utilizzato per il posizionamento della telecamera.
- Immergere la spugna PVA in soluzione di Ringer fino a saturazione. Rimuovere e asciugare rapidamente su un tovagliolo di carta 2-3 volte. Posizionare la spugna in un ambiente pulito 35 millimetri piastra di Petri.
- Posizionare il piatto Petri contenente la spugna sulla piattaforma di plastica in modo che il marchio può essere visualizzata dalla telecamera.
5. elettrodi Preparazione
NOTA: La configurazione zebrafish è costituito da un elettrodo di riferimento in contatto con la soluzione satura di PVA spugna del Ringer e un elettrodo di registrazione a contatto con la cornea. L'elettrodo di riferimento costituito da un pellet Ag / AgCl. L'elettrodo di registrazione è una micropipetta di vetro tirato riempito con soluzione di Ringer e tenuto da un supporto microelettrodo contenente un filo di Ag.
- Cloruro gli elettrodi, mettetelo a bagno in 6-9 ipoclorito% di sodio (candeggina) per 5 min (il MICR registrazioneoelectrode fili) o 15 minuti (l'elettrodo di riferimento). Aria secca su un Kimwipe per 5 min.
- A seconda dello stile di taglio effettuato nel passo 4.2, posizionare il pellet Ag / AgCl dell'elettrodo di riferimento in (per la farfalla taglio verticale) o sotto (per il taglio superficiale longitudinalmente sul fondo) la spugna. Attaccare il cavo elettrodo di riferimento al sistema di registrazione.
- In alternativa, se l'impostazione ERG ha vincoli di spazio o ci sono particolarmente forti artefatti fotovoltaici dall'elettrodo Ag / AgCl, collegare l'elettrodo di riferimento sulla spugna attraverso un ponte salino agar per spostare l'elettrodo dal percorso ottico.
- Attaccare ~ 40 cm di tubo di dimensioni appropriate per una siringa da 5 ml di blocco non-Luer. Riempire la siringa con soluzione di Ringer. Titolari di microelettrodi possesso prese di pressione vengono spediti con adattatori per ospitare tubi con diametri interni di 1/16 ", 3/32", 1/8 "o 5/32".
- Riempire un 1 ml non Luer Siringa serratura conSoluzione di Ringer e, utilizzando un Micro-fil, riempire accuratamente il supporto microelettrodo. Evitare la formazione di bolle.
- Attaccare la siringa da 5 ml di porta di pressione del titolare microelettrodo con tubi e utilizzarla per garantire che il titolare microelettrodo è pieno di soluzione di Ringer. Utilizzando il Micro-fil e la siringa da 1 ml riempita con soluzione di Ringer, riempire il bicchiere micropipetta dalla punta e accertarsi che non siano presenti bolle.
- Fissare la micropipetta di vetro al titolare microelettrodo, facendo attenzione a mantenere il dritto filo elettrodo. Una volta fissato, utilizzare la siringa 5 ml di forzare accuratamente soluzione di Ringer attraverso il microelettrodo fino ad una piccola quantità di soluzione è visibile sulla punta. Applicazione occasionale della pressione alla siringa (quando non è applicata alla cornea) impedirà la formazione di bolle d'aria, nonché occlusioni dovute alla polvere o accumulo di sali, nella punta micropipetta.
- Se la soluzione viene fuori come un flusso, sostituire la gmicropipetta lass, come l'apertura punta è troppo grande o è danneggiato.
- Posizionare con cura il microelettrodo registrazione nel micromanipolatore e collegare il cavo al sistema di registrazione.
6. Analisi Elettroretinogramma
NOTA: A causa del predominio cono della retina larvale, risultati di ERG di alta qualità possono essere ottenuti quando i preparativi per la registrazione vengono eseguite sotto bassi livelli di luce bianca indiretta (<1 lux) o con brevi periodi (<1 min) di maggiore intensità ( ≤250 lux) Luce di lavoro. È quindi richiesto un breve periodo di adattamento al buio prima della registrazione (vedere il passaggio 6.7). Tuttavia, gli esperimenti possono essere eseguiti in fioca luce rossa o infrarossa utilizzando una telecamera a raggi infrarossi sensibile. Tutti gli esperimenti sono stati eseguiti in (0,22 micron) di acqua sistema di filtraggio-sterilizzato dal Fondo UNC Zebrafish acquacoltura, i media alternativi di embrioni possono essere utilizzati.
- Tagliare asciugamani di carta quadrato di misura di circa 1cm 2.
- Se misurazione isolato potenziale recettore massa cono, incubare 3-5 larve in acqua sistema con 500 pM (±) -2-Amino-4-fosfonobutirrico acido (APB) per 5 min.
NOTA: Mentre APB è una miscela racemica di attivo (L) e inattive (R) forme di AP4, è efficace come L-AP4 ed è meno costoso. - Anestetizzare 3-5 larve in acqua sistema con 0,02% (w / v) Tricaine fino risponde, circa 1-2 min.
- Utilizzare una pompa pipetta e pipetta Pasteur per trasferire con attenzione larve individuale su carta assorbente quadrati sotto uno stereoscopio dissezione con illuminazione minima (≤250 lux per <1 min). Controllare la posizione di ogni larva e scegliere un candidato che è dorsale verso l'alto con un occhio non occluse.
- Per le registrazioni estese (> 30 min), mantenere la larva umido dal vetro il corpo fino a, ma non compresa la testa con 3% metilcellulosa con un pennello fine di peli di cammello.
- Utilizzando pinze, trasferire il tovagliolo di carta piae con la larva alla spugna umida PVA.
- Per le registrazioni estese (> 30 min), applicare un flusso continuo di saturo d'acqua 100% O 2 gas sopra la larva facendo gorgogliare il gas attraverso una pietra porosa in un pallone braccio laterale contenente acqua distillata. Posizionare il tubo uscita dal braccio laterale pallone che convoglia l'ossigeno umidificato vicino alla testa del larva.
NOTA: Passo 6.4.1 e 6.5.1 passo sarà prolungare la vita dei pesci 16.
- Per le registrazioni estese (> 30 min), applicare un flusso continuo di saturo d'acqua 100% O 2 gas sopra la larva facendo gorgogliare il gas attraverso una pietra porosa in un pallone braccio laterale contenente acqua distillata. Posizionare il tubo uscita dal braccio laterale pallone che convoglia l'ossigeno umidificato vicino alla testa del larva.
- Sotto illuminazione minima, utilizzare il micromanipolatore e fotocamera per posizionare la punta microelettrodo a metà tra il nasale e le estremità caudale dell'occhio e premere delicatamente sul limite dorsale della cornea.
NOTA: smarrimento della punta dell'elettrodo alle zone distali lontano della cornea può provocare ERG forme d'onda di polarità invertita. - Lasciare larva di dark-adattamento per 5-10 min.
- Registra le risposte di prova in flash per luce fornita da una sorgente luminosa a LED o stimolatore ottico utilizzando il Available stimolazione e registrazione attrezzature. Regolare i parametri del protocollo come l'intensità del flash, lunghezza flash, il colore del flash, l'intensità e il colore di sfondo e filtro impostazioni per adattarsi l'esperimento.
- Al termine con l'esperimento, eutanasia larve secondo le linee guida AVMA / IACUC.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Tipicamente, ERG sono registrati da larve di zebrafish a 5 dpf, dal momento che un certo numero di studi hanno pubblicato le registrazioni ERG in questa fase 9, 16,20. Risposte larvali sono stati misurati in condizioni di oscurità adattato senza retroilluminazione utilizzando uno stimolo 20 msec di luce LED bianca. Abbiamo utilizzato un sistema di ERG disponibile in commercio costituito da uno stimolatore luce Ganzfeld e computer di controller / registratore. Lo stimolatore utilizza un sistema di modulazione a larghezza di impulsi strettamente controllata proprietario (PWM) per controllare la luminanza sia lo sfondo e flash stimolo. Le risposte sono state registrate con un amplificatore interamente differenziale proprietario con un filtro anti-aliasing hardware guidare una analogico 16 bit convertitore digitale (ADC). Stimolo e risposta registrazioni sono state controllate dal software proprietario fornito con l'apparecchiatura secondo il protocollo del produttore. Le nostre attrezzature è stato programmato di utilizzare una frequenza di campionamento di 1 kHz, digitale casc Besselfiltri ade impostati una banda passante compresa tra 0.312 Hz e 300 Hz, e un filtro notch 60 Hz per rimuovere il rumore eccesso. Nel larva adattata al buio gli aumenti b-wave in ampiezza con crescente intensità di luce (Figura 1). L'a-onda è tipicamente oscurata dal b-wave e non può essere rilevato in modo affidabile. La b-wave può essere bloccato incubando larve con l'agonista dei recettori metabotropici del glutammato (mGluR6), acido 4-fosfono-butirrico (APB). Questo permette il potenziale di massa del recettore cono (o "a-wave") da rilevare. Questo "a-onda" aumenti di risposta in ampiezza con crescente intensità di luce (Figura 2).
Paradigmi aggiuntivi possono essere utilizzati per testare parametri visive oltre funzione visiva base e sensibilità. Attraverso l'uso di un paradigma doppio flash, si può misurare la capacità del fotorisposta cono di recuperare dalla stimolo iniziale (Figura 3A). Come l'intervallo interstimulus(ISI) aumenta, l'ampiezza della seconda aumenti di risposta, che indica il recupero dallo stimolo iniziale (Figura 3B). Le APB-isolati "a-onda" tracce presentati sono la media di tre passate e sono conformi ai rapporti pubblicati dei zebrafish ERG larvali che utilizzano simili paradigmi di stimolazione 2, 9,16.
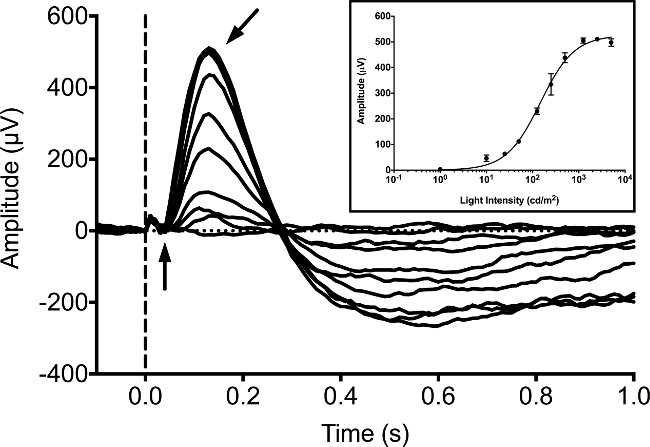
Figura 1: registrazione ERG tipica in 5 dpf zebrafish larvale. La serie intensità è stato ottenuto in condizioni di oscurità adattato. I pesci sono esposti a luce bianca LED per una durata di 20 msec con intensità pari 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 e 5.000 cd / m 2. L'insorgenza di stimolo luminoso è indicato dalla linea verticale tratteggiata. Il potenziale a-onda negativa (freccia verticale) è difficile distinguere, mentre il positivopotenziale b-wave (freccia angolato) è il picco dominante della forma d'onda. Un piccolo artefatto fotovoltaico si può osservare come una deflessione positiva minore prima dell'inizio della a-onda. Inset, media ampiezze di risposta b-wave con crescente intensità di luce che sono stati in forma con l'equazione Naka-Rushton 21, 22. Barre di errore rappresentano SEM.

Figura 2: cono APB-isolati potenziale del recettore di massa registrato da zebrafish larvale serie Intensity ottenuto in condizioni di oscurità adattato a 5 dpf.. Lo stimolo è una luce bianca di 20 msec a LED con intensità pari all'1, 10, 25, 50 125, 250, 500, 1.250, 2.500 e 5.000 cd / m 2. L'insorgenza di stimolazione luminosa è indicata dalla linea verticale tratteggiata. L'isolato massa cono recettore potenziale ("a-wave") è l'elemento dominante della forma d'onda (freccia). Un piccolofotovoltaico manufatto può essere osservata come una deviazione positiva minore prima della comparsa della risposta cono. Inset, media ampiezze di risposta con l'aumento di intensità di luce che sono stati in forma con l'equazione Naka-Rushton. Barre di errore rappresentano SEM.

Figura 3:.. Cone recettore potenziale massa di registrazione utilizzando un paradigma doppio flash a 5 dpf larva APB trattato è stato sottoposto a due lampi 20 msec di luce bianca (sorgente LED), ciascuno con una intensità di 1000 cd / m 2 (A) La risposta a 2 lampi successivi con un intervallo interstimulus (ISI) pari a 2 sec. Esposizioni leggeri sono caratterizzati da linee verticali tratteggiate. L'ampiezza della seconda risposta è inferiore a quella della prima risposta, che indica il recupero risposta incompleta. (B) Il rapporto del cono isolato recettore massa poten massimaziale risposta del secondo stimolo a quella dello stimolo iniziale per ogni ISI. È stata applicata una analisi di regressione non lineare best-fit. Come il ISI aumenta, la risposta al secondo aumento di stimolo in ampiezza relativa alla risposta allo stimolo iniziale indica progressivo recupero della sensibilità dei fotorecettori. Cliccate qui per vedere una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In questo protocollo una procedura semplice per ERG registrazioni di zebrafish larvale è dettagliata. Questa procedura consente una analisi rapida e completa di function.There visiva sono diversi passaggi critici della procedura che dovrebbe essere tenuto in considerazione. Le larve zebrafish deve essere in buona salute prima dell'esperimento per evitare la morte durante i potenziali trattamenti farmacologici e garantire il sostentamento prolungata durante le registrazioni ERG. Inoltre, è importante che le larve utilizzato in esperimenti sono strettamente pari età. Ciò è dovuto al rapido sviluppo della retina (cioè, lo sviluppo differenziale dei sottotipi cono) e anche la morfologia complessiva e fisiologia delle larve. Ad esempio, dopo 7 dpf l'efficienza della traspirazione epiteliale diminuisce rendendo più difficile mantenere vivo il pesce. Un altro fattore importante è la qualità degli elettrodi di registrazione e di riferimento. Bisogna fare attenzione quando si tira capillari di vetro per evitare ruvido tips. Un microforge micropipetta potrebbe essere impiegato al fuoco-polacco tirato elettrodi e contribuiscono a migliorare l'acquisizione del segnale. Inoltre, mantenendo la qualità degli elettrodi Ag / AgCl è molto importante. Dopo l'uso, devono essere lavate con acqua distillata ed essiccato all'aria immediatamente. Mentre inscurimento della superficie esterna di elettrodi possono verificarsi nel tempo e non influisce sulle prestazioni, appannato (giallo al rosso scuro) o elettrodi denocciolate dovrebbero essere evitati. Evitare di elettrodi di gestione a mani nude, come la contaminazione di proteine può influenzare negativamente il comportamento degli elettrodi. Infine, va rilevato che gli elettrodi Ag / AgCl sono fotosensibili e possono causare artefatti in flash se non protetto. Tuttavia, abbiamo trovato questi artefatti per essere minima (vedi leggende di figure 1 e 2) e non interferiscono con le nostre misurazioni delle risposte zebrafish larvale a lampeggiare stimoli. In alternativa, un ponte sale può essere usato per collegare l'elettrodo Ag / AgCl sulla spugna tramite un sa agarponte lt per spostare l'elettrodo dal percorso ottico. Sebbene un ponte salino è usato in corrente continua (DC) registrazioni dirette a stabilizzare il potenziale dell'elettrodo 23, la registrazione ERG utilizza corrente alternata (AC). Pertanto l'unico scopo di un ponte salino in questo sistema sarebbe se la configurazione particolare ha vincoli di spazio o particolarmente forti artefatti fotovoltaici.
ERG ha diversi vantaggi rispetto ad altre tecniche per misurare la funzione visiva. Il vantaggio principale è che si tratta di una registrazione in vivo. Lo svantaggio è che l'attività di cellule specifiche deve essere dedotto dalla forma d'onda piuttosto che misurata direttamente, come sarebbe il caso per elettrodi aspirazione o patch clamp registrazioni di fotorecettori e altre cellule della retina. Normalmente, registrazioni elettrodo di aspirazione, registrazioni patch clamp e tutta retina ERG hanno il vantaggio che gli agenti farmacologici possono essere facilmente introdotti nelle cellule per definire i componenti molecolaridella risposta, che è più difficile in vivo utilizzando modelli di mammifero. La permeabilità delle larve zebrafish a tali agenti supera questo inconveniente.
Analisi di larve adattata al buio in assenza di agenti farmacologici produce una forma d'onda ERG dominata dalla b-wave, un risultato che è stato osservato da un certo numero di altri gruppi 2, 9,24 -26. Dimostriamo la capacità di isolare il potenziale del recettore massa cono sfruttando la capacità di agenti farmacologici per penetrare zebrafish larvale. Larve trattati con APB visualizzare l'abrogazione della b-wave, permettendo "a onda" per essere visualizzati 14-17. Le forme d'onda con eccellente rapporto segnale rumore sono stati ottenuti da una media di 3 spazza. Variazione delle forme d'onda di risposta a volte è notato, ma Makhankov et al. 2 hanno riferito che la varianza di misure ripetute dello stesso animale è menodi quella vista tra gli individui. Pertanto, la varianza è probabilmente il risultato di variazione biologica piuttosto che la variabilità nella tecnica.
Abbiamo anche utilizzato analisi ERG esaminare recupero cono in vivo usando un paradigma doppio flash, simili ai risultati pubblicati in presenza e assenza di retroilluminazione 9, 16. Ciò è stato realizzato misurando la capacità della retina larvale di rispondere a lampi successive di varia ISI. Se utilizzato in combinazione con agenti farmacologici o strategie di ingegneria del genoma quali Talens per mettere fuori target pathway, il pesce zebra è potente sistema per lo studio in vivo dei meccanismi molecolari di adattamento del cono e recupero visivo.
La nostra procedura e le attrezzature possono essere facilmente adattati per esaminare isolate occhi larvali, zebrafish anziani o altri vertebrati 27, 28. Infatti, il sistema di stimolazione e la registrazione ERGche impieghiamo è stato principalmente progettato per l'uso in ambito clinico e poi modificato per la sperimentazione sui topi. Adattare la piattaforma per le larve zebrafish è stato semplice e potrebbe essere facilmente replicato in altri laboratori per basso costo. Configurazioni simili, comprensivi di attrezzature elettrofisiologica classica potrebbero essere costruiti per un costo minimo, e hanno dimostrato di fornire risultati affidabili 16. Nel complesso, questa tecnica è di grande beneficio per i ricercatori che studiano i meccanismi della funzione visiva.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Nessun conflitto di interessi dichiarati.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



