Abstract
El electrorretinograma (ERG) es un método electrofisiológico no invasivo para determinar la función de la retina. A través de la colocación de un electrodo en la superficie de la córnea, la actividad eléctrica generada en respuesta a la luz puede ser medido y utilizado para evaluar la actividad de las células de la retina in vivo. Este manuscrito describe el uso de la ERG para medir la función visual en el pez cebra. El pez cebra se han utilizado mucho como modelo para el desarrollo de vertebrados debido a la facilidad de la supresión de genes por los oligonucleótidos de morfolino y la manipulación farmacológica. En 5-10 dpf, sólo los conos son funcionales en la retina larval. Por lo tanto, el pez cebra, a diferencia de otros animales, es un poderoso sistema modelo para el estudio de la función visual cono in vivo. Este protocolo utiliza anestesia estándar, micromanipulación y protocolos estereomicroscopía que son comunes en los laboratorios que realizan investigación de pez cebra. Los métodos descritos hacen uso de la ecuación de electrofisiología estándarCONEXIONES y una cámara de poca luz para guiar la colocación de la grabación de microelectrodos sobre la córnea larval. Por último, demostrar cómo un comercialmente disponible ERG estimulador / grabador diseñado originalmente para su uso con ratones se puede adaptar fácilmente para su uso con el pez cebra. ERG de larvas de pez cebra ofrece un excelente método de ensayo de la función visual de cono en los animales que han sido modificados por la inyección de oligonucleótido morfolino, así como las técnicas de ingeniería del genoma más recientes, como los dedos de zinc nucleasas (ZFNs), Transcripción Activador-Como Efector Nucleasas (Talens), y agrupados Regularmente Interspaced cortos Palindromic Repeticiones (CRISPR) / Cas9, todos los cuales han aumentado en gran medida la eficiencia y la eficacia de la orientación de genes en el pez cebra. Además, aprovechamos la capacidad de los agentes farmacológicos para penetrar en larvas de pez cebra para evaluar los componentes moleculares que contribuyen a la fotorrespuesta. Este protocolo describe una configuración que puede ser modificado y utilizado por los investigadorescon varios objetivos experimentales.
Introduction
El electrorretinograma (ERG) es un método electrofisiológico no invasiva que se ha utilizado ampliamente en la clínica para determinar la función de la retina en los seres humanos. La actividad eléctrica en respuesta a un estímulo de luz se mide mediante la colocación de electrodos de registro en la superficie externa de la córnea. Las características del paradigma estímulo y la respuesta de la forma de onda definen las neuronas de la retina que contribuyen a la respuesta. Este método ha sido adaptado para su uso con un número de modelos animales, incluyendo ratones y pez cebra. La respuesta típica de vertebrados ERG tiene cuatro componentes principales: la onda a, que es un potencial córnea negativa derivada de la actividad de las células fotorreceptoras; la onda b, un potencial córnea positivo derivado de la EN células bipolares; la onda d, un potencial de córnea positiva interpretarse como la actividad de las células bipolares OFF; y la onda c, que se produce varios segundos después de la onda b y refleja la actividad en las células de Müller y la retinal epitelio pigmentario de 1-4. Referencias adicionales para la comprensión de la historia y los principios de análisis de ERG en humanos y modelos animales son el libro de texto en línea, Webvision, de la Universidad de Utah y textos tales como los Principios y Práctica de Electrofisiología Clínica de la Visión 4, 5.
Danio rerio (pez cebra) ha sido favorecido como un modelo para el desarrollo de vertebrados, debido a su rápida maduración y la transparencia, que permite el análisis morfológico no invasiva de órganos y sistemas, ensayos de comportamiento y de ambos adelante y atrás pantallas genéticos (para una revisión, ver Fadool y Dowling 6). Larvas de pez cebra son altamente susceptibles de manipulación genética y farmacológica, que, cuando junto con su alta fecundidad, los hacen un excelente modelo animal para los análisis biológicos de alto rendimiento. La mayor proporción de conos para varillas en larvas de pez cebra - aproximadamente 1: 1 en comparación con ratones (~ 3% de conos) - hacen particularmente útiles para el estudio de la función de cono 7-9.
En la retina de los vertebrados, los conos se desarrollan antes de varillas 10. Curiosamente, los conos de pez cebra son operativos ya en 4 dpf, permitiendo selectiva análisis electrofisiológico de conos en esa etapa 6, 11,12. En contraste, las respuestas de ERG en barras aparecen entre 11 y 21 dpf 13. Por lo tanto, las larvas de pez cebra a 4-7 servir dpf funcionalmente como una retina todo-cono. Sin embargo, la respuesta fotópica nativo ERG de 4-7 larvas dpf está dominada por la onda b. La aplicación de agentes farmacológicos, tales como L - (+) - 2-amino-4-fosfono-butírico (L-AP4), un agonista para el glutamato metabotrópicos (mGluR6) receptor expresado por la sobre las células bipolares, bloquea eficazmente la generación de la onda b y revela el potencial de masa aislado cono receptor, (la "onda a") 14-17.
Aquí se describe un simple y reliablmétodo para el análisis e ERG usando equipo ERG comercial, diseñado para su uso con ratones que han sido adaptados para su uso con las larvas de pez cebra. Este sistema puede ser utilizado en larvas de pez cebra de diferentes antecedentes genéticos, así como los tratados con agentes farmacológicos, para ayudar a los investigadores en la identificación de las vías de señalización que contribuyen a la sensibilidad visual y adaptación a la luz 16. Los procedimientos experimentales descritos en este protocolo guiarán los investigadores en el uso del análisis de ERG para responder a una variedad de cuestiones biológicas relativas a la visión, y demostrar la construcción de una configuración flexible de ERG.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
El mantenimiento de los animales y los protocolos experimentales fueron aprobados por los comités de Cuidado y Uso de Animales Institucional de la Universidad de Carolina del Norte en Chapel Hill, y cumplen con todos los requisitos de la Oficina de NIH de Laboratorio Bienestar Animal y la Asociación para la Evaluación y Acreditación de Laboratorio Animal Care International.
Se emplearon Para obtener larvas para el análisis ERG, publicado protocolos para la cría de peces cebra estándar y mantenimiento 18: NOTA. Las larvas se obtiene a través de la reproducción natural y alojado bajo un 14 h luz / 10 h oscuridad ciclo. Este protocolo ha sido optimizado para las larvas a los 5-7 días después de la fertilización (DPF), pero lo ideal podría ser realizado en peces de más edad con pequeñas modificaciones en el procedimiento. En este caso, utilice la cepa TL de larvas de pez cebra de tipo salvaje a 5 dpf.
1. Micropipetas Producción
- Tire varias micropipetas utilizando 1,5 x 0,86 mm (diámetro exterior de diámetro interior) capilares de vidrio de borosilicato pulidas al fuego confilamento (temperatura de fusión, 821 ° C) y un P-97 Flaming / Castaño Micropipeta Puller equipado con filamento de calor caja. Utilice el programa para la configuración de micropipetas descritos en la Tabla 1.
- Compruebe cada micropipeta con un microscopio con un gobernante retícula apropiada para asegurar que los consejos están a 10-15 m de diámetro y tiene una abertura de la punta suave (es decir, sin bordes dentados).
- Guarde cuidadosamente micropipetas para prevenir el daño de la punta y la exposición al polvo. Las opciones de almacenamiento incluyen placas de Petri con cinta laboratorio, cajas de espuma forrada, o contenedores de almacenamiento micropipeta disponibles en el mercado.
Nota: Otros extractores de micropipeta de vidrio y los capilares se pueden utilizar siempre y cuando el diámetro correcto de la micropipeta y se consigue una punta de alta calidad.
| Presión | Calor | Halar | Velocidad Tiempo | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabla 1: Programa para la producción de micropipetas utilizando un / marrón micropipeta Puller P-97 Flaming equipado con un filamento de calor cuadro Micropipetas se hacen usando 1,5 x 1,0 mm 2 (diámetro externo por el diámetro interior) capilares de vidrio de borosilicato pulidas al fuego con filamento. (temperatura de fusión, 821 ° C).
2. Preparación Buffer
- Use filtrada, tampón de Ringer oxigenada goldfish 19 en el capilar microelectrodo y para saturar la esponja de alcohol de polivinilo (PVA) sobre el que las larvas se colocan para los experimentos. Como alternativa, utilice el E3 medios embrión o solución salina equilibrada de Hank.
- Prepare la solución 10x goldfish de Ringer como se describe en la Tabla 2. Ajustar a pH 7,8, y esterilizar usando un filtro de 0,22 micras y almacenar la 10x a 4 ° C.
- Crear una solución de trabajo en el día del experimento diluyendo solución del 10x de Ringer a 1x con agua destilada desionizada. Filtra el uso de un sistema de filtro de 0,22 micras. De compuestos oxigenados por burbujeo con 95% de O2 / 5% de CO 2 de gas durante 10 minutos. Cap herméticamente después para asegurar que la solución permanece oxigenada.
| NaCl | 1,25 M |
| KCl | 26 mM |
| CaCl 2 | 25 mM |
| MgCl 2 | 10 mM |
| glucosa | 100 mM |
| HEPES | 100 mM |
3. Plataforma Electrorretinograma
- Realizar experimentos ERG en una mesa de anti-vibración dentro de una jaula de Faraday para mejorar la relación señal a ruido. Adjunte una plataforma de acero de encargo a la mesa antivibraciones usando tuercas hexagonales. Coloque una plataforma de plástico movible con un polímero de uretano inferior amortiguador viscoelástico sobre la mesa bajo la fuente de luz.
- Coloque la cámara con un soporte imantado, dirigido hacia abajo en la plataforma móvil de plástico. Coloque el micromanipulador (que celebrará el microelectrodo grabación) con un segundo soporte imantado a la derecha de la plataforma de plástico movible. Asegúrese de que la cámara y el micromanipulador no se verá afectado por el movimiento de otros equipos y que no bloqueen la iluminación de la fuente de luz.
- Conecte la cámara a un monitor de vídeo y posicionarlo para ver el ojo de lalarva para colocar el electrodo en la posición correcta.
- Asegúrese de que la configuración correcta conexión a tierra con cable de cobre. Para comprobar el ruido, colocar el electrodo de referencia y la punta de la microelectrodo grabación en una placa de Petri de 35 mm llena con solución de Ringer. Compruebe los niveles de ruido eléctrico de la instalación con un osciloscopio o una característica incorporada del aparato ERG. Los niveles de ruido deben ser no más de ± 10 mV del valor inicial.
4. Preparación de la esponja
- Corte un pequeño rectángulo de esponja PVA seco que se ajuste perfectamente en un plato de Petri de 35 mm. El espesor de la esponja no debe ser mayor que la profundidad del plato. Use un cuchillo con una hoja de afeitar limpia para cortar.
- Hacer un recorte adicional en la esponja para acomodar el electrodo de referencia (ya sea un corte superficial a lo largo en la parte inferior de la esponja o una mariposa cortado verticalmente a través de uno de los extremos más pequeños).
- Use un marcador resistente químicamentepara marcar un pequeño punto en la esponja (donde se colocará la larva) que puede ser utilizado para el posicionamiento de la cámara.
- Sumerja la esponja PVA en solución de Ringer hasta saturación. Retire y seque rápidamente sobre una toalla de papel 2-3 veces. Coloque la esponja en un recipiente limpio 35 mm placa de Petri.
- Coloque la placa de Petri que contiene la esponja en la plataforma de plástico tal que la marca puede ser visualizada por la cámara.
5. Preparación del electrodo
NOTA: La configuración de pez cebra se compone de un electrodo de referencia en contacto con una solución saturada de esponja de PVA de Ringer y un electrodo de registro en contacto con la córnea. El electrodo de referencia se compone de un pellet de Ag / AgCl. El electrodo de registro es una micropipeta de vidrio tirado lleno de solución de Ringer y sostenido por un soporte de microelectrodos que contiene un alambre de Ag.
- Cloruro de los electrodos sumergiéndolos en 9.6% de hipoclorito de sodio (lejía) durante 5 minutos (el micr grabaciónalambre oelectrode) o 15 min (el electrodo de referencia). Deje secar al aire en un Kimwipe durante 5 min.
- Dependiendo del estilo de corte hecho en el paso 4.2, colocar la pastilla de Ag / AgCl del electrodo de referencia en (para el corte de mariposa vertical) o bajo (para el corte superficial longitudinal en la parte inferior) de la esponja. Conecte el cable del electrodo de referencia al sistema de grabación.
- Alternativamente, si la configuración de ERG tiene limitaciones de espacio o no son particularmente fuertes artefactos fotovoltaicas desde el electrodo de Ag / AgCl, conectar el electrodo de referencia a la esponja a través de un puente salino de agar para mover el electrodo fuera de la trayectoria de la luz.
- Adjuntar ~ 40 cm de tubo de tamaño apropiado a un 5 ml no Luer de la jeringa de bloqueo. Llene la jeringa con solución de Ringer. Titulares de microelectrodos que poseen puertos de presión envían típicamente con adaptadores para acomodar tubos con diámetros interiores de 1/16 ", 3/32", 1/8 "o 5/32".
- Llene un 1 ml Luer no jeringa con bloqueoSolución de Ringer y, con un Micro-fil, llenar cuidadosamente el titular de microelectrodos. Evitar la formación de burbujas.
- Coloque la jeringa de 5 ml al puerto de presión del titular de microelectrodos con tubo y lo utilizan para garantizar que el titular de microelectrodos está lleno de solución de Ringer. Uso de la Micro-fil y 1 ml jeringa llena con solución de Ringer, llenar el vaso micropipeta de la punta y asegúrese de que no hay burbujas.
- Coloque la micropipeta de vidrio al titular de microelectrodos, teniendo cuidado de mantener la recta de alambre electrodo. Una vez asegurado, utilice la jeringa de 5 ml para forzar cuidadosamente la solución de Ringer a través del microelectrodo hasta que una pequeña cantidad de solución es visible en la punta. Aplicación ocasional de la presión a la jeringa (cuando no se aplica a la córnea) evitará la formación de burbujas de aire, así como oclusiones debidas a la acumulación de polvo o sal, en la punta de la micropipeta.
- Si la solución sale como una corriente, sustituya el gmicropipeta muchacha, como la abertura de la punta es demasiado grande o está dañado.
- Con cuidado, coloque el microelectrodo de grabación en el micromanipulador y conecte el cable al sistema de grabación.
6. Análisis Electrorretinograma
NOTA: Debido al predominio de cono de la retina de larvas, resultados ERG de alta calidad se pueden obtener cuando los preparativos para la grabación se realizan bajo los bajos niveles de luz blanca indirecta (<1 lux) o con períodos cortos (<1 min) de mayor intensidad ( ≤250 lux) Luz de trabajo. Un breve período de adaptación a la oscuridad todavía se requiere antes de la grabación (consulte el paso 6.7). Sin embargo, los experimentos pueden llevarse a cabo bajo la luz roja o infrarroja tenue con una cámara sensible al infrarrojo. Todos los experimentos se realizaron en esterilizada por filtración (0,22 micras) del agua del sistema de la Línea de UNC pez cebra acuicultura pero los medios de embrión de alternativas pueden ser utilizados.
- Cuadrados de toallas de papel cortadas que miden aproximadamente 12 cm.
- Si la medición aislada potencial receptor masa cono, incubar 3-5 larvas en el agua del sistema con 500 mM (±) -2-4-fosfonobutírico Amino ácido (APB) durante 5 min.
NOTA: Mientras APB es una mezcla racémica de la activa (L) y (R) formas inactivas de AP4, es tan eficaz como la L-AP4 y es menos costoso. - Anestesie 3-5 larvas en agua del sistema con 0,02% (w / v) tricaína hasta que no responde, aproximadamente 1-2 min.
- Utilice una pipeta y una pipeta Pasteur bomba para transferir cuidadosamente larvas individuales en las casillas de toallas de papel en un estereoscopio de disección utilizando iluminación mínima (≤250 lux para <1 min). Compruebe la posición de cada larva y elegir un candidato que es dorsal hacia arriba con un ojo no ocluida.
- Para grabaciones prolongadas (> 30 min), mantener la larva húmeda acristalamiento cuerpo hasta, pero sin incluir la cabeza con 3% de metilcelulosa usando un cepillo de pelo de camello bien.
- Con unas pinzas, transfiera el squar toalla de papele con la larva de la esponja PVA húmedo.
- Para grabaciones prolongados (> 30 min), aplicar una corriente continua de agua saturada de 100% de O 2 de gas sobre la larva por burbujeo del gas a través de una piedra de aire en un matraz de brazo lateral que contiene agua destilada. Coloque el tubo que sale de la boca lateral frasco que transporta el oxígeno humidificado cerca de la cabeza de la larva.
NOTA: El paso 6.4.1 y 6.5.1 paso para prolongar la vida de los peces 16.
- Para grabaciones prolongados (> 30 min), aplicar una corriente continua de agua saturada de 100% de O 2 de gas sobre la larva por burbujeo del gas a través de una piedra de aire en un matraz de brazo lateral que contiene agua destilada. Coloque el tubo que sale de la boca lateral frasco que transporta el oxígeno humidificado cerca de la cabeza de la larva.
- Bajo iluminación mínima, utilice el micromanipulador y cámara para posicionar la punta de microelectrodos en el punto medio entre la nasal y extremos caudales de los ojos y presione suavemente sobre el límite dorsal de la córnea.
NOTA: El mal posicionamiento de la punta del electrodo a las áreas distales de la medida de la córnea puede dar lugar a formas de onda ERG de polaridad invertida. - Permita larva a oscuro-adaptarse durante 5-10 minutos.
- Respuestas de flash protocolo de ensayo a la luz proporcionada por una fuente de luz LED o estimulador óptica utilizando el avaiequipos de estimulación y registro lable. Ajustar parámetros de protocolo, como la intensidad del flash, flash de longitud, color flash, intensidad de fondo y ajustes de color y filtros para adaptarse a la experiencia.
- Cuando haya terminado con el experimento, la eutanasia larvas según las directrices de la AVMA / IACUC.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Típicamente, los ERG se registran a partir de larvas de pez cebra a 5 dpf, ya que un número de estudios han publicado grabaciones ERG en esta etapa 9, 16,20. Respuestas de larvas se midieron en condiciones adaptadas a la oscuridad sin iluminación de fondo utilizando un 20 mseg estímulo de la luz LED blanco. Hemos utilizado un sistema ERG disponible comercialmente que consiste en un estimulador Ganzfeld luz y equipo de controlador / grabadora. El estimulador utiliza una modulación de ancho de sistema para controlar la luminancia de tanto el fondo como estímulo de flash muy controlado pulso propietario (PWM). Las respuestas se registraron utilizando un amplificador diferencial patentada totalmente con un filtro anti-aliasing hardware conducción de un análogo de 16 bits al convertidor digital (ADC). Estímulo y respuesta grabaciones fueron controlados por el software propietario que se incluye con el equipo de acuerdo con el protocolo del fabricante. Nuestro equipo estaba programado para utilizar una frecuencia de muestreo de 1 kHz, casc Bessel digitalesfiltros ade establecen en un paso de banda de entre 0.312 Hz y 300 Hz, y un filtro de muesca 60 Hz para eliminar el exceso de ruido. En la larva adaptada a la oscuridad de los b-onda aumenta en amplitud con el aumento de la intensidad de luz (Figura 1). La onda es típicamente un oscurecida por la onda b y no se puede detectar de forma fiable. La onda b puede ser bloqueada por incubación de las larvas con el agonista del receptor de glutamato metabotrópico (mGluR6), ácido 4-fosfono-butírico (APB). Esto permite que el receptor potencial de masa cono (o "de onda a") para ser detectado. Este "una ola" respuesta aumenta en amplitud con el aumento de intensidad de luz (Figura 2).
Paradigmas adicionales pueden ser utilizados para probar los parámetros visuales más allá de la función visual básica y sensibilidad. Mediante el uso de un paradigma de flash dual, se puede medir la capacidad de la fotorrespuesta cono para recuperarse de la estímulo inicial (Figura 3A). A medida que el intervalo inter-(ISI) aumenta, la amplitud de los segundos incrementos de respuesta, lo que indica la recuperación del estímulo inicial (Figura 3B). Las huellas aisladas-APB "una onda" presentados son el promedio de tres barridos y se ajustan a los informes publicados de los peces cebra ERG larvas utilizan paradigmas de estimulación similares 2, 9,16.
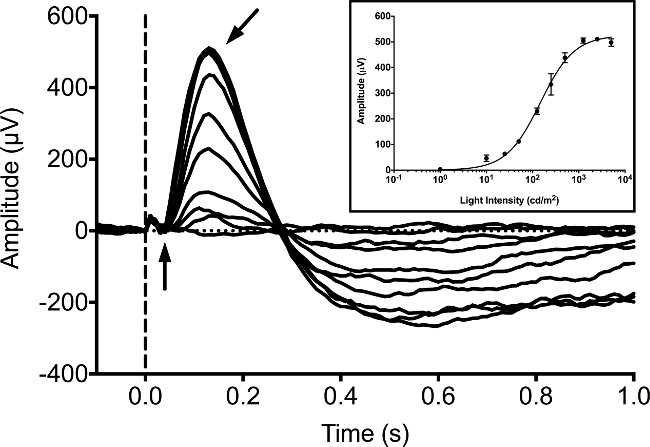
Figura 1: Grabación ERG típica en 5 dpf larvas de pez cebra. La serie intensidad se obtuvo en condiciones adaptadas a la oscuridad. Los peces se exponen a la luz blanca LED para una duración de 20 ms con intensidades igualando 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 y 5.000 cd / m 2. El inicio de estímulo de luz se denota por la línea vertical de puntos. El potencial de una onda negativa (flecha vertical) es difícil distinguir, mientras que el positivopotencial de la onda b (flecha en ángulo) es el pico dominante de la forma de onda. Un pequeño artefacto fotovoltaica se puede observar como una menor deflexión positiva antes del inicio de la onda a. Inserción, promedió amplitud de la respuesta de la onda b con el aumento de la intensidad de la luz que se han encajar utilizando la ecuación de Naka-Rushton 21, 22. Las barras de error representan SEM.

Figura 2: aislado-APB cono potencial receptor masa grabado de larvas de pez cebra serie Intensidad obtenido en condiciones adaptadas a la oscuridad a 5 dpf.. El estímulo es una luz blanca 20 mseg LED con intensidades que equivale a 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 y 5.000 cd / m 2. El inicio de la estimulación de luz se denota por la línea vertical de puntos. El aislado receptor masa cono potencial ("una onda") es el elemento dominante de la forma de onda (flecha). Una pequeñaartefacto fotovoltaica se puede observar como una menor deflexión positiva antes del inicio de la respuesta de los conos. Inserción, promedió amplitudes de respuesta con el aumento de la intensidad de la luz que se han encajar utilizando la ecuación de Naka-Rushton. Las barras de error representan SEM.

Figura 3:.. Cono receptor masa potencial de grabación utilizando un paradigma de flash dual a 5 dpf larva tratado-APB fue sometido a dos flashes 20 ms de luz blanca (fuente LED), cada uno con una intensidad de 1.000 cd / m 2 (A) La respuesta a 2 destellos sucesivos con un intervalo inter (ISI) igual a 2 seg. Exposiciones de luz están marcados por líneas verticales punteadas. La amplitud de la segunda respuesta es inferior a la de la primera respuesta, lo que indica la recuperación de respuesta incompleta. (B) La relación de la máxima poten receptor masa aislado conoTial respuesta del segundo estímulo a la del estímulo inicial para cada ISI. Un análisis de regresión no lineal de ajuste óptimo se ha aplicado. A medida que aumenta la ISI, la respuesta a los segundos incrementos de estímulo de amplitud respecto a la respuesta al estímulo inicial que indica la recuperación progresiva de la sensibilidad de los fotorreceptores. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En este protocolo se detalla un procedimiento sencillo para grabaciones ERG de larvas de pez cebra. Este procedimiento permite un ensayo rápido y completo de function.There visual son varios pasos críticos de todo el procedimiento que se debe tener en cuenta. Las larvas de pez cebra debe estar sano antes del experimento para prevenir la muerte durante los tratamientos farmacológicos potenciales y asegurar medios de vida prolongada durante las grabaciones ERG. Además, es importante que las larvas utilizado en los experimentos están estrechamente emparejados por edad. Esto es debido al rápido desarrollo de la retina (es decir, el desarrollo diferencial de los subtipos de cono) y también la morfología general y la fisiología de las larvas. Por ejemplo, después de las 7 dpf la eficiencia de transpiración epitelial disminuye por lo que es más difícil de mantener con vida a los peces. Otro factor importante es la calidad de los electrodos de registro y de referencia. Se debe tener cuidado al tirar capilares de vidrio para evitar bordes rugosos tips. Un microforge micropipeta se podría emplear a fuego-pula tirado electrodos y ayuda a mejorar la adquisición de la señal. Además, el mantenimiento de la calidad de los electrodos de Ag / AgCl es muy importante. Después de su uso, deben ser enjuagados con agua destilada y se secaron al aire inmediatamente. Mientras que el oscurecimiento de la superficie exterior de los electrodos puede ocurrir con el tiempo y no afecta al rendimiento, empañado (amarillo a rojo oscuro) o electrodos sin hueso deben ser evitados. Evite electrodos de manipulación con las manos descubiertas, ya que la contaminación de proteínas puede afectar negativamente el comportamiento del electrodo. Por último, cabe señalar que los electrodos de Ag / AgCl son fotosensibles y pueden conducir a artefactos de flash si no se protegen. Sin embargo, hemos encontrado estos artefactos ser mínimo (ver leyendas de las figuras 1 y 2) y no interferir con las mediciones de las respuestas larvas de pez cebra a parpadear estímulos. Alternativamente, un puente de sal se puede utilizar para conectar el electrodo de Ag / AgCl a la esponja a través de un sa agarlt puente para mover el electrodo fuera de la trayectoria de la luz. Aunque un puente de sal se utiliza en (DC) grabaciones directos actuales para estabilizar el electrodo de potencial de 23, la grabación ERG utiliza corriente alterna (AC). Por lo tanto el único propósito de un puente de sal en este sistema sería si la configuración particular tiene limitaciones de espacio o particularmente fuertes artefactos fotovoltaicos.
ERG tiene varias ventajas sobre otras técnicas para medir la función visual. La principal ventaja es que es una grabación en vivo. La desventaja es que la actividad de las células específicas debe inferirse de la forma de onda en lugar de medir directamente, como sería el caso de los electrodos de succión o patch clamp grabaciones de fotorreceptores y otras células en la retina. Normalmente, las grabaciones de electrodos de succión, grabaciones de patch clamp y toda retina ERG tienen la ventaja de que los agentes farmacológicos pueden ser fácilmente introducidos en las células para definir los componentes molecularesde la respuesta, mientras que esto es más difícil en vivo utilizando modelos de mamíferos. La permeabilidad de las larvas de pez cebra a tales agentes supera esta desventaja.
Análisis de larvas adaptada a la oscuridad en ausencia de agentes farmacológicos produce una forma de onda ERG dominado por la onda b, un resultado que se ha observado por un número de otros grupos 2, 9,24 -26. Se demuestra la capacidad de aislar el potencial del receptor de masa de cono mediante el aprovechamiento de la capacidad de los agentes farmacológicos para penetrar en larvas de pez cebra. Las larvas tratadas con APB mostrar una abrogación de la onda b, permitiendo que la "onda a" para ser visualizado 14-17. Las formas de onda con una excelente relación señal-ruido se obtuvieron promediando 3 barridos. La variación en las formas de onda de respuesta se observó a veces, pero Makhankov et al. 2 han informado de que la varianza en mediciones repetidas del mismo animal es menosque la observada entre los individuos. Por lo tanto, la varianza es probable que sea el resultado de la variación biológica en lugar de variabilidad en la técnica.
También usamos el análisis ERG para examinar la recuperación de cono en vivo utilizando un paradigma de flash dual, similar a los resultados publicados en la presencia y ausencia de iluminación de fondo 9, 16. Esto se logró mediante la medición de la capacidad de la retina de larvas para responder a destellos sucesivas de diferentes ISI. Cuando se utiliza en combinación con agentes farmacológicos o estrategias de ingeniería del genoma tales como Talens para noquear a los objetivos de la vía, el pez cebra es potente sistema para el estudio in vivo de la mecánica molecular de la adaptación de cono y la recuperación visual.
Nuestro procedimiento y equipo pueden ser fácilmente adaptados para examinar los ojos de larvas de pez cebra mayores aislados, o de otros vertebrados 27, 28. De hecho, la estimulación y de grabación del sistema ERGque empleamos fue diseñado principalmente para su uso en un entorno clínico y luego modificado para la experimentación en ratones. La adaptación de la plataforma para larvas de pez cebra fue sencillo y fácilmente podría ser replicado en otros laboratorios de bajo costo. Configuraciones similares que consisten en equipo electrofisiológico clásica podrían ser construidos por un costo mínimo, y se han demostrado proporcionar resultados fiables 16. En general, esta técnica es de gran beneficio para los investigadores que estudian los mecanismos de la función visual.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
No hay conflictos de interés declarado.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



