Abstract
전위도 (ERG)은 망막의 기능을 결정하기위한 비 침습적 전기 생리 학적 방법이다. 각막의 표면에 전극의 배치를 통해, 전기적 활성도를 측정하여 생체 내에서 망막 세포의 활성을 평가하기 위해 사용할 수있는 광에 응답하여 생성. 이 원고 지브라 피쉬의 시각 기능을 측정 ERG의 사용을 설명한다. Zebrafish의 긴 인해 모르 폴리 노 올리고 뉴클레오티드 및 약리학 적 유전자 조작에 의한 억제의 용이함 척추 개발을위한 모델로서 이용되어왔다. 5-10 DPF에서, 만 콘 애벌레 망막 기능입니다. 따라서, 제브라 피쉬는 다른 동물과 달리, 생체 내에서 콘 시각 기능의 연구를위한 모델 강력한 시스템이다. 이 프로토콜은 표준 마취, 미세 조작 및 제브라 피쉬의 연구를 수행 실험실에서 흔히 실체 현미경 프로토콜을 사용합니다. 설명 방법은 표준 전기 생리학 EQ를 사용합니다uipment과 저조도 카메라는 애벌레 각막에 기록 미세 전극의 위치를 안내합니다. 마지막으로, 우리는 원래 쥐와 함께 사용하도록 설계된 시판 ERG 자극기 / 레코더 쉽게 지브라 피쉬 함께 사용하도록 적응 될 수있는 방법을 보여준다. 애벌레 제브라 피쉬의 ERG는 모르 폴리 노 올리고 뉴클레오타이드 주입에 의해 수정 된 동물에서 콘 시각 기능을 분석의 우수한 방법뿐만 아니라 아연 핑거 뉴 클레아 제 (ZFNs) 같은 새로운 게놈 엔지니어링 기술을 제공, 전사 활성제와 같은 이펙터 클레아 제 (TALENs) 및 정기적으로 클러스터 Interspaced 짧은 회문 반복 (CRISPR) / 크게 효율성과 제브라 피쉬에서 대상 유전자의 효능을 증가 모두 Cas9. 또한, 우리는 광 응답에 기여하는 분자 성분을 평가하기 지브라 피쉬 유충 침투되는 약물의 능력을 이용한다. 이 프로토콜은 변형 된 연구자에 의해 사용될 수있는 설정을 간략다양한 실험 목표.
Introduction
전위도 (ERG)은 인간의 망막 기능을 결정하기위한 임상에서 널리 사용되어 전기 생리 비 침습적 방법이다. 광 자극에 응답하여 전기적 활성도는 각막의 외부면에 기록 전극을 배치하여 측정된다. 자극 패러다임과 응답 파형의 특성이 반응에 기여하는 망막 신경 세포를 정의한다. 이 방법은 마우스와 관상어 동물 모델의 수와 함께 사용하도록되어왔다. 일반적인 척추 ERG 응답은 네 개의 주 성분 갖는다 : 시각 세포 유래의 활성 각막 마이너스 전위 파형 발생기; B-파도 극세포 ON으로부터 유도 각막 양의 전위; D-파도 OFF 쌍극 세포의 활동으로 해석 각막 양의 전위; 와 B 파 후 몇 초 발생하고 C-파, 뮐러 아교 세포와 RET 활동을 반영원고 판 색소 상피 1-4. 인간과 모델 동물에서 ERG 분석의 역사와 원리를 이해하기위한 추가 참조는 원칙과 비전 4, 5의 임상 전기 생리학의 연습으로 유타와 텍스트의 대학에서 온라인 교과서, WebVision을이다.
다니오의 레 리오 (rerio) (제브라 피쉬)는 긴 인해 기관 시스템, 행동 분석의 비 침습적 인 형태 학적 분석과 순방향 및 역방향 유전 화면 (검토를 위해, Fadool과를 볼 수 있습니다 급속한 성숙과 투명성에, 척추 개발을위한 모델로 선호되었다 다울 링 6). Zebrafish의 유충, 높은 생산력과 결합 할 때, 그 높은 처리량 생물학적 분석을위한 훌륭한 동물 모델 만드는 유전 및 약리 조작에 매우 의무가 있습니다. 애벌레 제브라 피쉬의 막대에 콘의 높은 비율 - 약 1 : 1 마우스 (~ 3 % 콘에 비해S) - 콘 기능 7-9의 연구에 특히 유용합니다.
척추 동물의 망막에서 콘로드 (10) 전에 개발. 흥미롭게도, 제브라 피쉬 콘은 그 단계 6, 11, 12에 콘의 선택적 전기 생리학 분석을 허용, 이르면 4 DPF로 동작한다. 반면, 막대의 ERG 응답은 11 21 13 DPF 사이에 나타납니다. 따라서, 4-7에서 제브라 피쉬의 유충은 DPF 모든 콘 망막으로 기능적 역할을한다. 그러나 4-7 DPF 유충의 기본 포토 픽 ERG 응답은 B 파에 의해 지배된다. (+) - - 2- 아미노 -4- 포스 포노 부티르산 (L-AP4), 대사성 글루타메이트에 대한 작용제 쌍극 세포에 의해 발현 (mGluR6) 수용체를 효과적으로 차단 예컨대 L로서 생성되는 약물의 응용 B 파의와 격리 된 콘 질량 수용체 가능성, ( "파") 14 ~ 17을 보여준다.
여기에서 우리는 간단하고 reliabl을 설명제브라 피쉬 애벌레와 함께 사용하도록 적응 된 생쥐와 함께 사용하도록 설계 ERG 시판 장비를 이용하여 ERG의 전자 분석 방법. 이 시스템은 시각 감도 및 빛 적응에 기여 16 신호 전달 경로의 식별을 돕기 위해 연구자, 유전 배경 변화뿐만 아니라 약리학 적 제제로 처리 된 것과 같은 지브라 피쉬의 유충에 이용 될 수있다. 이 프로토콜에 설명 된 실험 절차는 비전에 관한 생물학적 다양한 질문에 대답 ERG 분석의 사용에 수사관을 안내하고, 유연한 ERG 설정의 건설을 시연 할 예정이다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
동물 보수 및 실험 프로토콜은 채플 힐 노스 캐롤라이나 대학의 기관 동물 케어 및 사용위원회에 의해 승인 및 실험 동물 복지의 NIH 사무실과 평가 및 실험 동물 관리 국제 인증 협회의 모든 요구 사항을 충족했다.
참고 : 표준 제브라 피쉬 사육 및 유지 보수 ERG 분석을위한 유충을 얻으려면, 출판 프로토콜 18을 사용 하였다. 애벌레는 자연 번식을 통해 구입해야하며 14 시간 조명 / 10 시간 어두운주기에 따라 보관되어 있습니다. 이 프로토콜은 포스트 수정 (DPF) 5-7일에서 유충에 최적화 된,하지만 이상적 절차에 작은 수정을 오래된 생선을 수행 할 수 있습니다. 여기, 5 DPF에서 야생 형 제브라 피쉬 애벌레의 TL 균주를 사용합니다.
1. 마이크로 피펫 생산
- 화재 연마 붕규산 유리 모세관을 1.5 × 0.86 mm (내경에 의해 외경)를 사용하여 여러 개의 마이크로 피펫을 당겨필라멘트 (821 ° C, 용융 온도)와 P-97 불타는 / 브라운 마이크로 피펫 풀러 상자 열 필라멘트를 장착. 표 1에 설명 된 마이크로 피펫을 도운에 대한 프로그램을 사용하십시오.
- 팁 직경이 10 ~ 15 μm의 것을 보장하기 위해 적절한 계수 선 통치자와 현미경 각 마이크로 피펫을 확인하고 부드러운 선단 구 (즉, 매끄러운 가장자리)가 있습니다.
- 조심스럽게 먼지 팁 손상과 노출을 방지하기 위해 마이크로 피펫을 저장합니다. 스토리지 옵션은 실험실 테이프, 거품 늘어선 상자, 상업적으로 이용 가능한 마이크로 피펫 저장 용기와 배양 접시를 포함한다.
주의 : 다른 마이크로 피펫 풀러 유리 모세관은 정확한 마이크로 피펫의 직경 고품질 팁이 달성되는 한 사용될 수있다.
| 압박 | 열 | 당기세요 | 속도 시간 | |
| (500) | (560) | - | (30) | (200) |
| (500) | (450) | - | (30) | (200) |
| (500) | (410) | (55) | (40) | (200) |
표 1 : 상자 열 필라멘트가 장착 된 P-97 불타는 / 갈색 마이크로 피펫 풀러를 사용하여 마이크로 피펫의 생산을위한 프로그램을 마이크로 피펫은 필라멘트에 불을 연마 붕규산 유리 모세관을 1.5 × 1.0 mm 2 (내경에 의해 외경)를 사용하여 만들어집니다. (용융 온도 821 ° C에서).
2. 버퍼 준비
- 미세 모세관에서 산소화 금붕어 링거 완충액 (19)를 사용하고, 여과 유충을 실험에 배치되는 폴리 비닐 알코올 (PVA) 스펀지 포화. 또한, E3를 사용 배아 매체 또는 행크의 균형 소금 솔루션.
- pH를 7.8로 조정 한 0.22 μm의 필터를 사용하여 살균 및 4 ℃에서 10 배 주식을 저장 표 2에 설명 된대로 10 배 금붕어 링거액을 준비합니다.
- 탈, 증류수로 1 배 10 배 링어의 솔루션을 희석하여 실험 당일 작업 솔루션을 만듭니다. 0.22 μm의 필터를 사용하여 필터링 시스템. 10 분 동안 95 %의 각 2 O / 5 % CO 2 가스를 버블 링함으로써 네이트. 단단히 나중에 캡 솔루션이 산소 유지되도록합니다.
| 염화나트륨 | 1.25 M |
| 의 KCl | 26 mM의 |
| 염화칼슘 2 | 25 mM의 |
| 의 MgCl 2 | 10 mM의 |
| 포도당 | 100 mM의 |
| HEPES | 100 mM의 |
3. 전위도 플랫폼
- 신호 대 잡음비를 개선하기 위해 패러데이 케이지 안에 방진 테이블 ERG 실험을 수행한다. 육각 너트를 사용한 방진 테이블 정의 강철 플랫폼을 첨부. 광원 아래 테이블에 점탄성 우레탄 폴리머 충격 흡수 바닥으로 이동 플라스틱 플랫폼을 놓습니다.
- 이동 플라스틱 플랫폼에서 아래로 목표 자화 스탠드와 카메라를 배치합니다. 이동 플라스틱 플랫폼의 오른쪽에 두 번째 자화 스탠드 (기록 미세 전극을 개최합니다) 미세 조작기를 놓습니다. 카메라와 미세 조작기가 다른 장비의 이동에 의해 방해되지 않습니다 그들이 광원으로부터 조명을 차단하지 않도록해야합니다.
- 비디오 모니터에 카메라를 연결하고의 눈을 볼을 위치적절한 위치에 전극을 배치하기위한 충.
- 설치가 제대로 구리 와이어 접지되어 있는지 확인합니다. 소음을 확인하려면, 링거액 가득 35mm 페트리 접시에 기록 미세 전극의 기준 전극 팁을 배치합니다. 오실로스코프 또는 ERG 장치의 내장 기능 설정의 전기 노이즈 레벨을 확인합니다. 소음 수준은 기준선 이하 ± 10 μV해야한다.
4. 스폰지 준비
- 35mm 페트리 접시에 딱 맞는 건조 PVA 스폰지의 작은 사각형을 잘라. 스폰지의 두께는 접시의 깊이보다 크지 않아야한다. 절단 깨끗한 면도날 유틸리티 나이프를 사용합니다.
- (스폰지의 바닥 또는 작은 끝 중 하나를 통해 수직으로 잘라 나비 길이 중 하나 얕은 컷) 기준 전극을 수용하기 위해 스펀지에 추가 컷을 확인합니다.
- 화학적 내성 마커를 사용하여카메라를 위치에 사용할 수있는 스폰지 (유충이 배치 될 위치)에 작은 점을 표시합니다.
- 포화 될 때까지 링거액에 PVA 스폰지 십니다. 2 ~ 3 회를 제거하고 종이 타월에 신속시킨다. 깨끗한 35mm 페트리 접시에 스폰지를 놓습니다.
- 마크가 카메라에 의해 가시화 될 수 있도록 플라스틱 플랫폼을 포함하는 스폰지 페트리 접시를 배치.
5. 전극 준비
주 : 피쉬 설치 링거액 포화 PVA 스폰지와 각막에 접촉 기록 전극과 접촉 기준 전극으로 구성. 기준 전극의 Ag / AgCl로 구성되어 펠릿. 기록 전극은 와이어의 Ag를 함유하는 미세 전극 홀더에 의해 링거액 채우고 유지 뽑아 유리 마이크로 피펫이다.
- 5 분 (기록 MICR 6-9 %의 차아 염소산 나트륨 (표백제)에서 그들을 담가 전극 클로라이드oelectrode 와이어) 또는 15 분 (기준 전극). 5 분 킴에 공기 건조.
- 단계 4.2에서 만든 컷의 스타일에 따라, 스폰지 (하단에 세로로 얕은 인하) (수직 나비 인하) 또는 아래에 기준 전극의 자세 / AgCl을 펠렛을 배치합니다. 기록 시스템에 기준 전극 리드를 부착.
- ERG 설치 공간의 제약이 있거나의 Ag / AgCl을 전극으로부터 특히 강한 태양 광 인공물이있는 경우 또는, 광로 밖으로 전극을 이동 한천 염다리 통하여 스폰지에 기준 전극을 연결한다.
- 5 ml의 비 루어 잠금 주사기 ~ 적당한 크기의 튜브 40cm를 연결합니다. 링거액과 주사기를 입력합니다. 압력 포트는 일반적으로 어댑터와 함께 제공 갖는 미세 전극 홀더, "3/32"1/8 1/16의 내부 직경을 갖는 튜브를 수용 "또는 5/32"합니다.
- 함께 1 ml의 비 루어 로크 시린지를 채우기마이크로 FIL를 사용 링거액하고,주의 깊게 미세 전극 홀더를 입력합니다. 거품의 형성을 방지합니다.
- 튜브와 미세 전극 홀더의 압력 포트에 5 ML의 주사기를 연결하고 미세 전극 홀더 링거액의 전체 있는지 확인하는 데 사용합니다. 링거액 가득 마이크로 FIL 1-ML의 주사기를 사용하여 끝에서 마이크로 피펫 유리를 작성하고 기포가 존재하지 않는 것을 확인합니다.
- 전극 와이어를 똑바로되지 않도록 조심스럽게 미세 전극 홀더에 유리 마이크로 피펫을 연결합니다. 일단, 보안 솔루션의 작은 양 끝에 표시 될 때까지 조심스럽게 미세 전극을 통해 링거액을 강제로 5 ML의 주사기를 사용합니다. 마이크로 피펫 팁에서, 먼지 또는 염 축적으로 인한 기포뿐만 아니라 폐색의 형성을 방지한다 (각막에인가되지 않음) 주사기에 압력을 적용 수시.
- 이 솔루션은 스트림으로 나오는 경우, g 교체아가씨 마이크로 피펫, 선단 개구가 너무 크거나 손상 때문이다.
- 조심스럽게 미세 조작기의 기록 미세 전극을 배치하고 기록 시스템에 리드를 연결합니다.
6. 전위도 분석
참고 : 녹음을위한 준비가 간접 백색광의 낮은 수준에서 수행 할 때 애벌레 망막의 원추 지배력, 높은 품질의 ERG 결과를 얻을 수 인해 (<1 룩스) 또는 짧은 기간에 높은 강도의 (<1 분) ( ≤250 LUX) 작업 등. 어두운 적응의 짧은 기간이 여전히 기록하기 전에 필요합니다 (단계 6.7 참조). 그러나, 실험에 민감한 적외선 카메라를 사용하여 희미 적색 또는 적외선 광 하에서 수행 될 수있다. 모든 실험은 UNC Zebrafish의 양식 시설에서 멸균 필터 (0.22 μm의) 물 시스템에서 수행되었지만 대체 배아 매체가 사용될 수있다.
- 약 1 측정 잘라 종이 타월 사각형cm 2.
- 절연 콘 질량 수용체 전위를 측정하는 경우, 5 분 동안 500 μM (±) -2- 아미노 -4- phosphonobutyric 산 (APB)으로 시스템 물 3-5 유충 부화.
참고 : APB는 활성 (L)의 라 세미 혼합물 및 AP4의 비활성 (R) 형태이지만, 그것은 L-AP4만큼 효과적이고 저렴합니다. - 0.02 % 응답, 1 ~ 2 분까지 (w / v)의 Tricaine와 시스템 물에 3-5 애벌레를 마취.
- 신중하게 최소한의 조명 (<1 분 ≤250 럭스)를 사용하여 해부 입체경에서 종이 타월 사각형에 개별 애벌레를 전송하는 파스퇴르 피펫과 피펫 펌프를 사용합니다. 각 유충의 위치를 확인하고 가려지지 않은 눈을 가진 지느러미 쪽을 위로하는 후보를 선택합니다.
- 확장 된 기록 (> 30 분)의 경우에 몸을 유약하지만 좋은 낙타 털 브러시를 사용하여 3 % 메틸 셀룰로오스와 머리를 포함하지 않음으로써 촉촉한 유충을 유지합니다.
- 집게를 사용하면 종이 타월의 오준석를 전송젖은 PVA 스폰지에 유충과 전자.
- 확장 된 기록 (> 30 분)를 들면, 증류 물을 함유하는 부착 플라스크에 airstone 통해 가스를 버블 링시킴으로써 유충 위에 물 - 포화 된 100 % O 2 가스의 연속적인 흐름을 적용한다. 유충의 머리 근처 가습 된 산소를 전달하는 플라스크 사이드 암에서 나오는 튜브를 배치합니다.
참고 : 단계 6.4.1 단계 6.5.1 물고기 (16)의 수명을 연장합니다.
- 확장 된 기록 (> 30 분)를 들면, 증류 물을 함유하는 부착 플라스크에 airstone 통해 가스를 버블 링시킴으로써 유충 위에 물 - 포화 된 100 % O 2 가스의 연속적인 흐름을 적용한다. 유충의 머리 근처 가습 된 산소를 전달하는 플라스크 사이드 암에서 나오는 튜브를 배치합니다.
- 최소한의 조명 아래, 코와 눈의 꼬리 끝 사이의 중간 점에 미세 전극 팁의 위치를 미세 조작기 카메라를 사용하여 각막의 등의 제한에 부드럽게 눌러줍니다.
참고 : 각막의 가장 먼 영역에 전극 팁의 오정렬이 반대 극성의 ERG 파형이 발생할 수 있습니다. - 에 유충 5 ~ 10 분 동안 어두운 - 적응 허용합니다.
- 호 텔를 사용하여 LED 광원 또는 광 자극기에서 제공하는 빛에 기록 테스트 플래시 응답lable가 자극 및 녹음 장비. 이러한 플래시 광량, 플래시 길이 플래시 컬러, 강도와 배경 실험에 맞게 컬러 필터와 같은 설정 프로토콜 파라미터를 조정한다.
- 실험이 완료되면, AVMA / IACUC 지침에 따라 유충을 안락사.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
일반적으로, 망막 전위는 많은 연구가이 단계 9, 16, 20에서 ERG 녹음을 게시 한 이후, 5 DPF에서 zebrafish의 유충으로 기록됩니다. 유생 응답은 백색 LED 광의 20msec의 자극을 이용하여 설정된 배경 조명 암순응 조건으로 측정 하였다. 우리 Ganzfeld 광 자극기 및 컴퓨터 제어기 / 레코더 이루어진 시판 ERG 시스템을 이용했다. 자극기는 배경 및 플래시 자극 모두의 휘도를 제어하는 고유 엄격하게 제어 펄스 폭 변조 (PWM) 시스템을 사용한다. 응답은 디지털 변환기 (ADC)에 대한 16 비트 아날로그 구동 하드웨어 안티 앨리어싱 필터와 독점적 완전 차동 증폭기를 사용하여 기록 하였다. 자극 및 응답 녹음하여 제조사의 프로토콜에 따라 기기에 포함 된 전용 소프트웨어에 의해 제어되었다. 우리의 장비는 1 kHz의 샘플링 레이트를 이용하도록 프로그램 된 디지털 베셀 CASC에이드 필터는 0.312 Hz에서 300 Hz에서, 과도한 노이즈를 제거하기위한 60 Hz에서 노치 필터 사이의 대역 통과로 설정. 암순응 유충의 광 강도가 증가함에 따라 진폭의 B1의 파장이 증가 (도 1). 웨이브는 일반적으로 B 파에 의해 가려하고 안정적으로 검출 할 수 없습니다. B-파 대사성 글루타메이트 수용체 (mGluR6) 작용제와 인큐베이션 유충에 의해 차단 될 수 -4- 포스 포노 부티르산 (APB). 이는 검출 될 (또는 "표면파") 콘 질량 수용체 가능성을 허용한다. 빛의 증가 강도와 진폭이 "파"응답이 증가 (그림 2).
추가의 패러다임을 염기성 시각 기능과 감도를 넘어 시각 파라미터를 테스트하는 데에 이용 될 수있다. 듀얼 플래시 패러다임의 사용을 통해, 하나의 초기 자극 (도 3a)에서 복구 콘 광 응답의 능력을 측정 할 수있다. interstimulus 간격으로(ISI)을 초기 자극 (도 3b)로부터의 회복을 나타내는, 상기 제 2 응답의 진폭이 증가하여 증가한다. 제시된 APB-격리 "파"흔적은 세 스윕의 평균이며, 유사한 자극 패러다임 2, 9,16를 사용하는 제브라 피쉬 애벌레 망막 전위의 게시 된 보고서에 따릅니다.
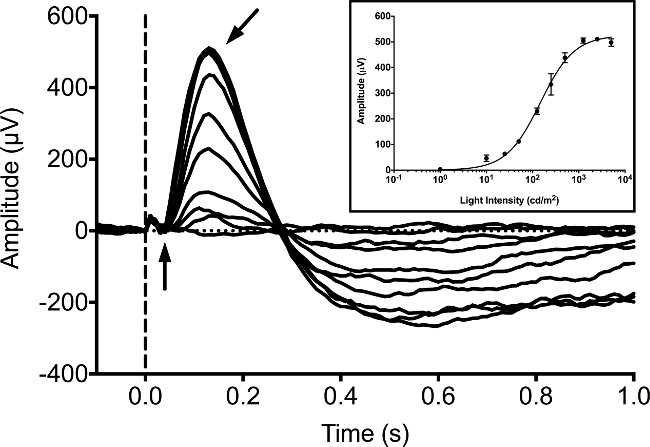
그림 1 : 애벌레 제브라 피쉬 DPF 5 일반적인 ERG 기록. 강도 시리즈는 어두운 적응 조건에서 얻었다. 물고기는 강도가 1, 10, 25, 50, 125, 250, 500, 1,250, 2,500 및 5,000 cd / ㎡의 동등 해 20 밀리의 기간 동안 백색 LED 빛에 노출되어있다. 빛 자극의 발병은 세로 점선으로 표시됩니다. 음의 전위 파 (수직 화살표)는 긍정적 인 반면, 구분하기가 어렵습니다전위 B 표면파 (화살표 각도) 파형의 피크 지배적이다. 작은 태양 광 이슈는 파의 발병하기 전에 작은 양의 편향으로 관찰 할 수있다. 인셋은 나카 러쉬 튼 방정식 (21, 22)를 이용하여 맞춰 된 빛의 강도가 증가함에 따라 B 파 진폭 응답을 평균화. 오차 막대는 SEM을 나타냅니다.

그림 2 :. 5 DPF에서 어두운 적응 조건에서 얻은 애벌레 zebrafish의 강도 시리즈에서 기록 APB-고립 콘 대량 수용체 가능성. 자극은 1, 10, 25, 50, 125, 250, 500, 1,250, 2,500 및 5,000 cd / ㎡의 대등 세기와 20 밀리 백색 LED 빛입니다. 빛의 자극 증상은, 세로 점선으로 표시되어있다. 전위 절연 콘 질량 수용체 ( "표면파")은 파형 (화살표)의 지배적 인 요소이다. 작은광전지 아티팩트 콘 응답의 발병 전에 마이너 긍정적 편향로서 관찰 될 수있다. 인셋은 나카 러쉬 튼 식을 이용하여 적합 된 광의 강도의 증가에 응답하여 진폭을 평균화. 오차 막대는 SEM을 나타냅니다.

그림 3 :.. 듀얼 플래시 패러다임을 활용 콘 대량 수용체 잠재적 기록 APB 처리 유충 DPF (5)는 1,000 cd / ㎡의의 강도 흰색 빛 (LED 소스)의 두 개의 20 밀리 초 점멸, 각 하였다 (A) 2 초에 상당하는 interstimulus 간격 (ISI)와 2 연속 점멸에 대한 응답. 빛의 노출은 수직 점선으로 표시됩니다. 제 2 응답의 진폭 응답은 불완전한 복구를 나타내는, 상기 제 1 응답의 그것보다 낮다. (B)의 최대 격리 콘 질량 수용체의 비율 poten각 ISI의 초기 자극의 두 번째 자극의 반응을 자유형. 최적 비선형 회귀 분석을 적용하고있다. ISI가 증가함에 따라, 광 수용체의 민감도의 점진적 회복을 나타내는 초기 자극에 대한 반응에 진폭 상대의 두 번째 자극이 증가에 대한 응답. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
이 프로토콜에서 애벌레 제브라 피쉬의 ERG 녹음에 대한 간단한 절차를 자세히 설명되어 있습니다. 명심해야한다 절차를 통해 몇 가지 중요한 단계는이 절차는 시각 function.There의 신속하고 종합적인 분석이 가능하다. 실험이 잠재적 인 약물 치료 중에 죽음을 방지하고 ERG 녹음 중에 장시간 생활을 보장하기 위해 전에 제브라 피쉬의 유충이 건강해야합니다. 또한, 실험에 이용 유충 밀접 연령대 것이 중요하다. 이는 망막 (콘 아형, 즉 차동 개발), 또한 유생의 전체적인 형태 및 생리 급속한 발전이다. 예를 들어, 상피 증산 효율 DPF 7 후에 더 어렵게 살아 물고기를 유지하게 감소한다. 또 다른 중요한 요소는 기록 전극과 기준 전극의 품질이다. 거친 가장자리 t을 방지하기 위해 유리 모세관을 당겨 때주의가 필요하다IPS. 마이크로 피펫 microforge는 신호 수집을 개선하기 위해 전극과 도움을 뽑아 불 닦으에 사용될 수있다. 또한 자세 / AgCl을 전극의 품질을 유지하는 것은 매우 중요하다. 사용 후, 즉시 건조 증류 물과 공기로 세척해야합니다. (어두운 붉은 황색) 변색 또는 움푹 전극 피해야, 성능에 영향을주는 시간이 발생할 수없는 전극의 외면 어둡게한다. 단백질 오염에 악영향 전극의 행동에 영향을 미칠 수 있으므로, 맨손으로 취급 전극을 피하십시오. 마지막으로, 그것의 Ag / AgCl을 전극 감광성이며 보호되지 않는 경우 플래시 아티팩트가 발생할 수 있음을 유의해야한다. 그러나, 우리가 최소화 이러한 유물을 발견했다 (그림 1에 전설과 2 참조)과 자극을 깜박 애벌레 제브라 피쉬의 답변 우리의 측정을 방해하지 않습니다. 대안 적으로, 염다리는 한천 SA 통해 스펀지의 Ag / AgCl을 전극을 연결하는데 사용될 수있다LT의 다리는 빛의 경로가 전극을 이동합니다. 염다리 전위가 전극 (23)을 안정화하기 위해 직류 (DC) 레코딩에 사용되지만, ERG 기록 전류 (AC)를 교대로 사용한다. 특히 설치 공간의 제약이나 특히 강한 태양 광 아티팩트가있는 경우 따라서이 시스템의 소금 다리의 유일한 목적은 것입니다.
ERG는 시각 기능을 측정하는 다른 기술에 비해 몇 가지 장점을 가지고있다. 주요 장점은 생체 기록되어있다. 단점은 망막 광 수용체 및 다른 세포의 흡인 전극 또는 패치 클램프 기록을위한 경우 일 것이다 같은 특정 세포의 활성을 직접적으로 측정하는 대신 파형으로부터 추정되어야한다는 것이다. 일반적으로, 흡입 전극 녹음, 패치 클램프 기록 및 전체 망막 ERG의 약리 제제를 쉽게 분자량 성분을 정의하기 위해 세포로 도입 될 수 있다는 장점을 가지고응답하는 반면, 이는 포유 동물 모델을 사용하여 생체 내에서 더 어렵다. 이러한 에이전트에 제브라 피쉬 애벌레의 투과성이 단점을 극복한다.
약리학 적 제제의 부재하에 암순응 유충 분석 B 파장에 의해 지배 ERG 파형, 다른 그룹 2 9,24 -26의 숫자로 관찰 한 결과를 생성한다. 우리는 제브라 피쉬 유충 침투되는 약물의 능력을 활용하여 콘 질량 수용체 전위를 분리하는 능력을 입증한다. APB으로 처리 애벌레는 "파"가 14 ~ 17 가시화 될 수 있도록, B 파의 폐기를 표시합니다. 잡음비 우수한 신호 파형은 3 스윕 평균을 수득 하였다. 응답 파형의 변동이 종종 언급되지만 Makhankov 등. (2)는 동일한 동물에서의 반복 측정 분산이 작다는 것을보고했다개인 사이에 볼보다. 따라서, 분산이 기술에서는 생물학적 변화보다는 변동의 결과 일 가능성이 높다.
또한 배경 조명 (9), (16)의 존재 및 부재하에 유사한 결과 발표 듀얼 플래시 패러다임을 사용하여 생체 내에서 콘 복구를 검사 ERG 분석을 이용했다. 이는 ISI의 다양한 연속 깜박에 응답 유생 망막의 능력을 측정함으로써 수행 하였다. TALENs이 경로 대상을 노크로되는 약물 또는 게놈 엔지니어링 전략과 함께 사용되는 경우, 제브라 피쉬는 콘 적응과 시력 회복의 분자 역학의 생체 연구를위한 강력한 시스템입니다.
우리의 절차 및 장비가 쉽게 절연 28 유생 눈, 제브라 피쉬 이전 또는 다른 척추 동물 27을 검사하도록 구성 될 수있다. 사실, ERG 자극 및 녹화 시스템우리는 주로 쥐에 실험을 위해 수정 한 후 임상에서 사용하도록 설계되었다 사용하는 것이. 제브라 피쉬의 유충을위한 플랫폼을 적응하는 것은 간단했다 쉽고 저렴한 비용으로 다른 실험실에서 복제 할 수 있습니다. 고전 전기 생리 유사 장비 이루어진 설정은 최소 비용으로 구성 될 수 있고, 신뢰할 수있는 결과 (16)를 제공하는 것으로 입증되었다. 전반적으로,이 기술은 시각 기능의 메커니즘을 연구 연구에 큰 도움이된다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
관심 없음 충돌 선언하지 않습니다.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



