Abstract
Das Elektroretinogramm (ERG) ist eine nicht-invasive elektrophysiologische Verfahren zur Bestimmung der Netzhautfunktion. Durch die Anordnung einer Elektrode auf der Oberfläche der Hornhaut, in Antwort auf Licht erzeugte elektrische Aktivität kann gemessen und verwendet, um die Aktivität von Netzhautzellen in vivo zu beurteilen. Diese Handschrift beschreibt die Verwendung von der ERG zur Sehfunktion im Zebrafisch zu messen. Zebrafische sind seit langem als Modell für die Entwicklung von Wirbeltieren wegen der Leichtigkeit der Gen-Unterdrückung durch Morpholino Oligonukleotiden und pharmakologische Manipulation genutzt. 5-10 dpf sind nur Zapfen Funktions im Larvennetzhaut. Daher ist die Zebrafisch, im Gegensatz zu anderen Tieren, ist ein leistungsfähiges Modellsystem für das Studium der Kegel visuellen Funktion in vivo. Dieses Protokoll verwendet Standard-Anästhesie, Mikromanipulation und Stereomikroskopie-Protokolle, die in Labors, die Zebrafisch-Forschung führen gemeinsam sind. Die beschriebenen Methoden verwenden Standard-Elektrophysiologie equipment und eine Lichtkamera, um die Platzierung der Aufnahme Mikroelektroden auf die Larvenhornhaut führen. Schließlich zeigen wir, wie ein handelsüblicher ERG Stimulator / Recorder ursprünglich für den Einsatz mit Mäusen entwickelt, kann leicht für die Verwendung mit Zebrafisch angepasst werden. ERG der Larven Zebrafisch ist eine ausgezeichnete Verfahren zur Untersuchung Kegel Sehfunktion bei Tieren, die von Morpholino Oligonukleotid Einspritzung geändert wurden, sowie neuere Genom-Engineering-Techniken wie beispielsweise Zink-Finger-Nukleasen (ZFNs) Transkriptionsaktivator-Like Effektor Nukleasen (Talens) und Regelmäßig gruppierten beabstandeten Kurz Palindromic Repeats (CRISPR) / Cas9, alle haben die Effizienz und Wirksamkeit des Gen-Targeting in Zebrabärbling stark erhöht. Darüber hinaus nutzen wir die Fähigkeit von pharmakologischen Mitteln zur Zebrafisch-Larven, die molekularen Komponenten, die dem Photo beitragen bewerten zu durchdringen. Dieses Protokoll beschreibt eine Einrichtung, die geändert und von den Forschern verwendet werden könnenmit verschiedenen experimentellen Ziele.
Introduction
Das Elektroretinogramm (ERG) ist eine nicht-invasive elektrophysiologischen Verfahren, die ausführlich in der Klinik für die Bestimmung der Funktion der Retina in Menschen verwendet wird. Die elektrische Aktivität in Reaktion auf einen Lichtreiz, wird durch Anordnen Aufzeichnungselektroden auf der äußeren Oberfläche der Hornhaut gemessen. Die Eigenschaften des Reizparadigma und der Antwort-Wellenform zu definieren, die retinalen Neuronen, die zur Reaktion. Dieses Verfahren ist für den Einsatz mit einer Reihe von Tiermodellen, einschließlich Mäusen und Zebrafisch angepasst. Die typische Wirbel ERG Antwort hat vier Hauptkomponenten: das a-Welle, die eine Hornhaut-negatives Potential von Photorezeptorzellaktivität abgeleitet ist; die b-Welle, eine Hornhaut-positives Potential von der ON bipolaren Zellen abgeleitet; der d-Welle, eine Hornhaut-positiven Potential wie die Aktivität der OFF bipolaren Zellen interpretiert; und die c-Welle, die nach der b-Welle einige Sekunden auftritt und spiegelt Aktivität in Müller Glia und retinal Pigmentepithel 1-4. Zusätzliche Hinweise für das Verständnis der Geschichte und Prinzipien der ERG Analyse bei Menschen und Modelltiere sind die Online-Lehrbuch, Webvision, von der University of Utah und Texte wie den Principles and Practice of Clinical Elektrophysiologie des Sehens 4, 5.
Danio rerio (Zebrafisch) ist seit langem als Modell für die Entwicklung von Wirbeltieren begünstigt worden, aufgrund seiner schnellen Reifung und Transparenz, die für die nichtinvasive morphologische Analyse von Organsystemen, Verhaltens-Assays und sowohl vorwärts und rückwärts genetischen Screens (zur Übersicht siehe Fadool und ermöglicht Dowling 6). Zebrafisch-Larven sind sehr gut für genetische und pharmakologische Manipulation, die, wenn sie mit ihrer hohen Fruchtbarkeit, machen sie eine ausgezeichnete Tiermodell für die Hochdurchsatz-biologischen Analysen. Das höhere Verhältnis von Kegeln mit Stangen in Larven Zebrabärbling - etwa 1: 1 im Vergleich zu Mäusen (~ 3% Konuse) - machen sie besonders nützlich für die Untersuchung der Kegelfunktion 7-9.
In der Retina von Wirbeltieren entwickeln Kegel vor Stangen 10. Interessanterweise sind Zebrafisch Kegel operative bereits 4 dpf, was eine selektive elektrophysiologische Analyse der Kegel in diesem Stadium 6, 11,12. Im Gegensatz dazu ERG-Antworten in Stäbe erscheinen zwischen 11 und 21 dpf 13. Daher Zebrafisch-Larven bei 4-7 dpf funktionell dienen als All-Kegel Netzhaut. Allerdings ist die Mutterphotopischen ERG Antwort von 4-7 dpf Larven von der b-Welle dominiert. Anwendung von pharmakologischen Mitteln, wie beispielsweise L - (+) - 2-Amino-4-phosphono-buttersäure (L-AP4), ein Agonist des metabotropen Glutamat (mGluR6) Rezeptors durch den, bezogen auf die bipolaren Zellen, blockiert wirksam die Erzeugung der b-Welle und zeigt die isolierte Kegel Masse receptor potential, (die "a-Welle"), 14-17.
Hier beschreiben wir eine einfache und reliable Verfahren für ERG Analyse mit handelsüblichen ERG Geräte für den Einsatz mit Mäusen, die für die Verwendung mit Zebrafisch-Larven adaptiert wurden konzipiert. Dieses System kann auf Zebrafisch-Larven mit unterschiedlichen genetischen Hintergründen, sowie diejenigen, mit pharmakologischen Mitteln behandelt, die Forscher bei der Identifizierung von Signalwegen, die visuelle Empfindlichkeit und leichte Anpassung 16 beitragen unterstützen genutzt werden. Die in diesem Protokoll beschriebenen experimentellen Verfahren wird Ermittler im Gebrauch von ERG-Analyse, um eine Vielzahl von biologischen Fragen zu beantworten Vision führen und zeigen den Aufbau eines flexiblen ERG-Setup.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tier Pflege und experimentelle Protokolle wurden von den Institutional Animal Care und Verwenden Ausschüsse der University of North Carolina in Chapel Hill genehmigt, und erfüllen alle Anforderungen der NIH Office of Laboratory Animal Welfare und der Gesellschaft für Evaluierung und Akkreditierung für Labortier Care International.
HINWEIS: Um die Larven für ERG Analyse zu erhalten, veröffentlicht Protokolle für Standard Zebrafischhaltung und Wartung eingesetzt wurden 18. Larven werden durch natürliche Zucht erhalten und unter einem 14 Stunden Licht / 10 h Dunkel-Zyklus untergebracht. Dieses Protokoll wurde für die Larven in 5-7 Tage nach der Befruchtung (dpf) optimiert worden, konnte aber im Idealfall auf ältere Fische mit kleinen Änderungen an der Vorgehensweise durchgeführt werden. Hier verwenden Sie die TL-Stamm von Wildtyp-Zebrafisch-Larven bei 5 dpf.
1. Mikropipette Produktion
- Ziehen Sie mehrere Mikropipetten mit 1,5 x 0,86 mm (Außendurchmesser von Innendurchmesser) feuerpolierte Borosilikatglas Kapillaren mitFilament (Schmelztemperatur, 821 ° C) und eine P-97 Flaming / Braun Mikropipette Abzieher mit Feld Wärme Filament eingebaut. Verwenden Sie das Programm für die Gestaltung in Tabelle 1 beschriebenen Mikropipetten.
- Überprüfen Sie jede Mikropipette unter dem Mikroskop mit einem geeigneten Raster Lineal, um sicherzustellen, dass Spitzen sind 10-15 um im Durchmesser und hat eine glatte Bahnöffnung (dh keine scharfen Kanten).
- Sorgfältig zu verwahren Mikropipetten zur Spitze Schäden und die Belastung durch Staub zu verhindern. Speicheroptionen Petrischalen mit Labor-Band, mit Schaumstoff ausgekleideten Boxen, oder im Handel erhältliche Mikropipette Lagerbehälter.
Hinweis: andere Mikropipette Abzieher und Glaskapillaren kann, solange die richtigen Durchmesser der Mikropipette und eine hochwertige Spitze erreicht wird.
| Druck | Wärme | Ziehen | Geschwindigkeit Zeit | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabelle 1: Programm für die Herstellung von Mikropipetten mit einem P-97 Flaming / braun Mikropipette Abzieher mit einem Kasten Wärme Filament eingebaut Mikropipetten werden mit 1,5 x 1,0 mm 2 (Außendurchmesser von Innendurchmesser) feuerpolierte Borosilikatglas Kapillaren mit Filament. (Schmelztemperatur 821 ° C).
2. Buffer Vorbereitung
- Gebrauch gefiltert, oxygenierte fish Ringer-Puffer 19 in der Mikroelektrode Kapillare und den Polyvinylalkohol (PVA) Schwamm, auf welche die Larven werden für Experimente platziert sättigen. Alternativ können Sie E3 Embryo Medien oder Hanks Balanced Salt Solution.
- Bereiten Lösung 10x Goldfisch Ringer wie in Tabelle 2 beschrieben einstellen auf pH 7,8 und sterilisiert mit einem 0,22 um Filter und lagern Sie die 10-faches bei 4 ° C.
- Erstellen Sie eine Arbeitslösung auf dem Tag des Experiments durch die 10x Ringerlösung verdünnt mit deionisiertem, destilliertem Wasser 1x. Filter mit einem 0,22 um Filter-System. Oxygenat durch Blasenbildung mit 95% O 2/5% CO & sub2; -Gas für 10 Minuten. Deckel fest danach, um sicherzustellen, dass die Lösung bleibt oxygenierten.
| NaCl | 1,25 M |
| KCl | 26 mM |
| CaCl 2 | 25 mM |
| MgCl2 | 10 mM |
| Glucose | 100 mM |
| HEPES | 100 mM |
3. Elektroretinogramm Platform
- Führen ERG Experimente an einem Anti-Vibrationstisch in einem Faraday-Käfig, um das Signal-Rausch-Verhältnis zu verbessern. Befestigen Sie eine benutzerdefinierte Stahlplattform mit dem Antivibrationstisch mit Sechskantmuttern. Legen Sie eine bewegliche Kunststoffplattform mit einem viskoelastischen Urethanpolymer stoßdämpfenden Boden auf den Tisch unter die Lichtquelle.
- Positionieren Sie die Kamera mit einem magnetisierten stand, sich an den beweglichen Kunststoff-Plattform ab. Positionieren Sie den Mikromanipulator mit einem zweiten magnetisierten Stand auf der rechten Seite des beweglichen Kunststoff-Plattform (die die Aufzeichnungsmikro halten wird). Sicherzustellen, dass die Kamera und der Mikromanipulator wird nicht durch die Bewegung der anderen Geräte gestört werden und dass sie nicht die Beleuchtung von der Lichtquelle zu blockieren.
- Schließen Sie die Kamera an einen Videomonitor und positionieren Sie es, um das Auge des sehenLarve für die Platzierung der Elektrode in der richtigen Position.
- Stellen Sie sicher, dass das Setup richtig mit Kupferdraht geerdet. Um das Rauschen zu überprüfen, legen Sie die Referenzelektrode und die Spitze der Mikroelektrode in einer Aufnahme 35 mm Petrischale mit Ringer-Lösung gefüllt. Überprüfen Sie die elektrische Geräuschpegel des Setup mit einem Oszilloskop oder einem eingebauten Merkmal der ERG Gerät. Der Geräuschpegel sollte nicht mehr als ± 10 & mgr; V von der Grundlinie sein.
4. Sponge Vorbereitung
- Schneiden Sie ein kleines Rechteck von trockenem PVA Schwamm, der fest in einer 35 mm Petrischale passt. Die Dicke des Schwammes sollte nicht größer als die Tiefe der Schale sein. Mit einem Messer mit einer sauberen Rasierklinge zum Schneiden.
- Vereinbaren Sie einen zusätzlichen Schnitt in den Schwamm, um die Referenzelektrode unterzubringen (entweder ein flacher Schnitt der Länge nach auf den Boden der Schwamm oder ein Schmetterling vertikal durch eine der kleineren beschnitten).
- Verwenden Sie einen chemisch beständigen Markierungum einen kleinen Punkt auf dem Schwamm (wo die Larve gelegt werden), die zur Positionierung der Kamera verwendet werden kann, zu markieren.
- Weichen Sie die PVA Schwamm in Ringer-Lösung bis zur Sättigung. Entfernen und tupfen Sie schnell auf ein Papiertuch 2-3 mal. Setzen Sie den Schwamm in einer sauberen 35-mm-Petrischale.
- Platzieren Sie die Petrischale mit dem Schwamm auf der Plastikplattform, so daß die Markierung von der Kamera sichtbar gemacht werden.
5. Elektrodenvorbereitung
HINWEIS: Der Zebrafisch Aufbau besteht aus einer Referenzelektrode in Kontakt mit der Ringerlösung gesättigten PVA-Schwamm und einer Aufzeichnungselektrode, die in Kontakt mit der Hornhaut. Die Bezugselektrode besteht aus einer Ag / AgCl-Pellet. Die Aufzeichnungselektrode ist eine gezogene Glasmikropipette mit Ringer-Lösung gefüllt und durch ein Mikroelektrodenhalter, die eine Ag-Draht gehalten.
- Chlorid die Elektroden durch Einweichen in 6-9% Natriumhypochlorit (Bleiche) für 5 min (die Aufzeichnungs microelectrode Draht) oder 15 Minuten (die Referenzelektrode). Luft trocknen auf einem Kimwipe für 5 min.
- In Abhängigkeit von der Art der Schnitt in Schritt 4.2 gemacht, legen Sie die Ag / AgCl-Pellet der Referenzelektrode in die (für die vertikale Schmetterling ausschneiden) oder mit (für die flache Schnitt der Länge nach auf den Boden) dem Schwamm. Befestigen Sie die Referenzelektrode führen zu dem Aufzeichnungssystem.
- Alternativ, wenn die ERG Setup hat Platz oder gibt es besonders starke Photovoltaik-Artefakten aus der Ag / AgCl-Elektrode, schließen Sie die Referenzelektrode mit dem Schwamm über ein Agar-Salzbrücke, die Elektrode aus dem Lichtweg zu bewegen.
- Bringen ~ 40 cm von geeigneter Größe Schlauch an einen 5 ml nicht-Luer-Lock-Spritze. Füllen Sie die Spritze mit Ringerlösung. Mikroelektrodenhalter besitzen Druckanschlüsse versenden in der Regel mit Adaptern für Schläuche mit Innendurchmessern von 1/16 unterzubringen ", 3/32", 1/8 "oder 5/32".
- Füllen Sie eine 1 ml nicht-Luer-Lock-Spritze mitRinger-Lösung und mit einem Micro-fil, sorgfältig füllen die Mikroelektrodenhalter. Verhindern die Bildung von Blasen.
- Befestigen Sie die 5-ml-Spritze mit dem Druckanschluss der Mikroelektrode Halter mit Schlauch und es verwenden, um sicherzustellen, dass die Mikroelektrodenhalter ist voll von Ringer-Lösung. Mit dem Micro-fil und 1-ml-Spritze mit Ringer-Lösung gefüllt, füllen Sie die Mikropipette Glas von der Spitze und sicherzustellen, dass keine Luftblasen vorhanden sind.
- Befestigen Sie die Glas-Mikropipette auf die Mikroelektrodenhalter, wobei Sie darauf achten, den Elektrodendraht gerade zu halten. Sobald gesichert mit der 5 ml Spritze sorgfältig zwingen Ringerlösung durch die Mikroelektrode, bis eine kleine Menge der Lösung auf die Spitze sichtbar ist. Gelegentliche Anwendung von Druck auf die Spritze (wenn sie nicht an der Hornhaut angewendet wird) wird die Bildung von Luftblasen sowie Einschlüsse aufgrund von Staub oder Salzansammlung zu verhindern, in die Mikropipettenspitze.
- Wenn die Lösung herauskommt als ein Strom, ersetzen Sie die glass Mikropipette, die Spitzenöffnung zu groß ist oder beschädigt ist.
- Legen Sie das Aufnahme-Mikroelektrode im Mikromanipulator und befestigen Sie das Kabel mit dem Aufnahmesystem.
6. Elektroretinogramm Analyse
HINWEIS: Aufgrund der Kegel Dominanz des Larvennetzhaut, können qualitativ hochwertige ERG Ergebnisse erhalten, wenn die Vorbereitungen für die Aufnahme unter niedrigen indirekten weißem Licht durchgeführt werden (<1 Lux) oder für kurze Zeit (<1 min) höherer Intensität ( ≤250 Lux) Arbeitslicht. Eine kurze Zeit der Dunkeladaptation ist weiterhin erforderlich, vor der Aufnahme (siehe Schritt 6.7). Jedoch können Versuche unter schwach rot oder Infrarotlicht unter Verwendung einer infrarotempfindlichen Kamera durchgeführt werden. Alle Experimente wurden in steril filtriert (0,22 um) System Wasser von der UNC Zebrafisch Aquakulturanlage durchgeführt, aber alternative Embryo Mittel können angewendet werden.
- Schneiden Sie Papiertuch Quadraten mit Abmessungen von ungefähr 1cm 2.
- Wenn die Messung isoliert Kegel Masse receptor potential, Inkubation 3-5 Larven im System Wasser mit 500 uM (±) -2-Amino-4-phosphonobutyric Säure (APB) für 5 min.
HINWEIS: Wenn APB ist eine racemische Mischung des aktiven (L) oder inaktiven (R) Formen AP4, ist es als L-AP4 als wirksame und weniger teuer. - Anesthetize 3-5 Larven im System Wasser mit 0,02% (w / v) Tricaine, bis nicht mehr reagiert, ca. 1-2 min.
- Verwenden einer Pasteurpipette und Pipettenpumpe einzelne Larven vorsichtig Transfer auf Papiertuch Quadrate unter Sezieren Stereoskop mit minimalen Beleuchtungsstärke (Lux ≤250 <1 min). Überprüfen Sie die Position der einzelnen Larve und wählen Sie einen Kandidaten, der Rückenseite mit einer nicht verschlossenen Auge ist.
- Für längere Aufnahmen (> 30 min), feucht zu halten die Larve durch Verglasung der Körper bis zu aber nicht einschließlich der Kopf mit 3% Methylcellulose mit einem feinen Kamelhaarbürste.
- Mit einer Pinzette, übertragen Sie die Papiertuch square mit der Larve in die feuchten PVA Schwamm.
- Für längere Aufnahmen (> 30 min), gelten ein kontinuierlicher Strom von wassergesättigter 100% O 2 -Gas über die Larve durch Einblasen des Gases durch eine Ausströmer in einem Seitenarm-Kolben, der destilliertes Wasser. Positionieren Sie den Schlauch Verlassen der Kolben Seitenarm, der die befeuchteten Sauerstoff in der Nähe von Kopf der Larve vermittelt.
HINWEIS: Schritt 6.4.1 und Schritt 6.5.1 wird die Lebensdauer des Fisches 16 zu verlängern.
- Für längere Aufnahmen (> 30 min), gelten ein kontinuierlicher Strom von wassergesättigter 100% O 2 -Gas über die Larve durch Einblasen des Gases durch eine Ausströmer in einem Seitenarm-Kolben, der destilliertes Wasser. Positionieren Sie den Schlauch Verlassen der Kolben Seitenarm, der die befeuchteten Sauerstoff in der Nähe von Kopf der Larve vermittelt.
- Unter minimale Beleuchtung, verwenden Sie den Mikromanipulator und Kamera, um die Mikroelektrodenspitze in der Mitte zwischen der Nasen und Schwanzenden der Augenposition und drücken Sie vorsichtig auf die dorsale Grenze der Hornhaut.
HINWEIS: Fehlanordnung der Elektrodenspitze in die entfernt distalen Bereichen der Hornhaut in ERG-Wellenformen mit umgekehrter Polarität führen. - Lassen Larve bis dunkel anpassen 5-10 min.
- Nehmen Testblitz Reaktionen auf Licht von einer LED-Lichtquelle oder Licht Stimulator zur Verfügung gestellt mit dem avaiLabel Stimulation und Aufnahmegeräte. Passen Protokollparameter wie die Blitzintensität, Blitzweite, Blitzfarbe, Hintergrundintensität und Farb und Filtereinstellungen, um das Experiment zu passen.
- Wenn das Experiment beendet ist, einschläfern Larven nach AVMA / IACUC Richtlinien.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Typischerweise werden ERGs von Zebrafisch-Larven bei 5 dpf erfasst, da eine Reihe von Studien haben ERG Aufnahmen in dieser Phase 9, 16,20 veröffentlicht. Larven Antworten wurden unter dunkeladaptierten Bedingungen ohne Hintergrundbeleuchtung mit einem 20 ms Reiz weißem LED-Licht gemessen. Wir verwendeten einen handelsüblichen ERG-System, bestehend aus einem Ganzfeld Licht Stimulator und Computer-Controller / Recorder. Der Stimulator verwendet ein proprietäres Pulsbreitenmodulation (PWM) System streng kontrolliert, um die Leuchtdichte sowohl der Hintergrund und Flash Stimulus steuern. Reaktionen wurden unter Verwendung eines proprietären voll differentiellen Verstärkers mit einem Hardware-Antialiasing-Filter Antreiben eines 16-Bit-Analog-Digital-Wandler (ADC) aufgezeichnet. Stimulus- und Antwort-Aufnahmen wurden von proprietärer Software mit dem Gerät enthalten sind, gemäß dem Herstellerprotokoll gesteuert. Unsere Ausrüstung wurde so programmiert, daß eine Abtastrate von 1 kHz nutzen, digital Bessel cascade Filter mit einem Bandpass zwischen 0.312 Hz und 300 Hz und 60 Hz-Notch-Filter, um überschüssige Rauschen zu entfernen setzen. In der dunkeladaptierten Larve die b-Welle nimmt in der Amplitude mit zunehmender Lichtintensitäten (Abbildung 1). Die a-Welle wird typischerweise durch die b-Welle verdeckt und kann nicht sicher erkannt werden. Der b-Welle kann durch Inkubieren der Larven, die mit dem metabotropen Glutamatrezeptor (mGluR6) Agonisten blockiert, 4-phosphono-buttersäure (APB). Dies ermöglicht die Membranmasse Rezeptorpotential (oder "a-Welle") erkannt werden. Diese "a-Welle" Reaktion erhöht sich in der Amplitude mit zunehmender Lichtstärken (Abbildung 2).
Zusätzliche Paradigmen können genutzt werden, um visuelle Parameter über grundlegende Sehfunktion und Sensibilität zu testen. Durch die Verwendung eines Doppelblitz Paradigmas kann man die Fähigkeit des Kegels Photo aus den Anfangsimpulsen (3A) wiederherzustellen messen. Als Interstimulusintervall(ISI) zunimmt, die Amplitude der zweiten Reaktion erhöht, was anzeigt, Erholung von dem anfänglichen Stimulus (3B). Die APB-isoliert "a-Welle" Spuren sind der Durchschnitt von drei Durchläufen und entsprechen den veröffentlichten Berichten der Zebrafisch-Larven ERGs Verwendung ähnliche Stimulation Paradigmen 2, 9,16.
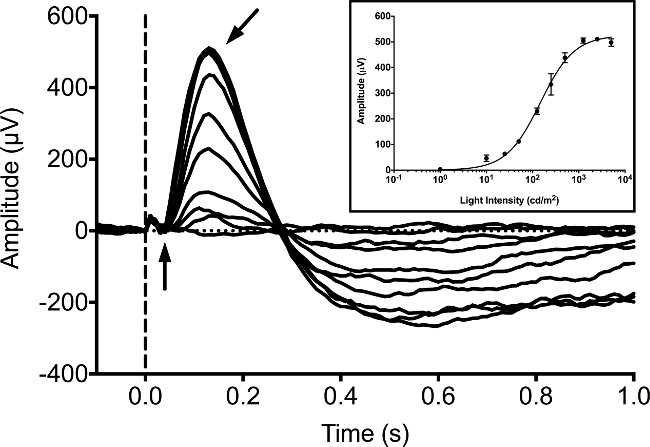
Abbildung 1: Typische ERG Aufzeichnung in 5 dpf Larven Zebrafisch. Die Intensität Serie wurde unter dunkeladaptierten Bedingungen. Die Fische werden auf LED-Weißlicht während einer Dauer von 20 ms mit Intensitäten gleich 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 und 5.000 cd / m 2 ausgesetzt. Das Einsetzen der Lichtreiz ist durch die gestrichelte vertikale Linie bezeichnet. Das negative Potential ein Wellen (vertikaler Pfeil) ist schwierig zu unterscheiden, während die positivePotential b-Welle (gewinkelt Pfeil) ist die dominante Spitze der Wellenform. Eine kleine Photovoltaik-Artefakt kann als eine kleine positive Ablenkung vor der a-Welle zum Auftreten zu beobachten. Inset, gemittelt b-Wellenreaktionsamplituden bei zunehmender Lichtintensitäten unter Verwendung der Naka-Rushton Gleichung 21, 22, die fit sind. Die Fehlerbalken stellen SEM.

Abbildung 2: APB-Kegel isoliert Masse receptor potential von Zebrafisch-Larven-Intensity-Serie unter dunkeladaptierten Bedingungen bei 5 dpf erhalten aufgezeichnet.. Der Stimulus ist ein 20 ms LED-weißes Licht mit Intensitäten gleich 1, 10, 25, 50 125, 250, 500, 1.250, 2.500 und 5.000 cd / m 2. Das Einsetzen der Lichtstimulation ist durch die gestrichelte vertikale Linie bezeichnet. Die isolierte Kegel Masse Rezeptorpotential ("a-Welle") ist das dominierende Element der Wellenform (Pfeil). Eine kleinePhotovoltaik Artefakt als geringe positive Auslenkung vor der Konus Reaktion zum Auftreten beobachtet werden. Inset, Mittelwert der Reaktion Amplituden mit zunehmender Lichtintensitäten unter Verwendung der Naka-Rushton-Gleichung, die fit sind. Die Fehlerbalken stellen SEM.

Fig. 3:. Cone Massenrezeptorpotential Aufzeichnung unter Verwendung eines Dualblitz Paradigmas A 5 dpf APB behandelten Larven wurden mit einer Intensität von 1.000 cd / m 2, um zwei 20 ms Blitze weißem Licht (LED-Quelle), die jeweils (a) unterworfen Die Reaktion auf 2 aufeinander blinkt mit einer Interstimulusintervall (ISI) gleich 2 sec. Belichtungen durch gestrichelte vertikale Linien markiert. Die Amplitude der zweiten Reaktion ist geringer als die von der ersten Antwort, was die unvollständig Reaktion Erholung. (B) Das Verhältnis der maximalen isolierten Membranmasse Rezeptor potenTiAl Antwort des zweiten Stimulus zu dem des ersten Stimulus für jeden ISI. Ein Best-Fit-nicht-linearer Regressionsanalyse aufgetragen wurde. Da die ISI erhöht, die Reaktion auf die zweiten Konjunktursteigerungen Amplitude relativ zur Antwort auf die ursprüngliche Stimulus zeigt progressive Erholung der Photorezeptorempfindlichkeit. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In diesem Protokoll ein einfaches Verfahren für die ERG-Aufnahmen von Larven Zebrafisch wird beschrieben. Dieses Verfahren ermöglicht eine schnelle und umfassende Test der visuellen function.There gibt mehrere wichtige Schritte im Rahmen des Verfahrens, das im Auge behalten werden sollte. Der Zebrafisch-Larven sollten gesund sein, bevor das Experiment zu Tode während der potenzielle medikamentöse Behandlungen zu vermeiden und eine längere Lebensunterhalt während der ERG-Aufnahmen. Darüber hinaus ist es wichtig, daß die in den Experimenten verwendeten Larven sind eng gleichaltrigen. Dies ist auf die rasante Entwicklung der Netzhaut (dh der Differential Entwicklung der Kegel-Subtypen), aber auch der gesamten Morphologie und Physiologie der Larven. Zum Beispiel wird nach 7 dpf Effizienz epithelialer Transpiration verringert so dass es schwierig ist, den Fisch am Leben zu halten. Ein weiterer wichtiger Faktor ist die Qualität der Aufnahme und Referenz-Elektroden. Vorsicht beim Ziehen von Glaskapillaren zu kantig t verhindern genommen werdenips. Eine Mikropipette Mikroschmiede könnten Feuerpolitur eingesetzt werden gezogen Elektroden und helfen, die Signalerfassung zu verbessern. Zusätzlich ist die Aufrechterhaltung der Qualität der Ag / AgCl-Elektroden sehr wichtig. Nach dem Gebrauch müssen sie mit destilliertem Wasser und Luft sofort getrocknet gespült werden. Während Verdunkelung der äußeren Oberfläche von Elektroden kann mit der Zeit auftreten, und nicht auf die Leistung auswirken, getrübt (gelb nach dunkelrot) oder narbige Elektroden zu vermeiden. Vermeiden Handhabung Elektroden mit bloßen Händen, da Protein-Kontamination kann sich negativ Elektrode Verhalten beeinflussen. Schließlich ist anzumerken, dass Ag / AgCl Elektroden lichtempfindlich sind und in Blink-Artefakten führen kann, wenn nicht geschützt werden. (2 sehen Legenden auf die 1 und) und nicht mit unseren Messungen der Larven Zebrafisch Reaktionen auf Reize blinken stören Allerdings haben wir diese Artefakte gefunden minimal. Alternativ kann eine Salzbrücke verwendet werden, um die Ag / AgCl-Elektrode mit dem Schwamm über eine Agar sa verbindenlt Brücke, die Elektrode aus dem Lichtweg zu bewegen. Obwohl eine Salzbrücke in Gleichstrom (DC) Aufzeichnungen verwendet, um die Elektrodenpotential 23 zu stabilisieren, verwendet die ERG Aufzeichnungs Wechselstrom (AC). Daher ist der einzige Zweck eine Salzbrücke in diesem System wäre, wenn die speziellen Setup hat Platz oder besonders starke Photovoltaik-Artefakte.
ERG hat mehrere Vorteile gegenüber anderen Techniken der visuellen Funktion zu messen. Der Hauptvorteil ist, dass es ein in vivo-Aufnahme. Der Nachteil ist, dass die Aktivität von spezifischen Zellen müssen von der Wellenform nicht direkt gemessen zu entnehmen ist, wie es der Fall für die Saugelektrode oder Patch-Clamp-Messungen von Photorezeptoren und andere Zellen in der Retina. Normalerweise Saugelektrode Ableitungen, Patch Clamp Messungen und ganze Netzhaut ERGs haben den Vorteil, dass pharmakologische Mittel können leicht in Zellen eingebracht, um die molekularen Komponenten zu definierender Reaktion ist während dies schwieriger in vivo unter Verwendung von Säugetiermodellen. Die Durchlässigkeit der Zebrabärblingembryonen derartige Mittel überwindet diesen Nachteil.
Analyse des dunkeladaptierten Larven in Abwesenheit von pharmakologischen Mitteln erzeugt ein ERG-Wellenform durch die b-Welle bestimmt, ein Ergebnis, das durch eine Reihe von anderen Gruppen 2, 9,24 -26 beobachtet wurde. Wir zeigen die Fähigkeit, die Membranmasse Rezeptorpotential durch Ausnutzen der Fähigkeit von pharmakologischen Mitteln auf Larven Zebrabärbling dringen isolieren. Larven APB behandelt zeigen eine Aufhebung der b-Welle, so dass die "a-Welle" visualisiert 14-17 werden. Wellenformen mit hervorragenden Signal-Rausch-Verhältnisse wurden durch Mittelung 3 Läufe erhalten. Variation in der Antwortwellenformen wird manchmal festgestellt, aber Makhankov et al. 2 haben berichtet, daß die Varianz in wiederholten Messungen von demselben Tier weniger istals die zwischen Individuen gesehen. Daher ist die Varianz wahrscheinlich das Ergebnis der biologischen Variation statt Variabilität in der Technik.
Zudem ERG Analyse verwendet, um Kegel Erholung in vivo unter Verwendung eines Dual-Flash-Paradigma ähnlich veröffentlichten Ergebnisse in der Anwesenheit und Abwesenheit von Hintergrundbeleuchtung 9, 16 zu prüfen. Dies wurde durch Messung der Fähigkeit des Larven Retina zu aufeinanderBlitze unterschiedlicher ISI reagieren bewerkstelligt. In Kombination mit pharmakologischen Wirkstoffen oder Genom-Engineering-Strategien wie verwendet als Talens, knock out abzielt, ist der Zebrafisch leistungsfähiges System für die In-vivo-Untersuchung der molekularen Mechanismen der Kegel Anpassung und visuelle Erholung.
Unsere Verfahren und Geräte können problemlos an isolierten Larven Augen älteren Zebrafisch oder anderen Wirbeltieren zu untersuchen 27, 28 werden. In der Tat, die ERG Stimulation und Aufzeichnungssystemdass wir beschäftigen wurde hauptsächlich für den Einsatz in der Klinik entwickelt und dann für Experimente an Mäusen modifiziert. Anpassung der Plattform für Zebrafisch-Larven war einfach und könnte leicht in anderen Labors für niedrige Kosten repliziert werden. Ähnliche Aufbauten, die aus klassischen elektro Geräte könnte für minimale Kosten konstruiert werden, und demonstriert worden, um zuverlässige Ergebnisse 16 zu liefern. Insgesamt ist diese Technik von großem Nutzen für die Forscher, die die Mechanismen der visuellen Funktion.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Keine Interessenskonflikte erklärt.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



