Abstract
Elektroretinogram (ERG) är en icke-invasiv elektrofysiologisk metod för bestämning retinal funktion. Genom placering av en elektrod på ytan av hornhinnan, elektriska aktiviteten genereras som svar på ljuset kan mätas och användas för att utvärdera aktiviteten av retinala celler in vivo. Detta manuskript beskriver användningen av ERG för att mäta synfunktionen i zebrafisk. Zebrafisk har länge använts som en modell för ryggradsdjur utveckling på grund av den enkla gensuppression genom morfolinogrupper oligonukleotider och farmakologisk manipulation. Vid 5-10 dpf, bara kottar är funktionella i larv näthinnan. Därför, zebrafisk, till skillnad från andra djur, är ett kraftfullt modellsystem för studier av könen synfunktionen in vivo. Detta protokoll använder standard anestesi, mikromanipulation och stereomikroskopi protokoll som är vanliga i laboratorier som utför zebrafisk forskning. De beskrivs metoder att använda sig av standardelektrofysiologi equipment och ett svagt ljus kamera för att styra placeringen av inspelningen mikroelektrod på larvhornhinnan. Slutligen visar vi hur en kommersiellt tillgänglig ERG stimulator / inspelare ursprungligen konstruerad för användning med möss kan enkelt anpassas för användning med zebrafisk. ERG av larver zebrafisk ger en utmärkt metod för att analysera kon synfunktion hos djur som har modifierats av morfolino oligonukleotid injektion samt nyare genomingenjörstekniker såsom zinkfinger nukleaser (ZFNs), Transkription Activator-Like Effector nukleaser (Talens), och klustrade Regelbundet mellanrum Korta palindromiska Upprepar (CRISPR) / Cas9, som alla har kraftigt ökat effektiviteten och effekten av riktad genmodifiering i zebrafisk. Dessutom tar vi nytta av möjligheten för farmakologiska medel att tränga zebrafisk larver att utvärdera de molekylära komponenter som bidrar till fotoresponsen. Detta protokoll beskriver en inställning som kan ändras och används av forskaremed olika experimentella mål.
Introduction
Elektroretinogram (ERG) är en icke-invasiv elektrofysiologisk metod som har använts i stor utsträckning i kliniken för att bestämma funktionen av näthinnan hos människor. Den elektriska aktiviteten som svar på en Ijusstimulus mäts genom att placera registreringselektrod på den yttre ytan av hornhinnan. Egenskaperna för stimulans paradigm och svarsvågformen definierar näthinnans nervceller bidrar till svaret. Denna metod har anpassats för användning med ett antal djurmodeller inklusive möss och zebrafisk. Den typiska ryggradsdjur ERG svar har fyra huvudkomponenter: a-våg, som är en hornhinna-negativ potential härrör från fotoreceptor cellaktivitet; b-våg, en hornhinna-positiv potential härledd från PÅ bipolära celler; d-våg, en hornhinna-positiv potential tolkas som aktiviteten hos de OFF bipolära celler; och c-våg, som uppträder flera sekunder efter det att B-vågen och återspeglar aktiviteten i Muller Glia och retginalets pigmentepitel 1-4. Ytterligare referenser för att förstå historien och principer för ERG analys hos människor och modelldjur är online lärobok, Webvision, från University of Utah och texter såsom Principles and Practice of Clinical Elektro av Vision 4, 5.
Danio rerio (zebrafisk) har länge använts som en modell för ryggradsdjur utveckling, på grund av dess snabba mognad och öppenhet, vilket möjliggör icke-invasiv morfologisk analys av organsystem, beteendeanalyser och både framåt och bakåt genetiska skärmar (för översikt se Fadool och Dowling 6). Zebrafisk larver är mycket mottagliga för genetisk och farmakologisk manipulation, vilket, när den kombineras med deras höga fruktsamhet, gör dem till en utmärkt djurmodell för hög genomströmning biologiska analyser. Den högre förhållande mellan koner till stavar i larvzebrafisk - ungefär 1: 1 jämfört med möss (~ 3% kons) - gör dem särskilt användbara för studier av konen funktion 7-9.
I ryggradsdjur näthinnan, koner utvecklas innan stängerna 10. Intressant, zebrafisk kottar är operativ så tidigt som 4 dpf, vilket möjliggör selektiv elektrofysiologiska analys av koner i det skedet 6, 11,12. Däremot ERG svar i stavar visas mellan 11 och 21 dpf 13. Därför zebrafisk larver vid 4-7 dpf fungera funktionellt som en all-kon näthinnan. Emellertid är den nativa fotopiska ERG svaret hos 4-7 dpf larver domineras av b-vågen. Tillämpning av farmakologiska medel, såsom L - (+) - 2-amino-4-fosfono-smörsyra (L-AP4), en agonist för metabotropa glutamat (mGluR6) receptorn uttryckt av PÅ bipolära celler, effektivt blockerar alstringen av b-vågen och avslöjar den isolerade kon massreceptorpotential, ("a-wave") 14-17.
Här beskriver vi en enkel och reliable metod för ERG analys med hjälp av kommersiellt tillgängliga ERG utrustning avsedd för användning med möss som har anpassats för användning med zebrafisk larver. Detta system kan utnyttjas på zebrafisk larver av olika genetiska bakgrunder, liksom de som behandlats med farmakologiska medel, för att hjälpa forskarna vid identifiering av signalvägar som bidrar till visuell känslighet och ljus anpassning 16. De experimentella förfaranden som beskrivs i detta protokoll kommer att vägleda utredarna i användningen av ERG analys för att svara på en rad olika biologiska frågor som rör synen, och demonstrera byggandet av en flexibel ERG setup.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Djur underhåll och experimentella protokoll godkändes av Institutional Animal Care och användning kommittéer University of North Carolina i Chapel Hill, och uppfyller alla krav i NIH Office of Laboratory Animal Welfare och Föreningen för bedömning och ackreditering av försöksdjurs Care International.
OBS: För att få larver för ERG analys publicerade protokoll för standard zebrafisk djurhållning och underhåll var anställda 18. Larver erhålls genom naturlig avel och förvarade under en 14 timmar ljus / mörker-cykel 10 tim. Detta protokoll har optimerats för larver vid 5-7 dagar efter befruktning (DPF), men kunde helst utföras på äldre fisk med små modifieringar av förfarandet. Här kan du använda TL-stammen av vildtyp zebrafisk larver vid 5 dpf.
1. Mikropipett Produktion
- Dra flera mikropipetter som använder 1,5 x 0,86 mm (ytterdiameter av innerdiameter) brand polerad borosilikatglas kapillärer medfilament (smälttemperatur, 821 ° C) och en P-97 flammande / brun mikropipett avdragare försedd med låda värmefilament. Använd programmet för forma mikropipetter som beskrivs i tabell 1.
- Kontrollera varje mikropipett under ett mikroskop med en lämplig gradnät linjal för att säkerställa att tips är 10-15 pm i diameter och har en slät spets öppning (dvs. inga ojämna kanter).
- Försiktigt lagra mikropipetter för att förhindra spetsskador och exponering för damm. Lagringsalternativen petriskålar med labb tejp, skum-fodrade lådor, eller kommersiellt tillgängliga behållare mikropipett lagring.
Anmärkning: Andra mikropipett avdragare och glaskapillärer kan användas så länge som den korrekta diametern på mikropipett och en högkvalitativ spetsen uppnås.
| Tryck | Hetta | Dra | Velocity Tid | |
| 500 | 560 | - | 30 | 200 |
| 500 | 450 | - | 30 | 200 |
| 500 | 410 | 55 | 40 | 200 |
Tabell 1: Program för produktion av mikropipetter med användning av en P-97 flammande / brun mikropipett avdragare försedd med en låda värmefilaMikro görs med användning av 1,5 x 1,0 mm 2 (ytterdiameter av innerdiametern) brand polerad borosilikatglas kapillärer med filament. (smälttemperatur, 821 ° C).
2. Buffert Framställning
- Använd filtrerades syrsatt guldfisk Ringers buffert 19 i mikroelektroden kapillären och att mätta polyvinylalkohol (PVA) svamp på vilken larverna är placerade för experiment. Alternativt kan du använda E3 embryo media eller Hanks balanserade saltlösning.
- Förbered 10x guldfisk Ringers lösning såsom beskrivs i tabell 2. Justera till pH 7,8, och sterilisera med användning av ett 0,22 pm filter och lagra 10x lager vid 4 ° C.
- Skapa en arbetslösning på dagen för experimentet genom att späda 10x Ringers lösning till 1x med avjoniserat, destillerat vatten. Filtrera med hjälp av en 0,22 ìm filtersystem. Oxygenat genom bubbling med 95% O2 / 5% CO2-gas under 10 minuter. Cap tätt efteråt för att se till att lösningen förblir syresatt.
| NaCl | 1,25 M |
| KCl | 26 mM |
| CaCl2 | 25 mM |
| MgCl2 | 10 mM |
| glukos | 100 mM |
| HEPES | 100 mM |
3. elektroretinogram Plattform
- Utför ERG experiment på en anti-vibrations tabell inuti en Faraday-bur för att förbättra signal-brusförhållandet. Bifoga en anpassad stålplattform till anti-vibrationsbordet med hjälp muttrarna. Placera en rörlig plast plattform med en viskoelastisk uretanpolymer stötdämpande botten på tabellen under ljuskällan.
- Placera kameran med en magnetiserad stativ, som syftar ner vid den rörliga plastplattform. Placera mikromanipulator (vilket kommer att hålla inspelningsmikroelektrod) med en andra magnetiserad monter till höger om den rörliga plastplattform. Se till att kameran och mikromanipulator inte kommer att störas av förflyttning av annan utrustning och att de inte blockerar belysning från ljuskällan.
- Anslut kameran till en videomonitor och placera den för att visa ögalarv för att placera elektroden i rätt position.
- Se till att installationen är korrekt jordad med koppartråd. För att kontrollera brus, placera referenselektroden och dricks av inspelningen mikroelektrod i en 35 mm petriskål fylld med Ringers lösning. Kontrollera de elektriska bullernivåer i setup med ett oscilloskop eller en inbyggd funktion av ERG apparaten. Bullernivåerna bör inte vara mer än ± 10 μV från baslinjen.
4. Svamp Framställning
- Skär en liten rektangel torr PVA svamp som kommer passa väl i en 35 mm petriskål. Tjockleken av svampen bör inte vara större än djupet av skålen. Använd en mattkniv med en ren rakblad för kapning.
- Gör ytterligare en skuren i svampen för att rymma referenselektroden (antingen ett grunt snitt på längden på botten av svamp eller en fjäril skära vertikalt genom en av de mindre ändarna).
- Använd en kemiskt resistent marköratt markera en liten prick på svampen (där larven kommer att placeras) som kan användas för positionering av kameran.
- Blöt PVA svampen i Ringers lösning tills mättad. Ta bort och blot snabbt på en pappershandduk 2-3 gånger. Placera svampen i en ren 35 mm petriskål.
- Placera petriskål med svampen på plastplattformen så att märket kan visualiseras genom kameran.
5. Elektrod Framställning
OBS: Sebrafisken installationen består av en referenselektrod i kontakt med Ringers lösning mättad PVA svamp och ett registreringselektrod i kontakt med hornhinnan. Referenselektroden består av en Ag / AgCl-pelleten. Den registrerande elektroden är en drog glasmikropipett fylld med Ringers lösning och hålls av en mikroelektrod hållare innehållande en Ag tråd.
- Chloride elektroderna genom blötlägga dem i 6-9% natriumhypoklorit (blekmedel) i 5 min (inspelnings MICRoelectrode tråd) eller 15 min (referenselektrod). Lufttorka på en Kimwipe i 5 min.
- Beroende på typ av snitt görs i steg 4.2, placera Ag / AgCl pellet av referenselektrod in (för vertikala butterfly cut) eller under (för grunt snitt på längden på botten) svampen. Fäst referenselektrodledning till inspelningssystemet.
- Alternativt, om ERG installationen har utrymmesbegränsningar eller om det finns särskilt starka solcells artefakter från Ag / AgCl-elektrod, anslut referenselektrod till svampen via en agar saltbrygga att flytta elektroden ur strålgången.
- Fäst ~ 40 cm av lämpligt dimensionerad slang till en 5 ml ej låsande luerspruta. Fyll sprutan med Ringers lösning. Mikroelektrodhållare som har tryckportar skickas normalt med adaptrar för att rymma slang med innerdiameter av 1/16 ", 3/32", 1/8 "eller 5/32".
- Fyll en 1 ml ej Luer spruta medRingers lösning och, med användning av en Micro-fil, noggrant fylla mikroelektroden hållaren. Förhindra bildandet av bubblor.
- Fäst 5 ml-sprutan till tryckporten på mikroelektrodhållaren med slang och använda den för att säkerställa att mikroelektrodhållaren är full av Ringers lösning. Med användning av Micro-fil och en-ml spruta fylld med Ringers lösning, fylla mikropipett glas från spetsen och se till att inga bubblor är närvarande.
- Fäst glasmikropipett till mikroelektrod hållaren, var noga med att hålla elektrodtråden rakt. När säkrade, använd 5 ml spruta för att noggrant tvinga Ringers lösning genom mikroelektrod tills en liten mängd lösning syns på spetsen. Enstaka applicering av tryck på sprutan (när den inte tillämpas på hornhinnan) kommer att förhindra bildningen av luftbubblor, samt ocklusioner grund av damm eller salt ansamling i mikropipett spetsen.
- Om lösningen kommer ut som en ström, byt glass mikropipett, eftersom spetsöppningen är för stor eller är skadad.
- Placera försiktigt inspelningsmikroelektrod i mikromanipulator och fäst ledningen till registreringssystemet.
6. elektroretinogram Analys
OBS: På grund av kon dominans larv näthinnan, kan högkvalitativa ERG resultat erhållas när förberedelserna för inspelningen utförs under låga nivåer av indirekt vitt ljus (<1 lux) eller med korta perioder (<1 min) av högre intensitet ( ≤250 lux) arbetsbelysning. En kort period av mörker anpassning krävs fortfarande inför inspelningen (se steg 6.7). Däremot kan experiment utföras under dim rött eller infrarött ljus med hjälp av en infraröd känslig kamera. Alla experiment utfördes i filtersteriliserad (0,22 ^ m) systemvattnet från UNC Zebrafish vattenbruksanläggning men kan användas alternativa embryomedia.
- Klipp pappershandduks rutor mäter ca 1cm 2.
- Om mätning isolerade kon masspotentialen receptor, inkubera 3-5 larver i systemet vatten med 500 iM (±) -2-amino-4-fosfonsmörsyra (APB) i 5 min.
OBS: Medan APB är en racemisk blandning av den aktiva (L) och inaktiva (R) former av AP4 är det lika effektivt som L-AP4 och är billigare. - Söva 3-5 larver i systemet vatten med 0,02% (vikt / volym) Tricaine tills svarar, ca 1-2 min.
- Använd en pasteurpipett och pipett pumpen att noggrant överföra individuella larver på papper handduk torg under ett dissekera stereoskop använder minimal belysning (≤250 lux för <1 minut). Kontrollera positionen för varje larv och välj en kandidat som är ryggsidan upp med en oockluderad öga.
- För längre inspelningar (> 30 min), håll larven fuktig genom inglasning kroppen upp till men inte inräknat huvudet med 3% metylcellulosa med en fin kamel-borste.
- Använd pincett, överföra pappershandduk square med larven till den fuktiga PVA svampen.
- För längre inspelningar (> 30 min), tillämpa en kontinuerlig ström av vattenmättad 100% O 2 gas över larven genom att bubbla gasen genom ett airstone i en sidoarm kolv innehållande destillerat vatten. Placera slangen lämnar kolven sidoarm som förmedlar fuktad syre nära larven huvud.
OBS: Steg 6.4.1 och steg 6.5.1 kommer att förlänga livslängden på fisken 16.
- För längre inspelningar (> 30 min), tillämpa en kontinuerlig ström av vattenmättad 100% O 2 gas över larven genom att bubbla gasen genom ett airstone i en sidoarm kolv innehållande destillerat vatten. Placera slangen lämnar kolven sidoarm som förmedlar fuktad syre nära larven huvud.
- Under minimal belysning, använd mikromanipulator och kamera för att placera mikroelektrod spetsen vid mittpunkten mellan den nasala och kaudala ändarna av ögat och försiktigt tryck på den dorsala gränsen av hornhinnan.
OBS: felplacerade elektrodspetsen till långt distala delar av hornhinnan kan resultera i ERG vågformer för omvänd polaritet. - Låt larv till mörk-anpassning i 5-10 min.
- Rekordprov flash reaktioner på ljus tillhandahålls från en LED-ljuskälla eller optisk stimulator med hjälp av tilable stimulans och inspelningsutrustning. Justera protokollparametrar såsom blixtintensitet, blixtlängd, flash färg, bakgrunds intensitet och färg och filterinställningar för att passa experimentet.
- När du är klar med experimentet euthanize larver enligt AVMA / IACUC riktlinjer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Normalt är ERGs registreras från zebrafisk larver på 5 dpf, eftersom ett antal studier har publicerats ERG inspelningar i detta skede 9, 16,20. Larver svar mättes under mörka anpassade villkor utan bakgrundsbelysningen med hjälp av en 20 ms stimulans av vitt LED-ljus. Vi utnyttjade en kommersiellt tillgänglig ERG-systemet består av en Ganzfeld ljus stimulator och datorstyrenhet / inspelare. Stimulatorn använder en hårt kontrollerad egenpulsbreddsmodulering (PWM) system för att styra ljuset från både bakgrunden och blixt stimulans. Svaren registrerades med hjälp av en egenutvecklad fullt differentialförstärkare med en hårdvaru antivikningsfilter kör en 16-bitars analog till digital omvandlare (ADC). Stimulus och svarsinspelningar kontrollerades av proprietär programvara medföljer utrustningen enligt tillverkarens protokoll. Vår utrustning var programmerad att utnyttja en samplingsfrekvens på 1 kHz, digitala Bessel CASCADE filter inställd på en bandpass på mellan 0.312 Hz och 300 Hz, och en 60 Hz notchfilter för att avlägsna överskott brus. I mörkret anpassade larv de B-vågen ökar i amplitud med ökande ljusintensiteter (Figur 1). Den a-våg typiskt skyms av b-vågen och kan inte detekteras tillförlitligt. The b-vågen kan blockeras genom att inkubera larverna med den metabotropiska glutamatreceptorn (mGluR6) -agonist, 4-fosfono-smörsyra (APB). Detta möjliggör för den potentiella receptor konen massa (eller "en-våg") som skall detekteras. Denna "en-wave" svars ökningar i amplitud med ökande intensiteter av ljus (Figur 2).
Ytterligare paradigm kan utnyttjas för att testa visuella parametrar utöver grundläggande visuella funktion och känslighet. Genom användningen av en dubbel blixt paradigm, kan man mäta förmågan hos könen fotoresponsen att återhämta sig från det initiala stimulus (figur 3A). Som interstimulus intervall(ISI) ökar amplituden för det andra svaret ökar, vilket indikerar återhämtning från den initiala stimulus (figur 3B). De APB-isolerade "a-wave" spår presenteras är genomsnittet av tre svep och uppfylla publicerade rapporter av zebrafisk larver ERGs utnyttjar liknande stimulerings paradigm 2, 9,16.
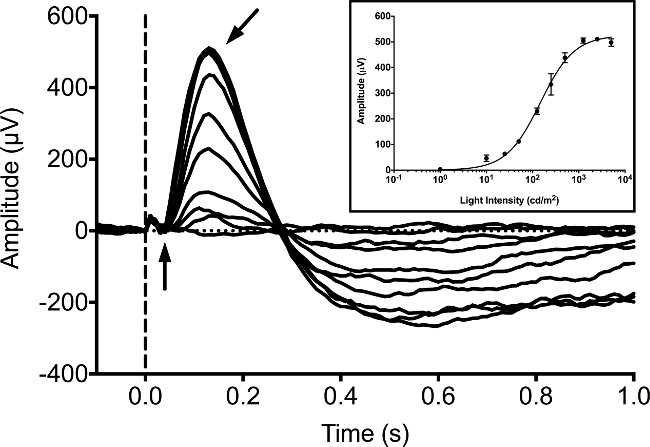
Figur 1: Typisk ERG inspelning i 5 DPF larver zebrafisk. Intensiteten serien erhölls under mörka anpassade villkor. Fisken exponeras för LED vitt ljus med en löptid på 20 ms med intensiteter lika 1, 10, 25, 50 125, 250, 500, 1250, 2500 och 5000 cd / m 2. Uppkomsten av Ijusstimulus betecknas med den prickade vertikala linjen. Den negativa potentialen a-våg (vertikal pil) är svår att urskilja, medan den positivapotentiell b-våg (vinklad pil) är den dominerande toppen av vågformen. En liten solcells artefakt kan observeras som en mindre positiv nedböjning före debut av a-vågen. Infälld, genomsnitt B-våg svars amplituder med ökande intensitet av ljus som har plats med hjälp av Naka-Rushton ekvation 21, 22. Felstaplar representerar SEM.

Figur 2: APB-isolerade kon massreceptorpotential inspelad från larver zebrafisk Intensitet serie erhållits under mörka anpassade villkor vid 5 DPF.. Stimulansen är en 20 ms LED vitt ljus med intensiteter är lika 1, 10, 25, 50 125, 250, 500, 1250, 2500 och 5000 cd / m 2. Uppkomsten av ljus stimulering betecknas med den prickade vertikala linjen. Den isolerade kon mass receptor potential ("a-wave") är den dominerande beståndsdelen i vågformen (pilen). En litensolcells artefakt kan observeras som en mindre positiv nedböjning före debut av konen svaret. Inset genomsnitt svars amplituder med ökande intensitet av ljus som har plats med hjälp av Naka-Rushton ekvationen. Felstaplar representerar SEM.

Figur 3:.. Cone massreceptorpotential inspelning använder en dubbel blixt paradigm A 5 dpf APB-behandlad larven utsattes för två 20 ms blixtar av vitt ljus (LED källa), vardera med en intensitet på 1000 cd / m 2 (A) Svaret på 2 på varandra blinkar med en interstimulus intervall (ISI) lika med 2 sek. Ljus exponeringar är markerade med streckade vertikala linjer. Amplituden för det andra svaret är lägre än den för det första svaret, vilket indikerar ofullständig reaktion återhämtning. (B) förhållandet mellan den maximala isolerade kon massreceptor potenTiAl respons hos den andra stimulans till den hos den ursprungliga stimulansen för varje ISI. Kurvanpassning icke-linjär regressionsanalys har applicerats. Som ISI ökar, svaret på den andra stimulansökningar amplitud i förhållande till svar på den ursprungliga stimulans indikerar progressiv återhämtning av ljusmätare känslighet. Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I detta protokoll en enkel procedur för ERG inspelningar av larver zebrafisk beskrivs. Detta förfarande möjliggör en snabb och omfattande analys av visuell function.There finns flera viktiga steg under hela förfarandet som bör hållas i åtanke. Den zebrafisk larver bör vara friska före försöket att förhindra dödsfall under potentiella läkemedelsbehandlingar och se långvarig försörjning under ERG inspelningar. Dessutom är det viktigt att larverna utnyttjas i experiment är tätt åldersmatchade. Detta beror på den snabba utvecklingen av näthinnan (dvs, differential utveckling av kon subtyper) och även den totala morfologi och fysiologi larverna. Till exempel, efter 7 dpf effektiviteten i epitelial transpira minskar vilket gör det svårare att hålla fisken vid liv. En annan viktig faktor är kvaliteten på inspelningen och referenselektroder. Man måste vara försiktig när man drar glaskapillärer att förhindra grova kanter tips. En mikropipett microforge skulle kunna användas till brand polish drog elektroder och hjälp för att förbättra signal förvärvet. Dessutom är det mycket viktigt att upprätthålla kvaliteten på de Ag / AgCl-elektroder. Efter användning måste de sköljas med destillerat vatten och lufttorkas omedelbart. Medan mörkn av den yttre ytan av elektroderna kan förekomma med tiden och inte påverka prestanda, fläckas (gul till mörkt röd) eller urkärnade elektroder bör undvikas. Undvik hantering elektroder med bara händer, eftersom kontamination protein kan påverka elektrodbeteende. Slutligen bör det noteras att Ag / AgCl-elektroder är ljuskänsliga och kan leda till flash artefakter, om inte skyddad. Vi har dock funnit dessa artefakter att vara minimal (se legender till figur 1 och 2) och inte störa våra mätningar av larver zebrafisk svaren blinka stimuli. Alternativt kan en saltbrygga användas för att ansluta Ag / AgCl-elektrod till svampen via en agar salt bro att flytta elektroden ur strålgången. Även om en saltbrygga används i likström (DC) inspelningar att stabilisera elektrodpotentialen 23, utnyttjar ERG inspelning växelström (AC). Därför det enda syftet med en saltbrygga i detta system skulle vara om det specifika konfiguration har utrymmesbegränsningar eller särskilt starka solcells artefakter.
ERG har flera fördelar över andra tekniker för att mäta synfunktionen. Den främsta fördelen är att det är ett in vivo-inspelning. Nackdelen är att aktiviteten av specifika celler härledas ur vågformen snarare än direkt mäts, såsom skulle vara fallet för sug elektroden eller patch clamp inspelningar av fotoreceptorer och andra celler i näthinnan. Normalt sugelektrod inspelningar, patch clamp inspelningar och hela näthinnan ERGs har fördelen att farmakologiska medel lätt kan införas i celler för att definiera de molekylära komponenternaav svaret är Detta svårare in vivo med hjälp däggdjurs modeller. Permeabiliteten hos zebrafisk larver till sådana medel övervinner denna nackdel.
Analys av mörk-anpassad larver i avsaknad av farmakologiska medel ger en ERG vågform som domineras av b-vågen, ett resultat som har observerats av ett antal andra grupper 2, 9,24 -26. Vi visar förmågan att isolera den potentiella receptor konen massa genom att dra fördel av förmågan hos farmakologiska medel att penetrera larver zebrafisk. Larver behandlas med APB visa ett upphävande av b-vågen, vilket gör att "en-våg" som ska visualiseras 14-17. Vågformer med utmärkt signal till brusförhållanden erhölls genom genomsnitt 3 svep. Variation i svars vågformer ibland noteras, men Makhankov et al. 2 har rapporterat att variansen i upprepade mätningar från samma djur är mindreän den som sågs mellan individer. Därför är det troligt att vara ett resultat av biologiska variationen snarare än variabiliteten i tekniken variansen.
Vi utnyttjade också ERG analys för att undersöka kon återhämtning in vivo med hjälp av en dubbel blixt paradigm, liknande publicerade resultat i närvaro och frånvaro av bakgrundsbelysningen 9, 16. Detta åstadkoms genom att mäta förmågan hos larv näthinnan att reagera på varandra följande blixtar av varierande ISI. Vid användning i kombination med farmakologiska medel eller genomet tekniska strategier såsom Talens att slå ut pathway mål är zebrafisk kraftfullt system för att studera de molekylära mekanismerna för kon anpassning och visuell återhämtning in vivo.
Vårt förfarande och utrustning kan enkelt anpassas för att undersöka isolerade larver ögon, äldre zebrafisk eller andra ryggradsdjur 27, 28. Faktum ERG stimulering och registreringssystematt vi anställer var huvudsakligen avsedd för användning i en klinisk miljö och sedan modifierats för experiment på möss. Att anpassa plattformen för zebrafisk larver var enkel och lätt kunde vara fallet i andra laboratorier för låg kostnad. Liknande uppställningar bestående av klassisk elektroutrustning skulle kunna konstrueras för minimal kostnad, och har visat sig ge tillförlitliga resultat 16. Sammantaget är denna teknik till stor nytta för forskare som studerar mekanismerna för synfunktionen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Inga intressekonflikter deklareras.
Materials
| Name | Company | Catalog Number | Comments |
| Faraday cage | 80/20 Inc | custom | Custom designed aluminum "Industrial Erector Set" for Cage framework |
| PVA sponge | Amazon | B000ZOWG1C | Provides a soft, moist platform for placement of zebrafish larvae |
| 150 ml Sterile Filter systems | Corning | 431154 | Filtering solutions to prevent small articulates from blocking micropipettes |
| Espion E2 | Diagnosys, LLC | contact | Modular electrophysiology system capable of generating visual stimuli for any stimulator and digital recording and analysis of responses using propietary software, more information at http://www.diagnosysllc.com |
| Colordome | Diagnosys, LLC | contact | Light stimulator with RGB LED and Xenon light sources for Ganzfeld ERG, more information at http://www.diagnosysllc.com |
| Micromanipulator | Drummond | 3-000-024-R | Holding and positioning the recording microelectrode |
| Magnetic ring stand | Drummond | 3-000-025-MB | Holding and positioning of the camera and refrence electrode |
| Lead extensions | Grass Technologies | F-LX | Spare female to male 1.5 mm lead cables for connecting electrodes |
| Male Pin to Female SAFELEAD Adaptor | Grass Technologies | DF-215/10 | Connecting 2 mm pins to 1.5 headboard pins |
| Window screen frame (metal) and spline | Lowes or Home Depot | various | For attaching copper mesh to Faraday cage framework |
| Steriflip 50 ml filters | Millipore | SCGP00525 | Filtering solutions to prevent small articulates from blocking micropipettes |
| BNC adaptor | Monoprice | 4127 | Connecting camera to BNC cable |
| BNC cable | Monoprice | 626 | Connecting camera to video adaptor |
| Camera lens | Navitar | 1582232 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Camera coupler | Navitar | 1501149 | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Luna BNC to VGA + HDMI Converter | Sewell | SW-29297-PRO | BNC to VGA adaptor allowing camera image to project on computer monitor |
| APB | Sigma | A1910 | mGluR6 agonist, blocks b-wave allowing analysis of the isolated cone mass receptor potential |
| Borosilicate glass | Sutter | BF-150-86-10 | Fire- polished borosilicate glass (metling temperature = 821°C) with filament and dimensions of 1.5mm x 0.86 mm (outer diameter by inner diameter) |
| P97 Flaming/Brown puller | Sutter | P97 | For pulling glass micropipettes |
| Sorbothane sheet | Thorlabs | SB12A | Synthetic viscoelastic urethane polymer, placed under Passive Isolation Mounts and ERG platform to absorb shock and prevent slipping, can be cut to size |
| Breadboard | Thorlabs | B2436F | Vibration isolation platfrom for ERG stimulator and zebrafish specimen |
| Passive Isolation Mounts | Thorlabs | PWA074 | Provides vibration isolation to breadboard |
| Copper mesh | TWP | 022X022C0150W36T | To line Faraday Cage |
| Pipette pump | VWR | 53502-233 | Used with Pasteur pipettes to carefully transfer zebrafish larvae |
| Pasteur pipettes | VWR | 14672-608 | Used with Pipette pump to carefully transfer zebrafish larvae |
| Camera | Watec | WAT-902B | Visualizing the positioning of the recording microelectrode onto the larval cornea |
| Tricaine (MS-222) | Western Chemical | Tricaine-S | Pharmaceutical-grade anesthetic, |
| Micro-fil | WPI | MF28G-5 | Filling microelectrode holder and microelectrode glass |
| Microelectrode holder | WPI | MEH2SW15 | Holds glass microelectrode, connects to ERG equipment |
| Reference Electrode | WPI | DRIREF-5SH | Carefully break off last centimeter of casing to drain electrolyte and expose sintered Ag/AgCl pellet electrode |
| Reference Electrode (alternative) | WPI | EP1 | Alternative to DRIREF-5SH. Ag/AgCl electrode that must be wired/soldered to connecting lead |
| Low-noise cable for Microelectrode holder | WPI | 13620 | Connecting recording microelctrode holder to adaptor/headboard |
References
- Dowling, J. E. The retina: an approachable part of the brain. , Harvard University Press. Cambridge, MA. (1987).
- Makhankov, Y. V., Rinner, O., Neuhauss, S. C. An inexpensive device for non-invasive electroretinography in small aquatic vertebrates. J Neurosci. Methods. 135, 205-210 (2004).
- Wu, J., Peachey, N. S., Marmorstein, A. D. Light-evoked responses of the mouse retinal pigment epithelium. J Neurophysiol. 91, 1134-1142 (2004).
- Heckenlively, J. R., Arden, G. B. Principles and Practice of Clinical Electrophysiology of Vision. , 2nd edn, The MIT Press. Cambridge, MA. (2006).
- Perlman, I. Webvision: The Organization of the Retina and Visual System. Kolb, H., Nelson, R., Fernandez, E., Jones, B. , (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. ProgRetin. Eye Res. 27, 89-110 (2008).
- Doerre, G., Malicki, J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech. Dev. 110, 125-138 (2002).
- Brockerhoff, S. E., et al. Light stimulates a transducin-independent increase of cytoplasmic Ca2+ and suppression of current in cones from the zebrafish mutant nof. J Neurosci. 23, 470-480 (2003).
- Rinner, O., Makhankov, Y. V., Biehlmaier, O., Neuhauss, S. C. Knockdown of cone-specific kinase GRK7 in larval zebrafish leads to impaired cone response recovery and delayed dark adaptation. Neuron. 47, 231-242 (2005).
- Harada, T., Harada, C., Parada, L. F. Molecular regulation of visual system development: more than meets the eye. Genes Dev. 21, 367-378 (2007).
- Branchek, T. The development of photoreceptors in the zebrafish, brachydaniorerio. II. Function. J Comp Neurol. 224, 116-122 (1984).
- Schmitt, E. A., Dowling, J. E. Early retinal development in the zebrafish, Daniorerio: light and electron microscopic analyses. J Comp Neurol. 404, 515-536 (1999).
- Bilotta, J., Saszik, S., Sutherland, S. E. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn. 222, 564-570 (2001).
- Wong, K. Y., Adolph, A. R., Dowling, J. E. Retinal bipolar cell input mechanisms in giant danio. I. Electroretinographic analysis. J Neurophysiol. 93, 84-93 (2005).
- Nelson, R. F., Singla, N. A spectral model for signal elements isolated from zebrafish photopicelectroretinogram. Vis Neurosci. 26, 349-363 (2009).
- Korenbrot, J. I., Mehta, M., Tserentsoodol, N., Postlethwait, J. H., Rebrik, T. I. EML1 (CNG-modulin) controls light sensitivity in darkness and under continuous illumination in zebrafish retinal cone photoreceptors. J Neurosci. 33, 17763-17776 (2013).
- Gurevich, L., Slaughter, M. M. Comparison of the waveforms of the ON bipolar neuron and the b-wave of the electroretinogram. Vision Res. 33, 2431-2435 (1993).
- Westerfield, M. The Zebrafish Book: A guide for the laboratory use of zebrafish (Daniorerio). , 5th edn, University of Oregon Press. Portland, OR. (2007).
- Kim, D. Y., Jung, C. S. Gap junction contributions to the goldfish electroretinogram at the photopic illumination level. Korean J PhysiolPharmacol. 16, 219-224 (2012).
- Brockerhoff, S. E., Dowling, J. E., Hurley, J. B. Zebrafish retinal mutants. Vision Res. 38, 1335-1339 (1998).
- Naka, K. I., Rushton, W. A. S-potentials from colour units in the retina of fish (Cyprinidae). J Physiol. 185, 536-555 (1966).
- Naka, K. I., Rushton, W. A. S-potentials from luminosity units in the retina of fish (Cyprinidae). J Physiol. 185, 587-599 (1966).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. J Neurosci. Methods. 159, 108-115 (2007).
- Brockerhoff, S. E., et al. A behavioral screen for isolating zebrafish mutants with visual system defects. ProcNatlAcadSci. U S A. 92, 10545-10549 (1995).
- Fleisch, V. C., Jametti, T., Neuhauss, S. C. Electroretinogram (ERG) Measurements in Larval Zebrafish. CSH protocols. , (2008).
- Seeliger, M. W., Rilk, A., Neuhauss, S. C. Ganzfeld ERG in zebrafish larvae. Doc Ophthalmol. 104, 57-68 (2002).
- Kainz, P. M., Adolph, A. R., Wong, K. Y., Dowling, J. E. Lazy eyes zebrafish mutation affects Müller glial cells, compromising photoreceptor function and causing partial blindness. J Comp Neurol. 463, 265-280 (2003).
- Lewis, A., et al. Celsr3 is required for normal development of GABA circuits in the inner retina. PLoS. genetics. 7, e1002239 (2011).



