ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
이 프로토콜은 9 주 된 쥐의 branchiomeric 머리 근육에서 위성 세포의 분리에 대해 설명합니다. 근육은 다른 아가미 아치에서 시작. 이어서, 위성 세포 분화를 연구하기 mm 크기의 스폿 코팅에 배양했다. 이 접근 방법은 위성 세포의 팽창 및 계대를 피한다.
Introduction
약 1 : 500 ~ 1 : 1,000 신생아는 입술 및 / 또는 구개 (CLP)를 포함하는 틈을 전시; 따라서, 이것은 한 사람의 가장 흔한 선천성 기형이다. 부드러운 입천장의 근육은 음성, 연하, 그리고 흡입하는 동안 부드러운 미각의 기능을 위해 중요하다. 부드러운 미각의 갈라진 틈이있는 경우, 이러한 근육이 비정상적으로 구개 뼈의 뒤쪽 끝 부분에 삽입됩니다.
연구 개는 코를 통해 공기가 빠져 나가는 것을 방지 연설에서 위아래로 이동합니다. 미각의 갈라진 어린이는 구개 범인 두 기능 부전 2,3로 알려진 현상의 결과로이 제어 기능이 없습니다. 치료 프로토콜이 변수이지만, 부드러운 구개의 수술 수리 유아 (생후 6-36개월) 4에서 일어난다. 부드러운 미각의 이상 삽입 근육 수술 5-7 보정 할 수 있지만, 구개 범인 두 기능 부전은 30 %로 7 %에서 지속환자 2,3,8-10의.
위성 세포 SCS ()의 작용을 통해 재생하는 골격근의 기능은 잘 확립되어있다 (11, 12). 근육 손상시, SCS는 활성화 및 부상의 사이트로 이동한다. 그런 다음, 증식 분화, 새로운 근섬유 또는 수리 손상된 사람 (13)을 형성하기 위해 융합. 그들의 자손, 증식 근육 모세포가 추가로 근육 조직 결정 요인 1 (MyoD) (16)을 표현하면서 대기 SCS는, 전사 인자 Pax7 14, 15를 표현한다. 차별화 근육 아세포 17 (MyoG)를 오게 닌 표현하기 시작합니다. 근육 아세포 분화의 단자는 근섬유의 형성 및 미오신 중쇄 (MyHC) (16, 18)와 같은 근육 특이 단백질의 발현에 의해 표시된다.
최근 몇 가지 전략은 사지의 근육 19-23의 근육 재생을 향상시키기 위해 재생 의학에 사용되어왔다. 에 대한 구체적인 연구그것은 최근에 그들이 여러 측면 (24)의 다른 근육과 다를 것을 증명했기 때문에 branchiomeric 머리 근육도 중요하다. 사지 근육과는 대조적으로, 그것은 branchiomeric 머리 근육이 덜으로 SC (25)를 포함하는 느린 재생,보다 섬유 결합 조직이 다른 전사 인자를 발현 branchiomeric 머리 근육에서 SC와 증식, 또한 부상 (26) 이후에 형성하는 것이 제안되었다. 예를 들어, Tcf21, 안면 근육 형성 용 전사 인자 강하게 머리 근육 재생에 있지만 거의 사지의 근육 (25)를 재생 표시된다. CLP 환자의 부드러운 입천장의 근육은 일반적으로 작고 덜 정상 구개 근육 27,28에 비해 잘 구성되어 있습니다. 느리고 빠른 섬유는 모두 부드러운 구개 근육에 존재하지만 느린 섬유는 더 풍부하다. 대조적으로, 분열 근육도 빠르고 높은 섬유의 비율 및 감소 된 모세관 공급 포함일반 연구 개 근육 29-31 비교. 빠른 섬유는 수축에 의한 상해 31-33 더 많은 경향이있다. 첨부 가난한 모세관 공급도 섬유증 (34, 35)을 촉진 할 수있다. 이러한 모든 측면은 수술 갈라진 폐쇄 (36) 후 연구 개 근육의 가난한 재생에 기여할 수있다. 이러한 관점에서, 헤드 branchiomeric 근육으로 SC의 분리 및 특성화를위한 프로토콜은 중요하다. 이 branchiomeric 머리 근육의 SC 생물학을 연구 할 수있는 가능성을 제공합니다. 또한, 조직 공학을 기반으로 새로운 치료법은 CLP 및 두개 안면 영역을 손상시키지 다른 조건에서 수술 후 근육의 재생을 촉진하기 위해 개발 될 수있다.
일반적으로, SCS는 근육 조직 (14)의 분해 후에 얻어 질 수있다. 닦지 효소 소화 및 분쇄은 일반적으로 자신의 틈새 시장에서 희주를 해제해야합니다. SCS는 FR, 무지 14,37,38 접시에 미리 도금에 의해 정제 할 수있다actionation는 퍼콜 (39, 40)에, 직관 형 형광등 또는 자기 또는 셀은 41-43 정렬. 여기에서 우리는 젊은 성인 쥐의 branchiomeric 머리 근육에서 위성 세포의 분리를 위해 새로운 경제 및 신속한 프로토콜을 제시한다. 이 프로토콜은 이전 원고 (14) 및 특히 작은 조직 샘플에 대한 적응에 기초한다. 1 차, 2 차, 4 차 아가미 아치에서 발생하는 대표적인 근육에서 희주의 분리는 설명한다. 분리 후 위성 세포의 낮은 숫자는 분화를 연구 할 수 밀리미터 크기의 세포 외 기질 젤 관광 명소 배양. 이 방법은 확장으로 SC 및 계대에 대한 요구를 피한다.
Protocol
여기에 설명 된 모든 실험은 네덜란드 법률 및 규정 (RU 12 월 2013-205)에 따라 Radboud 대학 네이 메헨에서 동물 실험에 대한 지역위원회의 승인을했다.
1. 세포 외 기질 젤 명소
- 분리하기 전에 다음 단계를 일일를 수행합니다
- 적어도 1.5 시간 동안 4 ℃에서 분취 외 매트릭스 젤 (100 μL)를 해동. 둘 베코의 수정 이글의 중간에 1:10 희석; 4500 밀리그램 / L 글루코스, 4mM의 L- 글루타민 및 110 ㎎ / ㎖ 나트륨 피루 베이트 (DMEM)와. 항상 4 ℃에서 세포 외 기질 젤을 유지합니다. 참고 : 갑작스러운 온도 변화가 고르지 코팅 및 결정 형성에 발생합니다.
- 15 분 동안 얼음에 희석 외 매트릭스 겔 용액을 유지.
- 10 분 동안 20 μL 마이크로 피펫을 사전 진정.
- 100mm 페트리 접시에 8 잘 챔버 슬라이드를 넣고 10 분 동안 차가운 표면 (예 : 냉동 팩)에 접시를 전송합니다.
- 각 웰에 10 ㎕의 세포 외 기질 겔 방울을 넣어 예비 냉각 마이크로 피펫을 사용한다. 적어도 다른 7 분 (그림 1A)의 차가운 표면에 페트리 접시를 유지합니다.
- 완전히 남아있는 세포 외 기질 젤 (그림 1B)를 제거하고, 밤새 37 ℃에서 우물을 건조.
2. 해부 머리의 근육 (턱, Digastric 및 상안검 거근 벨리 Palatini)
- 해부하기 전에, 인산염 완충 식염수 2 % 페니실린 - 스트렙토 마이신 (P / S)로 보충 (PBS)의 50 ㎖를 준비합니다. 얼음에 보관하십시오.
- CO 2 / O 2 일 젊은 성인 쥐 (9 주)의 안락사 후, 머리를 목을 벨과 머리에서 피부를 제거합니다. 얼음처럼 차가운 PBS에 머리를 전송은 50 ㎖ 튜브에 2 % P / S 보충.
- (1 아가미 아치에서 파생) 턱 근육
- 실리콘 패드에 한면을 위로 머리를 놓고 피하 N으로 해결eedles (그림 2A).
- 이하선과 안면 신경 (그림 2A)를 확인합니다. 글 랜드를 덮고 깊은 근막을 노출. 근막을 잘라 해부 가위를 사용하여 선을 제거합니다. 외이도를 확인합니다. stylomastoid 난원에서 안면 신경을 추적 조심스럽게 메스 블레이드 번호 15, 시간적 광대뼈, 및 구강 가지를 제거합니다.
- 근막을 제거하여 턱 근육의 표면 머리를 무료로 제공됩니다. 턱 근육의 표면과 깊은 모두 머리를 식별합니다. 상악의 광대뼈 과정에서 삽입의 두께 건의 건막 때까지 표면 머리를 추적합니다.
- 직선 집게와 광대뼈 과정에서 그 기원에서 건을 분리합니다. 메스 블레이드 제 15 호 또는 해부 가위 조심스럽게 인생을 (그림 2B)로 잘라.
- 그 각도로 삽입 및 T의 열등한 반까지 턱의 표면 머리를 해부하다그는 메스 블레이드 제 15 호 (그림 2C)과 하악의 골지의 표면 측 방향의. 이제 완전히 근육을 제거합니다.
- (2 차 아가미 아치에서 파생) digastric 근육의 후방 배
- 실리콘 패드 앙와위에서 머리를 놓고 피하 주사 바늘 (그림 3A)이 수정.
- 설하과 턱밑 샘을 모두 덮는 피하 지방을 제거합니다. 다음으로, 표면 근막 및 해부 가위를 사용하여 땀샘을 제거합니다. digastric 근육 (전방 및 후방 배)을 노출.
- 직선 집게와 후방 배의 앞쪽 힘줄을 잡고 잘라하고, 고막 수포 (그림 3B)에서 그 기원까지 조심스럽게 해부. 반대편에서 같은 작업을 수행합니다.
- (4 아가미 아치에서 파생) 상안검 거근 벨리의 palatini 근육
- digastric 근육의 후방 배의 절개 후, 옆으로 당겨, stylohyoid 근육을 지역화, 조심스럽게 (그림 4A)를 제거합니다.
- 고막 수포 (그림 4A)에 삽입 눈꺼풀 올림 근 벨리의 palatini의 건 지역화. 조심스럽게 해부하고 양쪽에 잘라.
- 기관과 그 뒤에 실행 식도를 찾습니다. 식도를 들어 올리고 인두, 후두와 부드러운 미각을 노출.
- 눈꺼풀 올림 근 벨리의 palatini 삽입 부드러운 미각의 영역을 현지화하고 느슨한 (그림 4B)을 잘라.
참고 : 직접 절개 한 후, 조심스럽게 스테레오 현미경으로 각 근육에서 건과 결합 조직을 제거합니다. 에탄올 70 %에 신속하게 모든 표본 잠수함, 그리고 얼음처럼 차가운 PBS로 전송 15 ML 튜브에 2 % P / S를 보충.
위성 세포의 분리 (3)
- 근육의 3 그룹의 SC 격리를위한 다음과 같은 준비 단계를 수행합니다 :
- DMEM에 0.1 % 프로 나아 7.5 ml의를 준비합니다. 0.22 μm의 필터를 통해 솔루션을 필터링합니다. 분리하기 전에 10 분 동안 수욕에서 37 ℃에서 용액을 미리 가온.
- 준비 10 % 말 혈청 (HS), 1 %의 P / S가 보충 된 DMEM 35 ml의. 또한 미리 따뜻한 37 ℃ 수욕.
- 20 % 소 태아 혈청 (FBS), 10 % HS, 1 % P / S, 1 % 닭 배아 추출액 (CEE)가 보충 된 DMEM으로 구성되어 15 ml의 배지를 준비한다. 수욕에서 37 ° C에서 미리 따뜻한.
- 프리 코트 여섯 플라스틱 피펫을 사용하기 전에 적어도 10 분 동안 함께 HS (10 mL) 및 건조.
- 배양 후드에서, 6 웰 플레이트의 각 웰에 근육을 전송. 해부 가위를 사용하여, 약 2mm의 작은 조각에 근육을 잘라. 조직을 너무 많이 말하다하지 않도록주의하십시오.
- 조심스럽게 각 웰에 0.1 % 프로 나제 용액 2.5 mL를 추가하고 60 분 동안 37 ° C에서 배양한다. 조심스럽게 20, 40, 60 분 후 판을 흔들. 참고 : 정확한 duratio을배양 n은 동물의 나이와 변형 등의 요인에 따라 달라집니다.
- 현미경으로 모니터링합니다. 근육 조각을 확인하고 섬유 번들이 느슨해 모양 (그림 5)를 얻을 때 효소 소화를 중지합니다.
- DMEM 2.5 ml의 10 % 및 1 % HS의 P / S가 보충 된 추가. 5 분 동안 400 XG에 15 ML 튜브와 원심 분리기에 튜브를 전송합니다. 경사에 의해 상층 액을 버린다.
- 10 % HS와 1 % P / S 보충을 5 ml의 DMEM을 추가합니다. 조직을 균질화 위 아래로 10 ml의 플라스틱 피펫 (분쇄)에 적어도 20 번 솔루션을 피펫.
- 4 분 동안 200 XG에서 튜브를 원심 분리기. 상층 액을 수집하고 15 ML 튜브로 전송할 수 있습니다.
- 10 % HS와 1 % P / S 보충을 5 ml의 DMEM을 추가합니다. 피펫 다시 조직 조각까지 10 ml의 플라스틱 피펫과 피펫을 통해 쉽게 전달합니다.
- 4 분 200 XG에서 튜브를 원심 분리기와 15 ML 튜브에 뜨는를 수집합니다.
- 피50 ㎖ 튜브에 세포 스트레이너 (40 μm의) UT 및 필터 상에 해리 된 세포를 포함하는 상등액을 전송. 최대 세포 복구를 위해 1 ML의 DMEM 씻으시오.
- 10 분 동안 1,000 XG에서 튜브를 원심 분리기와 피펫으로 상층 액을 버린다.
- 300 ㎕의 배양 배지에 펠렛을 재현 탁하고에서 혈구 세포를 카운트.
세포 외 기질 젤 명소에 위성 세포의 분화 (4)
- 배지 10 ㎕를 1.5 × 103 세포를 얻기 위해 세포 현탁액을 희석.
- 테이프로 챔버 슬라이드 커버를 안전하고 개체 유리의 바닥면에 검은 색 마커 지점을 표시합니다.
- 마이크로 피펫을 사용하여, 세포 외 기질 겔 스팟 상에 10 ㎕의 세포 현탁액의 방울을 넣어. 세포 현탁액의 방울을 그 자리에 정확하게 배치되었는지를 현미경으로 확인한다. 37 ℃에서 6 시간 동안 품어.
- 주의LY는 배양 배지 (20 % FBS가 보충 된 DMEM, 10 % HS, 1 % P / S 및 1 % CEE) 400 μL를 추가하고, 37 ℃에서 사흘 동안 배양한다.
참고 :이 시점에서, 갓 격리 SC는 대규모 외상 (효소 다이제스트 및 거친 분쇄)을 실시하고 복구 할 필요가있다. 3 일 (37) 동안 셀들을 방해하지 않도록, 배양 배지는 실험의 유형에 따라 변경 될 수있다.
세포 외 기질 겔 스팟 분화 검정 용 높은 세포 밀도 (1.5~2.5 × 10 20분의 3 μL) 시드 될 수있다. 배양액 (DMEM은 20 % FBS, 10 % HS, 1 % P / S, 1 % 닭 배아 추출물로 보충) 매 세 번째 날 대체 될 수있다. - 확장 및 전달이 요구되는 경우 또는, 다음 단계를 수행합니다 :
- 적어도 1.5 시간 동안 4 ℃에서 분취 외 매트릭스 젤 (500 μL)를 해동. DMEM에서 1:10 희석과 포인트 1.1.1의 권장 사항을 따르십시오.
- 4에서 10 분 동안 10 ml의 피펫을 사전 진정# 176; C.
- 10 분 동안 차가운 표면 (예 : 냉동 팩)에 세 T75 플라스크를 전송합니다.
- 각 플라스크에 1 ml의 세포 외 기질 젤을 넣어 미리 냉장 피펫을 사용합니다. 표면이 완전히 덮여 있는지 확인합니다. 적어도 다른 7 분 (그림 1A)의 차가운 표면에 플라스크를 유지합니다.
- 완전히 10 ㎖ 피펫 나머지 외 매트릭스 겔을 제거하고, 1 시간 동안 37 ° C에서 건조 웰.
- 계산 한 후, 배양 배지를 미리 코팅 된 T75 플라스크에 종자 (20 % FBS, 10 % HS, 1 % P / S, 1 % 닭 배아 추출물이 보충 된 DMEM) 10ml에 갓 절연 SC와 재현 탁.
- 삼일 후, 80 %의 합류 때까지 매체 (모든 셋째 날)를 변경하는 것은 도달한다. 계대를 들어, PBS로 T75 플라스크를 세 번 씻는다. 다음 1 ml의 0.25 %를 트립신 용액을 첨가하고 37 ℃에서 세 분 동안 품어. 배지 9 용액에 재현 탁은 (DMEM은 10 % HS, 1 % P / S, 20 %의 FBS로 보충1 % 닭 배아 추출액)과 5 분 동안 200 XG 원심 분리기. 상층 액을 버린다. 계산 한 후, 배양 배지 중 1000 μL를 1 × 106 세포를 재현 탁하고, 세포를 동결.
Representative Results
이 프로토콜을 이용하여, 턱 근육 (한쪽) 0.8-1 × 106 세포 digastric 근육 (후방 배) 1.5 X 105 세포를 수득하고, 거근 벨리 palatini 근육 수율 1.5 × 105 세포를 산출한다. 셀 수익률은 동물의 근육 유형, 변형, 나이에 따라 달라집니다. 세 근육 그룹 간 비교를 위하여, 갓 고립으로 SC는 동일한 셀 밀도 (1.5 × 10 10분의 3 μL) 시딩 하였다. 직접 분리 한 후 신선하게 분리 된 세포의 90 % 이상은 Pax7 (도 6)을 표현한다.
4 일, 7, 10 문화는 Pax7, MyoD, MyoG 및 MyHC의 면역 염색에 대한 항체로 염색했다. 임의의 5 필드는 20X 대물 렌즈를 이용하여 배양 당 계수 하였다. 4 일 팍스 7 및 묘 D 모든 근육 그룹에서 발현된다 (도 6 및도 7 및도 8), 턱과 digastric 근육에서의 SatCs 그러나 자손 EXPRES 시작오게 닌 이전 눈꺼풀 올림 근 벨리의 palatini 근육 (그림 9)보다 노래. 10 일에, MyoG의 발현이 강하게 모든 그룹에서 (그림 9) 감소한다. 며칠 외 매트릭스 겔 스팟에 파종 후, 증식하는 세포를 융합 및 미오신 중쇄를 발현 멀티 myotubes 핵을 형성하기 시작한다. 작은 myotubes는 7 일 (그림 10)에서 명확하게 볼 수 있습니다. 10 일에, myotubes의 경련은 (비디오 1)을 관찰 할 수있다.

그림 1 :. 챔버 슬라이드에 세포 외 기질 젤 명소 (가) 쉬운 조작, 100mm 페트리 접시에 8 잘 챔버 슬라이드를 배치합니다. 피펫 10 μL 세포 외 기질 각 챔버에서 젤 차가운 표면 (7 분)에 넣어. (B)를 초과하는 세포 외 기질 G 후 회의소 슬라이드엘이 제거됩니다.

그림 2 :. 측면보기 동물의 턱 근육의 해부 (A) 머리. 귀 (E), 이하선 (P)과 안면 신경 (VII). (B) 턱 근육 (MS)와 시간적 근육 (t)의 표면 머리의 건의 건막 (테). 집게와의 삽입에서 건을 분리합니다. (C)는 조심스럽게 하악의 골지에서의 삽입 때까지 근육을 해부하다. E : 귀, P : 이하선, VII : 안면 신경, T : 임시 근육, MS : 턱 근육, 테의 표면 머리 : 건, 헌병 : 턱 근육의 깊은 머리.

그림 3 : digastric 근육의 후방 배의 해부 (.앙와위에서 동물의) 머리. 악하선 SG (), 턱 근육 (M), 안면 신경 (VII)과 흉쇄 근육 (SCM)를 로컬 라이즈. 턱밑 샘을 제거합니다. (B) digastric 근육 전방 (AD) 및 후방 배 (PD)를 로컬 라이즈. 직선 집게로, 후방 배의 앞쪽 힘줄을 잘라와 고막 수포 (타이)에서 그 기원까지 조심스럽게 해부. E : 귀 판관비 : 턱밑 샘, VII : 안면 신경, M : 턱 근육, SMC : 흉쇄 근육, 광고 : 전방 배 digastric 근육, PD : 후방 배 digastric 근육, 타이 : 고막 수포.

그림 4 :. 눈꺼풀 올림 근 벨리의 palatini 근육의 해부 () digastric 근육 (후방 배)의 절개 후 일반보기를. Stylohyoid 근육 (세인트)과 눈꺼풀 올림 근의 건벨리의 palatini은 지역화 할 수 있습니다. 뒤에 실행 기관 (T)과 식도 (들) 참고. 기관과 인두 (P)가 노출되어 식도를 해제 한 후 (B). 부드러운 입맛에 눈꺼풀 올림 근 벨리의 palatini의 삽입은 이제 볼 수 있습니다. 화살표는 양측 상안검 거근 벨리의 palatini의 근육 해부 부드러운 미각을 나타냅니다. E : 귀, ST : stylohyoid 근육, VII : 안면 신경, M : 턱 근육, 광고 : 전방 배 digastric 근육, PD : 후방 배 digastric 근육, T : 기관, 에스 : 식도, P : 인두, * 눈꺼풀 올림 근 벨리의 palatini 근육 .

도 5 : 프로 나제와 효소 분해 후 전에 근육 조직 (A)의 외관 및 (B). 근육 번들 효소 소화 한 후 느슨하게 한 것으로 나타났습니다합니다.
도 6 : 7 팍스 면역 격리 끝에 외 매트릭스 겔인가 갓 절연 : SCS (약 6 시간 초기 티슈 소화 후).. 임의의 5 필드는 필드 당 210 세포의 평균 10X 대물 렌즈를 이용하여 계수 하였다. 세포의 약 90 %가 양성 조절제 7이다. DAPI : 파랑, Pax7 : 빨간색. 스케일 바, 100 μm의.

그림 7 :. 팍스 (7), MyoD 면역 4 일, 7, 10 문화는 Pax7에 대한 항체, 및 MyoD의 면역 염색으로 염색 하였다. (A - C) 및 (D - F) 4 일 대표 현미경 사진과 턱 근육에서 7 문화. (G와 H + + MyoD 및 현미경 필드 당 핵의 수를 계수하고 핵의 총수 (DAPI)의 백분율로 표시 하였다. DAPI : 파랑, Pax7 : 빨강, 및 MyoD : 녹색. 저울 막대, 100 ㎛. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8 :. 턱, digastric과 눈꺼풀 올림 근 벨리 팔라티노 근육에서 문화 단핵 세포에서 문화 Pax7 ± / MyoD ±의 분포 (A - C) 4 일, 7, 10 문화 Pax7에 대한 항체, 및 MyoD의 면역 염색으로 염색 하였다. 세포의 총 수는 핵의 총수 (DAPI)을 기반으로한다. (D) CEL ± Pax7 ± / MyoD의 데이터 정량화LS. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9 :. 오게 닌 면역 4 일, 7, 10 문화가 오게 닌에 대한 항체로 염색했다. (- D) 대표 4 일의 현미경 사진과 눈꺼풀 올림 근 벨리의 팔라티노 근육에서 7 문화. (E) + MyoG 현미경 필드 당 핵의 수를 계수하고 핵의 총수 (DAPI)의 백분율로 표시 하였다. MyoG + 세포 (F) 데이터 정량화. DAPI : 파랑, 오게 닌 : 녹색. 저울 막대, 100 ㎛. 이 figur의 더 큰 버전을 보려면 여기를 클릭하십시오전자.

그림 10. 마이 오신 중쇄 면역 4 일, 7, 10 문화는 마이 오신 중쇄 (MyHC)에 대한 항체로 염색했다. 대표 하루 4, 7의 현미경 사진과 digastric (DIG) 근육에서 10 문화. 하루에 10 긴과 잘 조직 된 myotubes 분명 동안 7 일에, 작은 myotubes는 존재한다. 스케일 바, 200 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1 :.. Myotube 꿈틀 꿈틀 myotubes 두 대표적인 분야로는 하루 digastric 근육에서 10 문화를 나타낸다 이 비디오를 보려면 여기를 클릭하십시오.
Discussion
다른 branchiomeric 머리 근육에서 희주 전에 확장 및 계대없이 한 9 주령의 Wistar 쥐와 세포 외 기질 젤 명소에 직접 배양에서 분리 하였다. 분리 후, 세포를 계수하고, 동일한 셀 밀도로 시딩. 세 가지 다른 근육의 병렬 분리의 경우,이 방법은 약 4 시간이 걸립니다. 배양 오염을 방지하기 위해, 중요한 단계는 근육 절개 후 70 % 알코올에 신속한 세정이다.
SC 분리 중에 작은 조각으로 근육 조직 (약 2mm)을 절단하지만,이 때문에 세포 손상의 소세포 수율 초래하므로 너무 닦지을 방지하는 것이 중요하다. 또한, 소화 효소의 지속 기간은 또한 손상되지 않도록주의하여 현미경으로 점검해야한다. 소화의 목적은 근섬유를 해리하는 것이다. 분리 된 세포의 90 % 이상이 Pax7을 표현하기 때문에, 더 이상의 정제 (도 6-8) 필요하지 않다.이 같은 퍼콜 (39, 40)에 코팅 요리 14,37,38에 사전 도금, 분류 등의 다른 방법의 추가 정제 단계를 피할 수, 직관 형 형광등 또는 자기 또는 셀은 41, 43 정렬. 분쇄하고 이것이 기계적으로 SC의 방출을 허용하는 조직편과 피펫 팁의 개구부 사이에 전단을 야기하는 것이 필수적이다. (직경 팁 내부 : 1mm) 10ml를 피펫으로 분쇄가 어려운 경우, (직경 팁 내부 : 2mm)을 5 ml 피펫 먼저 사용할 수 있습니다. 대안으로, 유리 파스퇴르 피펫 원하는 직경에서 절단 될 수 있고 사용될 수. 이 방법은 간단하고 효율적인 다른 근육 샘플들로부터 SC의 동시 분리를 허용한다.
용으로 SC 배양 플레이트는 젤라틴이나 콜라겐으로 코팅 될 수 있지만, 우리의 이전 연구는 세포 외 기질은 콜라겐 겔 (38)보다 전위 근육 조직의 유지를위한 훨씬 더 나은 것을 보여준다. 세포 외 기질의 겔 스팟밀리미터 크기 (10 μL / O 2mm 또는 20 μL / O 4mm)의 증식과 세포의 제한된 숫자와 희주의 분화에 대한 연구를 할 수 있습니다. 분화 분석을 위해 약 8-20 배 적은 세포를 24 웰 플레이트 (O 15.6 ㎜)에 비해 필요하며, 적은 약 80-200 배는 35mm 페트리 접시 (Ø 35mm) 14,38 비교.
세포 외 기질 겔 고가이기 때문에,이 방법은 또한보다 비용 효율적이다. 또한, 챔버 슬라이드를 플라스틱 커버에 의해 대체 될 수는 더 비용 절감을 미끄러. 세포 외 기질 겔의 제조를위한 챔버 슬라이드 밤새 건조 필수적인 스폿. 세포 외 기질 겔 스팟 투명 같이, 조명을 위로하여 바닥면에 점을 표시 할 필요가있다. 챔버 슬라이드 쉬운 조작의 페트리 접시에 고정되어 있습니다. 또한 세포 배양 확장에 작은의 희주를 연구 할 수있는 가능성을 제공하는 필요가 없습니다근육 또는 작은 근육 샘플을 LER. 다르게는, PCR 또는 근육에 대한 예는 셀이 더 필요한 경우 전술 한 바와 같이, 갓 고립으로 SC 먼저 T75 플라스크로 확장 될 수있다 구성한다.
SCS는이 프로토콜을 사용하는 분리 직후 유동 세포 계측법으로 추가의 정제에는 적합하지 않다 절연. 프로 나제와 소화 표면의 광범위한 소화 14 항원이 발생합니다. 다른 로트 번호가 차등 아세포의 증식과 분화에 영향으로 세포 배양에 사용되는 말의 혈청 및 소 태아 혈청 먼저 제대로 분리하기 전에 특징으로해야합니다.
최근, 아가미 아치와 헤드 중배엽 (예 외안근) (24)로부터 유도 된 근육에 관심이 증가하고있다. 그것은 분명 머리와 다리 근육이 매우 다른 특성을 가지고 있음을 입증하고있다. 오래된 동물의 턱 근육이 다시 보인다사지 근육 (25), (26)과 비교하여 자신의 재생 능력을 주석 박. 외안근에서 SCS는 머리 근육에서 희주에 필적하는 강력한 증식과 분화 능력을 보유하고, 사지 근육으로 SC (24)보다 더 큰 생착 가능성을 보여줍니다.
섬유 형 분포 및 미오신 조성물은 근육 그룹 중에서 또한 종간 변한다. 인간의 첫 번째 아가미 아치에서 발생하는 근육은 심장 근육을 개발하기위한 전형적인 느리고 빠른 두 섬유 (서브 타입 인천 국제 공항과 IIX), 신생아 myosins 및 myosins가 포함되어 있습니다. 설치류에서 이러한 근육은 약 95 % 빠른 섬유 마이 오신 IIA 및 IIB) 44 ~ 46이 포함되어 있습니다. 조류 근육에 대한 연구는 서로 다른 근육 섬유 유형에서 희주는 분화 능력에 차이가 있음을 보여줍니다. 느린 섬유에서 희주의 두 섬유의 종류 47로 분화 할 수있는 동안 빠른 섬유에서 SCS는 만, 빠른 근육 섬유로 분화. 또한, 빠른 근육 희주의 비율섬유는 느린 근육 섬유 48, 49에 비해 낮다. 이것은 섬유 형 분포 안면 영역에서 근육에 대한 연구에서 고려되어야한다는 것을 나타낸다. 구개열 근육과 마찬가지로, 설치류의 LVP 빠른 섬유 (50)에게 거의 독점적으로 포함되어 있습니다. 그 때문에, LVP로부터 SCS는 구개열 분야의 전임상 연구를 위해 적합하다.
이 프로토콜은 branchiomeric 머리 근육 또는 다른 작은 근육 또는 작은 근육 샘플에서 파생 된 희주을 연구하는 새로운 가능성을 제공합니다. 이는 구개열로서뿐만 아니라 작은 근육에 영향을 미치는 다른 조건에 조건 악안면 영역에서 근육의 재생을 개선하기위한 새로운 치료법의 개발을 용이하게 할 것이다.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
발달 생물학 문제 (101) 머리 근육 눈꺼풀 올림 근 벨리의 palatini 근육 digastric 근육 턱 근육 위성 세포 분리 일차 전지 구개열 재생 의학 조직 공학 세포 분화 근섬유 줄기Erratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
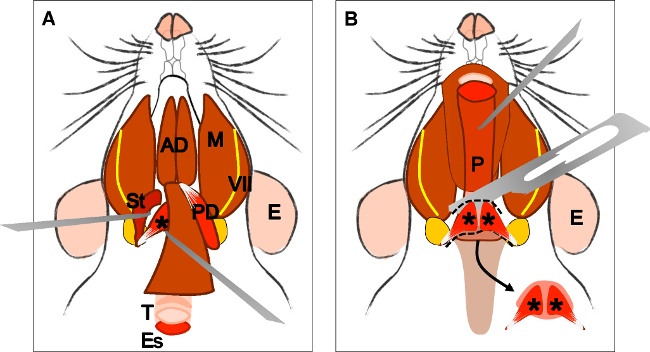
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
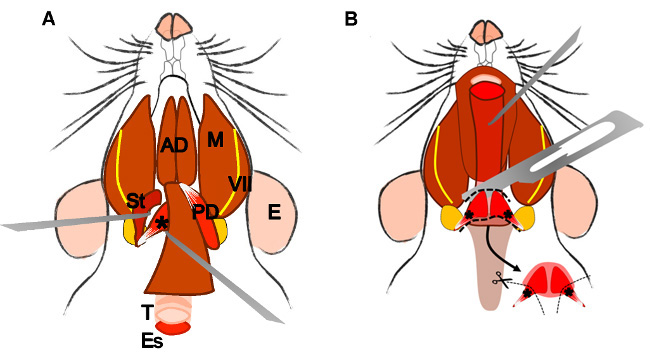
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



