ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
このプロトコルは、9週齢のラットのbranchiomeric頭筋からの衛星細胞の単離を記載しています。筋肉は異なる鰓弓に由来します。次いで、衛星細胞は、それらの分化を研究するためのミリメートルサイズのスポットコーティング上で培養されます。このアプローチは、衛星細胞の増殖および継代を避けることができます。
Introduction
約1:500から1:1,000の新生児は、唇および/または口蓋(CLP)を含む割れ目を示します。このように、これは、人間1における最も一般的な先天性奇形です。軟口蓋の筋肉は、音声、嚥下、および吸引時の軟口蓋の機能に重要です。軟口蓋の裂け目が存在する場合、これらの筋肉が異常口蓋骨の後方端部に挿入されています。
軟口蓋は鼻から脱出する空気を防ぐ、演説の中で上下に移動します。口蓋裂のある子どもでは、口蓋帆咽頭機能不全2,3と呼ばれる現象が生じる。この制御機能を持っていません。治療プロトコルが可変であるが、軟口蓋の外科的修復は、幼児(生後6-36ヶ月)4で行われます。軟口蓋の異常挿入筋肉が外科的に5-7に補正することができるが、口蓋帆咽頭の機能不全は30%7%に持続します2,3,8-10の患者。
衛星細胞(SCS)の作用を介して再生する骨格筋の能力は十分11,12を確立されています。筋損傷の際に、SCが活性化され、損傷部位に移動します。そして、彼らは、増殖と分化、およびヒューズ新しい筋線維または修理損傷したもの13を形成します。その子孫、増殖する筋芽細胞は、さらに、筋原決意因子1(MyoDの)16を表現しながら、自己消費のSCは、転写因子PAX7 14,15を発現します。差別筋芽細胞は、ミオゲニン(MyoG)17を表現するために開始します。筋芽細胞の分化は、筋線維の形成、およびそのようなミオシン重鎖(MyHC)16,18などの筋特異的タンパク質の発現によって特徴付けられます。
最近、いくつかの戦略は、四肢の筋肉19-23の筋肉再生を改善するために、再生医療に使用されてきました。上の特定の研究それが最近、彼らはいくつかの側面24に他の筋肉とは異なることが示されたため、branchiomeric頭の筋肉も重要です。四肢の筋肉とは対照的に、それはbranchiomeric頭筋が少ないのSC 25が含まれていることが示唆されている、再生遅く、多くの線維性結合組織がbranchiomeric頭筋からのSCは、他の転写因子を発現する増殖性、さらに損傷26の後に形成されています。例えば、Tcf21、頭蓋顔面筋形成のための転写因子が強く頭筋の再生ではなく、ほとんど肢の筋肉25の再生中で発現されます。 CLP患者の軟口蓋の筋肉は、通常、サイズが小さく、通常の口蓋筋27,28と比較して、よく組織されています。低速および高速繊維は、両方の軟口蓋の筋肉に存在するが、遅い繊維はより豊富です。これとは対照的に、割れ目筋肉が速い繊維のより高い割合で含有し、また低減毛細管供給通常の軟口蓋の筋肉29-31と比較。高速繊維が収縮誘発性損傷31-33になりやすいです。添付悪い毛細管供給も線維症34,35を促進することができます。すべてのこれらの局面は、手術裂閉鎖36の後軟口蓋の筋肉の悪い再生に寄与することができます。そこで、branchiomeric頭筋SCの単離および特徴付けのためのプロトコルは非常に重要です。これはbranchiomeric頭筋のSCの生物学を研究する可能性を提供します。さらに、組織工学に基づく新しい治療は、CLPおよび頭蓋顔面領域を損なう他の状態で手術後の筋肉再生を促進するために開発することができます。
一般的には、SCが筋肉組織14の分離後に得られることができます。ミンチ、酵素消化、およびトリチュレーションは、一般的に、それらのニッチからのSCを解放する必要があります。 SCがコーティングされていない皿14,37,38、FRにプレめっきにより精製することができますパーコール39,40のactionation、または41〜43のソートfluorescent-または磁気セル。ここでは、若い成体ラットのbranchiomeric頭筋からの衛星細胞の単離のための新たな経済と迅速なプロトコルを提示します。このプロトコルは、前の原稿14に基づいて、具体的に小さな組織サンプルのために適合されています。 第 1、 第 2、および第 4鰓弓から生じる代表的な筋からのSCの単離が記載されています。単離後、衛星細胞の少数は、それらの分化を研究するためのミリメートルサイズの細胞外マトリックスゲルスポット上で培養されます。このアプローチは、SCの拡大と継代の必要性を回避します。
Protocol
本明細書に記載の全ての実験は、オランダの法律および規制(RU-DEC 2013から205)に応じてラートボウト大学ナイメーヘンから動物実験のために地元の理事会で承認されました。
1.細胞外マトリックスゲルスポット
- 分離前に1日以下の手順を実行します。
- 少なくとも1.5時間、4℃で一定分量外マトリックスゲル(100μl)を解凍します。ダルベッコ改変イーグル培地中で1:10に希釈し、 4,500 mg / Lのグルコース、4mMのL-グルタミン、および110 mg / mlのピルビン酸ナトリウム(DMEM)を有します。すべての回で4℃での細胞外マトリックスゲルを保管してください。注:急激な温度変化が塗布ムラや結晶形成をもたらします。
- 15分間氷上で希釈された細胞外マトリックスゲル溶液を保管してください。
- 10分間、20μlのマイクロピペットを事前に冷やし。
- 100ミリメートルペトリ皿に8ウェルチャンバースライドを入れ、10分間冷表面( 例えばフリーザーパック)上に皿を転送します。
- 各ウェルに10μlの細胞外マトリックスゲルのドロップを入れて予備冷却マイクロピペットを使用してください。少なくとも他7分( 図1A)、冷表面にペトリ皿にしてください。
- 完全に残っている細胞外マトリックスゲル( 図1B)を削除し、37℃で一晩、ウェルを乾燥させます。
2.解剖頭の筋肉(咬筋、顎二腹筋、及び挙ヴェリ口蓋)
- 切開の前に、2%のペニシリン - ストレプトマイシン(P / S)を補充したリン酸緩衝生理食塩水(PBS)50mlのを準備します。氷の上に保管してください。
- CO 2 / O 2と一人の若い成体ラット(9週)の安楽死の後、頭を刎ねると頭から皮膚を削除します。氷冷PBSにヘッドを移すを50mlチューブ中の2%P / Sを補充しました。
- (第1鰓弓由来)咬筋
- シリコンパッド上の一側を上に頭を置き、皮下Nで固定eedles( 図2A)。
- 耳下腺および顔面神経( 図2A)を特定します。腺を覆う深い筋膜を露出させます。筋膜をカットし、解剖ハサミを使用して腺を削除します。外耳道を識別します。茎乳突孔から顔面神経をトレースし、慎重に手術用メスの刃の第15号で、時間的な頬骨と頬枝を削除します。
- 筋膜を除去することによって咬筋の表面的な頭を解放します。咬筋の表面と深部の両方のヘッドを特定します。上顎の頬骨突起に挿入されたその太い腱腱膜まで表面的なヘッドをトレースします。
- ストレートピンセットで頬骨突起を原点から腱を分離します。手術用メスの刃15号や解剖ハサミでそれをカットし、慎重に生活して( 図2B)。
- その角度で挿入し、Tの下半分まで咬筋の表面的な頭を解剖彼は手術用メスの刃番15( 図2C)と下顎の枝の表面を横。今、完全に筋肉を削除します。
- ( 第 2鰓弓由来)二腹筋の後方腹
- シリコンパッド上に仰臥位で頭部を置き、皮下注射針( 図3A)で固定します。
- 舌下および顎下腺の両方の上に位置する皮下脂肪を除去します。次に、表在性筋膜と解剖ハサミを使用して腺を削除します。二腹筋(前方および後方腹)を公開します。
- ストレートピンセットで後方腹の前腱を持ち、それをカットし、鼓室胞( 図3B)にその起源まで慎重に解剖。反対側で同じ操作を行います。
- (第4鰓弓由来)口蓋帆挙筋筋
- 二腹筋の後方腹の切開後の( 図4A)、横方向に引き、そして慎重に取り外し、茎突舌骨筋をローカライズ。
- 鼓膜胞( 図4A)で挿入口蓋帆挙筋の腱をローカライズ。慎重にそれを分析し、両側にそれをカット。
- 気管およびその背後に実行食道を探します。食道を持ち上げ、咽頭、喉頭および軟口蓋を公開します。
- 口蓋帆挙筋が挿入された軟口蓋の領域を局所化した( 図4B)緩いそれをカット。
注:直接切開した後、慎重に実体顕微鏡下で各筋肉の腱および結合組織を除去します。エタノール70%に迅速に全ての検体を水没し、氷冷PBSに転送15mlチューブに2%P / Sを加えたもの。
衛星細胞の単離3
- 筋肉の3つのグループからのSC単離するための以下の製造手順を実行します。
- DMEM中の0.1%プロナーゼの7.5ミリリットルを準備します。 0.22μmのフィルターを通してソリューションをフィルタリングします。分離前に10分間、水浴中で37℃で溶液を事前に温めます。
- 準備、10%ウマ血清(HS)および1%P / Sを添加したDMEMの35ミリリットル。また、事前に暖かい37℃の水浴中。
- 20%ウシ胎児血清(FBS)、10%HS、1%P / S、1%ニワトリ胚抽出物(CEE)を添加したDMEMから成る15ミリリットルの培地を調製します。水浴中で37℃でのプレ暖かいです。
- プレコート6プラスチックピペット使用前に少なくとも10分間、HSと(10ml)および乾燥。
- 培養フードでは、6ウェルプレートのウェルに各筋肉を転送します。解剖ハサミを使用して、約2mmの小片に筋を切りました。あまりにも多くの組織をミンチしないように注意してください。
- 慎重に各ウェルに0.1%のプロナーゼ溶液を2.5ミリリットルを追加し、37℃で60分間インキュベートします。静かに20、40、および60分後にプレートを横に振ります。注:正確なduratioインキュベーションのNは、動物の年齢や歪みなどの要因に依存します。
- 顕微鏡下で監視します。筋肉の断片を確認し、繊維束が緩ん外観( 図5)を取得するときに、酵素消化を停止します。
- DMEM 2.5mlの10%HSおよび1%P / Sを補充した追加。 5分間400×gで15ミリリットルチューブと遠心分離機にチューブを転送します。デカンテーションにより上澄み液を捨てます。
- 10%HSおよび1%P / Sを補充した5ミリリットルのDMEMを追加します。溶液をピペットで上下10ミリリットルのプラスチックピペット(トリチュレーション)で組織を均質化するために、少なくとも20回。
- 4分間200×gでチューブを遠心。上清を回収し、15 mlチューブに移します。
- 10%HSおよび1%P / Sを補充した5ミリリットルのDMEMを追加します。 10ミリリットルのプラスチックピペットを用いて、再びピペット組織断片をピペットを介して容易に通過するまで。
- 4分間200×gでチューブを遠心し、15mlチューブ内の上清を収集します。
- P50mlのチューブにセルストレーナー(40μm)をユタ、フィルター上に解離した細胞を含む上清を移します。最大の細胞回収のために1ミリリットルのDMEMで洗浄しました。
- 10分1,000×gでチューブを遠心し、ピペットで上清を捨てます。
- 300μlの培養液中にペレットを再懸濁し、血球計で細胞をカウントします。
細胞外マトリックスゲルスポットの衛星細胞の分化4
- 培地10μl中1.5×10 3個の細胞を得るために、細胞懸濁液を希釈します。
- テープでチャンバースライドのカバーを固定して、オブジェクトのガラスの下側に黒のマーカーでスポットをマークします。
- マイクロピペットを使用して、細胞外マトリックスゲルスポットに10μlの細胞懸濁液の液滴を置きます。細胞懸濁液の低下がその場で正しく配置されているかどうかを顕微鏡で確認してください。 37℃で6時間インキュベートします。
- 注意深いですLYは、培養培地(20%FBSを補充したDMEM、10%HS、1%P / S、1%CEE)の400μlを添加し、37℃で3日間インキュベートします。
注:この時点では、新たに単離されたSCは、大規模な外傷(酵素消化および過酷なトリチュレーション)にかけ、彼らが回復する必要があります。第三日37時の次に細胞を乱さないで、培養培地は、実験の種類に応じて変更することができます。
細胞外マトリックスゲルスポットを分化アッセイのための高細胞密度(1.5〜2.5×10 20分の3μL)を播種することができます。培養媒体(DMEM、20%FBS、10%HS、1%P / S、1%ニワトリ胚抽出物を補充した)三日毎に交換することができます。 - あるいは、拡張および通過を希望する場合は、次の手順に従います。
- 少なくとも1.5時間、4℃で一定分量外マトリックスゲル(500μl)を解凍します。 DMEM中で1:10に希釈し、ポイント1.1.1の推奨事項に従ってください。
- 4で10分間プレ寒10ミリリットルピペット° C。
- 10分間の冷表面( 例えばフリーザーパック)に3 T75フラスコを転送します。
- 各フラスコに1ミリリットルの細胞外マトリックスゲルを入れて予備冷却したピペットを使用してください。表面が完全に覆われていることを確認してください。少なくとも他7分( 図1A)、冷表面にフラスコを保管してください。
- 完全に10ミリリットルピペットで残っている細胞外マトリックスゲルを除去し、37℃で1時間、ウェルを乾燥させます。
- カウントした後、培養培地を予め被覆T75フラスコおよびシード(20%FBS、10%HS、1%P / S、1%ニワトリ胚抽出物を補充したDMEM)10ml中の新たに単離したのSCを再懸濁します。
- 80%のコンフルエンスに到達するまで、3日後、培地(と3日ごと)に変更します。継代のために、PBSでT75フラスコを3回洗浄します。次に1ミリリットルを、0.25%トリプシン溶液を添加し、37℃で3分間インキュベートします。培地9mlの再懸濁は(DMEM、10%HS、1%P / S、20%FBSを補充し1%ニワトリ胚抽出物)と5分間、200×gで遠心します。上清を捨てます。カウントした後、培地1000μlの1×10 6細胞を再懸濁し、細胞を凍結します。
Representative Results
このプロトコルを使用して、咬筋(片側)は0.8〜1×10 6個の細胞、二腹筋(事後腹)1.5〜2×10 5個の細胞が得られると、挙筋ヴェリ口蓋筋利回り1〜1.5×10 5個の細胞が得られます。細胞収率は、筋肉型、株、および動物の年齢に依存します。 3筋肉群間の比較のために、新たに単離されたSCが同一の細胞密度(1.5×10 10分の3μL)で播種しました。直接単離後に、新たに単離した細胞の90%以上がPAX7( 図6)を発現します。
4日目、7と10の文化をPAX7、MyoDの、MyoGとMyHC免疫染色に対する抗体で染色しました。五任意のフィールドが20倍の対物レンズを用いて培養あたりで計数しました。 4日目にパックス7ミオDは、すべての筋肉群において発現される( 図6、図7、図8)、しかし咬筋からSatCsの子孫と顎二腹筋の筋肉がEXPRESを開始しますミオゲニン以前口蓋帆挙筋筋( 図9)よりも歌います。 10日目において、MyoGの発現が強く、すべてのグループ( 図9)に低減されます。数日の細胞外マトリックスゲルスポットに播種後、増殖細胞を融合し、ミオシン重鎖を発現する多核筋管を形成し始めます。小さ な筋管は、7日目( 図10)ではっきりと見えます。 10日目に、筋管のけいれんを( ビデオ1)を観察することができます。

図1:チャンバースライド中の細胞外マトリックスゲルスポットは、(A)簡単操作のため、100ミリメートルペトリ皿に8ウェルチャンバースライドを配置します。ピペットで10μlの細胞外マトリックスの各チャンバ内のゲルと冷たい面(7分)の上に置きます。過剰な細胞外マトリックスG後(B)チャンバースライドELが除去されます。

図2:側面図で動物の咬筋の解剖(A)ヘッド。耳(E)、耳下腺(P)と、顔面神経(VII)。 (B)咬筋(MS)と頭筋(T)の表面的なヘッドの腱腱膜(TE)。ピンセットでその挿入から腱を分離します。 (C)慎重に下顎骨の枝でその挿入まで筋肉を解剖。 E:耳、P:耳下腺、VII:顔面神経、T:頭筋、MS:咬筋の表面的なヘッド、テ:腱、融点:咬筋の深いヘッド。

図3:二腹筋の後方腹の解剖(。仰臥位での動物のA)ヘッド。顎下腺(SG)、咬筋(M)、顔面神経(VII)と胸鎖乳突筋(SCM)をローカライズします。顎下腺を削除します。 (B)二腹筋の前方(AD)および後方腹(PD)をローカライズします。ストレートピンセットで、それをカットし、鼓膜胞(TY)を起源まで慎重に解剖、後部腹の前腱を取ります。 E:耳、Sgは:顎下腺、VII:顔面神経、M:咬筋、SMC:胸鎖乳突筋、AD:前腹二腹筋、PD:後部腹二腹筋、Tyの:鼓膜水疱。

図4:二腹筋(後部腹)の解剖後口蓋帆挙筋筋の解剖(A)一般ビュー。茎突舌骨筋(ST)と挙筋の腱ヴェリの口蓋をローカライズすることができます。その背後に実行されている気管(T)と食道(エス)に注意してください。気管と食道咽頭(P)が露出して昇降した後(B)。軟口蓋に口蓋帆挙筋の挿入が表示されるようになりました。矢印は、両側の口蓋帆挙筋の筋肉と解剖軟口蓋を示しています。 E:耳、セント:茎突舌骨筋、VII:顔面神経、M:咬筋、AD:前腹二腹筋、PD:後部腹二腹筋、T:気管、エス:食道、P:咽頭、*口蓋帆挙筋。

図5:プロナーゼで酵素消化後の前に筋肉組織(A)の外観と(B)。筋束は酵素消化後に緩めているように見えることに注意してください。
図6:パックス7免疫染色新たに単離したSCが、(約6時間の初期組織消化後の)分離の終了時に細胞外マトリックスゲルに適用されます。五任意のフィールドは、フィールド当たり210細胞の平均で10×対物レンズを用いて計数しました。細胞の約90%がパックス7陽性です。 DAPI:青、PAX7:赤。スケールバーは100μm。

図7:パックス7、MyoDの免疫染色 4日目、7と10の文化をPAX7に対する抗体、およびMyoDの免疫染色で染色しました。 (A - C)と(D - F)4日目の代表的な顕微鏡写真および咬筋から7の文化。 (GとH +とのMyoD +顕微鏡視野あたりの核の数をカウントし、核(DAPI)の合計数の割合として表しました。 DAPI:青、PAX7:赤、とのMyoD:緑。スケールバー、100μmである。 この図の拡大版を表示するには、こちらをクリックしてください。

図8:咬筋、顎二腹筋と挙筋ヴェリ口蓋筋から培養物中の単核細胞からの培養物中のPAX7±/ MyoDの±の分布(A - C)4日目、7と10の文化はPAX7に対する抗体、およびMyoDの免疫染色で染色しました。細胞の総数は、核の総数(DAPI)に基づいています。セル画±PAX7±/ MyoDのの(D)データの定量化LS。 この図の拡大版を表示するには、こちらをクリックしてください。

図9:ミオゲニン免疫染色 4日目、7と10の文化はミオゲニンに対する抗体で染色しました。 (A - D)代表4日目の顕微鏡写真と挙筋ヴェリの口蓋筋から7の文化。 (E)MyoG +顕微鏡視野あたりの核の数をカウントし、核の総数(DAPI)の百分率として表しました。 MyoG +細胞の(F)のデータの定量化。 DAPI:青、ミオゲニン:グリーン。スケールバー、100μmである。 このFIGURの拡大版を表示するには、こちらをクリックしてくださいE。

図10:ミオシン重鎖免疫染色 4日目、7及び10の培養物は、ミオシン重鎖(MyHC)に対する抗体で染色しました。 4日目の代表的な顕微鏡写真、顎二腹筋(DIG)筋から7と10の文化。日に10の長とよく組織化筋管が明らかであるが7日目に、小さな筋管が存在します。スケールバー、200μmである。 この図の拡大版を表示するには、こちらをクリックしてください。
ビデオ1:筋管けいれんけいれん筋管との2つの代表的なフィールドの例としては、日に二腹筋から10の文化を示しているこのビデオを見るにはこちらをクリックしてください。
Discussion
異なるbranchiomeric頭筋からのSCが膨張前および継代することなく、1 9週齢のWistar系ラットおよび細胞外マトリックスゲルスポットの直接培養から単離しました。単離後、細胞を計数し、同じ細胞密度で播種しました。三つの異なる筋の並列単離のために、この方法は、約4時間を要します。培養の汚染を回避するために、重要なステップは、筋肉の切開後、アルコール70%の急激な洗浄です。
SC分離中にそれを小片(約2mm)に筋肉組織を切断するが、これが原因で、細胞損傷の小さい細胞収率をもたらすようにあまりにも多くのミンチを回避することが重要です。また、酵素消化の期間は、さらなる損傷を避けるために、顕微鏡下で慎重にチェックする必要があります。消化の目的は、筋線維を解離することです。単離された細胞の90%以上がPAX7を発現するので、さらなる精製は( 図6-8)を必要としません。これは、パーコール39,40、または41,43をソートfluorescent-または磁気細胞に、コーティングされていない食器14,37,38にめっき前分画のような他の方法で追加の精製工程を回避します。磨砕のためには、これはSCの機械的な放出を可能にするように、組織断片及びピペット先端の開口部との間に剪断力を誘発することが不可欠です。 (直径チップ内部さ1mm)を10 mlピペットで粉砕が困難である場合は、(直径の先端内側さ2mm)を5mlピペットを最初に使用することができます。あるいは、ガラスパスツールピペットを所望の直径に切断することができ、使用されます。この方法は効率的で、シンプルであり、異なる筋肉サンプルからSCの同時単離を可能にします。
SCに培養プレートは、ゼラチン又はコラーゲンでコーティングすることができるが、我々の以前の研究は、細胞外マトリックスは、コラーゲンゲル38より筋電位の維持のためにはるかに優れていることを示しています。細胞外マトリックスゲルスポットミリサイズ(10μL/ O 2ミリメートルまたは20μL/Ø4ミリメートル)は、細胞の限られた数とSCの増殖および分化の研究を可能にします。分化アッセイのために、約8〜20倍少ない細胞を24ウェルプレート(O 15.6ミリメートル)と比較要求され、より少ない、約80〜200倍を35mmペトリ皿(Ø35ミリメートル)14,38と比較します。
細胞外マトリックスゲルは高価であるため、この方法は、よりコスト効率的です。また、チャンバースライドは、さらにコストを削減するためにプラスチック製カバースリップで置き換えることができます。チャンバースライドの細胞外マトリックスゲルスポットを一晩乾燥の調製のために不可欠です。細胞外マトリックスゲルスポットが透明であるように、バックライトを使用して下側のスポットをマークする必要があります。チャンバースライドを簡単に操作するためのペトリ皿に固定されています。さらに、細胞培養拡大はSmalのののSCを検討する可能性を提供する、必要はありませんLERの筋肉や小さな筋肉のサンプル。あるいは、より多くの細胞が必要とされる場合は、上記したように、新たに単離したSCSは最初T75フラスコ中で拡大することができるPCRまたは筋肉構築物について、例えば 。
SCがすぐに分離した後、フローサイトメトリーでさらに精製するには適していませんにこのプロトコルを使用して単離しました。プロナーゼによる消化は、表面抗原14の広範な消化を引き起こします。異なるロット番号を差動筋芽細胞の増殖および分化に影響を与えたように、細胞培養に使用されたウマ血清およびウシ胎児血清は最初に適切に、分離前に特徴付けされなければなりません。
近年では、鰓のアーチとヘッド中胚葉( 例えば、外眼筋)24から誘導された筋の関心が高まっています。これは、明らかに頭と手足の筋肉が非常に異なる特性を有することが実証されています。古い動物からの咬筋は再ようです四肢の筋肉25,26と比較して、その再生能力をTAIN。外眼筋からのSCは頭筋からのSCに匹敵する堅牢な増殖および分化能力を有しており、手足の筋肉のSC 24より大きい生着の可能性を示しています。
ファイバ型分布とミオシン組成物は、筋肉群の間で、また、種間で変化します。ヒトでは第一鰓弓から発信筋肉は心筋を開発するための典型的な低速および高速の両方の繊維(サブタイプIIAおよびIIX)、新生児のミオシンとミオシンが含まれています。げっ歯類では、これらの筋肉は約95%高速繊維ミオシンIIAおよびIIb)44-46を含んでいます。鳥類の筋肉の研究は、異なる筋線維タイプからSCSが分化能が変化することを示しています。遅い繊維からのSCSは、両方のファイバタイプ47に分化することができるしながら高速繊維からのSCのみ、速筋線維に分化します。また、速筋におけるSCの割合繊維は、遅筋線維48,49におけるよりも低いです。これは、ファイバ型分布は頭蓋顔面領域の筋肉の研究のために考慮されなければならないことを示しています。口蓋裂の筋肉と同様に、げっ歯類におけるLVPは、ほぼ独占的に高速繊維50が含まれています。そのため、LVPからのSCは、口蓋裂の分野での前臨床試験に適しています。
このプロトコルは、branchiomeric頭の筋肉や他の小さい筋肉や小さい筋肉サンプルから誘導されたのSCを研究するための新たな可能性を提供しています。これは、口蓋裂などの状態で顎顔面領域にも小さい筋肉に影響を与える他の条件の筋肉の再生を改善するための新しい治療法の開発を容易にします。
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
発生生物学、問題101、頭筋、口蓋帆挙筋筋、顎二腹筋の筋、咬筋、衛星細胞、単離一次細胞、口蓋裂、再生医療、組織工学、幹細胞を、分化、筋線維Erratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
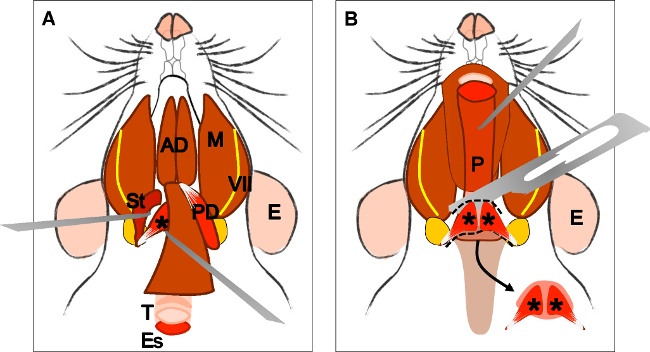
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
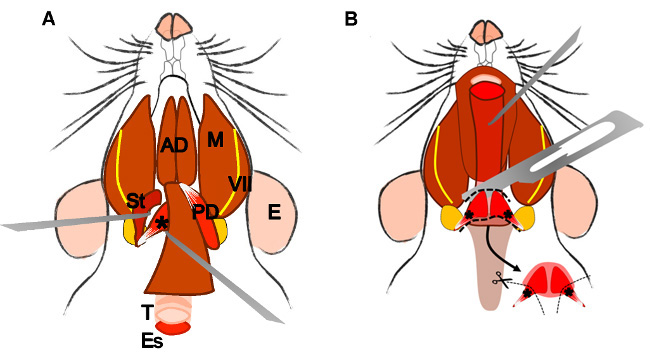
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



